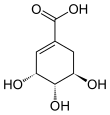
Шикимовая кислота
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК ( 3R , 4S ,5R ) -3,4,5-Тригидроксициклогекс-1-ен-1-карбоновая кислота | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.004.850 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С 7 Н 10 О 5 | |||
| Молярная масса | 174.15 g/mol | ||
| Температура плавления | От 185 до 187 ° C (от 365 до 369 ° F; от 458 до 460 К) | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Шикимовая кислота , более известная как ее анионная форма шикимат , представляет собой циклогексен , циклитол и циклогексанкарбоновую кислоту . Это важный биохимический метаболит растений и микроорганизмов. Его название происходит от японского цветка сикими ( シキミ , японский звездчатый анис , Illicium anisatum ), из которого он был впервые выделен в 1885 году Йоханом Фредриком Эйкманом . [1] Выяснение его строения было сделано почти 50 лет спустя. [2]
Биосинтез
[ редактировать ]Фосфоенолпируват и эритрозо-4-фосфат конденсируются с образованием 3-дезокси -D- арабиногептулозонат-7-фосфата (DAHP) в реакции, катализируемой ферментом DAHP-синтазой . Затем DAHP трансформируется в 3-дегидрохинат (DHQ) в реакции, катализируемой DHQ-синтазой . Хотя эта реакция требует никотинамидадениндинуклеотида (НАД) в качестве кофактора, ферментативный механизм регенерирует его, что приводит к полному использованию НАД.
ДГК дегидратируется до 3-дегидрошикимовой кислоты ферментом 3-дегидрохинатдегидратазой , которая восстанавливается до шикимовой кислоты ферментом шикиматдегидрогеназой , который использует никотинамидадениндинуклеотидфосфат (НАДФН) в качестве кофактора.
Путь Шикимате
[ редактировать ]Биосинтез ароматических аминокислот
[ редактировать ]Шикиматный путь — это семиэтапный метаболический путь, используемый бактериями , грибами , водорослями , паразитами и растениями для биосинтеза ароматических аминокислот ( фенилаланина , тирозина и триптофана ). Этот путь не обнаружен у животных; следовательно, фенилаланин и триптофан представляют собой незаменимые аминокислоты , которые должны быть получены из рациона животного (животные могут синтезировать тирозин из фенилаланина, и поэтому он не является незаменимой аминокислотой, за исключением особей, неспособных гидроксилировать фенилаланин до тирозина ).
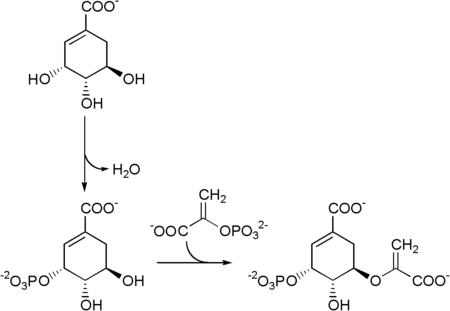
Семью ферментами, участвующими в шикиматном пути, являются DAHP-синтаза , 3-дегидрохинатсинтаза , 3-дегидрохинатдегидратаза , шикиматдегидрогеназа , шикиматкиназа , EPSP-синтаза и хоризматсинтаза . Путь начинается с двух субстратов : фосфоенолпирувата и эритрозо-4-фосфата и заканчивается хоризматом , субстратом для трех ароматических аминокислот. Пятый фермент задействованный — это шикиматкиназа , фермент, который катализирует АТФ- зависимое фосфорилирование шикимата с образованием шикимат-3-фосфата (показано на рисунке ниже). [3] Шикимат-3-фосфат затем соединяется с фосфоенолпируватом с образованием 5-енолпирувилшикимат-3-фосфата посредством фермента 5-енолпирувилшикимат-3-фосфат-синтазы (EPSP) .
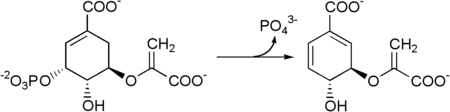
превращается в хоризмат Затем 5-енолпирувилшикимат-3-фосфат под действием хоризматсинтазы .
Префеновая кислота затем синтезируется путем Кляйзена перегруппировки хоризмата под действием хоризматмутазы . [4] [5]
Префенат подвергается окислительному декарбоксилированию с сохранением гидроксильной группы с образованием п- гидроксифенилпирувата, который переаминируется с использованием глутамата в качестве источника азота с образованием тирозина и α-кетоглутарата .
Отправная точка биосинтеза некоторых фенольных соединений.
[ редактировать ]Фенилаланин и тирозин являются предшественниками, используемыми в биосинтезе фенилпропаноидов . Фенилпропаноиды затем используются для производства флавоноидов , кумаринов , дубильных веществ и лигнина . Первым задействованным ферментом является фенилаланин-аммиаклиаза (PAL), которая превращает L - фенилаланин в транс - коричную кислоту и аммиак .
Биосинтез галловой кислоты
[ редактировать ]Галловая кислота образуется из 3-дегидрошикимата под действием фермента шикиматдегидрогеназы с образованием 3,5-дидегидрошикимата . Последнее соединение самопроизвольно перегруппировывается в галловую кислоту. [6]
Другие соединения
[ редактировать ]Шикимовая кислота является предшественником:
- индол , производные индола и ароматическая аминокислота триптофан и производные триптофана, такие как психоделическое соединение диметилтриптамин.
- многие алкалоиды и другие ароматические метаболиты
Микоспориноподобные аминокислоты
[ редактировать ]Микоспориноподобные аминокислоты представляют собой небольшие вторичные метаболиты, вырабатываемые организмами, обитающими в средах с большим количеством солнечного света, обычно в морской среде.
Использование
[ редактировать ]В фармацевтической промышленности шикимовая кислота китайского звездчатого аниса ( Illicium verum ) используется в качестве исходного материала для производства осельтамивира ( Тамифлю ). Хотя шикимовая кислота присутствует в большинстве автотрофных организмов, она является промежуточным продуктом биосинтеза и обычно обнаруживается в очень низких концентрациях. Низкий выход шикимовой кислоты из китайского звездчатого аниса является причиной нехватки осельтамивира в 2005 году. Шикимовую кислоту также можно экстрагировать из семян плодов сладкой резинки ( Liquidambar styraciflua ), [2] которого много в Северной Америке, урожайность составляет около 1,5%. Например, на четырнадцать упаковок Тамифлю необходимо 4 кг (8,8 фунта) семян сладкой резинки. Для сравнения, звездчатый анис содержит от 3% до 7% шикимовой кислоты. Пути биосинтеза E. coli недавно были усовершенствованы, что позволяет организму накапливать достаточно материала для коммерческого использования. [7] [8] [9] Исследование 2010 года, опубликованное Университетом штата Мэн, показало, что шикимовую кислоту также можно легко получить из хвои нескольких видов сосен . [10]
Защитные группы чаще используются в небольших лабораторных работах и первоначальных разработках, чем в процессах промышленного производства, поскольку их использование добавляет к процессу дополнительные этапы и материальные затраты. Однако доступность дешевого хирального строительного блока может компенсировать эти дополнительные затраты, например, шикимовой кислоты для осельтамивира .
Аминошикимовая кислота также является альтернативой шикимовой кислоте в качестве исходного материала для синтеза осельтамивира.
Мишень для наркотиков
[ редактировать ]Шикимат можно использовать для синтеза (6 S )-6-фторшикимовой кислоты . [11] антибиотик, ингибирующий путь биосинтеза ароматических веществ. [12] Более конкретно, глифосат ингибирует фермент 5-енолпирувилшикимат-3-фосфатсинтазу (EPSPS). «Roundup Ready» Генетически модифицированные культуры преодолевают этот запрет. [13]
возникновение
[ редактировать ]Он встречается в листьях древовидных папоротников, особь, называемая «фиддлхед» (скрученные листья молодого древовидного папоротника порядка Cyatheales , собираемые для использования в качестве овоща). Эти листья съедобны, но их можно поджарить, чтобы удалить шикимовую кислоту. [14]
Шикимовая кислота также является гликозидной частью некоторых гидролизуемых танинов . Кислота хорошо растворима в воде и нерастворима в неполярных растворителях, поэтому шикимовая кислота активна только в отношении грамположительных бактерий из-за внешней клеточной мембраны непроницаемости грамотрицательных бактерий . [15]
См. также
[ редактировать ]- Аминошикиматный путь , новый вариант шикиматного пути.
Ссылки
[ редактировать ]- ^ Эйкман, Дж. Ф. (1881). «Ботанические связи Illicium religiosum Sieb., Illicium anisatum Lour» . Американский фармацевтический журнал . 53 (8).
- ^ Jump up to: а б Энрич, Лиза Б.; Шойерманн, Маргарет Л.; Мохаджер, Эшли; Матиас, Кэтрин Р.; Эллер, Кристал Ф.; Ньюман, М. Скотт; Фудзинака, Майкл; Пун, Томас (апрель 2008 г.). « Ликвидамбар стирацифлуа : возобновляемый источник шикимовой кислоты». тетраэдра Буквы 49 (16): 2503–2505. дои : 10.1016/joint.2008.02.140 .
- ^ Херрманн, К.М.; Уивер, LM (1999). «Путь Шикимате». Ежегодный обзор физиологии растений и молекулярной биологии растений . 50 : 473–503. дои : 10.1146/annurev.arplant.50.1.473 . ПМИД 15012217 .
- ^ Гериш, Х. (1978). «О механизме хоризматмутазной реакции». Биохимия . 17 (18): 3700–3705. дои : 10.1021/bi00611a004 . ПМИД 100134 .
- ^ Каст, П.; Тевари, Ю.Б.; Уэст, О.; Хилверт, Д.; Хоук, КНДР ; Голдберг, Роберт Н. (1997). «Термодинамика превращения хоризмата в префенат: экспериментальные результаты и теоретические предсказания». Журнал физической химии Б. 101 (50): 10976–10982. дои : 10.1021/jp972501l .
- ^ «Путь галловой кислоты» . Metacyc.org .
- ^ Брэдли, Д. (декабрь 2005 г.). «Звездная роль бактерий в борьбе с пандемией гриппа?». Nature Reviews Открытие лекарств . 4 (12): 945–946. дои : 10.1038/nrd1917 . ПМИД 16370070 . S2CID 30035056 .
- ^ Кремер, М.; Бонгертс, Дж.; Бовенберг, Р.; Кремер, С.; Мюллер, У.; Орф, С.; Вубболтс, М.; Рэйвен, Л. (2003). «Метаболическая инженерия микробного производства шикимовой кислоты». Метаболическая инженерия . 5 (4): 277–283. дои : 10.1016/j.ymben.2003.09.001 . ПМИД 14642355 .
- ^ Йоханссон, Л.; Линдског, А.; Силверспаре, Дж.; Цимандер, К.; Нильсен, К.Ф.; Лиден, Г. (2005). «Продуцирование шикимовой кислоты модифицированным штаммом E. coli (W3110.shik1) в условиях с ограничением фосфатов и углерода». Биотехнология и биоинженерия . 92 (5): 541–552. дои : 10.1002/бит.20546 . ПМИД 16240440 . S2CID 19659961 .
- ^ «Иглы сосны штата Мэн дают ценный материал Тамифлю» . Бостон.com . 7 ноября 2010 г.
- ^ Сун, Чуаньцзюнь; Цзян, Шенде; Сингх, Гурдиал (4 августа 2011 г.). «Простой синтез (6S)-6-фторошикимовой кислоты и (6R)-6-гидроксишикимовой кислоты» . Химические исследования в китайских университетах . 18 (2): 146–152.
- ^ Дэвис, генеральный менеджер; Барретт-Би, К.Дж.; Джуд, окружной прокурор; Лехан, М; Николс, WW; Пиндер, ЧП; Тейн, Дж.Л.; Уоткинс, У.Дж.; Уилсон, Р.Г. (февраль 1994 г.). «(6S)-6-фторшикимовая кислота, антибактериальное средство, действующее на путь биосинтеза ароматических веществ» . Антимикробные средства и химиотерапия . 38 (2): 403–406. дои : 10.1128/AAC.38.2.403 . ПМЦ 284469 . ПМИД 8192477 .
- ^ Функе, Т.; Хан, Х.; Хили-Фрид, ML; Фишер, М.; Шенбрунн, Э. (29 августа 2006 г.). «Молекулярная основа устойчивости к гербицидам культур, готовых к Раундапу» . Труды Национальной академии наук . 103 (35): 13010–13015. Бибкод : 2006PNAS..10313010F . дои : 10.1073/pnas.0603638103 . ПМЦ 1559744 . ПМИД 16916934 .
- ^ Эванс, Айова; Осман, Массачусетс (июль 1974 г.). «Канцерогенность папоротника и шикимовой кислоты». Природа . 250 (5464): 348–349. Бибкод : 1974Natur.250..348E . дои : 10.1038/250348a0 . ПМИД 4211848 . S2CID 4175635 .
- ^ Чунг, Хай-Юнг (30 сентября 2009 г.). «Оценка биологической активности экстрактов звездчатого аниса (Illicium verum)». Профилактическое питание и пищевая наука . 14 (3): 195–200. дои : 10.3746/jfn.2009.14.3.195 .
Книги
[ редактировать ]- Хаслам, Э. (1974). Путь Шикимате (1-е изд.).
- Хаслам, Эдвин (1993). Шикимовая кислота: метаболизм и метаболиты . Уайли. ISBN 978-0-471-93999-3 .