3-дегидрохинатдегидратаза
| 3-дегидрохинатдегидратаза | |||
|---|---|---|---|
 Третий этап шикиматного пути катализируется DHQD. | |||
| Идентификаторы | |||
| Номер ЕС. | 4.2.1.10 | ||
| Номер CAS. | 9012-66-2 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| 3-дегидрохиназа типа I | |||
|---|---|---|---|
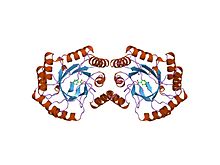 Структура 3-дегидрохинатдегидратазы I типа сальмонеллы тифи. | |||
| Идентификаторы | |||
| Символ | ДХхиназа_I | ||
| Пфам | PF01487 | ||
| Пфам Клан | CL0036 | ||
| ИнтерПро | ИПР001381 | ||
| PROSITE | PDOC00789 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 2dhq / SCOPe / СУПФАМ | ||
| CDD | cd00502 | ||
| |||
| Дегидрохиназа класса II | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ДХхиназа_II | ||
| Пфам | PF01220 | ||
| PROSITE | PDOC00789 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 2dhq / SCOPe / СУПФАМ | ||
| CDD | cd00466 | ||
| |||
Фермент . 3-дегидрохинатдегидратаза ( КФ 4.2.1.10 ) катализирует химическую реакцию
- 3-дегидрохинат 3-дегидрошикимат + H 2 O
Этот фермент принадлежит к семейству лиаз , в частности гидролиаз, которые расщепляют связи углерод-кислород. Этот фермент участвует в биосинтезе фенилаланина, тирозина и триптофана .
Открытие
[ редактировать ]Благодаря исследованиям Бернхарда Дэвиса и Дэвида Спринсона шикиматный путь был признан основным путем биосинтеза для производства ароматических аминокислот. [ 1 ]
Роль на пути шикимата
[ редактировать ]3-дегидрохинатдегидратаза — фермент , катализирующий третий этап шикиматного пути. Шикиматный путь — это путь биосинтеза, который позволяет растениям, грибам и бактериям производить ароматические аминокислоты . [ 2 ] У млекопитающих этот путь отсутствует, а это означает, что они должны получать эти незаменимые аминокислоты с пищей. Ароматические аминокислоты включают фенилаланин , тирозин и триптофан . [ 1 ]
Этот фермент дегидратирует 3-дегидрохинат, превращая его в 3-дегидрошикимат, как показано на диаграмме рядом. Это третий шаг на пути Шикимате. Он принадлежит к семейству лиаз , в частности гидролиаз, которые расщепляют связи углерод-кислород. Систематическое название этого класса ферментов — 3-дегидрохинатгидролиаза (3-дегидрошикиматобразующая) . Этот фермент является одним из немногих примеров конвергентной эволюции . Две отдельные версии этого фермента имеют разные аминокислотные последовательности. [ 2 ]
3-Дегидрохинатдегидратазу также обычно называют дегидрохинатдегидратазой и DHQD . Другие названия включают 3-дегидрохинатгидролазу, DHQase, 3-дегидрохиназу, 5-дегидрохиназу, дегидрохиназу, 5-дегидрохинатдегидратазу, 5-дегидрохинатгидролиазу и 3-дегидрохинатгидролиазу. [ 2 ]
Эволюционное происхождение
[ редактировать ]Назначение продукции
[ редактировать ]Ароматические аминокислоты, образующиеся по пути шикиматной кислоты, используются высшими растениями в качестве строительных блоков белка и предшественников некоторых вторичных метаболитов. Примерами таких вторичных метаболитов являются растительные пигменты и соединения для защиты от травоядных животных, насекомых и ультрафиолетового света. Конкретные производимые ароматические вторичные метаболиты, а также время и в каких количествах они производятся, варьируются в зависимости от типа растений. Млекопитающие потребляют незаменимые аминокислоты в своем рационе, превращая их в предшественники важных веществ, таких как нейротрансмиттеры.
Конвергентная эволюция
[ редактировать ]Как упоминалось ранее, существуют два класса 3-дегидрохинатдегидратазы, известные как типы I и II. Эти две версии имеют разные аминокислотные последовательности и разные вторичные структуры . Тип I присутствует у грибов, растений и некоторых бактерий и отвечает за биосинтез хоризмата . Он катализирует цис-дегидратацию 3-дегидрохината через ковалентный промежуточный имин. Тип I подвержен нагреванию и имеет значения K m в низком микромолярном диапазоне. Тип II присутствует в хинатном пути грибов и шикиматном пути большинства бактерий. Он катализирует транс-дегидратацию с использованием промежуточного енолята. Он термостабилен и имеет значения K m на один или два порядка выше значений типа IK m . [ 1 ]
Наиболее изученный фермент типа I принадлежит Escherichia coli (ген aroD) и родственным бактериям . Это гомодимерный белок . У грибов дегидрохиназа образует ядро пентафункционального комплекса AROM , который катализирует пять последовательных стадий шикиматного пути . [ 3 ] Гистидин каталитическом участвует в механизме . [ 4 ]
Другие цели
[ редактировать ]3-дегидрохинатдегидратаза также является ферментом, участвующим в процессе расщепления хината. И 3-дегидрохинат, и 3-дегидрошикимат являются промежуточными соединениями в механизме реакции. На следующем изображении показан этот процесс при деградации Quinate. [ 1 ]
Структура
[ редактировать ]Приложения
[ редактировать ]Шикиматный путь стал предметом исследований по разработке гербицидов и противомикробных средств, поскольку он является важным путем для многих растений, бактерий и паразитов, но не существует у млекопитающих. [ 1 ]
Ингибиторы шикиматного пути в микобактериях потенциально могут помочь в лечении туберкулеза. [ 5 ] [ 6 ]
Большая часть 3-дегидрохинатдегидратазы у бактерий и высших растений представляет собой ДГХД I типа. [ 1 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж Херрманн К.М. (июль 1995 г.). «Путь сикимата: ранние шаги в биосинтезе ароматических соединений» . Растительная клетка . 7 (7): 907–919. дои : 10.1105/tpc.7.7.907 . ПМК 160886 . ПМИД 12242393 .
- ^ Jump up to: а б с Херрманн К.М. (январь 1995 г.). «Шикиматный путь как вход во вторичный метаболизм ароматических веществ» . Физиология растений . 107 (1): 7–12. дои : 10.1104/стр.107.1.7 . ПМК 161158 . ПМИД 7870841 .
- ^ Арора Верасто, Х; Логотети, М; Альбрехт, Р; Лейтнер, А; Чжу, Х; Хартманн, доктор медицинских наук (6 июля 2020 г.). «Архитектура и функциональная динамика пентафункционального комплекса АРОМ». Химическая биология природы . 16 (9): 973–978. дои : 10.1038/s41589-020-0587-9 . ПМИД 32632294 . S2CID 220375879 .
- ^ Дека Р.К., Клеантус К., Коггинс-младший (ноябрь 1992 г.). «Идентификация незаменимого остатка гистидина в активном сайте дегидрохиназы Escherichia coli» . Журнал биологической химии . 267 (31): 22237–42. дои : 10.1016/S0021-9258(18)41660-2 . ПМИД 1429576 .
- ^ Диас М.В., Сни В.К., Бромфилд К.М., Пейн Р.Дж., Паланитан С.К., Чулли А., Ховард Н.И., Абелл С., Саккеттини Дж.К., Бланделл Т.Л. (июнь 2011 г.). «Структурное исследование конструкций ингибиторов, нацеленных на 3-дегидрохинатдегидратазу шикиматного пути микобактерий туберкулеза». Биохимический журнал . 436 (3): 729–39. дои : 10.1042/BJ20110002 . ПМИД 21410435 . S2CID 20397566 .
- ^ Райхау С., Цзяо В., Уокер С.Р., Хаттон Р.Д., Бейкер Э.Н., Паркер Э.Дж. (май 2011 г.). «Мощные ингибиторы фермента шикиматного пути микобактерий туберкулеза: сочетание дизайна, основанного на механизме и моделировании» . Журнал биологической химии . 286 (18): 16197–207. дои : 10.1074/jbc.M110.211649 . ПМЦ 3093739 . ПМИД 21454647 .
Дальнейшее чтение
[ редактировать ]- Мицухаши С., Дэвис Б.Д. (сентябрь 1954 г.). «Ароматический биосинтез. XII. Превращение 5-дегидрохиновой кислоты в 5-дегидрошикимовую кислоту 5-дегидрохиназой». Биохимика и биофизика Acta . 15 (1): 54–61. дои : 10.1016/0006-3002(54)90093-1 . ПМИД 13198937 .
- Мицухаси С., Дэвис Б.Д. (октябрь 1954 г.). «Ароматический биосинтез. XIII. Превращение хинной кислоты в 5-дегидрохиновую кислоту хинной дегидрогеназой». Биохимика и биофизика Acta . 15 (2): 268–80. дои : 10.1016/0006-3002(54)90069-4 . ПМИД 13208693 .