Митотическая катастрофа
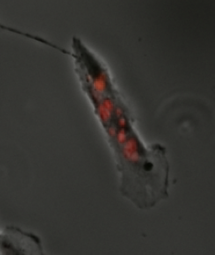
Митотическая катастрофа определяется либо как клеточный механизм предотвращения пролиферации потенциально раковых клеток, либо как способ клеточной смерти, который происходит в результате неправильного развития или входа клеточного цикла . [1] [2] Митотическая катастрофа может быть вызвана длительной активацией контрольной точки сборки веретена , ошибками в митозе или повреждением ДНК и действует для предотвращения геномной нестабильности. [3] Этот механизм исследуется как потенциальная терапевтическая мишень при раке , и многочисленные одобренные методы лечения вызывают митотическую катастрофу. [4]
Использование термина
[ редактировать ]Было предпринято множество попыток дать конкретное определение митотической катастрофе с тех пор, как этот термин впервые был использован для описания температурно-зависимой летальности у дрожжей Schizosaccharomyces pombe , которые демонстрировали аномальную сегрегацию хромосом. [2] [3] Этот термин использовался для определения механизма гибели клеток, который происходит, когда клетка находится в митозе, или как метод онкосупрессии, который предотвращает деление потенциально онкогенных клеток. [3] Эта онкосупрессия достигается путем инициирования формы гибели клеток, такой как апоптоз или некроз , или путем индукции клеточного старения . [3]
Механизм предотвращения развития рака
[ редактировать ]
Одним из вариантов использования термина «митотическая катастрофа» является описание онкосупрессивного механизма (т.е. механизма предотвращения пролиферации раковых клеток и развития опухолей), который возникает, когда клетки подвергаются и обнаруживают дефектного митоза . возникновение [5] Такое определение этого механизма было описано Международным номенклатурным комитетом по клеточной смерти. [6] [5] Согласно этому определению, клетки, которые подвергаются митотической катастрофе, либо стареют и перестают делиться, либо подвергаются регулируемой форме клеточной смерти во время митоза или другой форме клеточной смерти в следующей G 1 фазе клеточного цикла. [5] [3] Функция этого механизма заключается в предотвращении накопления клетками геномной нестабильности , которая может привести к онкогенезу. [3] [6]
Когда клетка подвергается клеточной гибели во время митоза, это известно как митотическая смерть. [3] Это характеризуется высоким уровнем циклина B1, который все еще присутствует в клетке во время гибели клетки, что указывает на то, что клетка так и не завершила митоз. [3] Митотическая катастрофа также может привести к тому, что клетка будет обречена на клеточную смерть в результате апоптоза или некроза после интерфазы клеточного цикла. [3] Однако время гибели клеток может варьироваться от нескольких часов после завершения митоза до нескольких лет спустя, что наблюдалось в тканях человека, обработанных лучевой терапией. [3] Наименее распространенным исходом митотической катастрофы является старение, при котором клетка перестает делиться и вступает в постоянную остановку клеточного цикла, которая предотвращает дальнейшее размножение клетки. [3]
Механизм клеточной смерти
[ редактировать ]Другое использование термина «митотическая катастрофа» — это описание способа гибели клеток, происходящего во время митоза. [2] Гибель клеток может произойти из-за накопления повреждений ДНК при наличии неправильно функционирующих контрольных точек структуры ДНК или неправильно функционирующих контрольных точек сборки веретена. [2] Клетки, подвергающиеся митотической катастрофической гибели, могут не активировать пути традиционных путей смерти, таких как апоптоз. [7] Хотя более поздние определения митотической катастрофы не используют ее для описания настоящего механизма гибели клеток, в некоторых публикациях она описывается как механизм гибели клеток. [5] [7]
Причины
[ редактировать ]Длительная активация контрольной точки шпиндельного узла
[ редактировать ]
В клетках есть механизм предотвращения неправильного разделения хромосом, известный как контрольная точка сборки веретена или митотическая контрольная точка. [3] Контрольная точка сборки веретена проверяет, что митотические веретена правильно прикрепились к кинетохорам каждой пары хромосом до того, как хромосомы разделятся во время деления клеток. [6] Если митотические веретена неправильно прикреплены к кинетохорам , контрольная точка сборки веретена предотвратит переход из метафазы в анафазу . [6] Этот механизм важен для обеспечения того, чтобы ДНК внутри клетки распределялась поровну между двумя дочерними клетками. [3] Когда активируется контрольная точка сборки веретена, она останавливает митоз клетки до тех пор, пока все хромосомы не прикрепятся и не выровняются должным образом. [3] Если контрольная точка активирована в течение длительного периода, это может привести к митотической катастрофе. [3]
Длительная активация контрольной точки сборки веретена ингибирует комплекс, способствующий анафазе. [8] В норме активация комплекса, способствующего анафазе, приводит к разделению сестринских хроматид и выходу клетки из митоза. [9] Комплекс митотических контрольных точек действует как негативный регулятор комплекса, способствующего анафазе. [9] Неприкрепленные кинетохоры способствуют образованию комплекса митотических контрольных точек, который состоит из четырех различных белков, известных как Mad2 , Cdc20 , BubR1 и Bub3 у людей. [9] Когда образуется комплекс митотической контрольной точки, он связывается с комплексом, способствующим анафазе, и предотвращает его способность стимулировать прогрессирование клеточного цикла. [9]
Ошибки в митозе
[ редактировать ]
Некоторые клетки могут иметь ошибочный митоз, но выжить и подвергнуться новому клеточному делению, что повышает вероятность того, что клетка подвергнется митотической катастрофе. [3] Например, клетки могут подвергаться процессу, называемому митотическим проскальзыванием, когда клетки выходят из митоза слишком рано, прежде чем процесс митоза завершится. [10] В этом случае клетка завершает митоз при наличии сигнализации контрольной точки сборки веретена, которая обычно препятствует выходу клетки из митоза. [3] Это явление вызвано неправильной деградацией циклина B1 и может привести к нарушению сегрегации хромосом. [3] Циклин B1 является основным регулятором клеточного цикла и управляет переходом клеток от фазы G2 к фазе M. [11] Циклин B1 работает со своим партнером по связыванию CDK1, чтобы контролировать это прогрессирование, и этот комплекс известен как фактор, способствующий митозу. [11] Хотя фактор, способствующий митозу, используется для направления клеток в митоз, его разрушение также управляет выходом клеток из митоза. [11] Обычно деградация циклина B1 инициируется комплексом, способствующим анафазе, после того, как все кинетохоры правильно прикреплены волокнами митотического веретена. [11] Однако, когда уровни циклина B1 разрушаются слишком быстро, это может привести к преждевременному выходу клетки из митоза, что приводит к потенциальным митотическим ошибкам, включая неправильную сегрегацию хромосом. [11]

Тетраплоидные или иначе анеуплоидные клетки подвергаются более высокому риску митотической катастрофы. [4] Тетраплоидные клетки — это клетки, которые продублировали свой генетический материал, но не подверглись цитокинезу и не разделились на две дочерние клетки и, таким образом, остались одной клеткой. [12] Анеуплоидные клетки — это клетки, которые имеют неправильное количество хромосом, включая полное добавление хромосом или полную потерю хромосом. [13] Клетки с аномальным количеством хромосом с большей вероятностью будут иметь ошибки сегрегации хромосом, которые приводят к митотической катастрофе. [4] Клетки, которые становятся анеуплоидными, часто предотвращаются от дальнейшего роста и деления клеток за счет активации путей супрессора опухоли, таких как р53, который переводит клетку в состояние непролиферации, известное как клеточное старение. [4] Учитывая, что анеуплоидные клетки часто могут стать онкогенными, этот механизм предотвращает размножение этих клеток и, таким образом, предотвращает развитие раковых заболеваний в организме. [3]
Клетки, которые подвергаются мультиполярному делению или, другими словами, делятся более чем на две дочерние клетки, также подвергаются более высокому риску митотической катастрофы. [3] Хотя многие из потомков мультиполярных делений не выживают из-за сильного несбалансированного числа хромосом, большинство клеток, которые выживают и подвергаются последующему митозу, вероятно, претерпят митотическую катастрофу. [3] Эти мультиполярные деления происходят из-за наличия более двух центросом. [14] Центросомы представляют собой клеточные органеллы, которые организуют сборку митотического веретена в клетке во время митоза и, таким образом, направляют сегрегацию хромосом во время митоза. [15] Обычно клетки имеют две центросомы, которые направляют сестринские хроматиды к противоположным полюсам делящейся клетки. [16] Однако, когда в митозе присутствует более двух центросом, они могут тянуть хромосомы в неправильных направлениях, в результате чего дочерние клетки становятся нежизнеспособными. [12] Многие виды рака имеют избыточное количество центросом, но чтобы предотвратить появление нежизнеспособных дочерних клеток, раковые клетки разработали механизмы кластеризации своих центросом. [12] Когда центросомы группируются к двум полюсам делящейся клетки, хромосомы правильно разделяются и образуются две дочерние клетки. [12] Таким образом, раковые клетки, способные адаптироваться к большему числу центросом, способны предотвращать митотическую катастрофу и размножаться в присутствии дополнительных центросом. [3]
повреждение ДНК
[ редактировать ]Высокие уровни повреждений ДНК, которые не восстанавливаются до того, как клетка вступит в митоз, могут привести к митотической катастрофе. [3] Клетки, у которых нарушена контрольная точка G2, не способны предотвращать продвижение по клеточному циклу, даже если в геноме клетки присутствует повреждение ДНК. [3] Контрольная точка G2 обычно функционирует, чтобы остановить прогресс клеток с поврежденной ДНК в митоз. [17] Контрольная точка G2 может быть нарушена, если супрессор опухоли р53 . в клетке больше не присутствует [3] Реакция на повреждение ДНК, присутствующее во время митоза, отличается от ответа на повреждение ДНК, обнаруженное во время остальной части клеточного цикла. [3] Клетки могут обнаруживать дефекты ДНК в течение оставшейся части клеточного цикла и либо восстанавливать их, если это возможно, либо подвергаться апоптозу старения. [3] Учитывая, что когда это происходит, клетка не переходит в митоз, это не считается митотической катастрофой. [3]
Митотическая катастрофа при раке
[ редактировать ]Предотвращение геномной нестабильности
[ редактировать ]Геномная нестабильность является одной из отличительных черт раковых клеток и способствует генетическим изменениям (как крупным хромосомным изменениям, так и изменениям отдельных нуклеотидов) в раковых клетках, которые могут привести к повышенному уровню прогрессирования опухоли за счет генетических вариаций в опухолевой клетке. [18] Было показано, что рак с более высоким уровнем геномной нестабильности имеет худшие исходы для пациентов, чем рак с более низким уровнем геномной нестабильности. [19] Клетки приобрели механизмы, которые противостоят повышенной геномной нестабильности в клетках. [3] Митотическая катастрофа — один из способов, с помощью которого клетки предотвращают размножение геномно нестабильных клеток. [3] Если митотическая катастрофа не удалась для клеток, геном которых стал нестабильным, они могут бесконтрольно размножаться и потенциально стать онкогенными. [6]
Уровень геномной нестабильности различен в зависимости от типа рака: эпителиальный рак более геномно нестабильен, чем рак гематологического или мезенхимального происхождения. [20] Мезотелиома , мелкоклеточный рак легких , рак молочной железы , яичников , немелкоклеточный рак легких и рак печени демонстрируют высокий уровень геномной нестабильности, тогда как острый лимфобластный лейкоз , миелодисплазия и миелопролиферативные заболевания имеют более низкий уровень нестабильности. [20]
Противораковая терапия
[ редактировать ]
Стимулирование митотической катастрофы в раковых клетках является областью исследований в области терапии рака, которая вызвала интерес и рассматривается как потенциальная мишень для преодоления резистентности, развившейся к современным химиотерапиям. [4] Было обнаружено, что раковые клетки более чувствительны к индукции митотической катастрофы, чем нераковые клетки организма. [3] Опухолевые клетки часто инактивируют механизмы, необходимые для апоптоза, такие как белок p53. [4] Обычно это достигается мутациями белка p53 или потерей участка хромосомы, содержащего его генетический код. [21] p53 предотвращает распространение опухолевых клеток и считается основным белком-супрессором опухоли. [21] p53 действует либо путем остановки клеточного цикла, когда ощущается неконтролируемое деление клеток, либо может способствовать гибели клеток посредством апоптоза при наличии непоправимого повреждения ДНК. [21] Митотическая катастрофа может происходить независимо от p53 и, таким образом, представляет собой терапевтический интерес. [4] Более того, было показано, что дозы повреждающих ДНК препаратов ниже летальных уровней вызывают митотическую катастрофу. [4] Это позволит вводить лекарство, пока у пациента будет меньше побочных эффектов. [3]
Терапия рака может вызвать митотическую катастрофу, либо повреждая ДНК клеток, либо ингибируя сборку веретена. [4] Лекарства, известные как яды веретена, влияют на полимеризацию или деполимеризацию веретен микротрубочек и, таким образом, мешают правильному формированию митотических веретен. [4] Когда это происходит, контрольная точка сборки веретена активируется и переход из метафазы в анафазу тормозится. [4]
| Лекарство | Разрешенное использование/фаза клинических испытаний/исследовательское использование | Механизм действия |
|---|---|---|
| Паклитаксел [4] | Разрешенное применение: связанная со СПИДом саркома Капоши , рак молочной железы , немелкоклеточный рак легких и рак яичников. [22] | Способствует сборке веретена микротрубочек и предотвращает отслоение микротрубочек, препятствуя правильному входу или выходу клетки из митоза. [23] |
| Доцетаксел [4] | Разрешенное применение: рак молочной железы, немелкоклеточный рак легких, рак предстательной железы , плоскоклеточный рак головы и шеи , аденокарцинома желудка и аденокарцинома желудочно-пищеводного перехода. [24] | |
| Винбластин [4] | Разрешенное применение: рак молочной железы, хориокарцинома , лимфома Ходжкина , саркома Капоши, грибовидный микоз , неходжкинская лимфома , герминогенные опухоли яичка. [25] | Деполимеризует микротрубочки [4] |
| Винкристин [4] | Разрешенное применение: острый лимфобластный лейкоз , лимфомы , нейробластомы , саркомы и опухоли центральной нервной системы. [26] | |
| Монастрол [3] | Исследовательское использование | Ингибитор EG5 , который нарушает движение хромосом во время митоза. [3] Это возмущение приводит к гибели клеток в митозе или в последующей интерфазе. [27] |
| ARRY-520 (филанесиб) [3] | Клиническое исследование III фазы : множественная миелома [27] | |
| ВХ-680 [3] | Доклинические исследования [28] | Ингибитор AURKA / AURKB , нарушающий движение хромосом и цитоскелета во время митоза. |
| МЛН8237 [4] | Клиническое исследование I фазы: рецидивирующие атипичные тератоидно-рабдоидные опухоли у детей и распространенные солидные опухоли у детей. Неудачное клиническое исследование лимфомы и рака легких у взрослых [29] |
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Галлуцци, Лоренцо; Витале, Илио; Ааронсон, Стюарт А.; Абрамс, Джон М.; Адам, Дитер; Агостинис, Патрисия; Алнемри, Эмад С.; Альтуччи, Люсия; Амелио, Ивано; Эндрюс, Дэвид В.; Анникьярико-Петруцелли, Маргарита; Антонов Алексей Владимирович; Арам, Эли; Береке, Эрик Х.; Барлев, Николай А. (март 2018 г.). по гибели клеток «Молекулярные механизмы гибели клеток: рекомендации Номенклатурного комитета Смерть клеток и дифференциация . 25 (3): 486–541. дои : 10.1038/ s41418-017-0012-4 ISSN 1476-5403 . ПМЦ 5864239 . ПМИД 29362479 .
- ^ Jump up to: а б с д Кастинг, Мэри; Перфеттини, Жан-Люк; Румье, Томас; Эндрю, Карин; Медема, Рене; Кремер, Гвидо (апрель 2004 г.). «Гибель клетки в результате митотической катастрофы: молекулярное определение» . Онкоген . 23 (16): 2825–2837. дои : 10.1038/sj.onc.1207528 . ISSN 1476-5594 . ПМИД 15077146 . S2CID 28061417 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в ах есть также Витале, Илио; Галлуцци, Лоренцо; Кастедо, Мария; Кремер, Гвидо (июнь 2011 г.). «Митотическая катастрофа: механизм предотвращения геномной нестабильности» . Nature Reviews Молекулярно-клеточная биология . 12 (6): 385–392. дои : 10.1038/nrm3115 . ISSN 1471-0080 . ПМИД 21527953 . S2CID 22483746 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д Денисенко Татьяна Владимировна; Сорокина Ирина Викторовна; Гогвадзе, Владимир; Животовский, Борис (январь 2016 г.). «Митотическая катастрофа и устойчивость к лекарствам от рака: связь, которую необходимо разорвать» . Обновления в области лекарственной устойчивости: обзоры и комментарии по противомикробной и противораковой химиотерапии . 24 : 1–12. дои : 10.1016/j.drup.2015.11.002 . ISSN 1532-2084 . ПМИД 26830311 .
- ^ Jump up to: а б с д Галлуцци, Лоренцо; Витале, Илио; Ааронсон, Стюарт А.; Абрамс, Джон М.; Адам, Дитер; Агостинис, Патрисия; Алнемри, Эмад С.; Альтуччи, Люсия; Амелио, Ивано; Эндрюс, Дэвид В.; Анникьярико-Петруцелли, Маргарита; Антонов Алексей Владимирович; Арам, Эли; Береке, Эрик Х.; Барлев, Николай А. (март 2018 г.). по гибели клеток «Молекулярные механизмы гибели клеток: рекомендации Номенклатурного комитета Смерть клеток и дифференциация . 25 (3): 486–541. дои : 10.1038/ s41418-017-0012-4 ISSN 1476-5403 . ПМЦ 5864239 . ПМИД 29362479 .
- ^ Jump up to: а б с д и МакГи, Маргарет М. (2015). «Нацеливание на сигнальный путь митотической катастрофы при раке» . Медиаторы воспаления . 2015 : 146282. дои : 10.1155/2015/146282 . ISSN 1466-1861 . ПМК 4600505 . ПМИД 26491220 .
- ^ Jump up to: а б Фу, Сяо; Ли, Му; Тан, Цюйлиан; Хуанг, Зежи; Наджафи, Масуд (декабрь 2021 г.). «Нацеливание на механизмы гибели раковых клеток с помощью ресвератрола: обзор» . Апоптоз . 26 (11–12): 561–573. дои : 10.1007/s10495-021-01689-7 . ISSN 1573-675X . ПМИД 34561763 . S2CID 237627882 .
- ^ Сазонова Елена Владимировна; Петричук Светлана Владимировна; Копейна Гелина С.; Животовский, Борис (09.12.2021). «Связь между митотическими дефектами и митотической катастрофой: обнаружение и судьба клеток» . Биология Директ . 16 (1): 25. дои : 10.1186/s13062-021-00313-7 . ISSN 1745-6150 . ПМЦ 8656038 . ПМИД 34886882 .
- ^ Jump up to: а б с д Лара-Гонсалес, Пабло; Пайнс, Джонатон; Десаи, Аршад (сентябрь 2021 г.). «Активация и глушение контрольной точки сборки шпинделя на кинетохорах» . Семинары по клеточной биологии и биологии развития . 117 : 86–98. дои : 10.1016/j.semcdb.2021.06.009 . ISSN 1096-3634 . ПМЦ 8406419 . ПМИД 34210579 .
- ^ Синха, Деботтам; Дуйф, Паскаль Х.Г.; Ханна, Кум Кум (2 января 2019 г.). «Митотическое проскальзывание: старая сказка с новым поворотом» . Клеточный цикл . 18 (1): 7–15. дои : 10.1080/15384101.2018.1559557 . ISSN 1538-4101 . ПМК 6343733 . ПМИД 30601084 .
- ^ Jump up to: а б с д и Гелли Лузерна ди Рора, Андреа; Мартинелли, Джованни; Симонетти, Джорджия (26 ноября 2019 г.). «Баланс между митотической смертью и митотическим проскальзыванием при остром лейкозе: новое терапевтическое окно?» . Журнал гематологии и онкологии . 12 (1): 123. дои : 10.1186/s13045-019-0808-4 . ISSN 1756-8722 . ПМК 6880427 . ПМИД 31771633 .
- ^ Jump up to: а б с д Ганем, Нил Дж; Сторхова, Зузана; Пеллман, Дэвид (1 апреля 2007 г.). «Тетраплоидия, анеуплоидия и рак» . Текущее мнение в области генетики и развития . Хромосомы и механизмы экспрессии. 17 (2): 157–162. дои : 10.1016/j.где.2007.02.011 . ISSN 0959-437X . ПМИД 17324569 .
- ^ Бен-Давид, Ури; Амон, Анжелика (январь 2020 г.). «Контекст решает все: анеуплоидия при раке» . Обзоры природы. Генетика . 21 (1): 44–62. дои : 10.1038/s41576-019-0171-x . hdl : 1721.1/126231 . ISSN 1471-0064 . ПМИД 31548659 . S2CID 202746570 .
- ^ Огден, А; Рида, ПКГ; Анеха, Р. (август 2012 г.). «Давайте соберемся, чтобы не допустить путаницы: декластеризация центросом как привлекательная противораковая стратегия» . Смерть клеток и дифференцировка . 19 (8): 1255–1267. дои : 10.1038/cdd.2012.61 . ISSN 1350-9047 . ПМЦ 3392635 . ПМИД 22653338 .
- ^ Борненс, Мишель (01 февраля 2021 г.). «Организация и функции центросом» . Современное мнение в области структурной биологии . Центросомальная организация и сборки ● Складывание и связывание. 66 : 199–206. дои : 10.1016/j.sbi.2020.11.002 . ISSN 0959-440X . ПМИД 33338884 . S2CID 229324538 .
- ^ Докси, Стивен; Циммерман, Венди; Микуле, Кейт (июнь 2005 г.). «Центросомный контроль клеточного цикла» . Тенденции в клеточной биологии . 15 (6): 303–311. дои : 10.1016/j.tcb.2005.04.008 . ISSN 0962-8924 . ПМИД 15953548 .
- ^ Старк, Джордж Р.; Тейлор, Уильям Р. (2004), Шонталь, Аксель Х. (ред.), «Анализ контрольной точки G2 / M» , Контроль контрольных точек и рак: Том 1: Обзоры и модельные системы , том. 280, Тотова, Нью-Джерси: Humana Press, стр. 51–82, doi : 10.1385/1-59259-788-2:051 , ISBN. 978-1-59259-788-8 , PMID 15187249 , получено 26 ноября 2022 г.
- ^ Ханахан, Дуглас (январь 2022 г.). «Признаки рака: новые измерения» . Открытие рака . 12 (1): 31–46. дои : 10.1158/2159-8290.CD-21-1059 . ISSN 2159-8290 . ПМИД 35022204 . S2CID 245916132 .
- ^ Андор, Ноэми; Мали, Карло С.; Джи, Ханли П. (01 мая 2017 г.). «Геномная нестабильность при раке: баланс на грани толерантности» . Исследования рака . 77 (9): 2179–2185. дои : 10.1158/0008-5472.CAN-16-1553 . ISSN 0008-5472 . ПМЦ 5413432 . ПМИД 28432052 .
- ^ Jump up to: а б Пикор, Лариса; Четверг, Келси; Вучич, Эмили; Лам, Ван (2013). «Обнаружение и влияние нестабильности генома при раке» . Обзоры рака и метастазов . 32 (3): 341–352. дои : 10.1007/s10555-013-9429-5 . ISSN 0167-7659 . ПМЦ 3843371 . ПМИД 23633034 .
- ^ Jump up to: а б с Канапатипиллай, Матумай (23 мая 2018 г.). «Лечение рака, связанного с агрегацией мутанта p53» . Раки . 10 (6): 154. doi : 10.3390/cancers10060154 . ISSN 2072-6694 . ПМК 6025594 . ПМИД 29789497 .
- ^ «Паклитаксел» . Национальный институт рака . 5 октября 2006 г. Проверено 29 ноября 2022 г.
- ^ Чжу, Линьян; Чен, Лицюнь (13 июня 2019 г.). «Прогресс в исследованиях паклитаксела и иммунотерапии опухолей» . Письма по клеточной и молекулярной биологии . 24:40 . дои : 10.1186/s11658-019-0164-y . ISSN 1425-8153 . ПМК 6567594 . ПМИД 31223315 .
- ^ «Доцетаксел-НЦИ» . www.cancer.gov . 05.10.2006 . Проверено 29 ноября 2022 г.
- ^ «Винбластина сульфат – НЦИ» . www.cancer.gov . 3 февраля 2011 г. Проверено 29 ноября 2022 г.
- ^ Триарико, Сильвия; Романо, Альберто; Аттина, Джорджо; Капоцца, Микеле Антонио; Маурици, Пальма; Мастранжело, Стефано; Руджеро, Антонио (16 апреля 2021 г.). «Винкристин-индуцированная периферическая нейропатия (ВИПН) при детских опухолях: механизмы, факторы риска, стратегии профилактики и лечения» . Международный журнал молекулярных наук . 22 (8): 4112. doi : 10.3390/ijms22084112 . ISSN 1422-0067 . ПМЦ 8073828 . ПМИД 33923421 .
- ^ Jump up to: а б Гарсиа-Саес, Изабель; Скуфиас, Димитриос А. (01 февраля 2021 г.). «Агенты, нацеленные на Eg5: от открытия нового ингибитора на основе антимитозов до терапии рака и устойчивости» . Биохимическая фармакология . 184 : 114364. doi : 10.1016/j.bcp.2020.114364 . ISSN 0006-2952 . ПМИД 33310050 . S2CID 229180081 .
- ^ Россари, Федерико; Минутоло, Филиппо; Орчуоло, Энрико (20 июня 2018 г.). «Прошлое, настоящее и будущее ингибиторов Bcr-Abl: от химической разработки до клинической эффективности» . Журнал гематологии и онкологии . 11 (1): 84. дои : 10.1186/s13045-018-0624-2 . ISSN 1756-8722 . ПМК 6011351 . ПМИД 29925402 .
- ^ Миллс, Кристофер С.; Колб, Э.А.; Сэмпсон, Валери Б. (01 декабря 2017 г.). «Обзор: последние достижения в области терапии ингибиторами клеточного цикла при лечении рака у детей» . Исследования рака . 77 (23): 6489–6498. дои : 10.1158/0008-5472.CAN-17-2066 . ISSN 0008-5472 . ПМК 5712276 . ПМИД 29097609 .