Точка ограничения

Точка ограничения ( R ), также известная как « Начало » или контрольная точка G 1 /S , представляет собой контрольную точку клеточного цикла в G 1 фазе животных клеточного цикла , в которой клетка становится «привязанной» к клеточному циклу, и после которой внеклеточные сигналы больше не требуются для стимуляции пролиферации. [1] Определяющей биохимической особенностью точки рестрикции является активация комплексов G 1 /S- и S-фазы циклин-CDK , которые, в свою очередь, фосфорилируют белки, инициирующие репликацию ДНК , дупликацию центросом и другие события раннего клеточного цикла. [2] Это одна из трех основных контрольных точек клеточного цикла, две другие — контрольная точка повреждения ДНК G2-M и контрольная точка веретена .
История
[ редактировать ]Первоначально Говард Мартин Темин показал, что куриные клетки достигают точки, в которой они начинают реплицировать свою ДНК и не зависят от внеклеточных сигналов. [3] Примерно 20 лет спустя, в 1973 году, Артур Парди существует единственная точка ограничения что в G1 продемонстрировал , . Ранее G1 определяли просто как время между митозом и S-фазой . Никаких молекулярных или морфологических маркеров положения клетки в G1 не было известно. Парди использовал метод двойного блока, в котором он переводил клетки из одного блока клеточного цикла (например, извлечение критических аминокислот или извлечение сыворотки) в другой и сравнивал эффективность каждого блока в предотвращении перехода к S-фазе. Он обнаружил, что обе блокады во всех рассмотренных случаях были одинаково эффективны в блокировании прогрессирования фазы S, что указывает на то, что все они должны действовать в одной и той же точке G 1 , которую он назвал «точкой ограничения» или R-точкой. [4]
В 1985 году Зеттерберг и Ларссон обнаружили, что на всех стадиях клеточного цикла лишение сыворотки приводит к ингибированию синтеза белка. Только в постмитотических клетках (т.е. клетках на ранней стадии G 1 ) удаление сыворотки приводило клетки в состояние покоя ( G 0 ). Фактически, Зеттерберг обнаружил, что практически вся изменчивость длины клеточного цикла может быть объяснена временем, которое требуется клетке для перехода от точки ограничения к S-фазе. [5]
Внеклеточные сигналы
[ редактировать ]За исключением раннего эмбрионального развития, большинство клеток в многоклеточных организмах сохраняются в состоянии покоя, известном как G 0 , где пролиферация не происходит, и клетки обычно окончательно дифференцируются; другие специализированные клетки продолжают делиться и во взрослом возрасте. Для обеих этих групп клеток было принято решение либо выйти из клеточного цикла и войти в состояние покоя (G0 ) , либо вновь войти в G1 .
Решение клетки войти или повторно войти в клеточный цикл принимается до S-фазы в G 1 в так называемой точке ограничения и определяется комбинацией стимулирующих и ингибирующих внеклеточных сигналов, которые принимаются и обрабатываются. До точки R клетка нуждается в этих внеклеточных стимуляторах, чтобы начать проходить первые три подфазы G 1 (компетентность, вход G 1a , прогрессирование G 1b ). Однако после прохождения точки R в G1b внеклеточные сигналы больше не требуются, и клетка необратимо готовится к дупликации ДНК . Дальнейшее прогрессирование регулируется внутриклеточными механизмами. Удаление стимуляторов до того, как клетка достигнет точки R, может привести к возвращению клетки в состояние покоя. [1] [3] В этих условиях клетки фактически возвращаются в клеточный цикл, и им потребуется дополнительное время (примерно на 8 часов больше, чем время вывода в культуре) после прохождения точки рестрикции, чтобы войти в S-фазу. [3]
Митогенная сигнализация
Факторы роста (например, PDGF , FGF и EGF ) регулируют вход клеток в клеточный цикл и продвижение к точке рестрикции. После прохождения этой похожей на переключатель «точки невозврата» завершение клеточного цикла больше не зависит от присутствия митогенов. [6] [4] [7] Устойчивая передача сигналов митогенов способствует входу в клеточный цикл в основном за счет регуляции циклинов G1 (циклин D1-3) и их сборки с Cdk4/6, что может осуществляться параллельно через пути MAPK и PI3K.
Сигнальный каскад МАПК
Связывание внеклеточных факторов роста с их рецепторными тирозинкиназами (RTK) запускает конформационные изменения и способствует димеризации и аутофосфорилированию тирозиновых остатков на цитоплазматическом хвосте RTK. Эти фосфорилированные остатки тирозина облегчают стыковку белков, содержащих SH2-домен (например, Grb2 ), которые впоследствии могут рекрутировать другие сигнальные белки на плазматическую мембрану и запускать сигнальные киназные каскады. RTK-ассоциированный Grb2 связывает Sos , который представляет собой фактор обмена гуаниновых нуклеотидов, который преобразует мембраносвязанный Ras в его активную форму (Ras-GDP Рас-ГТП). [8] Активный Ras активирует каскад киназы MAP, связывая и активируя Raf, который фосфорилирует и активирует MEK, который фосфорилирует и активирует ERK (также известный как MAPK, см. также путь MAPK/ERK ).
Активная ERK затем транслоцируется в ядро, где активирует несколько мишеней, таких как фактор транскрипционного фактора сывороточного ответа (SRF), что приводит к экспрессии немедленных ранних генов, особенно факторов транскрипции Fos и Myc . [8] [9] Димеры Fos/Jun включают комплекс транскрипционных факторов AP-1 и активируют гены замедленного ответа, включая основной G1 циклин , циклин D1 . [8] Myc также регулирует экспрессию широкого спектра пролиферативных и стимулирующих рост генов, включая некоторую индукцию циклина D2 и Cdk4 . [5] Кроме того, устойчивая активность ERK, по-видимому, важна для фосфорилирования и ядерной локализации CDK2 . [8] дальнейшая поддержка продвижения через точку ограничения.
Сигнализация пути PI3K
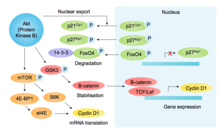
p85, другой белок, содержащий SH2-домен, связывает активированные RTK и рекрутирует PI3K (фосфоинозитид-3-киназу), фосфорилируя фосфолипид PIP2 в PIP3, что приводит к рекрутированию Akt (через его PH-домен). В дополнение к другим функциям, способствующим росту и выживанию, Akt ингибирует киназу гликогенсинтазы-3β ( GSK3β ), тем самым предотвращая опосредованное GSK3β фосфорилирование и последующую деградацию циклина D1. [10] ( см. рисунок [11] ). Akt дополнительно регулирует компоненты G1/S посредством mTOR-опосредованного стимулирования трансляции циклина D1, [12] фосфорилирование ингибиторов Cdk p27 кип1 (предотвращение ядерного импорта) и стр.21 Цип1 (снижение стабильности) и инактивация фосфорилирования фактора транскрипции FOXO4 (который регулирует экспрессию p27). [13] В совокупности эта стабилизация циклина D1 и дестабилизация ингибиторов Cdk способствуют активности G1 и G1/S-Cdk.
Антимитогенная сигнализация
Антимитогены, такие как цитокин TGF-β, ингибируют продвижение через точку рестрикции, вызывая остановку G1. Передача сигналов TGF-β активирует Smads, которые образуют комплекс с E2F4 /5, подавляя экспрессию Myc, а также связываются с Miz1, чтобы активировать экспрессию ингибитора Cdk p15. INK4b блокировать образование и активность комплекса циклин D-Cdk. [8] [14] Клетки, арестованные TGF-β, также накапливают p21 и p27. [14]
Механизм
[ редактировать ]Обзор
Как описано выше, сигналы от внеклеточных факторов роста передаются обычным образом. Фактор роста связывается с рецепторами на поверхности клетки, и различные каскады фосфорилирования приводят к образованию Ca 2+ поглощение и фосфорилирование белков. Уровни фосфопротеинов уравновешиваются фосфатазами. В конечном итоге происходит транскрипционная активация определенных генов-мишеней. Внеклеточная передача сигналов должна поддерживаться, и клетка также должна иметь доступ к достаточному количеству питательных веществ для поддержки быстрого синтеза белка. Накопление циклина D имеет важное значение. [15]
Связанные с циклином D Cdks 4 и 6 активируются Cdk-активирующей киназой и направляют клетку к точке рестрикции. Циклин D, однако, имеет высокую скорость оборота (t 1/2 <25 мин). Именно из-за такой быстрой скорости обновления клетка чрезвычайно чувствительна к уровням митогенной передачи сигналов, которые не только стимулируют выработку циклина D, но также помогают стабилизировать циклин D внутри клетки. [15] [16] Таким образом, циклин D действует как сенсор митогенного сигнала. [16] Ингибиторы Cdk (CKI), такие как белки Ink4 и p21 , помогают предотвратить неправильную активность циклина-cdk.
Активные комплексы циклин D-cdk фосфорилируют белок ретинобластомы (pRb) в ядре. Нефосфорилированный Rb действует как ингибитор G1 , предотвращая транскрипцию, опосредованную E2F . После фосфорилирования E2F активирует транскрипцию циклинов E и A. [15] [16] [17] Активный циклин E-cdk начинает накапливаться и завершает фосфорилирование pRb, как показано на рисунке. [18]
Ингибиторы Cdk и регуляция активности комплекса Cyclin D/Cdk
p27 и p21 являются стехиометрическими ингибиторами комплексов G1/S- и S-циклин-Cdk. В то время как уровни p21 повышаются во время входа в клеточный цикл, p27 обычно инактивируется по мере того, как клетки достигают поздней стадии G1. [8] Высокая плотность клеток, митогенное голодание и TGF-β приводят к накоплению p27 и остановке клеточного цикла. [14] Аналогично, повреждение ДНК и другие стрессоры повышают уровни p21, в то время как митоген-стимулированная активность ERK2 и Akt приводит к инактивации фосфорилирования p21. [19]
Ранние работы по сверхэкспрессии p27 показали, что он может связываться и ингибировать комплексы циклин D-Cdk4/6 и комплексы циклин E/A-Cdk2 in vitro и в некоторых типах клеток. [14] Однако кинетические исследования LaBaer et al. (1997) обнаружили, что титрование p21 и p27 способствует сборке комплекса циклин d-Cdk, увеличивая общую активность и ядерную локализацию комплекса. [20] Последующие исследования показали, что p27 может быть необходим для образования комплекса циклин D-Cdk, поскольку p27 -/- , стр.21 -/- MEF показали снижение комплексообразования циклин D-Cdk4, которое можно было спасти с помощью повторной экспрессии p27. [21]
Работа Джеймса и др. (2008) также предполагают, что фосфорилирование остатков тирозина на p27 может переключать p27 между ингибирующим и неингибирующим состоянием при его связывании с циклином D-Cdk4/6, предлагая модель того, как p27 способен регулировать как сборку комплекса циклин-Cdk, так и активность. [22] Ассоциация p27 с циклином D-Cdk4/6 может дополнительно способствовать прогрессированию клеточного цикла за счет ограничения пула p27, доступного для инактивации комплексов циклин E-Cdk2. [8] [23] Увеличение активности циклина E-Cdk2 в конце G1 (и циклина A-Cdk2 в начале S) приводит к фосфорилированию p21/p27, что способствует их ядерному экспорту, убиквитинированию и деградации.
Динамика
[ редактировать ]Статья, опубликованная группами Линчонг Ю и Джо Невинса в Университете Дьюка бистабильный истерический переключатель E2F в 2008 году, продемонстрировала, что в основе точки ограничения лежит . E2F способствует собственной активации, а также способствует ингибированию собственного ингибитора ( pRb ), образуя две петли обратной связи (среди прочих), которые важны для создания бистабильных систем. Авторы этого исследования использовали дестабилизированную GFP -систему под контролем промотора E2F в качестве индикатора активности E2F . Клетки, лишенные сыворотки, стимулировали различными концентрациями в сыворотке, и показания GFP записывались на уровне отдельных клеток. GFP Они обнаружили, что репортер был либо включен, либо выключен, что указывает на то, что E2F был либо полностью активирован, либо деактивирован на всех различных проанализированных уровнях сыворотки. Дальнейшие эксперименты, в которых они анализировали зависимость системы E2F от истории, подтвердили, что она работает как гистерезисный бистабильный переключатель. [24]
При раке
[ редактировать ]Рак можно рассматривать как нарушение нормальной функции точки ограничения, поскольку клетки постоянно и ненадлежащим образом повторно входят в клеточный цикл и не входят в G0 . [1] Мутации на многих этапах пути к точке ограничения могут привести к раковому росту клеток. Некоторые из генов, наиболее часто мутирующих при раке, включают Cdks и CKI; сверхактивные Cdks или недостаточно активные CKI снижают строгость точки рестрикции, позволяя большему количеству клеток обойти старение. [17]
Точка ограничения является важным фактором при разработке новых лекарственных препаратов. В нормальных физиологических условиях вся пролиферация клеток регулируется точкой рестрикции. Это можно использовать как способ защиты нераковых клеток от химиотерапии . Химиотерапевтические препараты обычно атакуют клетки, которые быстро пролиферируют. При использовании препаратов, которые ингибируют завершение точки ограничения, таких как ингибиторы рецепторов фактора роста , нормальные клетки предотвращаются от пролиферации и, таким образом, защищаются от химиотерапевтического лечения. [16]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с Парди AB (ноябрь 1989 г.). «События G1 и регуляция пролиферации клеток». Наука . 246 (4930): 603–8. Бибкод : 1989Sci...246..603P . дои : 10.1126/science.2683075 . ПМИД 2683075 .
- ^ Морган, Дэвид Оуэн, 1958- (2007). Клеточный цикл: принципы управления . Лондон: New Science Press. ISBN 978-0-19-920610-0 . ОСЛК 70173205 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Перейти обратно: а б с Зеттерберг А., Ларссон О., Виман К.Г. (декабрь 1995 г.). «Какая точка ограничения?». Современное мнение в области клеточной биологии . 7 (6): 835–42. дои : 10.1016/0955-0674(95)80067-0 . ПМИД 8608014 .
- ^ Перейти обратно: а б Парди AB (апрель 1974 г.). «Точка ограничения для контроля нормальной пролиферации клеток животных» . Труды Национальной академии наук Соединенных Штатов Америки . 71 (4): 1286–90. Бибкод : 1974PNAS...71.1286P . дои : 10.1073/pnas.71.4.1286 . JSTOR 63311 . ПМК 388211 . ПМИД 4524638 .
- ^ Перейти обратно: а б Зеттерберг А., Ларссон О (август 1985 г.). «Кинетический анализ регуляторных событий в G1, приводящих к пролиферации или покою клеток Swiss 3T3» . Труды Национальной академии наук Соединенных Штатов Америки . 82 (16): 5365–9. Бибкод : 1985PNAS...82.5365Z . дои : 10.1073/pnas.82.16.5365 . JSTOR 25651 . ПМК 390569 . ПМИД 3860868 .
- ^ Благосклонный М.В., Парди А.Б. (2002). «Точка ограничения клеточного цикла» . Клеточный цикл . 1 (2): 103–10. дои : 10.4161/cc.1.2.108 . ПМИД 12429916 .
- ^ Парди AB (апрель 1974 г.). «Точка ограничения для контроля нормальной пролиферации клеток животных» . Труды Национальной академии наук Соединенных Штатов Америки . 71 (4): 1286–90. Бибкод : 1974PNAS...71.1286P . дои : 10.1073/pnas.71.4.1286 . ПМК 388211 . ПМИД 4524638 .
- ^ Перейти обратно: а б с д и ж г Морган Д.О. (2007). Клеточный цикл: принципы управления . Новая научная пресса. стр. 208–213.
- ^ Адикари С., Эйлерс М. (август 2005 г.). «Регуляция транскрипции и трансформация белками Myc». Обзоры природы. Молекулярно-клеточная биология . 6 (8): 635–45. дои : 10.1038/nrm1703 . ПМИД 16064138 . S2CID 1290731 .
- ^ Диль Дж.А., Ченг М., Руссель М.Ф., Шерр С.Дж. (ноябрь 1998 г.). «Киназа гликогенсинтазы-3бета регулирует протеолиз циклина D1 и субклеточную локализацию» . Гены и развитие . 12 (22): 3499–511. дои : 10.1101/gad.12.22.3499 . ПМК 317244 . ПМИД 9832503 .
- ^ ВанАрсдейл Т., Бошофф С., Арндт К.Т., Абрахам Р.Т. (июль 2015 г.). «Молекулярные пути: воздействие на ось циклина D-CDK4/6 для лечения рака». Клинические исследования рака . 21 (13): 2905–10. дои : 10.1158/1078-0432.CCR-14-0816 . ПМИД 25941111 .
- ^ Хэй Н., Соненберг Н. (август 2004 г.). «Вверх и вниз по течению от mTOR» . Гены и развитие . 18 (16): 1926–45. дои : 10.1101/gad.1212704 . ПМИД 15314020 .
- ^ Лу З, Хантер Т (июнь 2010 г.). «Убиквитилирование и протеасомная деградация ингибиторов CDK p21(Cip1), p27(Kip1) и p57(Kip2)» . Клеточный цикл . 9 (12): 2342–52. дои : 10.4161/cc.9.12.11988 . ПМК 3319752 . ПМИД 20519948 .
- ^ Перейти обратно: а б с д Ши Ю, Массаге Дж (июнь 2003 г.). «Механизмы передачи сигналов TGF-бета от клеточной мембраны к ядру» . Клетка . 113 (6): 685–700. дои : 10.1016/S0092-8674(03)00432-X . ПМИД 12809600 .
- ^ Перейти обратно: а б с Шерр CJ, Робертс JM (май 1995 г.). «Ингибиторы циклинзависимых киназ G1 млекопитающих» . Гены и развитие . 9 (10): 1149–63. дои : 10.1101/gad.9.10.1149 . ПМИД 7758941 .
- ^ Перейти обратно: а б с д Благосклонный М.В., Парди А.Б. (2001). «Точка ограничения клеточного цикла» . В Благосклонном М.В. (ред.). Контрольные точки клеточного цикла и рак . Остин: Landes Bioscience. стр. 52–?. ISBN 978-1-58706-067-0 .
- ^ Перейти обратно: а б Малумбрес М., Барбацид М. (декабрь 2001 г.). «Ездить на велосипеде или не ездить на велосипеде: критическое решение при раке». Обзоры природы. Рак . 1 (3): 222–31. дои : 10.1038/35106065 . ПМИД 11902577 . S2CID 1967666 .
- ^ Холсбергер Д.Р., Кук П.С. (октябрь 2005 г.). «Понимание роли гормона щитовидной железы в развитии клеток Сертоли: механистическая гипотеза». Исследования клеток и тканей . 322 (1): 133–40. дои : 10.1007/s00441-005-1082-z . ПМИД 15856309 . S2CID 24033821 .
- ^ Шерр CJ, Робертс JM (июнь 1999 г.). «Ингибиторы CDK: положительные и отрицательные регуляторы прогрессирования G1-фазы» . Гены и развитие . 13 (12): 1501–12. дои : 10.1101/gad.13.12.1501 . ПМИД 10385618 .
- ^ ЛаБэр Дж., Гаррет М.Д., Стивенсон Л.Ф., Слингерленд Дж.М., Сандху С., Чоу Х.С., Фаттей А., Харлоу Э. (апрель 1997 г.). «Новая функциональная активность ингибиторов CDK семейства p21» . Гены и развитие . 11 (7): 847–62. дои : 10.1101/gad.11.7.847 . ПМИД 9106657 .
- ^ Ченг М., Оливье П., Диль Дж.А., Феро М., Руссель М.Ф., Робертс Дж.М., Шерр С.Дж. (март 1999 г.). «Ингибиторы CDK p21(Cip1) и p27(Kip1) являются важными активаторами циклин-D-зависимых киназ в мышиных фибробластах» . Журнал ЭМБО . 18 (6): 1571–83. дои : 10.1093/emboj/18.6.1571 . ПМЦ 1171245 . ПМИД 10075928 .
- ^ Джеймс М.К., Рэй А., Лезнова Д., Блейн С.В. (январь 2008 г.). «Дифференциальная модификация p27Kip1 контролирует его ингибирующую активность циклина D-cdk4» . Молекулярная и клеточная биология . 28 (1): 498–510. дои : 10.1128/MCB.02171-06 . ПМК 2223302 . ПМИД 17908796 . (В настоящее время в этом документе выражается обеспокоенность , см. дои : 10.1128/mcb.00323-22 , ПМИД 35993718 )
- ^ Гоэл С., ДеКристо М.Дж., Макаллистер С.С., Чжао Дж.Дж. (ноябрь 2018 г.). «Ингибирование CDK4/6 при раке: помимо остановки клеточного цикла» . Тенденции в клеточной биологии . 28 (11): 911–925. дои : 10.1016/j.tcb.2018.07.002 . ПМК 6689321 . ПМИД 30061045 .
- ^ Яо Дж., Ли Т.Дж., Мори С., Невинс-младший, Ю Л. (апрель 2008 г.). «Бистабильный переключатель Rb-E2F лежит в основе точки ограничения». Природная клеточная биология . 10 (4): 476–82. дои : 10.1038/ncb1711 . ПМИД 18364697 . S2CID 19089771 .
