Циклинзависимая киназа 2
| CDK2 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | CDK2 , циклинзависимая киназа 2, A630093N05Rik, CDKN2, p33(CDK2), циклинзависимая киназа 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 116953 ; МГИ : 104772 ; Гомологен : 74409 ; Генные карты : CDK2 ; OMA : CDK2 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Циклин-зависимая киназа 2 , также известная как протеинкиназа 2 клеточного деления или Cdk2, представляет собой фермент , который у человека кодируется CDK2 геном . [5] [6] Белок , кодируемый этим геном, является членом циклин-зависимых киназ семейства протеинкиназ Ser/Thr . Эта протеинкиназа очень похожа на генные продукты S. cerevisiae cdc28 и cdc2 S. pombe , также известные как Cdk1 у людей . Это каталитическая субъединица комплекса циклин-зависимой киназы , активность которой ограничена фазой G1-S клеточного цикла , когда клетки вырабатывают белки, необходимые для митоза, и реплицируют свою ДНК. Этот белок связывается с регуляторными субъединицами комплекса, включая циклин E или A, и регулируется ими . Циклин E связывает фазу G1 Cdk2, который необходим для перехода от фазы G1 к фазе S, тогда как связывание с циклином A необходимо для прохождения фазы S. [7] Его активность также регулируется фосфорилированием . Сообщалось о множестве альтернативно сплайсированных вариантов и множественных сайтах инициации транскрипции этого гена. [8] Роль этого белка в переходе G1-S недавно была поставлена под сомнение, поскольку сообщается, что клетки, лишенные Cdk2, не имеют проблем во время этого перехода. [9]
Незаменимость в нормально функционирующих тканях
[ редактировать ]Оригинальные эксперименты на клеточных культурах продемонстрировали остановку клеточного цикла при переходе G1-S в результате делеции Cdk2. [10] Более поздние эксперименты показали, что делеции Cdk2 удлиняют клеточного фазу G1 цикла в фибробластах эмбрионов мышей. Однако после этого периода они все же вошли в фазу S и смогли завершить оставшиеся фазы клеточного цикла. [11] Когда у мышей удалили Cdk2, животные остались жизнеспособными, несмотря на уменьшение размера тела. Однако мейотическая функция как самцов, так и самок мышей была ингибирована. Это предполагает, что Cdk2 не важен для клеточного цикла здоровых клеток, но необходим для мейоза и размножения. [10] Клетки у мышей, нокаутных по Cdk2, вероятно, подвергаются меньшему количеству делений, что способствует уменьшению размера тела. Половые клетки также перестают делиться в профазе мейоза, что приводит к репродуктивному бесплодию. [11] В настоящее время считается, что Cdk1 компенсирует многие аспекты делеции Cdk2, за исключением мейотической функции. [10]
Механизм активации
[ редактировать ]Циклинзависимая киназа 2 состоит из двух долей. Доля, начинающаяся с N-конца (N-доля), содержит множество бета-листов, а доля С-конца (С-доля) богата альфа-спиралями. [7] Cdk2 способен связываться со многими различными циклинами, включая циклины A, B, E и, возможно, C. [10] Недавние исследования показывают, что Cdk2 предпочтительно связывается с циклинами A и E, тогда как Cdk1 предпочитает циклины A и B. [12]
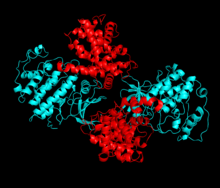
Cdk2 становится активным, когда белок циклин (А или Е) связывается в активном сайте, расположенном между долями N и C киназы. Благодаря расположению активного сайта партнерские циклины взаимодействуют с обеими долями Cdk2. Cdk2 содержит важную альфа-спираль, расположенную в доле C киназы, называемую C-спиралью или PSTAIRE-спиралью. Гидрофобные взаимодействия заставляют С-спираль связываться с другой спиралью активирующего циклина. Активация вызывает конформационные изменения, при которых спираль вращается и приближается к N-доле. [ нужна ссылка ] Это позволяет глутаминовой кислоте, расположенной на С-спирали, образовывать ионную пару с близлежащей боковой цепью лизина. Значение этого движения в том, что оно приводит сторонуцепь Glu 51, которая принадлежит к триаде остатков каталитического сайтаконсервативен во всех эукариотических киназах, в каталитическом сайте. Этоттриада (Lys 33, Glu 51 и Asp 145) участвует в фосфате АТФ.ориентация и координация магния, и считается, чтокритически важен для катализа. Это конформационное изменение также перемещает петлю активации в С-долю, открывая сайт связывания АТФ, который теперь доступен для новых взаимодействий. Наконец, остаток треонина-160 подвергается воздействию и фосфорилируется, поскольку сегмент активации C-доли вытесняется из каталитического сайта, и остаток треонина больше не является стерически затрудненным. Фосфорилированный остаток треонина обеспечивает стабильность конечной конформации фермента. Важно отметить, что на протяжении всего процесса активации циклины, связывающиеся с Cdk2, не претерпевают каких-либо конформационных изменений. [14] [7]

Роль в репликации ДНК
[ редактировать ]Успех процесса деления клеток зависит от точной регуляции процессов как на клеточном, так и на тканевом уровне. Сложные взаимодействия между белками и ДНК внутри клетки позволяют передавать геномную ДНК дочерним клеткам. Взаимодействия между клетками и белками внеклеточного матрикса позволяют новым клеткам внедряться в существующие ткани. На клеточном уровне процесс контролируется различными уровнями циклинзависимых киназ (Cdks) и их партнеров циклинов. Клетки используют различные контрольные точки как средство задержки развития клеточного цикла до тех пор, пока он не сможет устранить дефекты. [16]
Cdk2 активен во время фаз G1 и S клеточного цикла и, следовательно, действует как контрольная точка фазы G1 - S. Перед фазой G1 уровни Cdk4 и Cdk6 увеличиваются вместе с циклином D. Это позволяет частично фосфорилировать Rb и частичную активацию E2F в начале фазы G1 , что способствует синтезу циклина E и увеличению активности Cdk2. В конце G1 фазы комплекс Cdk2/Циклин Е достигает максимальной активности и играет значительную роль в инициации S-фазы. [17] G 1 -S Другие белки, не относящиеся к Cdk, также становятся активными во время фазового перехода . Например, белки ретинобластомы (Rb) и p27 фосфорилируются комплексами Cdk2 – циклин A/E, полностью деактивируя их. [18] Это позволяет факторам транскрипции E2F экспрессировать гены, которые способствуют переходу в S-фазу, где ДНК реплицируется перед делением. [19] [20] [18] Кроме того, NPAT, известный субстрат комплекса Cdk2-циклин E, активирует транскрипцию гена гистонов при фосфорилировании. [21] Это увеличивает синтез белков-гистонов (основного белкового компонента хроматина) и впоследствии поддерживает стадию репликации ДНК клеточного цикла. Наконец, в конце S-фазы убиквитиновая протеасома разрушает циклин Е. [11]
Пролиферация раковых клеток
[ редактировать ]Хотя Cdk2 в основном не нужен в клеточном цикле нормально функционирующих клеток, он имеет решающее значение для аномальных процессов роста раковых клеток. Ген CCNE1 продуцирует циклин E, один из двух основных белков-партнеров Cdk2. Сверхэкспрессия CCNE1 происходит во многих опухолевых клетках, в результате чего клетки становятся зависимыми от Cdk2 и циклина E. [12] Аномальная активность циклина Е также наблюдается при раке молочной железы, легких, колоректальном раке, раке желудка и костей, а также при лейкемии и лимфоме. [17] Аналогично, аномальная экспрессия циклина А2 связана с хромосомной нестабильностью и пролиферацией опухоли, тогда как ингибирование приводит к замедлению роста опухоли. [22] Таким образом, CDK2 и его партнеры по связыванию циклина представляют собой возможные терапевтические мишени для новых методов лечения рака. [12] Доклинические модели показали предварительный успех в ограничении роста опухоли, а также снижение побочных эффектов современных химиотерапевтических препаратов. [23] [24] [25]
Идентификация селективных ингибиторов Cdk2 затруднена из-за чрезвычайного сходства активных центров Cdk2 и других Cdk, особенно Cdk1. [12] Cdk1 является единственной незаменимой циклин-зависимой киназой в клеточном цикле, и ее ингибирование может привести к непредвиденным побочным эффектам. [26] Большинство кандидатов-ингибиторов CDK2 нацелены на сайт связывания АТФ и могут быть разделены на два основных подкласса: тип I и тип II. Ингибиторы типа I конкурентно нацелены на сайт связывания АТФ в его активном состоянии. Ингибиторы типа II нацелены на CDK2 в несвязанном состоянии, занимая либо сайт связывания АТФ, либо гидрофобный карман внутри киназы. Считается, что ингибиторы типа II более селективны. [24] Недавно доступность новых кристаллических структур CDK привела к идентификации потенциального сайта аллостерического связывания вблизи С-спирали. Ингибиторы этого аллостерического сайта классифицируются как ингибиторы типа III. [27] Другая возможная цель — Т-петля CDK2. Когда циклин А связывается с CDK2, N-концевая доля вращается, активируя сайт связывания АТФ и меняя положение петли активации, называемой Т-петлей. [28]
Ингибиторы
[ редактировать ]Интерпретация динамического моделирования и исследования свободной энергии связывания показали, что Лиганд2 (из 17 синтезированных собственными силами пирролон-конденсированных бензосубереновых соединений (PBS)) обладает стабильной и эквивалентной свободной энергией флавопиридола, SU9516 и ингибиторов CVT-313. Лиганд2 тщательно исследовался как селективный ингибитор CDK2 без нецелевого связывания (CDK1 и CDK9) на основании эффективности лиганда и аффинности связывания. [29]

Известными ингибиторами CDK являются p21Cip1 ( CDKN1A ) и p27Kip1 ( CDKN1B ). [30]
Препараты, которые ингибируют Cdk2 и останавливают клеточный цикл, такие как GW8510 и экспериментальный противораковый препарат селициклиб , могут снижать чувствительность эпителия ко многим противоопухолевым агентам, активным в клеточном цикле, и, следовательно, представляют собой стратегию предотвращения алопеции, вызванной химиотерапией . [31]
Метиловый эфир розмариновой кислоты представляет собой ингибитор Cdk2 растительного происхождения, который, как было показано, подавляет пролиферацию гладкомышечных клеток сосудов и уменьшает образование неоинтимы на рестеноза мышей. модели [32]
См. также галерею PDB ниже, показывающую взаимодействие со многими ингибиторами (включая пурваланол B).
Генная регуляция
[ редактировать ]В меланоцитарных типах клеток экспрессия гена CDK2 регулируется транскрипционным фактором, связанным с микрофтальмией . [33] [34]
Взаимодействия
[ редактировать ]Было показано, что циклинзависимая киназа 2 взаимодействует с:
- БРЦА1 , [35] [36] [37]
- CDK2AP1 , [38]
- CDKN1B [39] [40] [41] [42] [43]
- ЦДКН3 , [44] [45] [46]
- СЕБПА , [47]
- Циклин А1 , [48] [49] [50] [51]
- Циклин Е1 , [39] [52] [53] [54] [55] [56]
- Эндонуклеаза, специфичная для лоскутной структуры 1 , [57]
- ОРЦ1Л , [58]
- П21 , [43] [46] [53] [59] [60]
- ППМ1Б , [61]
- ППП2КА , [61]
- Ретинобластомоподобный белок 1 , [52] [62]
- Ретинобластомоподобный белок 2 , [52] [63] и
- СКП2 . [40] [59] [64]

Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000123374 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000025358 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Цай Л.Х., Харлоу Э., Мейерсон М. (сентябрь 1991 г.). «Выделение человеческого гена cdk2, который кодирует киназу p33, связанную с циклином A и аденовирусом E1A». Природа . 353 (6340): 174–7. Бибкод : 1991Natur.353..174T . дои : 10.1038/353174a0 . ПМИД 1653904 . S2CID 4358953 .
- ^ «Ген Энтрез: циклинзависимая киназа 2 CDK2» .
- ^ Jump up to: а б с Эшальер А., Эндикотт Дж. А., Нобл МЭ (март 2010 г.). «Последние разработки в области биохимических и структурных исследований циклинзависимой киназы». Biochimica et Biophysical Acta (BBA) - Белки и протеомика . 1804 (3): 511–9. дои : 10.1016/j.bbapap.2009.10.002 . ПМИД 19822225 .
- ^ «Ген Энтрез: циклинзависимая киназа 2 CDK2» .
- ^ Берте С., Алим Э., Коппола В., Тессаролло Л., Калдис П. (октябрь 2003 г.). «Мыши с нокаутом Cdk2 жизнеспособны» . Современная биология . 13 (20): 1775–85. Бибкод : 2003CBio...13.1775B . дои : 10.1016/j.cub.2003.09.024 . ПМИД 14561402 . S2CID 14320937 .
- ^ Jump up to: а б с д Сатьянараяна А., Калдис П. (август 2009 г.). «Регуляция клеточного цикла млекопитающих: несколько Cdks, многочисленные циклины и разнообразные компенсаторные механизмы» . Онкоген . 28 (33): 2925–39. дои : 10.1038/onc.2009.170 . ПМИД 19561645 .
- ^ Jump up to: а б с Су Т.Т., Стампфф Дж. (март 2004 г.). «Правила распущенности? Ненужность циклина E и Cdk2» . СТКЭ науки . 2004 (224): пе11. дои : 10.1126/stke.2242004pe11 . ПМЦ 3242733 . ПМИД 15026579 .
- ^ Jump up to: а б с д Вуд DJ, Корольчук С., Татум Н.Дж., Ван Л.З., Эндикотт Дж.А., Нобл М.Э., Мартин М.П. (ноябрь 2018 г.). «Различия в конформационном энергетическом ландшафте CDK1 и CDK2 предполагают механизм достижения избирательного ингибирования CDK» . Клеточная химическая биология . 26 (1): 121–130.e5. doi : 10.1016/j.chembiol.2018.10.015 . ПМК 6344228 . ПМИД 30472117 .
- ^ ВВП : 1FIN ; Джеффри П.Д., Руссо А.А., Поляк К., Гиббс Э., Гурвиц Дж., Массаге Дж., Павлетич Н.П. (июль 1995 г.). «Механизм активации CDK, выявленный структурой комплекса циклинА-CDK2». Природа . 376 (6538): 313–20. Бибкод : 1995Natur.376..313J . дои : 10.1038/376313a0 . ПМИД 7630397 . S2CID 4361179 .
- ^ Малумбрес М (30 июня 2014 г.). «Циклинзависимые киназы» . Геномная биология . 15 (6): 122. дои : 10.1186/gb4184 . ПМК 4097832 . ПМИД 25180339 .
- ^ PDB : 1W98 ; Хонда Р., Лоу Э.Д., Дубинина Е., Скамнаки В., Кук А., Браун Н.Р., Джонсон Л.Н. (февраль 2005 г.). «Структура циклина E1/CDK2: значение активации CDK2 и независимая от CDK2 роль» . Журнал ЭМБО . 24 (3): 452–63. дои : 10.1038/sj.emboj.7600554 . ПМК 548659 . ПМИД 15660127 .
- ^ Бартек Дж., Лукас С., Лукас Дж. (октябрь 2004 г.). «Проверка повреждений ДНК в S-фазе». Обзоры природы. Молекулярно-клеточная биология . 5 (10): 792–804. дои : 10.1038/nrm1493 . ПМИД 15459660 . S2CID 33560392 .
- ^ Jump up to: а б Карузо Дж.А., Дуонг М.Т., Кэри Дж.П., Хант К.К., Кейомарси К. (октябрь 2018 г.). «Низкомолекулярный циклин Е при раке человека: клеточные последствия и возможности таргетной терапии» . Исследования рака . 78 (19): 5481–5491. дои : 10.1158/0008-5472.can-18-1235 . ПМК 6168358 . ПМИД 30194068 .
- ^ Jump up to: а б Джачинти С, Джордано А (август 2006 г.). «РБ и прогрессирование клеточного цикла» . Онкоген . 25 (38): 5220–7. дои : 10.1038/sj.onc.1209615 . ПМИД 16936740 .
- ^ Кобриник Д. (апрель 2005 г.). «Карманные белки и контроль клеточного цикла» . Онкоген . 24 (17): 2796–809. дои : 10.1038/sj.onc.1208619 . ПМИД 15838516 .
- ^ Молекулярная основа рака . Мендельсон, Джон, 1936-, Грей, Джо В., Хоули, Питер М., Израиль, Марк А., Томпсон, Крейг (Крейг Б.) (Четвертое изд.). Филадельфия, Пенсильвания. 2015. ISBN 978-1-4557-4066-6 . OCLC 870870610 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) CS1 maint: другие ( ссылка ) - ^ Чжао Дж., Кеннеди Б.К., Лоуренс Б.Д., Барби Д.А., Матера А.Г., Флетчер Дж.А., Харлоу Э. (сентябрь 2000 г.). «NPAT связывает циклин E-Cdk2 с регуляцией репликационно-зависимой транскрипции генов гистонов» . Гены и развитие . 14 (18): 2283–97. дои : 10.1101/gad.827700 . ПМК 316937 . ПМИД 10995386 .
- ^ Гопинатан Л., Тан С.Л., Падмакумар В.К., Коппола В., Тессаролло Л., Калдис П. (июль 2014 г.). «Потеря Cdk2 и циклина А2 ухудшает пролиферацию клеток и онкогенез» . Исследования рака . 74 (14): 3870–9. дои : 10.1158/0008-5472.CAN-13-3440 . ПМК 4102624 . ПМИД 24802190 .
- ^ Ся П., Лю Ю, Чэнь Дж., Коутс С., Лю Д., Ченг З. (октябрь 2018 г.). «Ингибирование циклин-зависимой киназы 2 защищает от апоптоза кардиомиоцитов и кардиомиопатии, индуцированного доксорубицином» . Журнал биологической химии . 293 (51): 19672–19685. дои : 10.1074/jbc.ra118.004673 . ПМК 6314117 . ПМИД 30361442 .
- ^ Jump up to: а б Уиттакер С.Р., Маллингер А., Уоркман П., Кларк П.А. (май 2017 г.). «Ингибиторы циклинзависимых киназ как средства лечения рака» . Фармакология и терапия . 173 : 83–105. doi : 10.1016/j.pharmthera.2017.02.008 . ПМК 6141011 . ПМИД 28174091 .
- ^ Циценас Дж., Калян К., Сорокинас А., Станкунас Е., Леви Дж., Мескините И., Станкявичюс В., Каупинис А., Валюс М. (июнь 2015 г.). «Росковитин при раке и других заболеваниях» . Анналы трансляционной медицины . 3 (10): 135. doi : 10.3978/j.issn.2305-5839.2015.03.61 . ПМК 4486920 . ПМИД 26207228 .
- ^ Браун Н.Р., Корольчук С., Мартин М.П., Стэнли В.А., Мухаметцианов Р., Нобл М.Э., Эндикотт Дж.А. (апрель 2015 г.). «Структуры CDK1 обнаруживают консервативные и уникальные особенности CDK, необходимого для клеточного цикла» . Природные коммуникации . 6 : 6769. Бибкод : 2015NatCo...6.6769B . дои : 10.1038/ncomms7769 . ПМЦ 4413027 . ПМИД 25864384 .
- ^ Растелли Г., Анигоро А., Чипкова М., Каррасса Л., Брогджини М. (09.06.2014). «Структурное открытие первых аллостерических ингибиторов циклинзависимой киназы 2» . Клеточный цикл . 13 (14): 2296–305. дои : 10.4161/cc.29295 . ПМК 4111683 . ПМИД 24911186 .
- ^ Пеллерано М., Чернюк С., Пералс К., Нгок Ван Т.Н., Гарсин Э., Мауто-Бетцер Ф., Теулад-Фишо член парламента, Моррис М.К. (август 2017 г.). «Нацеленная на конформационную активацию киназы CDK2». Биотехнологический журнал . 12 (8): 1600531. doi : 10.1002/biot.201600531 . ПМИД 28430399 .
- ^ Jump up to: а б Сингх Р., Бхардвадж В.К., Шарма Дж., Дас П., Пурохит Р. (март 2021 г.). «Идентификация селективного ингибитора циклин-зависимой киназы 2 из библиотеки пирролон-слитых бензосубереновых соединений: исследование in silico» . Журнал биомолекулярной структуры и динамики . 40 (17): 7693–7701. дои : 10.1080/07391102.2021.1900918 . ПМИД 33749525 . S2CID 232309609 .
- ^ Левкау Б., Кояма Х., Рейнс Э.В., Клерман Б.Е., Херрен Б., Орт К., Робертс Дж.М., Росс Р. (март 1998 г.). «Расщепление p21Cip1/Waf1 и p27Kip1 опосредует апоптоз эндотелиальных клеток посредством активации Cdk2: роль каспазного каскада» . Молекулярная клетка . 1 (4): 553–63. дои : 10.1016/S1097-2765(00)80055-6 . ПМИД 9660939 .
- ^ Дэвис С.Т., Бенсон Б.Г., Брэмсон Х.Н., Чепмен Д.Э., Дикерсон Ш., Долд К.М., Эбервейн Д.Д., Эдельштейн М., Фрай С.В., Гампе Р.Т., Гриффин Р.Дж., Харрис П.А., Хасселл А.М., Холмс В.Д., Хантер Р.Н., Ник В.Б., Лэки К. , Лавджой Б., Луццио М.Дж., Мюррей Д., Паркер П., Рок В.Дж., Шевчук Л., Вил Дж.М., Уокер Д.Х., Кайпер Л.Ф. (январь 2001 г.). «Профилактика алопеции, вызванной химиотерапией, у крыс с помощью ингибиторов CDK». Наука . 291 (5501): 134–7. Бибкод : 2001Sci...291..134D . дои : 10.1126/science.291.5501.134 . ПМИД 11141566 . (Отозвано, см. дои : 10.1126/science.298.5602.2327b , ПМИД 12526115 )
- ^ Лю Р., Хейсс Э.Х., Вальтенбергер Б., Блажевич Т., Шахнер Д., Цзян Б., Кристоф В., Лю В., Швайгер С., Пенья-Родригес Л.М., Бреусс Х.М., Ступпнер Х., Дирш В.М., Атанасов А.Г. (апрель 2018 г.). «Компоненты средиземноморских специй, противодействующие пролиферации сосудистых гладкомышечных клеток: идентификация и характеристика метилового эфира розмариновой кислоты как нового ингибитора». Молекулярное питание и пищевые исследования . 62 (7): e1700860. дои : 10.1002/mnfr.201700860 . ПМИД 29405576 . S2CID 4634007 .
- ^ Ду Дж., Видлунд Х.Р., Хорстманн М.А., Рамасвами С., Росс К., Хубер В.Е., Нисимура Э.К., Голуб Т.Р., Фишер Д.Е. (декабрь 2004 г.). «Критическая роль CDK2 в росте меланомы связана с его специфической для меланоцитов регуляцией транскрипции с помощью MITF» . Раковая клетка . 6 (6): 565–76. дои : 10.1016/j.ccr.2004.10.014 . ПМИД 15607961 .
- ^ Хук К.С., Шлегель Н.К., Айххофф О.М., Видмер Д.С., Преториус С., Эйнарссон С.О., Валгейрсдоттир С., Бергштейнсдоттир К., Щепский А., Даммер Р., Штайнгримссон Е. (декабрь 2008 г.). «Новые цели MITF идентифицированы с использованием двухэтапной стратегии микрочипов ДНК» . Исследование пигментных клеток и меланомы . 21 (6): 665–76. дои : 10.1111/j.1755-148X.2008.00505.x . ПМИД 19067971 . S2CID 24698373 .
- ^ Чен Ю, Фармер А.А., Чен К.Ф., Джонс Д.С., Чен П.Л., Ли В.Х. (июль 1996 г.). «BRCA1 представляет собой ядерный фосфопротеин массой 220 кДа, который экспрессируется и фосфорилируется в зависимости от клеточного цикла». Исследования рака . 56 (14): 3168–72. ПМИД 8764100 .
- ^ Раффнер Х., Цзян В., Крейг А.Г., Хантер Т., Верма И.М. (июль 1999 г.). «BRCA1 фосфорилируется по серину 1497 in vivo в сайте фосфорилирования циклин-зависимой киназы 2» . Молекулярная и клеточная биология . 19 (7): 4843–54. дои : 10.1128/MCB.19.7.4843 . ПМЦ 84283 . ПМИД 10373534 .
- ^ Ван Х., Шао Н., Дин К.М., Цуй Дж., Редди Э.С., Рао В.Н. (июль 1997 г.). «Белки BRCA1 транспортируются в ядро в отсутствие сывороточных и сплайсинговых вариантов BRCA1a, BRCA1b представляют собой тирозиновые фосфопротеины, которые связываются с E2F, циклинами и циклинзависимыми киназами» . Онкоген . 15 (2): 143–57. дои : 10.1038/sj.onc.1201252 . ПМИД 9244350 .
- ^ Шинтани С., Охяма Х., Чжан Х., Макбрайд Дж., Мацуо К., Цудзи Т., Ху М.Г., Ху Г., Коно Ю., Лерман М., Тодд Р., Вонг Д.Т. (сентябрь 2000 г.). «p12(DOC-1) представляет собой новый белок, ассоциированный с циклинзависимой киназой 2» . Молекулярная и клеточная биология . 20 (17): 6300–7. дои : 10.1128/MCB.20.17.6300-6307.2000 . ПМК 86104 . ПМИД 10938106 .
- ^ Jump up to: а б Коннор М.К., Котчетков Р., Кариу С., Реш А., Лупетти Р., Бенистон Р.Г., Мельхиор Ф., Хенгст Л., Слингерланд Дж.М. (январь 2003 г.). «CRM1/Ran-опосредованный ядерный экспорт p27 (Kip1) включает сигнал ядерного экспорта и связывает экспорт p27 и протеолиз» . Молекулярная биология клетки . 14 (1): 201–13. дои : 10.1091/mbc.E02-06-0319 . ПМК 140238 . ПМИД 12529437 .
- ^ Jump up to: а б Рознер М., Хенгстшлегер М. (ноябрь 2004 г.). «Туберин связывает p27 и негативно регулирует его взаимодействие с компонентом SCF Skp2» . Журнал биологической химии . 279 (47): 48707–15. дои : 10.1074/jbc.M405528200 . ПМИД 15355997 .
- ^ Юн СК, Чо Х.Дж., Ким Ш., Ким Х.Б., Ким М.Х., Чанг И.Ю., Ли Дж.С., Чунг М.Х., Хам К.С., Ю Х.Дж. (февраль 2005 г.). «Экспрессия Bcl-2 подавляет активность восстановления несоответствий посредством ингибирования транскрипционной активности E2F». Природная клеточная биология . 7 (2): 137–47. дои : 10.1038/ncb1215 . ПМИД 15619620 . S2CID 42766325 .
- ^ Портер Л.А., Конг-Бельтран М., Донохью DJ (сентябрь 2003 г.). «Spy1 взаимодействует с p27Kip1, обеспечивая прогрессирование G1/S» . Молекулярная биология клетки . 14 (9): 3664–74. doi : 10.1091/mbc.E02-12-0820 . ЧВК 196558 . ПМИД 12972555 .
- ^ Jump up to: а б Ло Б.К., Читил А., Дюмон Н., Гамильтон Э.Г., Уолтнер-Лоу М.Э., Аакре М.Э., Ковингтон С., Мозес Х.Л. (декабрь 2002 г.). «Рапамицин потенцирует остановку роста, вызванную трансформирующим фактором роста бета, в нетрансформированных, онкогенно-трансформированных и раковых клетках человека» . Молекулярная и клеточная биология . 22 (23): 8184–98. дои : 10.1128/mcb.22.23.8184-8198.2002 . ПМК 134072 . ПМИД 12417722 .
- ^ Йе КТ, Лу СК, Чао СН, Чао МЛ (май 2003 г.). «Отмена взаимодействия между циклин-зависимой киназой 2 и Cdk-ассоциированной протеинфосфатазой с помощью усеченного мутанта KAP». Связь с биохимическими и биофизическими исследованиями . 305 (2): 311–4. дои : 10.1016/s0006-291x(03)00757-5 . ПМИД 12745075 .
- ^ Хэннон Дж.Дж., Кассо Д., Бич Д. (март 1994 г.). «KAP: фосфатаза двойной специфичности, которая взаимодействует с циклин-зависимыми киназами» . Труды Национальной академии наук Соединенных Штатов Америки . 91 (5): 1731–5. Бибкод : 1994PNAS...91.1731H . дои : 10.1073/pnas.91.5.1731 . ПМЦ 43237 . ПМИД 8127873 .
- ^ Jump up to: а б Харпер Дж.В., Адами Г.Р., Вэй Н., Кейомарси К., Элледж С.Дж. (ноябрь 1993 г.). «Белок Cip1, взаимодействующий с p21 Cdk, является мощным ингибитором циклин-зависимых киназ G1» . Клетка . 75 (4): 805–16. дои : 10.1016/0092-8674(93)90499-г . ПМИД 8242751 .
- ^ Ван Х, Якова П., Уайлд М., Велм А., Гуд Т., Рослер В.Дж., Тимченко Н.А. (октябрь 2001 г.). «C/EBPalpha останавливает пролиферацию клеток посредством прямого ингибирования Cdk2 и Cdk4» . Молекулярная клетка . 8 (4): 817–28. дои : 10.1016/s1097-2765(01)00366-5 . ПМИД 11684017 .
- ^ Суини С., Мерфи М., Кубелка М., Равник С.Е., Хокинс К.Ф., Уолгемут DJ, Кэррингтон М. (январь 1996 г.). «Отдельный циклин А экспрессируется в зародышевых клетках мыши». Разработка . 122 (1): 53–64. дои : 10.1242/dev.122.1.53 . ПМИД 8565853 .
- ^ Ян Р., Морозетти Р., Коффлер Х.П. (март 1997 г.). «Характеристика второго человеческого циклина А, который высоко экспрессируется в семенниках и в нескольких линиях лейкозных клеток». Исследования рака . 57 (5): 913–20. ПМИД 9041194 .
- ^ Мюллер-Тидоу С., Ван В., Идос Г.Е., Дидерихс С., Ян Р., Ридхед С., Бердель В.Е., Подача Х., Сэвилл М., Уотсон Р., Кёффлер Х.П. (апрель 2001 г.). «Циклин A1 напрямую взаимодействует с B-myb, а циклин A1/cdk2 фосфорилирует B-myb по функционально важным остаткам серина и треонина: тканеспецифическая регуляция функции B-myb» . Кровь . 97 (7): 2091–7. дои : 10.1182/blood.v97.7.2091 . ПМИД 11264176 .
- ^ Браун Н.Р., Ноубл М.Э., Эндикотт Дж.А., Джонсон Л.Н. (ноябрь 1999 г.). «Структурная основа специфичности субстрата и рекрутинговых пептидов циклин-зависимых киназ». Природная клеточная биология . 1 (7): 438–43. дои : 10.1038/15674 . ПМИД 10559988 . S2CID 17988582 .
- ^ Jump up to: а б с Шанахан Ф, Сегецци В, Парри Д, Махони Д, Лиз Э (февраль 1999 г.). «Циклин E связывается с BAF155 и BRG1, компонентами комплекса SWI-SNF млекопитающих, и изменяет способность BRG1 вызывать остановку роста» . Молекулярная и клеточная биология . 19 (2): 1460–9. дои : 10.1128/mcb.19.2.1460 . ПМК 116074 . ПМИД 9891079 .
- ^ Jump up to: а б Маккензи П.П., Дэнкс М.К., Кривацки Р.В., Харрис Л.К. (июль 2003 г.). «Дисфункция P21Waf1/Cip1 при нейробластоме: новый механизм ослабления остановки клеточного цикла G0-G1». Исследования рака . 63 (13): 3840–4. ПМИД 12839982 .
- ^ Кофф А., Джордано А., Десаи Д., Ямасита К., Харпер Дж.В., Элледж С., Нисимото Т., Морган Д.О., Франца Б.Р., Робертс Дж.М. (сентябрь 1992 г.). «Формирование и активация комплекса циклин E-cdk2 во время фазы G1 клеточного цикла человека». Наука . 257 (5077): 1689–94. Бибкод : 1992Sci...257.1689K . дои : 10.1126/science.1388288 . ПМИД 1388288 .
- ^ Майер С., Чжао Дж., Юань Х., Груммт И. (февраль 2004 г.). «mTOR-зависимая активация транскрипционного фактора TIF-IA связывает синтез рРНК с доступностью питательных веществ» . Гены и развитие . 18 (4): 423–34. дои : 10.1101/gad.285504 . ПМК 359396 . ПМИД 15004009 .
- ^ Будрез А., Бьюлленс М., Гроенен П., Ван Эйнде А., Вульстеке В., Ягайло И., Мюррей М., Крайнер А.Р., Сталманс В., Боллен М. (август 2000 г.). «NIPP1-опосредованное взаимодействие протеинфосфатазы-1 с CDC5L, регулятором сплайсинга пре-мРНК и вступления в митоз» . Журнал биологической химии . 275 (33): 25411–7. дои : 10.1074/jbc.M001676200 . ПМИД 10827081 .
- ^ Хеннеке Г., Кундриукофф С., Хюбшер У. (июль 2003 г.). «Фосфорилирование человеческого Fen1 циклин-зависимой киназой модулирует его роль в регуляции репликационной вилки» . Онкоген . 22 (28): 4301–13. дои : 10.1038/sj.onc.1206606 . ПМИД 12853968 .
- ^ Мендес Дж., Зоу-Янг XH, Ким С.Ю., Хидака М., Тэнси В.П., Стиллман Б. (март 2002 г.). «Большая субъединица комплекса распознавания человеческого происхождения разрушается в результате убиквитин-опосредованного протеолиза после инициации репликации ДНК» . Молекулярная клетка . 9 (3): 481–91. дои : 10.1016/s1097-2765(02)00467-7 . ПМИД 11931757 .
- ^ Jump up to: а б Ям Ч., Нг Р.В., Сиу, Вайоминг, Лау А.В., Пун Р.Ю. (январь 1999 г.). «Регуляция циклина A-Cdk2 с помощью компонента SCF Skp1 и белка F-бокса Skp2» . Молекулярная и клеточная биология . 19 (1): 635–45. дои : 10.1128/mcb.19.1.635 . ПМК 83921 . ПМИД 9858587 .
- ^ Оно Т., Китаура Х., Угай Х., Мурата Т., Ёкояма К.К., Игучи-Арига С.М., Арига Х. (октябрь 2000 г.). «TOK-1, новый белок, связывающий p21Cip1, который совместно усиливает p21-зависимую ингибирующую активность в отношении киназы CDK2» . Журнал биологической химии . 275 (40): 31145–54. дои : 10.1074/jbc.M003031200 . ПМИД 10878006 .
- ^ Jump up to: а б Ченг А., Калдис П., Соломон М.Дж. (ноябрь 2000 г.). «Дефосфорилирование циклин-зависимых киназ человека изоформами протеинфосфатазы альфа- и бета-2 типа 2C» . Журнал биологической химии . 275 (44): 34744–9. дои : 10.1074/jbc.M006210200 . ПМИД 10934208 .
- ^ Ленг X, Ноубл М., Адамс П.Д., Цинь Дж., Харпер Дж.В. (апрель 2002 г.). «Обращение подавления роста с помощью p107 посредством прямого фосфорилирования циклином D1/циклин-зависимой киназой 4» . Молекулярная и клеточная биология . 22 (7): 2242–54. дои : 10.1128/mcb.22.7.2242-2254.2002 . ПМЦ 133692 . ПМИД 11884610 .
- ^ Лейси С., Уайт П. (май 1997 г.). «Идентификация домена p130, опосредующего взаимодействие с комплексами циклин A/cdk 2 и циклин E/cdk 2» . Онкоген . 14 (20): 2395–406. дои : 10.1038/sj.onc.1201085 . ПМИД 9188854 .
- ^ Марти А., Вирбелауэр С., Шеффнер М., Крек В. (май 1999 г.). «Взаимодействие убиквитин-протеинлигазы SCFSKP2 и E2F-1 лежит в основе регуляции деградации E2F-1». Природная клеточная биология . 1 (1): 14–9. дои : 10.1038/8984 . ПМИД 10559858 . S2CID 8884226 .
Дальнейшее чтение
[ редактировать ]- Калдис П., Алим Э. (ноябрь 2005 г.). «Соперничество братьев и сестер клеточного цикла: Cdc2 против Cdk2» . Клеточный цикл . 4 (11): 1491–4. дои : 10.4161/cc.4.11.2124 . ПМИД 16258277 .
- Мур Н.Л., Нараянан Р., Вайгель Н.Л. (февраль 2007 г.). «Циклинзависимая киназа 2 и регуляция активности рецептора прогестерона человека» . Стероиды . 72 (2): 202–9. doi : 10.1016/j.steroids.2006.11.025 . ПМК 1950255 . ПМИД 17207508 .
Внешние ссылки
[ редактировать ]- Циклин-зависимая + киназа + 2 в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- CDK2 Расположение человеческого гена в браузере генома UCSC .
- Подробности о гене человека CDK2 в браузере генома UCSC .





![1di8: THE STRUCTURE OF CYCLIN-DEPENDENT KINASE 2 (CDK2) IN COMPLEX WITH 4-[3-HYDROXYANILINO]-6,7-DIMETHOXYQUINAZOLINE](http://upload.wikimedia.org/wikipedia/commons/thumb/a/ae/PDB_1di8_EBI.jpg/180px-PDB_1di8_EBI.jpg)












![1h0v: HUMAN CYCLIN DEPENDENT PROTEIN KINASE 2 IN COMPLEX WITH THE INHIBITOR 2-AMINO-6-[(R)-PYRROLIDINO-5'-YL]METHOXYPURINE](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b5/PDB_1h0v_EBI.jpg/180px-PDB_1h0v_EBI.jpg)
![1h0w: HUMAN CYCLIN DEPENDENT PROTEIN KINASE 2 IN COMPLEX WITH THE INHIBITOR 2-AMINO-6-[CYCLOHEX-3-ENYL]METHOXYPURINE](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5a/PDB_1h0w_EBI.jpg/180px-PDB_1h0w_EBI.jpg)









![1jsv: The structure of cyclin-dependent kinase 2 (CDK2) in complex with 4-[(6-amino-4-pyrimidinyl)amino]benzenesulfonamide](http://upload.wikimedia.org/wikipedia/commons/thumb/4/43/PDB_1jsv_EBI.jpg/180px-PDB_1jsv_EBI.jpg)
![1ke5: CDK2 complexed with N-methyl-4-{[(2-oxo-1,2-dihydro-3H-indol-3-ylidene)methyl]amino}benzenesulfonamide](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5f/PDB_1ke5_EBI.jpg/180px-PDB_1ke5_EBI.jpg)
![1ke6: CYCLIN-DEPENDENT KINASE 2 (CDK2) COMPLEXED WITH N-METHYL-{4-[2-(7-OXO-6,7-DIHYDRO-8H-[1,3]THIAZOLO[5,4-E]INDOL-8-YLIDENE)HYDRAZINO]PHENYL}METHANESULFONAMIDE](http://upload.wikimedia.org/wikipedia/commons/thumb/8/8e/PDB_1ke6_EBI.jpg/180px-PDB_1ke6_EBI.jpg)
![1ke7: CYCLIN-DEPENDENT KINASE 2 (CDK2) COMPLEXED WITH 3-{[(2,2-DIOXIDO-1,3-DIHYDRO-2-BENZOTHIEN-5-YL)AMINO]METHYLENE}-5-(1,3-OXAZOL-5-YL)-1,3-DIHYDRO-2H-INDOL-2-ONE](http://upload.wikimedia.org/wikipedia/commons/thumb/f/f9/PDB_1ke7_EBI.jpg/180px-PDB_1ke7_EBI.jpg)
![1ke8: CYCLIN-DEPENDENT KINASE 2 (CDK2) COMPLEXED WITH 4-{[(2-OXO-1,2-DIHYDRO-3H-INDOL-3-YLIDENE)METHYL]AMINO}-N-(1,3-THIAZOL-2-YL)BENZENESULFONAMIDE](http://upload.wikimedia.org/wikipedia/commons/thumb/0/0c/PDB_1ke8_EBI.jpg/180px-PDB_1ke8_EBI.jpg)
![1ke9: CYCLIN-DEPENDENT KINASE 2 (CDK2) COMPLEXED WITH 3-{[4-({[AMINO(IMINO)METHYL]AMINOSULFONYL)ANILINO]METHYLENE}-2-OXO-2,3-DIHYDRO-1H-INDOLE](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b6/PDB_1ke9_EBI.jpg/180px-PDB_1ke9_EBI.jpg)












![1pxk: HUMAN CYCLIN DEPENDENT KINASE 2 COMPLEXED WITH THE INHIBITOR N-[4-(2,4-Dimethyl-thiazol-5-yl)pyrimidin-2-yl]-N'-hydroxyiminoformamide](http://upload.wikimedia.org/wikipedia/commons/thumb/1/14/PDB_1pxk_EBI.jpg/180px-PDB_1pxk_EBI.jpg)
![1pxl: HUMAN CYCLIN DEPENDENT KINASE 2 COMPLEXED WITH THE INHIBITOR [4-(2,4-Dimethyl-thiazol-5-yl)-pyrimidin-2-yl]-(4-trifluoromethyl-phenyl)-amine](http://upload.wikimedia.org/wikipedia/commons/thumb/4/40/PDB_1pxl_EBI.jpg/180px-PDB_1pxl_EBI.jpg)
![1pxm: HUMAN CYCLIN DEPENDENT KINASE 2 COMPLEXED WITH THE INHIBITOR 3-[4-(2,4-Dimethyl-thiazol-5-yl)-pyrimidin-2-ylamino]-phenol](http://upload.wikimedia.org/wikipedia/commons/thumb/3/32/PDB_1pxm_EBI.jpg/180px-PDB_1pxm_EBI.jpg)
![1pxn: HUMAN CYCLIN DEPENDENT KINASE 2 COMPLEXED WITH THE INHIBITOR 4-[4-(4-Methyl-2-methylamino-thiazol-5-yl)-pyrimidin-2-ylamino]-phenol](http://upload.wikimedia.org/wikipedia/commons/thumb/9/9d/PDB_1pxn_EBI.jpg/180px-PDB_1pxn_EBI.jpg)
![1pxo: HUMAN CYCLIN DEPENDENT KINASE 2 COMPLEXED WITH THE INHIBITOR [4-(2-Amino-4-methyl-thiazol-5-yl)-pyrimidin-2-yl]-(3-nitro-phenyl)-amine](http://upload.wikimedia.org/wikipedia/commons/thumb/3/3b/PDB_1pxo_EBI.jpg/180px-PDB_1pxo_EBI.jpg)
![1pxp: HUMAN CYCLIN DEPENDENT KINASE 2 COMPLEXED WITH THE INHIBITOR N-[4-(2,4-Dimethyl-thiazol-5-yl)-pyrimidin-2-yl]-N',N'-dimethyl-benzene-1,4-diamine](http://upload.wikimedia.org/wikipedia/commons/thumb/d/de/PDB_1pxp_EBI.jpg/180px-PDB_1pxp_EBI.jpg)


![1urw: CDK2 IN COMPLEX WITH AN IMIDAZO[1,2-B]PYRIDAZINE](http://upload.wikimedia.org/wikipedia/commons/thumb/d/de/PDB_1urw_EBI.jpg/180px-PDB_1urw_EBI.jpg)




![1y8y: Crystal structure of human CDK2 complexed with a pyrazolo[1,5-a]pyrimidine inhibitor](http://upload.wikimedia.org/wikipedia/commons/thumb/3/31/PDB_1y8y_EBI.jpg/180px-PDB_1y8y_EBI.jpg)
![1y91: Crystal structure of human CDK2 complexed with a pyrazolo[1,5-a]pyrimidine inhibitor](http://upload.wikimedia.org/wikipedia/commons/thumb/9/97/PDB_1y91_EBI.jpg/180px-PDB_1y91_EBI.jpg)