ПРКАЦА
| ПРКАЦА | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | PRKACA , PKACA, PPNAD4, каталитическая субъединица альфа, активируемая протеинкиназой цАМФ, CAFD1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 601639 ; МГИ : 97592 ; Гомологен : 121574 ; GeneCards : PRKACA ; ОМА : PRKACA - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Каталитическая субъединица α протеинкиназы А является ключевым регуляторным ферментом , который у человека кодируется PRKACA геном . [ 5 ] Этот фермент отвечает за фосфорилирование других белков и субстратов, изменяя их активность. Каталитическая субъединица протеинкиназы А (PKA Cα) является членом семейства киназ AGC (протеинкиназы A, G и C ) и способствует контролю клеточных процессов, которые включают метаболизм глюкозы , деление клеток и контекстную память. [ 6 ] [ 7 ] [ 8 ] PKA Cα является частью более крупного белкового комплекса, который отвечает за контроль того, когда и где белки фосфорилируются. Нарушение регуляции активности холофермента ПКА связано с прогрессированием сердечно-сосудистых заболеваний, некоторых эндокринных заболеваний и рака.
Открытие
[ редактировать ]Эдмонд Х. Фишер и Эдвин Г. Кребс из Вашингтонского университета открыли PKA в конце 1950-х годов, работая над механизмами, управляющими гликогенфосфорилазой . Они поняли, что ключевой метаболический фермент, называемый киназой фосфорилазы, активируется другой киназой, которая зависит от вторичного мессенджера циклического АМФ (цАМФ). [ 9 ] Они назвали этот новый фермент цАМФ-зависимой протеинкиназой и приступили к очистке и характеристике этого нового фермента. Фишер и Кребс получили Нобелевскую премию по физиологии и медицине в 1992 году за это открытие и продолжение работы над киназами и их аналогами — протеинфосфатазами . Сегодня эту цАМФ-зависимую протеинкиназу проще обозначать как PKA.
Еще одно ключевое событие в истории ПКА произошло, когда Сьюзан Тейлор и Януш Совадски из Калифорнийского университета в Сан-Диего решили трехмерную структуру каталитической субъединицы фермента. [ 10 ] Также выяснилось, что внутри клеток каталитические субъединицы ПКА находятся в комплексе с регуляторными субъединицами и белками-ингибиторами, которые блокируют активность фермента. Дополнительный аспект действия PKA, который был впервые открыт Джоном Скоттом из Университета Вашингтона и Кьетилом Таскеном из Университета Осло, заключается в том, что фермент связан внутри клетки посредством ассоциации с семейством белков, закрепляющих А-киназы (AKAP). . Это привело к гипотезе о том, что субклеточная локализация закрепленной ПКА контролирует, какие белки регулируются киназой. [ 11 ]
Каталитические субъединицы
[ редактировать ]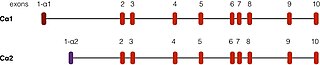
PRKACA обнаружен на 19 хромосоме у человека. [ 5 ] Есть два хорошо описанных транскрипта этого гена, возникающие в результате альтернативного сплайсинга . Наиболее распространенная форма, называемая Cα1, экспрессируется во всех тканях человека. Другой транскрипт, называемый Cα2, обнаруживается преимущественно в клетках спермы и отличается от Cα1 только первыми 15 аминокислотами . [ 12 ]
Кроме того, существуют две другие изоформы каталитической субъединицы PKA, называемые Cβ и Cγ, возникающие из разных генов, но имеющие сходные функции с Cα. [ 13 ] [ 14 ] Cβ в изобилии обнаруживается в головном мозге и в более низких концентрациях в других тканях, тогда как Cγ, скорее всего, экспрессируется в семенниках.
Сигнализация
[ редактировать ]
Неактивный голофермент ПКА существует в виде тетрамера, состоящего из двух регуляторных (R) субъединиц и двух каталитических (C) субъединиц. [ 15 ] Биохимические исследования показали, что существует два типа R-субъединиц. Субъединицы типа IR, имеющие две изоформы (RIα и RIβ), связывают каталитические субъединицы с образованием голофермента PKA типа I. Аналогичным образом субъединицы R типа II, имеющие две изоформы (RIIα и RIIβ), создают голофермент PKA типа II. В присутствии цАМФ каждая субъединица R связывает 2 молекулы цАМФ и вызывает конформационные изменения субъединиц R, которые высвобождают субъединицы C для фосфорилирования последующих субстратов. [ 16 ] Различные субъединицы R различаются по своей чувствительности к цАМФ, уровням экспрессии и субклеточному расположению. Белки, закрепляющие А-киназу (AKAP), связывают поверхность, образованную между обеими R-субъединицами, и направляют киназу в разные места в клетке. Это оптимизирует, где и когда происходит сотовая связь внутри ячейки. [ 11 ]
Клиническое значение
[ редактировать ]Протеинкиназа А участвует в ряде заболеваний, включая сердечно-сосудистые заболевания, опухоли коры надпочечников и рак. Было высказано предположение, что аномально высокий уровень фосфорилирования ПКА способствует развитию сердечно-сосудистых заболеваний. Это влияет на сопряжение возбуждения и сокращения, которое представляет собой ритмический процесс, контролирующий сокращение сердечной мышцы посредством синхронизированного действия ферментов, чувствительных к кальцию и цАМФ . [ 17 ] Существуют также доказательства, подтверждающие, что неправильная локализация передачи сигналов PKA способствует развитию сердечных аритмий , в частности синдрома удлиненного интервала QT . Это приводит к нерегулярному сердцебиению, которое может привести к внезапной смерти.
Мутации в гене PRKACA , которые способствуют аномальной активности ферментов, связаны с заболеваниями надпочечников. несколько мутаций PRKACA было обнаружено У пациентов с синдромом Кушинга , которые приводят к увеличению способности PKA широко фосфорилировать другие белки. Одна мутация в гене PRKACA , вызывающая замену аминокислоты лейцина на аргинин в положении 206, была обнаружена более чем у 60% пациентов с опухолями коры надпочечников . [ 18 ] Другие мутации и генетические изменения в гене PRKACA были идентифицированы в аденомах коры надпочечников , которые также нарушают передачу сигналов PKA, что приводит к аберрантному фосфорилированию PKA. Ген Cα также вовлечен в развитие различных видов рака, включая рак толстой кишки, почек, прямой кишки, простаты, легких, молочной железы, карциномы надпочечников и лимфомы.
В последнее время наблюдается растущий интерес к фиброламеллярной гепатоцеллюлярной карциноме . Молекулярной основой этой редкой формы рака печени, поражающей молодых людей, является генетическая делеция 19-й хромосомы. Утрата ДНК обнаруживается у очень большого процента пациентов. [ 19 ] Следствием этой делеции является аномальное слияние двух генов — DNAJB1 , который кодирует белок теплового шока 40 (Hsp40), и PRKACA . Дальнейшие анализы тканей фиброламеллярной гепатоцеллюлярной карциномы показывают увеличение уровней этого слитого белка DNAJ-PKAc. Это согласуется с гипотезой о том, что повышение уровня киназы в тканях печени может инициировать или поддерживать эту редкую форму рака печени. Учитывая обилие информации о трехмерных структурах DNAJ и PKA Cα, есть некоторая надежда, что могут быть разработаны новые лекарства, нацеленные на эту атипичную и потенциально канцерогенную слитую киназу.
Примечания
[ редактировать ]
Версия этой статьи 2015 года была обновлена внешним экспертом в рамках модели двойной публикации. Соответствующая академическая рецензируемая статья была опубликована в журнале Gene и может цитироваться как: Ригни Э. Тернхэм; Джон Д. Скотт (11 декабря 2015 г.). «Изоформа каталитической субъединицы протеинкиназы А PRKACA; История, функции и физиология» . Джин . Серия обзоров Gene Wiki. 577 (2): 101–108. дои : 10.1016/J.GENE.2015.11.052 . ISSN 0378-1119 . ПМЦ 4713328 . ПМИД 26687711 . Викиданные Q34505964 . |
Ссылки
[ редактировать ]- ^ Jump up to: а б с ENSG00000288516 GRCh38: выпуск Ensembl 89: ENSG00000072062, ENSG00000288516 — Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000005469 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б Таскен К., Сольберг Р., Чжао Й., Ханссон В., Янсен Т., Сицилиано М.Дж. (сентябрь 1996 г.). «Ген, кодирующий каталитическую субъединицу C альфа цАМФ-зависимой протеинкиназы (локус PRKACA), локализуется в области хромосомы человека 19p13.1». Геномика . 36 (3): 535–8. дои : 10.1006/geno.1996.0501 . ПМИД 8884279 .
- ^ Маллер Дж.Л., Кребс Э.Г. (март 1977 г.). «Стимулируемое прогестероном мейотическое деление клеток в ооцитах Xenopus. Индукция регуляторной субъединицей и ингибирование каталитической субъединицей аденозин-3':5'-монофосфат-зависимой протеинкиназы» . Журнал биологической химии . 252 (5): 1712–8. дои : 10.1016/S0021-9258(17)40606-5 . ПМИД 190238 .
- ^ Лестер Л.Б., Faux MC, Науэрт Дж.Б., Скотт Дж.Д. (март 2001 г.). «Целевая протеинкиназа А и PP-2B регулируют секрецию инсулина посредством обратимого фосфорилирования» . Эндокринология . 142 (3): 1218–27. дои : 10.1210/endo.142.3.8023 . ПМИД 11181538 .
- ^ Снайдер Э.М., Колледж М., Крозье Р.А., Чен В.С., Скотт Дж.Д., Медведь М.Ф. (апрель 2005 г.). «Роль белков, закрепляющих А-киназу (AKAPS), в транспортировке глутаматных рецепторов и долгосрочной синаптической депрессии» . Журнал биологической химии . 280 (17): 16962–8. дои : 10.1074/jbc.M409693200 . ПМЦ 3923403 . ПМИД 15718245 .
- ^ Фишер Э.Х., Кребс Э.Г. (сентябрь 1955 г.). «Превращение фосфорилазы b в фосфорилазу а в мышечных экстрактах» . Журнал биологической химии . 216 (1): 121–32. дои : 10.1016/S0021-9258(19)52289-X . ПМИД 13252012 .
- ^ Найтон Д.Р., Чжэн Дж.Х., Тен Эйк Л.Ф., Эшфорд В.А., Сюонг Н.Х., Тейлор С.С., Совадски Дж.М. (июль 1991 г.). «Кристаллическая структура каталитической субъединицы циклической аденозинмонофосфатзависимой протеинкиназы». Наука . 253 (5018): 407–14. Бибкод : 1991Sci...253..407K . дои : 10.1126/science.1862342 . ПМИД 1862342 .
- ^ Jump up to: а б Лангеберг Л.К., Скотт Дж.Д. (апрель 2015 г.). «Сигнальные леса и локальная организация клеточного поведения» . Nature Reviews Молекулярно-клеточная биология . 16 (4): 232–44. дои : 10.1038/nrm3966 . ПМЦ 4722875 . ПМИД 25785716 .
- ^ Соберг К., Янсен Т., Рогнес Т., Сколхегг Б.С., Лаердал Дж.К. (01 января 2013 г.). «Эволюционные пути каталитических субъединиц цАМФ-зависимой протеинкиназы (ПКА)» . ПЛОС ОДИН . 8 (4): е60935. Бибкод : 2013PLoSO...860935S . дои : 10.1371/journal.pone.0060935 . ПМЦ 3625193 . ПМИД 23593352 .
- ^ Улер, доктор медицинских наук, Кривиа Дж.С., Макнайт Г.С. (ноябрь 1986 г.). «Доказательства наличия второй изоформы каталитической субъединицы цАМФ-зависимой протеинкиназы» . Журнал биологической химии . 261 (33): 15360–3. дои : 10.1016/S0021-9258(18)66717-1 . ПМИД 3023318 .
- ^ Бибе С.Дж., Ойен О., Сандберг М., Фрёйса А., Ханссон В., Янсен Т. (март 1990 г.). «Молекулярное клонирование тканеспецифической протеинкиназы (С гамма) из семенников человека, представляющей собой третью изоформу каталитической субъединицы цАМФ-зависимой протеинкиназы» . Молекулярная эндокринология . 4 (3): 465–75. дои : 10.1210/mend-4-3-465 . ПМИД 2342480 .
- ^ Кребс Э.Г., Беаво Дж.А. (июнь 1979 г.). «Фосфорилирование-дефосфорилирование ферментов». Ежегодный обзор биохимии . 48 (1): 923–59. дои : 10.1146/annurev.bi.48.070179.004423 . ПМИД 38740 .
- ^ Уэлч Э.Дж., Джонс Б.В., Скотт Дж.Д. (апрель 2010 г.). «Взаимодействие с AKAP: контекстно-зависимая регуляция закрепленных ферментов» . Молекулярные вмешательства . 10 (2): 86–97. дои : 10.1124/ми.10.2.6 . ПМЦ 2895371 . ПМИД 20368369 .
- ^ Додж-Кафка К.Л., Лангеберг Л., Скотт Дж.Д. (апрель 2006 г.). «Компартментация передачи сигналов циклических нуклеотидов в сердце: роль белков, закрепляющих А-киназы» . Исследование кровообращения . 98 (8): 993–1001. дои : 10.1161/01.RES.0000218273.91741.30 . ПМИД 16645149 .
- ^ Лакруа А., Филдерс Р.А., Стратакис К.А., Ниман Л.К. (август 2015 г.). «Синдром Кушинга». Ланцет . 386 (9996): 913–27. дои : 10.1016/S0140-6736(14)61375-1 . ПМИД 26004339 . S2CID 22892253 .
- ^ Ханиман Дж.Н., Саймон Э.П., Робин Н., Кьярони-Кларк Р., Дарси Д.Г., Лим II, Глисон С.Э., Мерфи Дж.М., Розенберг Б.Р., Тиган Л., Такач К.Н., Ботеро С., Белот Р., Гермер С., Эмде А.К., Вачич В., Бханот У, член парламента ЛаКвальи, Саймон С.М. (февраль 2014 г.). «Обнаружение рецидивирующего химерного транскрипта DNAJB1-PRKACA при фиброламеллярной гепатоцеллюлярной карциноме» . Наука . 343 (6174): 1010–4. Бибкод : 2014Sci...343.1010H . дои : 10.1126/science.1249484 . ПМК 4286414 . ПМИД 24578576 .
Внешние ссылки
[ редактировать ]- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для каталитической субъединицы альфа цАМФ-зависимой протеинкиназы человека (PRKACA).



