CAMK
| Что 2+ /кальмодулин-зависимая протеинкиназа | |||
|---|---|---|---|
| Идентификаторы | |||
| ЕС №. | 2.7.11.17 | ||
| CAS №. | 97350-82-8 | ||
| Базы данных | |||
| Intenz | Intenz View | ||
| Бренда | Бренда вход | ||
| Расширение | Вид Nicezyme | ||
| Кегг | Кегг вход | ||
| Метатический | Метаболический путь | ||
| Напрямую | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Джин Онтология | АмиГО / QuickGO | ||
| |||
CAMK , также пишется как CaMK или CCaMK , является аббревиатурой Ca 2+ протеинкиназ /кальмодулин-зависимые ферменты класса . САМК активируются увеличением концентрации внутриклеточных ионов кальция (Ca 2+ ) и кальмодулин . При активации ферменты переносят фосфаты от АТФ к определенным остаткам серина или треонина в других белках, поэтому они представляют собой серин/треонин-специфичные протеинкиназы . Активированная САМК участвует в фосфорилировании факторов транскрипции и, следовательно, в регуляции экспрессии отвечающих генов. CAMK также регулирует жизненный цикл клеток (т.е. запрограммированную гибель клеток), перестройку цитоскелетной сети клетки и механизмы, участвующие в обучении и памяти организма. [ 1 ]
Типы
[ редактировать ]Существует два распространенных типа белков CAM-киназы: специализированные и многофункциональные CAM-киназы.
- Субстратно-специфичные CAM-киназы
- имеют только одну мишень, которую они могут фосфорилировать, например, киназы легкой цепи миозина. [ 1 ] В эту группу белков входит САМК III. Дополнительную информацию о CAMKIII можно найти по этой ссылке.
- Многофункциональные CAM-киназы
- имеют множество мишеней, которые они могут фосфорилировать, и участвуют в процессах, включая секрецию нейротрансмиттеров, метаболизм гликогена и регуляцию различных факторов транскрипции. [ 1 ] CAMK II является основным белком в этой подгруппе. Дополнительную информацию о CAMKII можно найти по этой ссылке.
Субстратное фосфорилирование
[ редактировать ]
Как только концентрация кальция в клетке повышается, CAM-киназы насыщаются и связывают максимум четыре молекулы кальция. [ 1 ] Это насыщение кальцием активирует киназу и позволяет ей претерпевать конформационные изменения, которые позволяют киназе связываться со своими целевыми сайтами фосфорилирования. CAMK удаляет фосфатную группу из АТФ, чаще всего с помощью Mg. 2+ ион и добавляет его к белку САМ, делая его активным. [ 2 ] САМ-киназа содержит высококонцентрированную глициновую петлю, в которой гамма-фосфат донорской молекулы АТФ легко связывается с ферментом, который затем использует ион металла для облегчения плавного переноса фосфата к целевому белку. [ 3 ] Этот перенос фосфата затем активирует мишень киназы и завершает цикл фосфорилирования.
На рисунке 1 показано, как присутствие кальция или кальмодулина позволяет активировать CAM-киназы (CAMK II).
Структура
[ редактировать ]Все киназы имеют общую структуру каталитического ядра, включающую сайт связывания АТФ и более крупный сайт связывания субстрата. [ 4 ] Каталитическое ядро обычно состоит из β-цепей, а сайт связывания субстрата состоит из α-спиралей. [ 5 ] Большинство киназ CAM включают в себя различные домены, в том числе: каталитический домен, регуляторный домен, ассоциативный домен и домен, связывающий кальций/кальмодулин. [ 6 ]
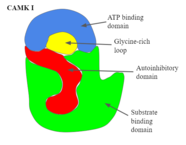
- Camk i
- Как показано на рисунке 2, имеет структуру с двойной локодистой, состоящую из каталитического субстрата-связывающего домена и аутоингибиторного домена. [ 1 ] Чтобы аутоингибиторный домен стал функциональным, он должен привести к тому, что белок соответствует таким образом, чтобы этот домен полностью блокирует субстратный домен от получения новых целей. Рисунок 2 входит в детали, показывая структуру и домены CAMK I.
- CAMK II
- Имеет множество различных форм, причем CAMK 2A является наиболее распространенным, как показано на рисунке 3. CAMK 2A имеет кольцевую кристаллическую структуру, состоящую из меньших функциональных групп. Эти группы допускают камерузависимую фосфорилирование мишеней, но также позволяют структуре аутофосфорилироваться и стать независимым от CAM, [ 7 ] Как видно на рисунке 1. Это означает, что после того, как белок CAMK 2A изначально активируется кальцием или кальмодулином, он, в свою очередь, может дополнительно активировать себя, поэтому он не становится неактивным, даже если он без кальция или кальмодулина.

Рисунок 3: Изображение CAMK 2A, которое является формой кальция/кальмодулин-зависимой киназы в ее кристаллической форме.
Члены семьи
[ редактировать ]Члены класса ферментов CAMK включают, но не ограничиваются:
- ЦАМКИ
- КАМЕРА
- САМКIII
- ЦАМКИВ
- CAMKV CAM -киназа, подобная везикулам, связана
- Скамк
- Ca2+/кальмодулин-зависимая протеинкиназа киназа
Псевдокиназы
[ редактировать ]Псевдокиназы представляют собой псевдоферменты , белки, которые напоминают ферменты структурно, но не имеют каталитической активности.
Некоторые из этих псевдокиназ, которые связаны с семьей CAMK, включают:
Ссылки
[ редактировать ]- ^ Подпрыгнуть до: а беременный в дюймовый и фон Swulius MT, Waxham MN (сентябрь 2008 г.). «CA (2+)/кальмодулин-зависимые протеинкиназы» . Клеточные и молекулярные науки о жизни . 65 (17): 2637–57. doi : 10.1007/s00018-008-8086-2 . PMC 3617042 . PMID 18463790 .
- ^ Адамс JA (август 2001 г.). «Кинетические и каталитические механизмы протеинкиназ». Химические обзоры . 101 (8): 2271–90. doi : 10.1021/cr000230w . PMID 11749373 .
- ^ Хеммер В., МакГлоун М., Цигельни И., Тейлор С.С. (июль 1997 г.). «Роль глициновой триады в АТФ-связывающем сайте цАМФ-зависимой протеинкиназы» . Журнал биологической химии . 272 (27): 16946–54. дои : 10.1074/jbc.272.27.16946 . ПМИД 9202006 . S2CID 33795382 .
- ^ Хэнкс С.К. (2003). «Геномный анализ суперсемейства эукариотической протеинкиназы: перспектива» . Биология генома . 4 (5): 111. DOI : 10.1186/GB-2003-4-5-111 . PMC 156577 . PMID 12734000 .
- ^ Тейлор С.С., Ян Дж., Ву Дж, Хсте Н.М., Радцио-Андзельм Е., Ананд Г (март 2004 г.). «PKA: портрет динамики протеинкиназы». Biochimica et Biophysica Acta (BBA) - белки и протеомика . 1697 (1–2): 259–69. doi : 10.1016/j.bbapap.2003.11.029 . PMID 15023366 .
- ^ Hudmon A, Schulman H (2002-06-01). «Нейрональный Ca2+/кальмодулин-зависимая протеинкиназа II: роль структуры и ауторегуляции в клеточной функции». Ежегодный обзор биохимии . 71 (1): 473–510. doi : 10.1146/annurev.biochem.71.110601.135410 . PMID 12045104 .
- ^ «CAMK2A кальций/кальмодулин -зависимая протеинкиназа II Альфа [Homo Sapiens (человек)] - ген - NCBI» . www.ncbi.nlm.nih.gov . Получено 2020-03-20 .
