Апоптосома
Апоптосома структура , — крупная четверичная белковая образующаяся в процессе апоптоза . Его образование запускается высвобождением цитохрома с из митохондрий в ответ на внутренний (внутренний) или внешний (внешний) стимул клеточной гибели. Стимулы могут варьироваться от повреждения ДНК и вирусной инфекции до сигналов развития, например, приводящих к деградации хвоста головастика .
В клетках млекопитающих цитохром c высвобождается, он связывается с цитозольным белком Apaf-1, способствуя образованию апоптосомы. Раннее биохимическое исследование предполагает соотношение цитохрома с и apaf-1 для образования апоптосом два к одному. Однако недавние структурные исследования показывают, что соотношение цитохрома с и apaf-1 составляет один к одному. Также было показано, что нуклеотид dATP в качестве третьего компонента связывается с apaf-1, однако его точная роль все еще обсуждается. Апоптосома млекопитающих никогда не была кристаллизована, но апоптосома APAF-1/цитохром-с человека была визуализирована с более низким разрешением (2 нм ) с помощью криогенной трансмиссионной электронной микроскопии в 2002 году. [ 2 ] обнаружение гептамерной частицы, напоминающей колесо, с 7-кратной симметрией. была также решена структура апоптосомы человека со средним разрешением (9,5 ангстрем) Недавно с помощью криоэлектронной микроскопии , что позволяет сделать однозначный вывод о положении всех доменов APAF-1 (CARD, NBARC и WD40) и цитохрома c. Теперь также существует кристаллическая структура мономерной неактивной субъединицы Apaf-1 (PDB 3SFZ). [ 1 ] [ 3 ]
После формирования апоптосома может рекрутировать и активировать неактивную прокаспазу-9 . После активации эта инициаторная каспаза может затем активировать эффекторные каспазы и запустить каскад событий, приводящих к апоптозу.
История
[ редактировать ]Термин «апоптосома» был впервые введен в статье Ёсихидэ Цудзимото в 1998 году «Роль белков семейства Bcl-2 в апоптозе : апоптосомы или митохондрии ?». [ 4 ] Однако до этого времени апоптосома была известна как тройной комплекс . Этот комплекс включал каспазу-9 и Bcl-XL , каждая из которых связывала определенный домен Apaf-1 . Тогда считалось, что образование этого комплекса играет регуляторную роль в гибели клеток млекопитающих . [ 5 ] В декабре того же года в «Журнале биологической химии» была опубликована еще одна статья, в которой говорилось, что Apaf-1 является регулятором апоптоза посредством активации прокаспазы-9. [ 6 ]
Критерии апоптосомы были сформулированы в 1999 году. Во-первых, это должен быть большой комплекс (более 1,3 миллиона дальтон). Во-вторых, его образование требует гидролиза высокоэнергетической связи АТФ или дАТФ. И, наконец, он должен активировать прокаспазу-9 в ее функциональной форме. Образование этого комплекса является точкой невозврата, и наступит апоптоз. Стабильный мультимерный комплекс APAF-1 и цитохрома соответствует этому описанию и теперь называется апоптосомой. [ 7 ]
Считалось, что апоптосома представляет собой мультимерный комплекс по двум причинам. Во-первых, чтобы сблизить несколько молекул прокаспазы-9 для расщепления. А во-вторых, повысить порог апоптоза, чтобы неспецифическая утечка цитохрома с не приводила к апоптозу. [ 7 ]
Когда было установлено, что апоптосома является активатором прокаспазы-9, мутации в этом пути стали важной областью исследований. Некоторые примеры включают клетки лейкемии человека , рак яичников и вирусные инфекции . [ 8 ] [ 9 ] [ 10 ] Текущие области исследований этого пути будут обсуждаться более подробно. Существуют также скрытые пути гибели клеток, которые не зависят от APAF-1 и, следовательно, от апоптосомы. Эти пути также не зависят от каспазы-3 и 9. Эти скрытые пути апоптоза медленнее, но могут оказаться полезными при дальнейших исследованиях. [ 11 ]

(Юань и др., 2010, Структура комплекса апоптосома-прокаспаза-9 CARD [ 1 ]
Структура
[ редактировать ]Апоптосома представляет собой мультимолекулярный голоферментный комплекс, собранный вокруг адаптерного белка Apaf1 (фактора активации апоптотической протеазы 1) при митохондриально -опосредованном апоптозе , который должен стимулироваться каким-либо типом стрессового сигнала. Для образования апоптосомы необходимо присутствие АТФ /дАТФ и цитохрома с в цитозоле . [ 12 ] Стрессовый стимул может вызвать высвобождение цитохрома С в цитоплазму, который затем связывается с С-концом Apaf-1 в области, содержащей несколько повторов WD-40. [ 2 ] Олигомеризация Apaf-1 , по-видимому, сопровождается синхронным привлечением прокаспазы-9 к мотиву CARD Apaf-1 на N-конце . [ 2 ] активацию каспаз внутреннего пути апоптоза . Апоптосома запускает [ 12 ]
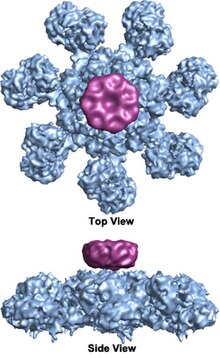
комплекс в форме колеса Гептамерный со структурой семикратной симметрии апоптосомы был впервые обнаружен с разрешением 27 Å методами электронной криомикроскопии и имеет расчетную массу около 1 МДа (Acehan et al. 2002). [ 2 ] Эта частица, похожая на колесо, имеет семь спиц и центральную ступицу. Дистальная часть спицы имеет выраженную Y-образную форму. [ 12 ] Домен концентратора соединен с доменом Y изогнутым рычагом. Каждый домен Y состоит из двух долей (большой и маленькой), между которыми расположены сайты связывания цитохрома с. [ 12 ] Поскольку разрешение структуры апоптосом было относительно низким, были предложены две противоречивые модели сборки апоптосом. Одна модель предполагает, что домены NOD образуют центральный узел, а домены CARD образуют более свободное кольцо в верхней части региона NOD. [ 2 ] Другая модель предполагает, что Apaf-1 организован расширенным образом, так что как N-концевая CARD, так и область связывания нуклеотидов образуют центральный узел апоптосомы, тогда как 13 повторов WD-40 составляют две доли. [ 12 ] Большая доля образована семью повторами, а малая доля - шестью повторами. [ 12 ] Каждая молекула каспазы-9 связывается с доменом CARD в центральном хабе, образуя куполообразную структуру. [ 12 ] Этот спор был разрешен благодаря недавнему исследованию структуры комплекса CARD апоптосома-прокаспаза-9 человека с высоким разрешением. [ 1 ] Эта структура ясно продемонстрировала, что только регионы NOD образуют центральный узел апоптосомы (см. рисунки), тогда как CARD гибко связан с платформой апоптосомы и становится неупорядоченным в основном состоянии апоптосомы. [ 1 ] Как только апоптосома связывается с прокаспазой-9, CARD Apaf-1 и CARD прокаспазы-9 образуют гибкую дискообразную структуру, расположенную над платформой. [ 1 ] количество повторов WD-40 составляет 15 вместо 13. Доказано также, что [ 1 ] и он состоит из 7-лопастного бета-винта и 8-лопастного бета-винта. [ 1 ]

Данные Ванга и его коллег показывают, что стехиометрическое соотношение прокаспазы-9 и Apaf-1 в комплексе составляет примерно 1:1. [ 7 ] Это было дополнительно подтверждено количественным масс-спектрометрическим анализом. [ 13 ] Доказано, что стехиометрия цитохрома с к Apaf-1 в составе комплекса составляет 1:1. [ 1 ] Существуют некоторые споры о том, требуется ли стабильное включение цитохрома с в апоптосому после олигомеризации, но недавние структурные данные подтверждают идею о том, что цитохром с стабилизирует олигомерную апоптосому человека. [ 1 ] Однако цитохром с может не потребоваться для сборки апоптосомы у видов, не относящихся к млекопитающим, таких как черви и плодовые мухи. [ 14 ] Кроме того, сообщалось, что несколько других молекул, в первую очередь каспаза-3, очищаются совместно с апоптосомой. [ 7 ] и было доказано, что каспаза-3 способна связывать комплекс апоптосома-прокаспаза-9. [ 13 ]
Apaf-1 образует основу апоптосомы. Он имеет три отдельные области: N-концевой домен рекрутирования каспазы (CARD, остатки 1–90), центральную область связывания нуклеотидов и олигомеризации (NB-ARC/NOD, 128–586) и C-концевую область WD40 ( 613–1248), составляющие белок массой около 140 кДа. [ 2 ]
- Домен CARD Apaf-1 взаимодействует с прокаспазой-9 и участвует в рекрутировании внутри апоптосомы. [ 2 ]
- Область NB-ARC/NOD демонстрирует значительное сходство последовательностей с белком Ced-4 C. elegans. [ 2 ]
- С-концевая область WD40 Apaf1 содержит 15 повторов WD-40, структурированных в два домена в форме b-пропеллера. [ 1 ] Повторы WD-40 представляют собой последовательности длиной около 40 аминокислот, которые заканчиваются на Trp-Asp и обычно участвуют в белок-белковом взаимодействии. [ 2 ]
Короткий линкер и нуклеотидсвязывающие домены a/b (NBD), которые содержат консервативные боксы Уокера A (p-петля 155-161) и B (239-243), следуют за N-концевым доменом CARD. [ 2 ] Боксы Уокера A/B имеют решающее значение для связывания dATP/ATP и Mg2+. [ 1 ] [ 2 ] За NBD следует небольшой спиральный домен (HD1), второй линкер и консервативный домен крылатой спирали (WHD). [ 2 ] Область NOD включает NBD, HD1 и WHD, образуя домен АТФазы, который является частью семейства АТФаз AAA+ . [ 1 ] [ 2 ] В месте соединения повторов NOD и WD-40 присутствует суперспиральный домен (HD2). [ 1 ] Повторы WD40 объединены в группы по восемь и семь человек с соединяющими их линкерами. [ 1 ]

Апоптосомы в других организмах
[ редактировать ]Приведенные выше описания относятся к апоптосоме человека. Сложные структуры апоптосом других организмов имеют много общего, но имеют совершенно разные размеры и количество субъединиц, как показано на рисунке. Система плодовых мушек, называемая Дарк, имеет кольцо из 8 субъединиц (PDB 4V4L). [ 14 ] Апоптосома нематод, называемая CED-4, октамерная, но гораздо меньшего размера (PDB 3LQQ) и не включает области, которые могли бы связывать цитохром C. [ 15 ]
Механизм действия
[ редактировать ]Инициация
[ редактировать ]Инициация действия апоптосомы соответствует первым этапам пути запрограммированной гибели клеток (PCD) . У животных апоптоз может катализироваться одним из двух способов; внешний путь включает связывание внеклеточных лигандов с трансмембранными рецепторами, тогда как внутренний путь осуществляется в митохондриях . [ 16 ] Этот внутренний путь включает высвобождение цитохрома С из митохондрий и последующее связывание с цитозольным белком Apaf-1 . [ 16 ] [ 17 ] Таким образом, высвобождение цитохрома с необходимо для инициации действия апоптосомы; это высвобождение регулируется несколькими способами, наиболее важным из которых является определение кальция уровней ионов . [ 16 ]
Цитохром с релиз
[ редактировать ]Предполагается, что высвобождение цитохрома с происходит одним из двух способов. Во-первых, пора перехода проницаемости (PTP), когда митохондрии получают сигнал, вызывающий гибель, и высвобождают белки межмембранного пространства (12). PTP состоит из потенциал-зависимого анионного канала (VDAC), внутренней мембраны белка-транслокатора адениновых нуклеотидов (AdNT) и матричного белка циклофилина D (CyD) (12). Эта пора вызывает набухание митохондрий и внешней митохондриальной мембраны разрыв (Diamond & McCabe, 2007). При этом изменении проницаемости , белки такие как цитохром с, высвобождаются в цитозоль (12). Это изменение, вероятно, вызывает переход митохондриальной проницаемости (MPT), при котором митохондриальный трансмембранный потенциал рушится и производство АТФ прекращается (12). Ингибирование этого метода фармацевтическим агентом циклоспорином А (CsA) привело к открытию второго пути (13). Второй метод высвобождения цитохрома с не зависит от PTP и включает только VDAC. Члены семейства Bcl-2 проапоптотические белки могут индуцировать открытие VDAC (12). Это приведет к такому же высвобождению белков межмембранного пространства, включая цитохром с, и последующему MPT (12).
Апаф-1
[ редактировать ]а. Отсутствие цитохрома с
[ редактировать ]В отсутствие цитохрома с Apaf-1 существует в мономерной форме; Считается, что домен WD-40 остается свернутым на белке, сохраняя Apaf-1 в автоингибированном состоянии. [ 16 ] Кроме того, некоторые участки настолько прочно связаны, что белок не может связываться ни с чем другим. [ 16 ] было установлено С помощью масс-спектрометрии , что в автоингибированном или «заблокированном» состоянии АДФ связан с АТФазным доменом Apaf-1. [ 16 ] В этом состоянии этот белок является единственным и не способен активировать какие-либо каспазы .
б. Присутствие цитохрома с
[ редактировать ]Цитохром c связывается с доменом WD-40 Apaf-1. [ 16 ] Это позволяет снять «блокировку», то есть этот домен больше не блокируется автоматически. [ 1 ] [ 16 ] Однако домены CARD и NB-ARC остаются в автоингибированном состоянии. [ 16 ] Домен CARD будет освобожден от этой блокировки только тогда, когда Apaf-1 будет связан с (d) ATP/ATP; когда АТФ связывается, домену CARD будет разрешено связываться с каспазой-9. [ 1 ] [ 16 ] Когда АДФ находится в домене АТФазы, олигомеризация ингибируется. Таким образом, связывание АТФ также позволяет олигомеризировать Apaf-1 в гептагональную структуру, необходимую для последующей активации каспазы. [ 1 ] [ 7 ] [ 16 ] Мутации в домене АТФазы делают белок неактивным; однако метод контроля этого обмена АДФ-АТФ неясен. [ 1 ] [ 7 ] [ 16 ] Таким образом, олигомеризация может происходить только в присутствии 7 молекул цитохрома с, 7 белков Apaf-1 и достаточного количества (d) АТФ/АТФ. [ 7 ] Домен АТФазы принадлежит к семейству АТФаз ААА+ ; это семейство известно своей способностью связываться с другими доменами АТФазы и образовывать гекса- или гептамеры. [ 16 ] Апоптосома считается активной, если семь молекул Apaf-1 расположены в форме колеса и ориентированы так, что домены NB-ARC располагаются в центре. [ 1 ] [ 16 ]
Активное действие апоптосомы
[ редактировать ]Эта функциональная апоптосома затем может обеспечить активацию платформы каспазы 9. [ 1 ] [ 16 ] Каспаза 9 существует в виде зимогена в цитозоле и, как полагают, обнаруживается в клетках в концентрации 20 нМ. [ 16 ] Хотя известно, что для того, чтобы стать активным, ферменту не требуется расщепление. [ 16 ] активность прокаспазы-9 может значительно увеличиться после расщепления. [ 13 ] Первая гипотеза состоит в том, что апоптосома обеспечивает место для димеризации двух молекул каспазы 9 перед расщеплением; эту гипотезу поддержали Рейдл и Салвасен в 2007 году. Второе заключается в том, что расщепление происходит, пока каспаза 9 все еще находится в мономерной форме. [ 13 ] [ 16 ] В каждом случае активация каспазы 9 приводит к активации полного каспазного каскада и последующей гибели клеток. Было высказано предположение, что эволюционная причина того, что мультимерный белковый комплекс активирует каспазный каскад, заключается в том, чтобы гарантировать, что следовые количества цитохрома с случайно не вызовут апоптоз. [ 7 ]
Области исследований
[ редактировать ]Что происходит, когда происходят мутации?
[ редактировать ]Хотя апоптоз необходим для естественного функционирования организма, мутации пути апоптосом вызывают катастрофические последствия и изменения в организме. Мутации клеточного пути могут либо способствовать гибели клеток, либо препятствовать гибели клеток, создавая огромное количество заболеваний в организме. Мутированные пути апоптоза, вызывающие заболевания, многочисленны и варьируются от рака из-за отсутствия активности апоптосом до болезни Альцгеймера из-за слишком высокой активности апоптосом и многих других нейродегенеративных заболеваний, таких как болезнь Паркинсона и болезнь Хантингтона . [ 18 ] Нейродегенеративные заболевания, такие как болезнь Альцгеймера, Паркинсона и Хантингтона, являются возрастными заболеваниями и включают повышенный апоптоз, при котором умирают клетки, которые все еще способны функционировать или способствуют поддержанию функции ткани. Apaf-1-ALT — это мутант Apaf-1, обнаруженный при раке простаты, который не имеет остатков 339–1248. Недавние структурные исследования апоптосом доказывают, что Apaf-1-ALT не может образовывать апоптосому, поскольку ему не хватает ключевых структурных компонентов для сборки. [ 1 ]
Подавление апоптоза, вызывающего рак
[ редактировать ]Генетические и биохимические аномалии внутри клетки обычно вызывают запрограммированную гибель клеток, чтобы избавить организм от нерегулярного функционирования и развития клеток; однако раковые клетки приобрели мутации, которые позволяют им подавлять апоптоз и выживать. Химиотерапия, такая как ионизирующее излучение, была разработана для активации этих подавленных путей PCD путем гиперстимуляции для содействия нормальному PCD. [ 19 ]
Мутации P53 при апоптозе
[ редактировать ]P53 опухоли действует как супрессор , который участвует в предотвращении рака и естественным образом возникает в путях апоптоза. P53 заставляет клетки вступать в апоптоз и нарушать дальнейшее деление клеток, тем самым предотвращая превращение этой клетки в раковую (16). В большинстве случаев рака именно путь р53 мутирует, что приводит к отсутствию способности уничтожать дисфункциональные клетки. Функция P53 также может быть ответственна за ограниченную продолжительность жизни, когда мутации гена p53 вызывают экспрессию доминантно-негативных форм, производящих долгоживущих животных. Например, в эксперименте с использованием C. elegans было обнаружено, что увеличение продолжительности жизни мутантов p53 зависит от усиления аутофагии. [ 19 ] В другом эксперименте с использованием дрозофилы мутация р53 оказала как положительное, так и отрицательное влияние на продолжительность жизни взрослого человека, что позволило сделать вывод о связи между половой дифференциацией, PCD и старением. [ 19 ] Определение того, как р53 влияет на продолжительность жизни, станет важной областью будущих исследований.
Нацеливание на апоптосому для терапии рака
[ редактировать ]Ингибирование апоптоза является одной из ключевых особенностей рака, поэтому поиск способов манипулирования и преодоления этого ингибирования для формирования апоптосомы и активации каспаз важен для разработки новых методов лечения рака. [ 20 ] Способность напрямую вызывать активацию апоптосом ценна при лечении рака, поскольку инфицированные раковые гены не могут быть уничтожены, что приводит к продолжению формирования рака. Путем активации апоптосомы внешним раздражителем может произойти апоптоз и избавиться от мутировавших клеток. В настоящее время разрабатываются многочисленные подходы для достижения этой цели, включая рекомбинантные биомолекулы, антисмысловые стратегии, генную терапию и классическую органическую комбинаторную химию для воздействия на специфические регуляторы апоптоза в подходе к коррекции чрезмерной или недостаточной гибели клеток при заболеваниях человека. [ 18 ]
В общем, повышающая регуляция антиапоптотических белков приводит к предотвращению апоптоза, которую можно решить с помощью ингибиторов, а понижающая регуляция антиапоптотических белков приводит к индукции апоптоза, который обращается активаторами, которые способны связывать и модифицировать их. активность. Важной молекулой-мишенью в терапии, основанной на апоптозе, является Bcl-2 для разработки лекарств. [ 18 ] Bcl-2 был первым онкогеном, вызывающим апоптоз, ингибирующий рак. Он чрезмерно экспрессируется в опухолях и устойчив к химиотерапии. [ 18 ] Ученые обнаружили, что связывание депрессоров с антиапоптотическим белками Bcl-2 ингибирует их и оставляет прямым активаторам возможность взаимодействовать с Bax и Bak . [ 18 ]
Другая целевая молекула для терапии рака включает семейство каспаз и их регуляторы. Ингибирование активности каспаз блокирует гибель клеток при заболеваниях человека, включая нейродегенеративные расстройства, инсульт, сердечный приступ и повреждение печени. Таким образом, ингибиторы каспаз являются перспективным фармакологическим средством лечения инсульта и других заболеваний человека. Существует несколько ингибиторов каспаз, которые в настоящее время находятся на доклинической стадии и продемонстрировали многообещающие доказательства обратного действия некоторых нейродегенеративных заболеваний. В недавнем исследовании ученые разработали обратимый ингибитор каспазы-3 под названием M-826 и протестировали его на мышиной модели, где он блокировал повреждение тканей головного мозга. Кроме того, он был протестирован на мышах с болезнью Хантингтона, и ингибитор предотвратил гибель поперечно-полосатых нейронов, что выявило многообещающие эффекты для дальнейшего изучения этого ингибитора каспаз. [ 18 ]
Апоптосомный комплекс выявил новые потенциальные мишени для молекулярной терапии
[ редактировать ]Формирование апоптосомы Apaf1/каспазы-9 является решающим событием апоптотического каскада. Идентификация новых потенциальных лекарств, которые предотвращают или стабилизируют образование активного апоптосомного комплекса, является идеальной стратегией лечения заболеваний, характеризующихся избыточным или недостаточным апоптозом. [ 18 ] Недавно таурин было обнаружено, что предотвращает апоптоз, вызванный ишемией, в кардиомиоцитах благодаря своей способности ингибировать образование апоптосом Apaf1/каспазы-9, не предотвращая митохондриальную дисфункцию. Возможный механизм, с помощью которого таурин ингибирует образование апоптосомы, был идентифицирован как способность снижать экспрессию каспазы-9, фундаментального компонента апоптосомы. Однако есть исследования, которые показывают, что Apaf1 и каспаза-9 играют независимые роли, помимо апоптосомы, поэтому изменение их уровней может также изменить функцию клеток. Таким образом, несмотря на обнадеживающие экспериментальные данные, некоторые проблемы остаются нерешенными и ограничивают использование экспериментальных препаратов в клинической практике. [ 18 ]
Открытие ингибиторов апоптосом предоставит новый терапевтический инструмент для лечения заболеваний, опосредованных апоптозом. Особое значение имеют новые соединения, способные ингибировать стабильность и активность апоптосом, воздействуя на внутриклеточные белок-белковые взаимодействия, не изменяя уровни транскрипции компонентов апоптосомы. [ 18 ] Недавние структурные исследования апоптосом могут предоставить ценные инструменты для разработки терапии на основе апоптосом. [ 1 ] [ 13 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В Юань С., Юй Х, Топф М., Лудтке С.Дж., Ван Х., Эйки К.В. «Структура комплекса CARD апоптосома-прокаспаза-9». Структура. Май 2010 г.;18(5):571-83.
- ^ Перейти обратно: а б с д и ж г час я дж к л м Ачехан Д., Цзян Х., Морган Д.Г., Хойзер Дж.Э., Ван Х., Эйки К.В. (февраль 2002 г.). «Трехмерная структура апоптосомы: значение для сборки, связывания прокаспазы-9 и активации» . Молекулярная клетка . 9 (2): 423–32. дои : 10.1016/s1097-2765(02)00442-2 . ПМИД 11864614 .
- ^ Т.Ф. Реубольд; С. Вольгемут; С. Эшенбург (2011). «Кристаллическая структура полноразмерного Apaf-1: как сигнал смерти передается на митохондриальном пути апоптоза» . Структура . 19 (8): 1074–1083. дои : 10.1016/j.str.2011.05.013 . ПМИД 21827944 .
- ^ Цудзимото Ю (ноябрь 1998 г.). «Роль белков семейства Bcl-2 в апоптозе: апоптосомы или митохондрии?» . Гены в клетки . 3 (11): 697–707. дои : 10.1046/j.1365-2443.1998.00223.x . ПМИД 9990505 .
- ^ Пан, Г.; О'Рурк, К.; Диксит, В.М. (1998). «Каспаза-9, Bcl-XL и Apaf-1 образуют тройной комплекс» . Журнал биологической химии . 273 (10): 5841–845. дои : 10.1074/jbc.273.10.5841 . ПМИД 9488720 .
- ^ Ху, Дин; Спенсер; Нуньес (1998). «Область повторов WD-40 регулирует самоассоциацию Apaf-1 и активацию прокаспазы-9» . Журнал биологической химии . 273 (50): 33489–3494. дои : 10.1074/jbc.273.50.33489 . ПМИД 9837928 .
- ^ Перейти обратно: а б с д и ж г час Цзоу Х, Ли Ю, Лю Х, Ван Х (апрель 1999 г.). «Мультимерный комплекс APAF-1.цитохром c представляет собой функциональную апоптосому, которая активирует прокаспазу-9» . Журнал биологической химии . 274 (17): 11549–56. дои : 10.1074/jbc.274.17.11549 . ПМИД 10206961 .
- ^ Цзя Л., Шринивасула С.М., Лю Ф.Т., Ньюленд А.С., Фернандес-Алнемри Т., Алнемри Э.С., Келси С.М. (июль 2001 г.). «Дефицит белка Apaf-1 придает устойчивость к цитохрому c-зависимому апоптозу в лейкозных клетках человека» . Кровь . 98 (2): 414–21. дои : 10.1182/blood.v98.2.414 . ПМИД 11435311 .
- ^ Битцер М., Армеану С., Принц Ф., Унгерехтс Г., Выбранец В., Шпигель М., Бернлер С., Чеккони Ф., Грегор М., Нойберт В.Дж., Шульце-Остхофф К., Лауэр У.М. (август 2002 г.). «Активация каспазы-8 и Apaf-1-независимой каспазы-9 в клетках, инфицированных вирусом Сендай» (PDF) . Журнал биологической химии . 277 (33): 29817–9824. дои : 10.1074/jbc.M111898200 . ПМИД 12021264 .
- ^ Вольф Б.Б., Шулер М., Ли В., Эггерс-Седлет Б., Ли В., Тейлор П., Фицджеральд П., Миллс ГБ, Грин Д.Р. (сентябрь 2001 г.). «Дефектная активация цитохрома c-зависимой каспазы в клеточных линиях рака яичников из-за уменьшенной или отсутствия активности апоптотической протеазы, активирующей фактор-1» . Журнал биологической химии . 276 (36): 34244–51. дои : 10.1074/jbc.M011778200 . ПМИД 11429402 .
- ^ Бельмохтар К.А., Хиллион Дж., Дудоньон К., Фиорентино С., Флексор М., Ланотт М., Сегал-Бендирджян Э. (август 2003 г.). «Апоптосомно-независимый путь апоптоза. Биохимический анализ дефектов APAF-1 и биологических результатов» . Журнал биологической химии . 278 (32): 29571–80. дои : 10.1074/jbc.M302924200 . ПМИД 12773531 .
- ^ Перейти обратно: а б с д и ж г Чекони Ф, Ферраро Э, Фуоко С, Страпаццон Ф (2010). «Структура и регуляция апоптосомы». пп. 27–39. дои : 10.1007/978-90-481-3415-1_2 . ISBN 978-90-481-3414-4 .
{{cite book}}:|journal=игнорируется ( помощь ) ; Отсутствует или пусто|title=( помощь ) - ^ Перейти обратно: а б с д и Юань С., Юй Х, Асара Дж.М., Хойзер Дж.Э., Лудтке С.Дж. и Акей К.В. «Голо-апоптосома: активация прокаспазы-9 и взаимодействие с каспазой-3». Структура. Август 2011 г.;19(8):1084–1096.
- ^ Перейти обратно: а б Юань С., Юй Х, Топф М., Дорстин Л., Кумар С., Лудтке С.Дж. и Эйки К.В. «Структура апоптосомы дрозофилы с разрешением 6,9 Å». Структура. Январь 2011 г.;19(1):128–140.
- ^ С. Ци; Ю. Панг; Вопрос Ху; К. Лю; Х. Ли; Ю. Чжоу; Т. Он; К. Лян; Ю. Лю; С. Юань; Г. Ло; Х. Ли; Дж. Ван; Н. Ян; Ю. Ши (2010). «Кристаллическая структура апоптосомы Caenorhabditis elegans демонстрирует октамерную сборку CED-4» . Клетка . 141 (3): 446–457. дои : 10.1016/j.cell.2010.03.017 . ПМИД 20434985 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р Ридл С.Дж., Салвесен Г.С. (май 2007 г.). «Апоптосома: сигнальная платформа гибели клеток». Обзоры природы. Молекулярно-клеточная биология . 8 (5): 405–13. дои : 10.1038/nrm2153 . ПМИД 17377525 . S2CID 3064077 .
- ^ Даймонд и МакКейб (2007). Митохондрии и растение запрограммировали гибель клеток. В: Логан, округ Колумбия (ред.), Растительные митохондрии. Ежегодный обзор растений, 2007 г., 31: 308–334.
- ^ Перейти обратно: а б с д и ж г час я Д'Амелио М., Тино Э., Чеккони Ф. (апрель 2008 г.). «Апоптосома: новые идеи и новые потенциальные цели для разработки лекарств» . Фармацевтические исследования . 25 (4): 740–51. дои : 10.1007/s11095-007-9396-z . ПМК 2279152 . ПМИД 17674158 .
- ^ Перейти обратно: а б с Шен Дж, Башня J (декабрь 2009 г.). «Запрограммированная смерть клеток и апоптоз в регуляции старения и продолжительности жизни». Медицина открытий . 8 (43): 223–6. ПМИД 20040274 .
- ^ Фишер У, Янссен К, Шульце-Остхофф К (2007). «Передовые методы лечения, основанные на апоптозе: панацея от рака?». Биопрепараты . 21 (5): 273–97. дои : 10.2165/00063030-200721050-00001 . ПМИД 17896835 . S2CID 36028755 .