АДАМ10
| АДАМ10 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | ADAM10 , AD10, AD18, CD156c, HsT18717, MADM, RAK, kuz, CDw156, металлопептидазный домен ADAM 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 602192 ; МГИ : 109548 ; Гомологен : 865 ; Генные карты : ADAM10 ; ОМА : ADAM10 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Эндопептидаза ADAM10 | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 3.4.24.81 | ||
| Номер CAS. | 193099-09-1 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
Белок 10, содержащий домен дизинтегрина и металлопротеиназы , также известный как ADAM10 или CDw156 или CD156c, представляет собой белок , который у людей кодируется ADAM10 геном . [5]
Функция
[ редактировать ]Члены семейства ADAM представляют собой белки клеточной поверхности с уникальной структурой, обладающие как потенциальными адгезивными , так и протеазными доменами . Шеддаза, общее название металлопептидазы ADAM, в первую очередь расщепляет мембранные белки на клеточной поверхности. После расщепления шеддазы высвобождают растворимые эктодомены с измененным расположением и функцией. [6] [7] [8]
Хотя одна шеддаза может «высвободить» множество веществ, несколько шеддаз могут расщеплять один и тот же субстрат, что приводит к различным последствиям. Этот ген кодирует члена семейства ADAM, который расщепляет многие белки, включая TNF-альфа и E-кадгерин. [5]
ADAM10 (EC#: 3.4.24.81) представляет собой шеддазу и обладает широкой специфичностью в реакциях гидролиза пептидов. [9]
ADAM10 расщепляет эфрин в составе комплекса эфрин/эф, образованного между двумя клеточными поверхностями. Когда эфрин высвобождается из противоположной клетки, весь комплекс эфрин/эф подвергается эндоцитозу. Это выделение транс ранее не было показано, но вполне может быть связано с другими событиями выделения. [10]
В нейронах ADAM10 является наиболее важным ферментом с активностью α-секретазы , обеспечивающим протеолитическую обработку белка-предшественника амилоида . [11] ADAM10, наряду с ADAM17 , расщепляет эктодомен запускающего рецептора, экспрессируемого на миелоидных клетках 2 ( TREM2 ), с образованием растворимого TREM2 (sTREM2), который был предложен в качестве биомаркера нейродегенерации в спинномозговой жидкости и сыворотке крови. [12]
ADAM10 принадлежит к подсемейству A, самому древнему подсемейству белков ADAM, которое характерно для всех основных групп животных , хоанофлагеллят , грибов и зеленых водорослей из класса Mamiellophyceae . [13]
Структура
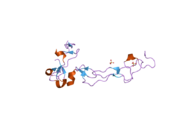
[ редактировать ]Хотя не было опубликовано никаких кристаллографических рентгеновских дифракционных анализов, которые бы отражали всю структуру ADAM10, один домен был изучен с использованием этого метода. Домен, богатый дезинтегрином и цистеином (показан справа), играет важную роль в регуляции активности протеазы in vivo. Недавние экспериментальные данные свидетельствуют о том, что эта область, отличная от активного центра, может отвечать за субстратную специфичность фермента. Предполагается, что этот домен связывается с определенными участками субстрата фермента, позволяя гидролизу пептидных связей происходить в четко определенных местах на определенных белках-субстратах. [14]
Предполагаемый активный сайт ADAM10 был идентифицирован с помощью анализа последовательности и идентичен ферментам семейства металлопротеиновых доменов змеиного яда. Консенсусной последовательностью каталитически активных белков ADAM является HE XG H NLGXX HD D. Структурный анализ ADAM17, который имеет ту же последовательность активного сайта, что и ADAM10, предполагает, что три гистидина в этой последовательности связывают Zn. 2+ атом, и что глутамат является каталитическим остатком. [15]
Каталитический механизм
[ редактировать ]Хотя точный механизм ADAM10 тщательно не изучен, его активный центр гомологичен хорошо изученным цинк-протеазам, таким как карбоксипептидаза А и термолизин. Таким образом, предполагается, что ADAM10 использует тот же механизм, что и эти ферменты.В цинковых протеазах ключевые каталитические элементы идентифицированы как остаток глутамата и Zn. 2+ ион координирован с остатками гистидина. [16]
Предлагаемый механизм начинается с депротонирования молекулы воды глутаматом. Образующийся гидроксид инициирует нуклеофильную атаку карбонильного углерода основной цепи пептида, образуя тетраэдрический промежуточный продукт. Этому этапу способствует отрыв электронов от кислорода Zn. 2+ и последующей стабилизацией цинком отрицательного заряда атома кислорода в промежуточном состоянии. Когда электроны движутся вниз от атома кислорода для повторного образования двойной связи, тетраэдрический интермедиат распадается на продукты с протонированием -NH остатком глутамата. [16]
Клиническое значение
[ редактировать ]Заболевания головного мозга
[ редактировать ]ADAM10 играет ключевую роль в модуляции молекулярных механизмов, ответственных за формирование, созревание и стабилизацию дендритных шипов, а также в регуляции молекулярной организации глутаматергического синапса. Следовательно, изменение активности ADAM10 строго коррелирует с возникновением различных типов синаптопатий, начиная от нарушений нервного развития, т.е. расстройств аутистического спектра, до нейродегенеративных заболеваний, т.е. болезни Альцгеймера. [17]
Взаимодействие с малярийным паразитом
[ редактировать ]Ряд различных белков на поверхности малярийных паразитов Plasmodium falciparum помогают захватчикам связываться с эритроцитами. Но однажды прикрепившись к клеткам крови хозяина, паразитам необходимо избавиться от «липких» поверхностных белков, которые в противном случае мешали бы проникновению в клетку. Фермент Шеддаза, в этом примере называемый PfSUB2, необходим паразитам для проникновения в клетки; без него паразиты погибают. Согласно исследованию, шеддаза хранится и высвобождается из клеточных отсеков вблизи кончика паразита. Оказавшись на поверхности, фермент прикрепляется к мотору, который перемещает его спереди назад, высвобождая липкие поверхностные белки. После удаления этих белков паразит попадает в эритроцит. Вся инвазия длится около 30 секунд, и без этой металлопептидазы ADAM малярия была бы неэффективна при проникновении в эритроциты. [18]
Рак молочной железы
[ редактировать ]В сочетании с низкими дозами герцептина селективные ингибиторы ADAM10 уменьшают пролиферацию в HER2 клеточных линиях со сверхэкспрессией , тогда как ингибиторы, которые не ингибируют ADAM10, не оказывают никакого влияния. Эти результаты согласуются с тем, что ADAM10 является основным фактором, определяющим выделение HER2, ингибирование которого может обеспечить новый терапевтический подход для лечения рака молочной железы и множества других видов рака с активной передачей сигналов HER2. [19]
Присутствие продукта этого гена в синапсах нейронов в сочетании с белком AP2 наблюдалось в повышенных количествах в нейронах гиппокампа пациентов с болезнью Альцгеймера . [20]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Ensembl, выпуск 89: ENSG00000137845 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000054693 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Перейти обратно: а б «Ген Энтрез: ADAM10 Металлопептидазный домен ADAM 10» .
- ^ Мосс М.Л., Барч Дж.В. (июнь 2004 г.). «Терапевтические преимущества от воздействия на членов семьи ADAM». Биохимия . 43 (23): 7227–35. дои : 10.1021/bi049677f . ПМИД 15182168 .
- ^ Нагано О, Сая Х (декабрь 2004 г.). «Механизм и биологическое значение расщепления CD44» . Раковая наука . 95 (12): 930–5. дои : 10.1111/j.1349-7006.2004.tb03179.x . ПМЦ 11159127 . ПМИД 15596040 . S2CID 9009213 .
- ^ Блобель CP (январь 2005 г.). «ADAM: ключевые компоненты передачи сигналов и развития EGFR». Обзоры природы. Молекулярно-клеточная биология . 6 (1): 32–43. дои : 10.1038/nrm1548 . ПМИД 15688065 . S2CID 7011302 .
- ^ «Запись эндопептидазы ADAM10 (EC-номер 3.4.24.81)» .
- ^ Джейнс П.В., Саха Н., Бартон В.А., Колев М.В., Виммер-Клейкамп Ш., Нивергалл Э. и др. (октябрь 2005 г.). «Адам встречает Eph: модуль распознавания субстрата ADAM действует как молекулярный переключатель расщепления эфрина в транс» . Клетка . 123 (2): 291–304. дои : 10.1016/j.cell.2005.08.014 . ПМИД 16239146 . S2CID 7962666 .
- ^ Хаас С., Кетер С., Тинакаран Г., Сисодиа С. (май 2012 г.). «Транспорт и протеолитическая обработка APP» . Перспективы Колд-Спринг-Харбора в медицине . 2 (5): а006270. doi : 10.1101/cshperspect.a006270 . ПМЦ 3331683 . ПМИД 22553493 .
- ^ Ян Дж, Фу Z, Чжан X, Сюн М, Мэн Л, Чжан Z (07.07.2020). «Эктодомен TREM2 и его растворимая форма при болезни Альцгеймера» . Журнал нейровоспаления . 17 (1): 204. дои : 10.1186/s12974-020-01878-2 . ISSN 1742-2094 . ПМЦ 7341574 . ПМИД 32635934 .
- ^ Соуза Дж., Лисбоа А., Сантос Т., Андраде М., Невес В., Телес-Соуза Дж. и др. (2020). «Эволюция семейства генов ADAM у эукариот» . Геномика . 112 (5): 3108–3116. дои : 10.1016/j.ygeno.2020.05.010 . ПМИД 32437852 . S2CID 218832838 .
- ^ Смит К.М., Готье А., Кузен Х., Альфандари Д., Уайт Дж.М., Дезимоун Д.В. (декабрь 2002 г.). «Богатый цистеином домен регулирует функцию протеазы ADAM in vivo» . Журнал клеточной биологии . 159 (5): 893–902. дои : 10.1083/jcb.200206023 . ПМК 2173380 . ПМИД 12460986 .
- ^ Вольфсберг Т.Г., Примакофф П., Майлз Д.Г., Уайт Дж.М. (октябрь 1995 г.). «ADAM, новое семейство мембранных белков, содержащих домен дизинтегрина и металлопротеазы: мультипотенциальные функции во взаимодействиях клетка-клетка и клетка-матрикс» . Журнал клеточной биологии . 131 (2): 275–8. дои : 10.1083/jcb.131.2.275 . ПМК 2199973 . ПМИД 7593158 .
- ^ Перейти обратно: а б Лолис Э, Пецко Г.А. (1990). «Аналоги переходного состояния в кристаллографии белков: зонды структурного источника ферментативного катализа». Ежегодный обзор биохимии . 59 : 597–630. дои : 10.1146/annurev.bi.59.070190.003121 . ПМИД 2197984 .
- ^ Марчелло Э., Боррони Б., Пелучки С., Гардони Ф., Ди Лука М. (ноябрь 2017 г.). «ADAM10 как терапевтическая мишень при заболеваниях головного мозга: от нарушений развития до болезни Альцгеймера». Мнение экспертов о терапевтических целях . 21 (11): 1017–1026. дои : 10.1080/14728222.2017.1386176 . ПМИД 28960088 . S2CID 46800368 .
- ^ « Шеддаза помогает малярийному паразиту проникнуть в эритроциты» . Архивировано из оригинала 12 апреля 2008 г.
- ^ Лю ПК, Лю Х, Ли Ю, Ковингтон М, Винн Р, Хубер Р и др. (июнь 2006 г.). «Идентификация ADAM10 как основного источника активности шеддазы эктодомена HER2 в клетках рака молочной железы, сверхэкспрессирующих HER2» . Биология и терапия рака . 5 (6): 657–64. дои : 10.4161/cbt.5.6.2708 . ПМИД 16627989 . S2CID 23463401 .
- ^ Марчелло Э., Сарасено С., Мусардо С., Вара Х., де ла Фуэнте А.Г., Пелуччи С. и др. (июнь 2013 г.). «Эндоцитоз синаптического ADAM10 при пластичности нейронов и болезни Альцгеймера» . Журнал клинических исследований . 123 (6): 2523–38. дои : 10.1172/JCI65401 . ПМЦ 3668814 . ПМИД 23676497 .
Дальнейшее чтение
[ редактировать ]- Вольфсберг Т.Г., Примакофф П., Майлз Д.Г., Уайт Дж.М. (октябрь 1995 г.). «ADAM, новое семейство мембранных белков, содержащих домен дизинтегрина и металлопротеазы: мультипотенциальные функции во взаимодействиях клетка-клетка и клетка-матрикс» . Журнал клеточной биологии . 131 (2): 275–8. дои : 10.1083/jcb.131.2.275 . ПМК 2199973 . ПМИД 7593158 .
- О'Брайан Дж.П., Фриделл Ю.В., Коски Р., Варнум Б., Лю Э.Т. (январь 1995 г.). «Тирозинкиназа трансформирующего рецептора Axl посттрансляционно регулируется путем протеолитического расщепления» . Журнал биологической химии . 270 (2): 551–7. дои : 10.1074/jbc.270.2.551 . ПМИД 7822279 . S2CID 46190313 .
- Ховард Л., Лу Х, Митчелл С., Гриффитс С., Глинн П. (июль 1996 г.). «Молекулярное клонирование MADM: каталитически активная дезинтегрин-металлопротеаза млекопитающих, экспрессируемая в различных типах клеток» . Биохимический журнал . 317 (Часть 1) (1): 45–50. дои : 10.1042/bj3170045 . ПМЦ 1217484 . ПМИД 8694785 .
- Маккай Н., Эдвардс Т., Даллас Дж., Хоутон А., Стрингер Б., Грэм Р. и др. (январь 1997 г.). «Экспрессия членов нового семейства мембраносвязанных металлопротеиназ (ADAM) в суставных хондроцитах человека». Связь с биохимическими и биофизическими исследованиями . 230 (2): 335–9. дои : 10.1006/bbrc.1996.5957 . ПМИД 9016778 .
- Розендаль М.С., Ко С.К., Лонг Д.Л., Брюэр М.Т., Розенцвейг Б., Хедл Э. и др. (сентябрь 1997 г.). «Идентификация и характеристика фермента, обрабатывающего альфа-фактор некроза опухоли, из семейства цинковых металлопротеаз ADAM» . Журнал биологической химии . 272 (39): 24588–93. дои : 10.1074/jbc.272.39.24588 . ПМИД 9305925 . S2CID 21399815 .
- Ямадзаки К., Мизуи Ю., Танака И. (октябрь 1997 г.). «Радиационное гибридное картирование гена ADAM10 человека на хромосоме 15». Геномика . 45 (2): 457–9. дои : 10.1006/geno.1997.4910 . ПМИД 9344679 .
- Ямадзаки К., Мизуи Ю., Сагане К., Танака I (декабрь 1997 г.). «Присвоение гена домена 10 дезинтегрина и металлопротеиназы (Adam10) хромосоме 9 мыши». Геномика . 46 (3): 528–9. дои : 10.1006/geno.1997.5043 . ПМИД 9441766 .
- Явари Р., Адида С., Брей-Уорд П., Бринс М., Сюй Т. (июль 1998 г.). «Металлопротеаза-дезинтегрин человека Кузбаниан регулирует судьбу симпатоадреналовых клеток в развитии и неоплазии» . Молекулярная генетика человека . 7 (7): 1161–7. дои : 10.1093/hmg/7.7.1161 . ПМИД 9618175 .
- Даллас DJ, Дженевер П.Г., Паттон А.Дж., Милличип М.И., Маккай Н., Скерри Т.М. (июль 1999 г.). «Локализация рецепторов ADAM10 и Notch в кости». Кость . 25 (1): 9–15. дои : 10.1016/S8756-3282(99)00099-X . ПМИД 10423016 .
- Диас Нето Э., Корреа Р.Г., Верёвски-Алмейда С., Брионес М.Р., Нагаи М.А., да Силва В. и др. (март 2000 г.). «Секвенирование транскриптома человека с помощью меток последовательности, экспрессируемых ORF» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (7): 3491–6. Бибкод : 2000PNAS...97.3491D . дои : 10.1073/pnas.97.7.3491 . ПМК 16267 . ПМИД 10737800 .
- Хаттори М., Остерфилд М., Фланаган Дж.Г. (август 2000 г.). «Регулируемое расщепление контактно-опосредованного репеллента аксонов». Наука . 289 (5483): 1360–5. Бибкод : 2000Sci...289.1360H . дои : 10.1126/science.289.5483.1360 . ПМИД 10958785 .
- Винсент Б., Патель Э., Сафтиг П., Фроберт Ю., Хартманн Д., Де Струпер Б. и др. (октябрь 2001 г.). «Дезинтегрины ADAM10 и TACE способствуют конститутивному и регулируемому форболовым эфиром нормальному расщеплению клеточного прионного белка» . Журнал биологической химии . 276 (41): 37743–6. дои : 10.1074/jbc.M105677200 . ПМИД 11477090 .
- Чубинская С., Михаил Р., Дойч А., Тиндал М.Х. (сентябрь 2001 г.). «Белок ADAM-10 присутствует в суставном хряще человека преимущественно в мембраносвязанной форме, его активность повышается при остеоартрите и в ответ на IL-1альфа в носовом хряще крупного рогатого скота» . Журнал гистохимии и цитохимии . 49 (9): 1165–76. дои : 10.1177/002215540104900910 . ПМИД 11511685 . S2CID 6879742 .
- Лемджаббар Х., Басбаум К. (январь 2002 г.). «Рецептор фактора активации тромбоцитов и ADAM10 опосредуют реакцию на золотистый стафилококк в эпителиальных клетках». Природная медицина . 8 (1): 41–6. дои : 10.1038/nm0102-41 . ПМИД 11786905 . S2CID 7135441 .
- Хили Э.Ф., Романо П., Мехиа М., Линдфорс Г. (ноябрь 2010 г.). «Ацетиленовые ингибиторы ADAM10 и ADAM17: анализ эффективности и селективности in silico». Журнал молекулярной графики и моделирования . 29 (3): 436–42. дои : 10.1016/j.jmgm.2010.08.006 . ПМИД 20863729 .
- Арндт М., Лендекель У., Рекен С., Неппле К., Вольке С., Шписс А. и др. (февраль 2002 г.). «Измененная экспрессия ADAM (дезинтегрин и металлопротеиназа) в фибрилляциях предсердий человека» . Тираж . 105 (6): 720–5. дои : 10.1161/hc0602.103639 . ПМИД 11839628 . S2CID 10279346 .
- Колчиаги Ф., Боррони Б., Пасторино Л., Марчелло Э., Циммерманн М., Каттабени Ф. и др. (февраль 2002 г.). «[альфа]-секретаза ADAM10, а также [альфа]APPs снижается в тромбоцитах и спинномозговой жидкости пациентов с болезнью Альцгеймера» . Молекулярная медицина . 8 (2): 67–74. дои : 10.1007/BF03402076 . ПМК 2039975 . ПМИД 12080182 .
- Лим Р., Винтерингем Л.Н., Уильямс Дж.Х., Маккаллох Р.К., Ингли Э., Тиао Дж.Ю. и др. (октябрь 2002 г.). «MADM, новый адаптерный белок, который опосредует фосфорилирование сайта связывания 14-3-3 фактора 1 миелоидного лейкоза» (PDF) . Журнал биологической химии . 277 (43): 40997–1008. дои : 10.1074/jbc.M206041200 . ПМИД 12176995 . S2CID 40077371 .
- Гатта Л.Б., Альбертини А., Равид Р., Финацци Д. (ноябрь 2002 г.). «Уровни мРНК бета-секретазы BACE и альфа-секретазы ADAM10 в гиппокампе болезни Альцгеймера». НейроОтчет . 13 (16): 2031–3. дои : 10.1097/00001756-200211150-00008 . ПМИД 12438920 .
- Гутвейн П., Мехтершаймер С., Ридле С., Сток А., Гаст Д., Йоумаа С. и др. (февраль 2003 г.). «ADAM10-опосредованное расщепление молекулы адгезии L1 на поверхности клетки и в высвободившихся мембранных везикулах» . Журнал ФАСЭБ . 17 (2): 292–4. doi : 10.1096/fj.02-0430fje . ПМИД 12475894 . S2CID 21521110 .
Внешние ссылки
[ редактировать ]- ADAM10 Расположение гена человека в браузере генома UCSC .
- Подробности о гене человека ADAM10 в браузере генома UCSC .
- Обзор всей структурной информации, доступной в PDB для UniProt : O14672 (белок 10, содержащий домен дизинтегрина и металлопротеиназы) на PDBe-KB .
Эта статья включает текст из Национальной медицинской библиотеки США , который находится в свободном доступе .