L1 (белок)
| L1CAM | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | L1CAM , CAML1, CD171, HSAS, HSAS1, MASA, MIC5, N-CAM-L1, N-CAML1, NCAM-L1, S10, SPG1, молекула клеточной адгезии L1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 308840 ; МГИ : 96721 ; Гомологен : 20128 ; Генные карты : L1CAM ; ОМА : L1CAM — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
L1 , также известный как L1CAM , представляет собой трансмембранный белок семейства белков L1 , кодируемый геном L1CAM . Этот белок массой от 200 до 220 кДа представляет собой молекулу адгезии нейрональных клеток , которая играет важную роль в миграции клеток, адгезии, росте нейритов, миелинизации и дифференцировке нейронов. [ 5 ] Благодаря своей функции он также играет ключевую роль в развитии резистентных к лечению видов рака. Впервые он был идентифицирован в 1984 году М. Шахнером, который обнаружил белок в постмитотических нейронах мышей .
Мутации в белке L1 являются причиной синдрома L1 , иногда известного под аббревиатурой CRASH (гипоплазия мозолистого тела, задержка развития, афазия, спастическая параплегия и гидроцефалия). [ 6 ]
Тканевое и клеточное распределение
[ редактировать ]Белок L1 расположен по всей нервной системе на поверхности нейронов. Он располагается вдоль клеточной мембраны так, что один конец белка остается внутри нервной клетки, а другой конец — на внешней поверхности нейрона. Такое положение позволяет белку активировать химические сигналы, которые распространяются по нейрону. [ 7 ]
Существует множество клеток, экспрессирующих белок L1, причем не только нейрональные, но и некоторые ненейрональные. [ 8 ] В настоящее время известно, что клетки, экспрессирующие белок L1, включают: незрелые олигодендроциты и шванновские клетки , которые не являются нейрональными клетками, обеспечивающими поддержку и защиту нейронов и образующими миелин; Т-клетки , которые представляют собой лимфоциты, участвующие в клеточном иммунитете; другие типы лимфоцитов, такие как B-клетки и моноциты . Он также экспрессируется в эпителиальных клетках-предшественниках кишечника, нейронах мозжечка, таких как гранулярные клетки мозжечка и клетки Пуркинье . Наконец, он экспрессируется во многих опухолевых клетках, например, в клетках меланомы и рака легких . [ 5 ]
L1CAM также часто используется в качестве маркера внеклеточных везикул (ВВ), происходящих из нейрональных клеток, хотя его присутствие конкретно на ВВ, полученных из нейронов, является спорным. [ 9 ]
Ген
[ редактировать ]человека Ген L1CAM обнаружен в участках Х-хромосомы, которые участвуют в различных нервно-мышечных заболеваниях, а также рядом с регионом, связанным с умственной отсталостью. Ген L1CAM расположен на длинном плече Х-хромосомы в положении Xq28. [ 10 ] [ 11 ]

Структура
[ редактировать ]
Молекула клеточной адгезии L1 (L1CAM) представляет собой гликопротеин клеточной поверхности , обнаруженный у людей (и других форм жизни, например мышей), который имеет белковую последовательность из 1253 аминокислот. Внеклеточная часть состоит из шести доменов иммуноглобулина, за которыми следуют пять доменов фибронектина типа III , которые соединены с небольшим внутриклеточным доменом трансмембранной спиралью. Человеческий белок очень похож на тот, который обнаружен у мышей (они на 92% идентичны на уровне аминокислот , что позволяет ученым изучить его структуру. Существуют и другие белки CAM, такие как Ng-CAM (обнаруженный у курицы), который имеет меньшее сходство с человеческим (они на 40% идентичны на аминокислотном уровне). Сравнение последовательностей человека, мыши, курицы и дрозофилы и их хорошая консервативность свидетельствуют о том, что домен 2 иммуноглобулина L1 и фибронектин типа III. домен 2 вероятно функционально важен. [ 12 ] [ 13 ]
Функция
[ редактировать ]L1 является важным белком для развития нервной системы, влияющим как на клеточную адгезию, так и на подвижность.
Клеточная адгезия
[ редактировать ]L1 выполняет статическую функцию молекулы клеточной адгезии , соединяющей разные клетки. Он участвует в адгезии между нейронами , а также в росте и объединении нейритов, что называется фасцикуляцией нейритов. [ 14 ]
Подвижность клеток
[ редактировать ]Функции, способствующие подвижности, связаны с регуляцией движения нервных клеток во время развития нервной системы . L1 присутствует в развивающихся нейронах и играет важную роль в направлении новых нейронов в правильные положения, а также помогает аксонам расти и устанавливать связи с другими нейронами. L1 также участвует в синаптической пластичности , то есть способности синапсов укрепляться или ослабляться, а также играет роль в регенерации после травмы.
Некоторые исследования доказали, что L1 играет роль в росте опухоли, инвазии опухолевых клеток, метастазировании меланомы, рака яичников и толстой кишки. [ 15 ] из-за сверхэкспрессии белка L1, который улучшает движение злокачественных клеток.
Домены этого белка способствуют гомофильным взаимодействиям, при которых молекулы адгезии на одной клетке взаимодействуют с идентичными молекулами на другой клетке. А также гетерофильные взаимодействия, когда молекула адгезии в одной клетке действует как рецептор, который соединяется с другой молекулой в другой клетке. [ 16 ] [ 17 ] Эти взаимодействия способствуют адгезии клеток и регуляции передачи сигнала .
Кроме того, L1 участвует в процессах миелинизации, которые участвуют в пролиферации миелина по нервной системе (в частности, прогрессирующей миелинизации нервных аксонных волокон), опосредуя удлинение шванновских клеток вдоль аксона.
Нервная система
[ редактировать ]L1 участвует в адгезии нейронов, фасцикуляции нейритов, росте нейритов, миграции зернистых клеток мозжечка, росте нейритов на шванновских клетках и взаимодействиях между эпителиальными клетками кишечных крипт. [ 18 ] Как следствие, мутации в гене L1CAM вызывают сбои в работе нервной системы . Основные нарушения, связанные с этой мутацией, известны под аббревиатурой CRASH или могут также называться синдромом L1 . Сюда входят такие расстройства, как HSAS , синдром MASA , агенезия мозолистого тела и спастическая параплегия . Спастичность нижних конечностей, умственная отсталость , гидроцефалия и сгибательная деформация больших пальцев — вот некоторые из симптомов, выраженных в основном у лиц мужского пола, страдающих этим заболеванием. [ 19 ] [ 20 ] [ 21 ] Хотя патологические механизмы, приводящие к синдрому L1, до сих пор неизвестны, около 200 мутаций гена L1CAM были идентифицированы и затем связаны с синдромом. Эти мутации в основном затрагивают структурно важные ключевые остатки во внеклеточной области L1, вызывая изменения свойств связывания белка, которые коррелируют с нарушением физиологических механизмов нейронов, таких как клеточная адгезия или специфическое взаимодействие с другими молекулами. [ 22 ] Взаимодействие анкирина с L1CAM является примером связывания белка, которое не удается у пациентов с CRASH. [ 23 ] из-за мутации, которая заставляет лейцин и гистидин заменять серин и тирозин соответственно в мотиве SFIGQY, где анкирин должен связываться с цитоплазматическим концом семейства L1CAM. [ 24 ] [ 25 ] Взаимодействие Ankyrin-L1CAM участвует в инициации конуса роста , следовательно, нарушение этого взаимодействия приводит к тому, что нейриты не достигают синаптической мишени.
Более того, данные показывают, что существует корреляция между расстройством алкогольного спектра плода и белком L1, поскольку этанол ингибирует опосредованную L1 адгезию и рост нейритов. [ 26 ] Болезнь Гиршпрунга также связана с неисправностью L1CAM. [ 27 ]
Транскрипция и синтез
[ редактировать ]Ген, регулирующий транскрипцию L1CAM, находится в хромосоме X. Ген L1CAM имеет длину 24 657 пар оснований и состоит из 28 экзонов. Альтернативный сплайсинг этого гена приводит к образованию множества вариантов транскрипта (существует 7 различных транскриптов гена). [ 28 ] включая некоторые, у которых есть альтернативный экзон , который считается специфичным для нейронов . [ 29 ] Транскрипция L1, как известно, происходит в мозге плода человека, а также в нейробластомы и ретинобластомы клеточных линиях . L1 также экспрессируется в клеточных линиях рабдомиосаркомы RD и А-204. У человека встречаются две формы L1, с той разницей, что одна имеет цитоплазматический сегмент длиной 12 п.о., а другая его лишена. [ 30 ] Регуляция экспрессии L1CAM при транскрипции до конца не изучена. Два участка были проверены на клеточных линиях карциномы эндометрия и, по-видимому, используются определенным образом в зависимости от типа клеток. Есть два сайта начала транскрипции, расположенные в двух разных экзонах (перед нетранслируемым экзоном 0 и рядом с первым экзоном 1, кодирующим белок). [ 31 ] SLUG ( SNAI2 ), фактор транскрипции, усиливает экспрессию L1CAM. [ 32 ]
Последовательности и различные изоформы
[ редактировать ]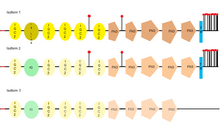
L1CAM имеет три разные изоформы , которые различаются аминокислотной последовательностью из-за альтернативного сплайсинга (процесса, который позволяет получать разные зрелые молекулы мРНК из одного первичного транскрипта мРНК ). Изоформа 1 L1CAM известна как каноническая последовательность . [ 33 ] Основное различие между ними заключается в том, где их можно найти, например, полноразмерная изоформа (изоформа 1) обычно обнаруживается в нервных клетках , тогда как короткая, или ненейронная изоформа (изоформа 2), преобладает в нервных клетках. другие типы клеток. [ 34 ]
| Длина (н аа) | Масса (Да) | Последовательность | |
|---|---|---|---|
| Изоформа 1
(в L1) |
1,257 | 140,003 | Каноническая последовательность . |
| Изоформа 2
(ш-Л1) |
1,253 | 139,517 | Отличается от канонической последовательности аминокислот между положениями 1177 и 1180, которые не встречаются в этой изоформе. |
| Изоформа 3 | 1,248 | 138,908 | Отличается от канонической последовательности аминокислот между позициями 26 и 31, где шесть аминокислот заменены на лейцин, и, как и от предыдущей, аминокислот между позициями 1177 и 1180, которые не встречаются в этой изоформе. [ 35 ] |
Взаимодействия
[ редактировать ]Было показано, что L1 (белок) взаимодействует с NUMB . [ 36 ]
Взаимодействие Ig-подобных доменов
[ редактировать ]L1CAM способен сворачиваться в подковообразную конфигурацию за счет установления гомофильных взаимодействий внутри Ig-подобных доменов одного и того же белка (первый и второй мотивы Ig складываются обратно на 4-й и 3-й мотивы). Эта конформация необходима для того, чтобы L1CAM могла взаимодействовать с другими молекулами и впоследствии выполнять некоторые из своих наиболее важных функций.
Ig-подобные домены участвуют во многих гомофильных взаимодействиях с другими белками L1CAM, расположенными в соседних клетках. Молекулы L1CAM взаимодействуют через Ig (1-4)-подобные домены, обеспечивая адгезию между клетками. Они также важны в формировании гетерофильных взаимодействий с NCAM , TAG-1 , F11 и рецепторными тирозинкиназами (особенно в период развития нервной системы).
Шесть мотивов Ig белка L1 содержат последовательность Arg-Gly-Asp, которая позволяет связываться с различными интегринами поверхностных клеток . Это взаимодействие приводит к сигнальному каскаду, который активирует киназы фокальной адгезии (FAK), которые затем переходят в активное состояние и образуют комплекс FAK/ SRC . Последний действует как активатор митоген-активируемых протеинкиназ . Другая функция, обусловленная связыванием интегрина, — это активация NF-κB , что приводит к тому, что клетки становятся более подвижными и инвазивными. [ 5 ]
Взаимодействие доменов фибронектина
[ редактировать ]Домены фибронектина белка L1 также способны связывать интегрины клеточной поверхности. Они взаимодействуют с рецептором фактора роста фибробластов 1 , что позволяет предположить, что это может быть связано с модуляцией дифференцировки нейронов. [ 5 ]
Взаимодействия цитоплазматического хвоста
[ редактировать ]Наиболее важными партнерами по связыванию цитоплазматического хвоста белков L1 являются анкирины . Взаимодействие осуществляется в сайтах связывания с высоким сродством, расположенных в так называемых «анковских повторах», также известных как мембраносвязывающие домены. [ 5 ] Это взаимодействие позволяет белку L1 соединяться с цитоскелетом клетки. Кроме того, цитоплазматический хвост белка L1 может связывать адаптер 2 (ADP) , ключевой компонент клатрин -опосредованного эндоцитоза .
Тот факт, что эта область содержит некоторые сайты фосфорилирования , позволяет предположить, что L1 может регулироваться киназами. [ 5 ]
Последствия метастазирования рака
[ редактировать ]Экспрессия белка L1CAM обычно ограничена нейронами. Однако было замечено, что во всех типах раковых клеток наблюдается сверхэкспрессия L1CAM, что связано с плохим прогнозом, прогрессированием опухоли и метастазированием . [ 37 ] Эта активация не обязательно может быть связана с мутациями в факторах транскрипции L1. Было замечено, что этот белок играет ключевую роль в воспалительных реакциях, происходящих в ткани, окружающей опухоль. Это может объяснить, почему этот белок внезапно начинает перепроизводиться в опухолевых клетках. Разнообразные функции L1CAM делают опухолевые клетки более агрессивными и устойчивыми. Их функции, связанные с миграцией и подвижностью, могут привести к ключевому клеточному эпителиально-мезенхимальному переходу (EMT), позволяющему клеткам потерять статические межклеточные соединения и апико-базальную полярность, что приводит к тому, что они становятся мигрирующими и независимыми. Кроме того, его способность образовывать адгезивные взаимодействия внутри разных типов клеток может дать преимущество опухолевым клеткам, когда дело доходит до кооптации и проникновения в окружающие ткани или капилляры.
Как только опухолевые клетки становятся независимыми от прикрепления и мигрируют из-за усиления регуляции L1, они покидают ткань, которой им принадлежат, и мигрируют через капилляры в другие органы. Одним из частых мест назначения опухолевых клеток является мозг. Таким образом, чтобы поселиться в мозге, опухолевым клеткам необходимо преодолеть гематоэнцефалический барьер (ГЭБ) , где они подвергаются воздействию плазмина, секретируемого астроцитами . Плазмин разрушает L1CAM и подавляет миграционные способности злокачественных клеток. Однако недавние исследования показали, что эти раковые клетки перепроизводят серпины анти-РА , которые являются обычными ингибиторами плазмина, что позволяет им пересекать ГЭБ и успешно метастазировать. [ 37 ]
Возможные методы лечения с использованием L1CAM
[ редактировать ]
Поскольку L1CAM считается ключевым фактором метастазирования , было высказано предположение, что блокирование этого белка может ингибировать миграцию раковых клеток и прогрессирование опухоли. Терапия антителами, направленными против L1CAM, на моделях рака на мышах блокирует рост опухоли, но усиливает ЕМТ . [ 38 ] инкапсулированная в липосомы, Малая интерферирующая РНК, также оказалась эффективным ингибитором экспрессии L1CAM, поскольку ее функция заключается в деградации определенного диапазона мРНК пар оснований (в данном случае тех, которые кодируют последовательность аминокислот L1CAM ) после транскрипции, так что белок не может быть синтезирован. [ нужна ссылка ] Тем не менее, эти возможные методы лечения, включающие L1CAM в качестве мишени при раке человека, все еще находятся на стадии доклинических исследований. [ 39 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000198910 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000031391 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б с д и ж Саматов Т.Р., Виклеин Д., Тоневицкий А.Г. (август 2016 г.). «L1CAM: Клеточная адгезия и многое другое» . Прогресс в гистохимии и цитохимии . 51 (2): 25–32. дои : 10.1016/j.proghi.2016.05.001 . ПМИД 27267927 .
- ^ «Ген Энтрез: молекула клеточной адгезии L1CAM L1» .
- ^ «Ген L1CAM» . Домашний справочник по генетике . Министерство здравоохранения и социальных служб США.
- ^ Анджолини Ф., Беллони Э., Джордано М., Кампиони М., Форнерис Ф., Паронетто М.П. и др. (март 2019 г.). «Новая изоформа L1CAM с ангиогенной активностью, генерируемая NOVA2-опосредованным альтернативным сплайсингом» . электронная жизнь . 8 : е44305. doi : 10.7554/eLife.44305 . ПМК 6398979 . ПМИД 30829570 .
- ^ Норман М., Тер-Ованесян Д., Трие В., Лазаровиц Р., Коваль Э.Дж., Ли Дж.Х. и др. (июнь 2021 г.). «L1CAM не связан с внеклеточными везикулами в спинномозговой жидкости или плазме человека» . Природные методы . 18 (6): 631–634. дои : 10.1038/s41592-021-01174-8 . ПМК 9075416 . ПМИД 34092791 . S2CID 235360393 .
- ^ Джабали М., Маттеи М.Г., Нгуен С., Ру Д., Деменжо Дж., Денизот Ф. и др. (август 1990 г.). «Ген, кодирующий L1, молекулу нейронной адгезии семейства иммуноглобулинов, расположен на Х-хромосоме у мыши и человека». Геномика . 7 (4): 587–93. дои : 10.1016/0888-7543(90)90203-7 . ПМИД 2387585 .
- ^ «Веб-страница мутации L1CAM» . База данных мутаций L1CAM . Университетский медицинский центр Гронингена. 12 октября 2012 года . Проверено 23 октября 2016 г.
- ^ Бейтман А., Жуэ М., Макфарлейн Дж., Ду Дж.С., Кенрик С., Чотия С. (ноябрь 1996 г.). «Обрисованная структура молекулы адгезии клеток L1 человека и места, где мутации вызывают неврологические расстройства» . Журнал ЭМБО . 15 (22): 6050–9. дои : 10.1002/j.1460-2075.1996.tb00993.x . ПМК 452426 . ПМИД 8947027 .
- ^ Хлавин М.Л., Леммон В. (октябрь 1991 г.). «Молекулярная структура и функциональное тестирование человеческого L1CAM: межвидовое сравнение». Геномика . 11 (2): 416–23. дои : 10.1016/0888-7543(91)90150-D . ПМИД 1769655 .
- ^ Хаспел Дж., Грумет М. (сентябрь 2003 г.). «Внеклеточная область L1CAM: многодоменный белок с модульным и кооперативным режимами связывания» . Границы бионауки . 8 (6): с1210-25. дои : 10.2741/1108 . ПМИД 12957823 .
- ^ «L1CAM (молекула клеточной адгезии L1)» .
- ^ Кушьер А. «Клеточные взаимодействия» . Мальтийский университет . Проверено 2 октября 2016 г.
- ^ Беккер В.М., Кляйнсмит Л.Дж., Хардин Дж., Рааш Дж. (2003). «Глава 16: Межклеточное распознавание и адгезия, клеточные соединения». Мир клетки (5-е изд.). Сан-Франциско: паб Benjamin/Cummings. Ко. стр. 302–14 . ISBN 978-0-8053-4852-1 .
- ^ Моос М., Таке Р., Шерер Х., Теплов Д., Фрю К., Шахнер М. (август 1988 г.). «Молекула нейронной адгезии L1 как член суперсемейства иммуноглобулинов со связывающими доменами, подобными фибронектину». Природа . 334 (6184): 701–3. Бибкод : 1988Natur.334..701M . дои : 10.1038/334701a0 . ПМИД 3412448 . S2CID 4330662 .
- ^ Франсен Э., Ван Кэмп Дж., Витс Л., Виллемс П.Дж. (1 января 1997 г.). «L1-ассоциированные заболевания: клинические генетики разделяются, молекулярные генетики объединяются». Молекулярная генетика человека . 6 (10): 1625–32. дои : 10.1093/hmg/6.10.1625 . ПМИД 9300653 .
- ^ Веллер С., Гертнер Дж (1 января 2001 г.). «Генетические и клинические аспекты Х-сцепленной гидроцефалии (болезнь L1): мутации в гене L1CAM». Человеческая мутация . 18 (1): 1–12. дои : 10.1002/humu.1144 . ПМИД 11438988 . S2CID 29343536 .
- ^ Кенрик С., Уоткинс А., Де Анджелис Э. (апрель 2000 г.). «Молекула L1, распознающая нервные клетки: связь биологической сложности с мутациями болезней человека» . Молекулярная генетика человека . 9 (6): 879–86. дои : 10.1093/hmg/9.6.879 . ПМИД 10767310 .
- ^ Шефер М.К., Альтефогт П. (июль 2010 г.). «Нарушение L1CAM в нервной системе и карциномы человека» . Клеточные и молекулярные науки о жизни . 67 (14): 2425–37. дои : 10.1007/s00018-010-0339-1 . ПМЦ 11115577 . ПМИД 20237819 . S2CID 22502589 .
- ^ Сожер-Вебер П., Мартин С., Ле Мёр Н., Лионне С., Мюнних А., Дэвид А. и др. (1 января 1998 г.). «Идентификация новых мутаций L1CAM с использованием анализа несоответствий с помощью флуоресценции» . Человеческая мутация . 12 (4): 259–66. doi : 10.1002/(SICI)1098-1004(1998)12:4<259::AID-HUMU7>3.0.CO;2-A . ПМИД 9744477 . S2CID 24449042 .
- ^ Чжан X, Дэвис JQ, Карпентер С., Беннетт В. (ноябрь 1998 г.). «Структурные требования к ассоциации нейрофасцина с анкирином» . Журнал биологической химии . 273 (46): 30785–94. дои : 10.1074/jbc.273.46.30785 . ПМИД 9804856 .
- ^ Гарвер Т.Д., Рен К., Тувиа С., Беннетт В. (май 1997 г.). «Фосфорилирование тирозина в сайте, высоко консервативном в семействе молекул клеточной адгезии L1, устраняет связывание анкирина и увеличивает латеральную подвижность нейрофасцина» . Журнал клеточной биологии . 137 (3): 703–14. дои : 10.1083/jcb.137.3.703 . ПМК 2139872 . ПМИД 9151675 .
- ^ Bearer CF (октябрь 2001 г.). «Развитая нейротоксичность. Иллюстрация принципов». Детские клиники Северной Америки . 48 (5): 1199–213, ix. дои : 10.1016/s0031-3955(05)70369-2 . ПМИД 11579669 .
- ^ Икава Х., Кавано Х., Такеда Ю., Масуяма Х., Ватанабе К., Эндо М. и др. (апрель 1997 г.). «Нарушение экспрессии молекулы адгезии нервных клеток L1 во внешних нервных волокнах при болезни Гиршпрунга». Журнал детской хирургии . 32 (4): 542–5. дои : 10.1016/s0022-3468(97)90703-x . ПМИД 9126750 .
- ^ «L1CAM (молекула клеточной адгезии L1)» . Атлас генетики и цитогенетики в онкологии и гематологии л . Проверено 6 октября 2016 г. [ постоянная мертвая ссылка ]
- ^ «Ген L1CAM» . Генные карты .
- ^ Рид Р.А., Хемперли Дж.Дж. (1992). «Варианты молекулы адгезии клеток L1 человека возникают в результате альтернативного сплайсинга РНК». Журнал молекулярной нейронауки . 3 (3): 127–35. дои : 10.1007/BF02919404 . ПМИД 1627459 . S2CID 24858876 .
- ^ Пфайфер М., Ширмер У., Гейсманн К., Шефер Х., Себенс С., Альтефогт П. (август 2010 г.). «Экспрессия L1CAM при карциномах эндометрия регулируется использованием двух разных областей промотора» . BMC Молекулярная биология . 11:64 . дои : 10.1186/1471-2199-11-64 . ПМЦ 2939505 . ПМИД 20799950 .
- ^ Лунд К., Дембински Дж.Л., Сольберг Н., Урбануччи А., Миллс И.Г., Краусс С. (2015). «Слизнезависимая активация L1CAM отвечает за повышенный потенциал инвазии раковых клеток поджелудочной железы после длительного лечения 5-ФУ» . ПЛОС ОДИН . 10 (4): e0123684. Бибкод : 2015PLoSO..1023684L . дои : 10.1371/journal.pone.0123684 . ПМЦ 4393253 . ПМИД 25860483 .
- ^ «L1CAM - молекула адгезии нервных клеток L1 - предшественник Homo sapiens (человек) - ген и белок L1CAM» . www.uniprot.org . Проверено 23 октября 2016 г.
- ^ Микулак Дж., Негрини С., Клайн А., Д'Алессандро Р., Мавилио Д., Мелдолези Дж. (март 2012 г.). «Двойная REST-зависимость L1CAM: от экспрессии гена до альтернативного сплайсинга, управляемого Nova2 в нервных клетках» . Журнал нейрохимии . 120 (5): 699–709. дои : 10.1111/j.1471-4159.2011.07626.x . ПМИД 22176577 . S2CID 5448318 .
- ^ «L1CAM - молекула адгезии нервных клеток L1 - предшественник Homo sapiens (человек) - ген и белок L1CAM» . ЮниПрот . Проверено 23 октября 2016 г.
- ^ Нисимура Т., Фуката Ю., Като К., Ямагути Т., Мацуура Ю., Камигути Х., Кайбути К. (сентябрь 2003 г.). «CRMP-2 регулирует поляризованный опосредованный Numb эндоцитоз для роста аксонов». Природная клеточная биология . 5 (9): 819–26. дои : 10.1038/ncb1039 . ПМИД 12942088 . S2CID 12118386 .
- ^ Jump up to: а б Валиенте М., Обенауф AC, Джин X, Чен Q, Чжан XH, Ли DJ и др. (февраль 2014 г.). «Серпины способствуют выживанию раковых клеток и кооптации сосудов при метастазах в головной мозг» . Клетка . 156 (5): 1002–16. дои : 10.1016/j.cell.2014.01.040 . ПМЦ 3988473 . ПМИД 24581498 .
- ^ Доберштейн К., Хартер П.Н., Хаберкорн У., Бретц Н.П., Арнольд Б., Карретеро Р. и др. (март 2015 г.). «Терапия антителами к L1CAM человека на модели трансгенных мышей блокирует локальный рост опухоли, но индуцирует ЕМТ». Международный журнал рака . 136 (5): Е326-39. дои : 10.1002/ijc.29222 . ПМИД 25230579 . S2CID 26322202 .
- ^ Альтефогт П., Доберштейн К., Фогель М. (апрель 2016 г.). «L1CAM при раке человека» . Международный журнал рака . 138 (7): 1565–76. дои : 10.1002/ijc.29658 . ПМИД 26111503 .
Дальнейшее чтение
[ редактировать ]- Франсен Э., Леммон В., Ван Кэмп Дж., Витс Л., Коук П., Виллемс П.Дж. (1996). «Синдром CRASH: клинический спектр гипоплазии мозолистого тела, умственной отсталости, приведения больших пальцев, спастического парапареза и гидроцефалии из-за мутаций в одном гене, L1». Европейский журнал генетики человека . 3 (5): 273–84. дои : 10.1159/000472311 . ПМИД 8556302 . S2CID 152852 .
- Bearer CF (октябрь 2001 г.). «Сигнальные каскады молекул клеточной адгезии L1: мишени для нейротоксичности этанола, связанной с развитием». Нейротоксикология . 22 (5): 625–33. дои : 10.1016/S0161-813X(01)00034-1 . ПМИД 11770884 .
- Розенталь А., Жуэ М., Кенрик С. (октябрь 1992 г.). «Аберрантный сплайсинг мРНК молекулы адгезии нервных клеток L1 в семье с Х-сцепленной гидроцефалией». Природная генетика . 2 (2): 107–12. дои : 10.1038/ng1092-107 . ПМИД 1303258 . S2CID 12575351 .
- Фринс Дж.П., Спепен А., Кассиман Дж.Дж., ван ден Берге Х. (июнь 1991 г.). «X-сцепленная осложненная спастическая параплегия, синдром MASA и X-сцепленная гидроцефалия вследствие врожденного стеноза сильвиева водопровода: вариабельная экспрессия одной и той же мутации в Xq28» . Журнал медицинской генетики . 28 (6): 429–31. дои : 10.1136/jmg.28.6.429-a . ПМК 1016918 . ПМИД 1870106 .
- Розенталь А., Маккиннон Р.Н., Джонс Д.С. (октябрь 1991 г.). «ПЦР-проход из микродиссекционного клона M54 идентифицирует три экзона человеческого гена молекулы адгезии нервных клеток L1 (CAM-L1)» . Исследования нуклеиновых кислот . 19 (19): 5395–401. дои : 10.1093/нар/19.19.5395 . ПМК 328904 . ПМИД 1923824 .
- Кобаяши М., Миура М., Асо Х., Уемура К. (октябрь 1991 г.). «Молекулярное клонирование молекулы клеточной адгезии L1 из нервной ткани человека: сравнение первичных последовательностей молекул L1 различного происхождения». Biochimica et Biophysical Acta (BBA) – Структура и экспрессия генов . 1090 (2): 238–40. дои : 10.1016/0167-4781(91)90108-X . ПМИД 1932117 .
- Харпер-младший, Принс Дж.Т., Хили П.А., Стюарт Дж.К., Науман С.Дж., Столлкап В.Б. (март 1991 г.). «Выделение и последовательность частичных клонов кДНК L1 человека: гомология L1 человека и грызуна в цитоплазматической области». Журнал нейрохимии . 56 (3): 797–804. дои : 10.1111/j.1471-4159.1991.tb01994.x . ПМИД 1993895 . S2CID 39994677 .
- Вольф Дж.М., Фрэнк Р., Муджу К., Спиро Р.К., Рейсфельд Р.А., Ратьен Ф.Г. (август 1988 г.). «Гликопротеин головного мозга человека, родственный молекуле L1 адгезии клеток мыши» . Журнал биологической химии . 263 (24): 11943–7. дои : 10.1016/S0021-9258(18)37877-3 . ПМИД 3136168 .
- Фридлендер Д.Р., Милев П., Картикеян Л., Марголис Р.К., Марголис Р.У., Грумет М. (май 1994 г.). «Нейрональный хондроитинсульфат-протеогликан нейрокан связывается с молекулами адгезии нервных клеток Ng-CAM/L1/NILE и N-CAM и ингибирует адгезию нейронов и рост нейритов» . Журнал клеточной биологии . 125 (3): 669–80. дои : 10.1083/jcb.125.3.669 . ПМК 2119998 . ПМИД 7513709 .
- Руис Дж.К., Куппенс Х., Легиус Э., Фринс Дж.П., Гловер Т., Маринен П., Кассиман Дж.Дж. (июль 1995 г.). «Мутации в L1-CAM в двух семьях с Х-сцепленной осложненной спастической параплегией, синдромом MASA и HSAS» . Журнал медицинской генетики . 32 (7): 549–52. дои : 10.1136/jmg.32.7.549 . ПМЦ 1050549 . ПМИД 7562969 .
- Олив С., Дюбуа С., Шахнер М., Ругон Г. (ноябрь 1995 г.). «Молекула F3, связанная с гликозилфосфатидилинозитолом нейронов, локализована в субдоменах мембраны, обогащенных гликолипидами, и взаимодействует с L1 и fyn-киназой в мозжечке». Журнал нейрохимии . 65 (5): 2307–17. дои : 10.1046/j.1471-4159.1995.65052307.x . ПМИД 7595520 . S2CID 39142478 .
- Жуэ М., Монкла А., Патерсон Дж., Маккеун С., Фрайер А., Карпентер Н. и др. (июнь 1995 г.). «Новые домены молекулы адгезии нервных клеток L1, участвующие в Х-сцепленной гидроцефалии и синдроме MASA» . Американский журнал генетики человека . 56 (6): 1304–14. ПМК 1801103 . ПМИД 7762552 .
- Франсен Э., Шрандер-Стампель С., Витс Л., Коук П., Ван Кэмп Дж., Виллемс П.Дж. (декабрь 1994 г.). «Х-сцепленная гидроцефалия и синдром MASA, присутствующие в одной семье, обусловлены единственной миссенс-мутацией в экзоне 28 гена L1CAM». Молекулярная генетика человека . 3 (12): 2255–6. дои : 10.1093/hmg/3.12.2255 . ПМИД 7881431 .
- Жуэ М., Розенталь А., Армстронг Г., Макфарлейн Дж., Стивенсон Р., Патерсон Дж. и др. (июль 1994 г.). «Х-сцепленная спастическая параплегия (SPG1), синдром MASA и Х-сцепленная гидроцефалия возникают в результате мутаций гена L1». Природная генетика . 7 (3): 402–7. дои : 10.1038/ng0794-402 . ПМИД 7920659 . S2CID 1454095 .
Внешние ссылки
[ редактировать ]- Запись GeneReviews/NCBI/NIH/UW о синдроме L1
- L1 + Клетка + Адгезия + Молекула в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
Эта статья включает текст из Национальной медицинской библиотеки США , который находится в свободном доступе .
Атлас генетики и цитогенетики в онкологии и гематологии: http://atlasgeneticsoncology.org/Genes/L1CAMID44110chXq28.html





