ПД-Л1
| CD274 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | CD274 , B7-H, B7H1, PD-L1, PDCD1L1, PDCD1LG1, PDL1, молекула CD274, лиганд 1 запрограммированной гибели клеток, hPD-L1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 605402 ; МГИ : 1926446 ; Гомологен : 8560 ; Генные карты : CD274 ; ОМА : CD274 – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Лиганд программируемой смерти 1 (PD-L1), также известный как кластер дифференцировки 274 (CD274) или гомолог 1 B7 (B7-H1), представляет собой белок , который у людей кодируется CD274 геном . [ 5 ]
Лиганд программируемой смерти 1 (PD-L1) представляет собой трансмембранный белок типа 1 массой 40 кДа , который, как предполагается, играет важную роль в подавлении адаптивного компонента иммунной системы во время определенных событий, таких как беременность , тканевые аллотрансплантаты , аутоиммунные заболевания и другие болезненные состояния. например, гепатит . Обычно адаптивная иммунная система реагирует на антигены , которые связаны с активацией иммунной системы экзогенными или эндогенными сигналами опасности . клональная экспансия антигенспецифичных и CD8+ Т-клеток /или CD4+ хелперных клеток В свою очередь, размножается . Связывание PD-L1 с молекулой ингибирующей контрольной точки PD-1 передает ингибирующий сигнал, основанный на взаимодействии с фосфатазами ( SHP-1 или SHP-2 ) через мотив переключения на основе тирозина иммунорецепторов (ITSM). [ 6 ] Это уменьшает пролиферацию антигенспецифических Т-клеток в лимфатических узлах, одновременно уменьшая апоптоз в регуляторных Т-клетках (противовоспалительные, супрессивные Т-клетки), что дополнительно опосредовано более низкой регуляцией гена Bcl-2 . [ нужна ссылка ] . PD-L1 экспрессируется как на гемопоэтических, так и на некроветворных клетках тканей. Однако точная роль PD-L1 в модуляции иммунных ответов на гемопоэтические и негематопоэтические клетки неясна. [ 7 ]
История
[ редактировать ]PD-L1, также известный как B7-H1, был охарактеризован в клинике Мэйо в 1999 году как иммунорегуляторная молекула. [ 8 ] Тогда же был сделан вывод, что B7-H1 помогает опухолевым клеткам уклоняться от противоопухолевого иммунитета. [ 9 ] В 2003 году было показано, что B7-H1 экспрессируется на миелоидных клетках в качестве белка контрольной точки и был предложен в качестве потенциальной мишени при иммунотерапии рака в клинике человека. [ 10 ]
Связывание
[ редактировать ]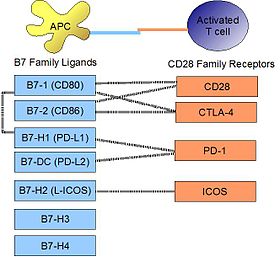
PD-L1 связывается со своим рецептором PD-1 , обнаруженным на активированных Т-клетках, В-клетках и миелоидных клетках, для модуляции активации или ингибирования. Сродство между PD-L1 и PD-1, определенное константой диссоциации Kd , составляет 770 нМ. PD-L1 также имеет заметное сродство к костимулирующей молекуле CD80 (B7-1), но не к CD86 (B7-2). [ 11 ] Сродство CD80 к PD-L1, 1,4 мкМ, является промежуточным между его сродством к CD28 и CTLA-4 (4,0 мкМ и 400 нМ соответственно). Родственная молекула PD-L2 не имеет такого сродства к CD80 или CD86, но использует PD-1 в качестве рецептора (с более сильным Kd, равным 140 нМ). Саид и др. показали, что PD-1, активация которого повышена на активированных CD4 Т-клетках, может связываться с PD-L1, экспрессируемым на моноцитах, и индуцирует выработку IL-10 последними. [ 12 ]
Сигнализация
[ редактировать ]Взаимодействие PD-L1 с его рецептором PD-1 на Т-клетках дает сигнал, который ингибирует TCR -опосредованную активацию продукции IL-2 и пролиферации Т-клеток. Механизм включает ингибирование фосфорилирования ZAP70 и его ассоциации с CD3ζ . [ 13 ] Передача сигналов PD-1 ослабляет PKC-θ фосфорилирование петли активации (в результате передачи сигналов TCR), необходимое для активации факторов транскрипции NF-κB и AP-1 , а также для продукции IL-2. Связывание PD-L1 с PD-1 также способствует индуцированному лигандом снижению TCR во время презентации антигена наивным Т-клеткам, индуцируя активацию убиквитинлигазы E3 CBL-b. [ 14 ]
Регулирование
[ редактировать ]Интерферонами
[ редактировать ]При стимуляции IFN-γ PD-L1 экспрессируется на Т-клетках, NK-клетках, макрофагах, миелоидных DC, B-клетках, эпителиальных клетках и эндотелиальных клетках сосудов. [ 15 ] Область промотора гена PD-L1 имеет элемент, отвечающий на IRF-1 , регуляторный фактор интерферона. [ 16 ] Интерфероны типа I могут также активировать PD-L1 в мышиных гепатоцитах, моноцитах, ДК и опухолевых клетках. [ 17 ]
На макрофагах и моноцитах
[ редактировать ]PD-L1 особенно экспрессируется на макрофагах . На мышах было показано, что классически активированные макрофаги (индуцированные Т-хелперами I типа или комбинацией ЛПС и гамма-интерферона ) значительно активируют PD-L1. [ 18 ] Альтернативно, макрофаги, активированные IL-4 (альтернативные макрофаги), слегка повышают уровень PD-L1 и в значительной степени повышают уровень PD-L2. было показано STAT1 На нокаутных мышах с дефицитом , что STAT1 в основном отвечает за активацию PD-L1 на макрофагах с помощью LPS или гамма-интерферона, но совсем не отвечает за его конститутивную экспрессию до активации у этих мышей. Было также показано, что PD-L1 конститутивно экспрессируется на мышином Ly6C. это неклассические моноциты в устойчивом состоянии. [ 19 ]
Роль микроРНК
[ редактировать ]человека Покоящиеся холангиоциты экспрессируют мРНК PD-L1, но не белок, из-за подавления трансляции микроРНК миР-513. [ 20 ] При лечении гамма-интерфероном уровень экспрессии миР-513 снижался, тем самым устраняя подавление белка PD-L1. Таким образом, гамма-интерферон может индуцировать экспрессию белка PD-L1 путем ингибирования генно-опосредованного подавления трансляции мРНК. фрагмент H миРНК EBV miR-BamH1 H, открывающая рамку считывания В то время как латентный мембранный белок-1 (LMP1) вируса Эпштейна-Барр (EBV) является известным мощным индуктором PD-L1, было показано, что 1 (BHRF1) 2-5p, регулируют LMP1-индуцированную экспрессию PD-L1. [ 21 ]
Эпигенетическая регуляция
[ редактировать ]Метилирование ДНК промотора PD-L1 может предсказать выживаемость при некоторых видах рака после операции. [ 22 ]
Клиническое значение
[ редактировать ]Рак
[ редактировать ]
Показано, что PD-L1 высоко экспрессируется при различных злокачественных новообразованиях, особенно при раке легких. Чтобы предвидеть эффективность генной терапии или системной иммунотерапии в блокировании контрольных точек PD-1 и PD-L1, PD-L1 можно использовать в качестве прогностического маркера и мишени противоракового иммунитета. [ 23 ] т.е. активация PD-L1 может позволить раку уклоняться от иммунной системы хозяина. Например, анализ 196 образцов опухолей от пациентов с почечно-клеточной карциномой показал, что высокая опухолевая экспрессия PD-L1 связана с повышенной агрессивностью опухоли и увеличением риска смерти в 4,5 раза. [ 24 ] В модели клеток лейкемии A20, инъецированных мышам F1, NK-клетки убивали опухолевые клетки-мишени с одинаковой эффективностью независимо от экспрессии PD-L1, тогда как экспрессия PD-L1 на опухолевых клетках A20 обеспечивала значительную защиту опухоли от отторжения Т-клетками CD8, что подтверждает роль коингибирующего рецептора PD-1 в модуляции их цитотоксической активности. [ 25 ]
Многие ингибиторы PD-L1 разрабатываются в качестве иммуноонкологической терапии и показывают хорошие результаты в клинических испытаниях. [ 26 ] Клинически доступные примеры включают дурвалумаб , атезолизумаб и авелумаб . [ 27 ] В нормальных тканях обратная связь между факторами транскрипции, такими как STAT3 и NF-κB, ограничивает иммунный ответ для защиты ткани хозяина и ограничения воспаления. При раке потеря ограничения по обратной связи между факторами транскрипции может привести к увеличению локальной экспрессии PD-L1, что может ограничить эффективность системного лечения агентами, нацеленными на PD-L1. [ 28 ] АВТОМОБИЛЬ-Т [ 29 ] и NK- клетки [ 30 ] нацеленные на PD-L1, оцениваются для лечения рака. Экспрессия pSTAT-1 и PDL-1 также сильно коррелирует при раке простаты. [ 31 ]
Повышение регуляции PD-L1 на иммунных клетках (особенно миелоидных клетках) также может привести к образованию иммуносупрессивной среды высоколокализованным образом, что также позволяет раковым клеткам пролиферировать. [ 32 ]
Анализ PD-L1 при TNBC важен для отбора пациентов, которым может быть назначена иммунотерапия. Соглашение между патологами и между наблюдателями оказалось существенным. Случаи, связанные с пороговым значением в 1%, являются особенно сложными. [ 33 ]
Листерия моноцитогенная
[ редактировать ]В мышиной модели внутриклеточной инфекции L. monocytogenes индуцировал экспрессию белка PD-L1 в Т-клетках, NK-клетках и макрофагах. Блокада PD-L1 (с использованием блокирующих антител) привела к увеличению смертности инфицированных мышей. Блокада снижала выработку TNFα и оксида азота макрофагами, снижала выработку гранзима B NK-клетками и уменьшала пролиферацию L. monocytogenes (но не CD4 Т-клеток). антигенспецифических CD8 Т-клеток [ 34 ] Эти данные свидетельствуют о том, что PD-L1 действует как положительная костимулирующая молекула при внутриклеточной инфекции.
Аутоиммунитет
[ редактировать ]Считается, что взаимодействие PD-1/PD-L1 играет роль в предотвращении деструктивного аутоиммунитета, особенно во время воспалительных состояний. Лучшим примером является желудок, где экспрессия PD-1 защищает гастрин, экспрессирующие G-клетки , от иммунной системы во время воспаления, спровоцированного Helicobacter pylori . [ 35 ] Но также различные доклинические исследования подтверждают мнение о том, что взаимодействие PD-1/PD-L1 участвует в аутоиммунитете. мышей NOD Было показано, что у , животной модели аутоиммунитета, которые проявляют предрасположенность к спонтанному развитию диабета I типа и других аутоиммунных заболеваний, развивается ускоренное начало диабета в результате блокады PD-1 или PD-L1 (но не PD-L2). . [ 36 ]
Было обнаружено, что у людей экспрессия PD-L1 изменена у педиатрических пациентов с системной красной волчанкой (СКВ). При изучении изолированных РВМС от здоровых детей незрелые миелоидные дендритные клетки и моноциты экспрессировали мало PD-L1 при первоначальном выделении, но спонтанно повышали уровень PD-L1 в течение 24 часов. Напротив, как mDC, так и моноциты пациентов с активной СКВ не смогли активировать PD-L1 в течение 5-дневного курса, экспрессируя этот белок только во время ремиссии заболевания. [ 37 ] Это может быть одним из механизмов потери периферической толерантности при СКВ.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Ensembl выпуск 89: ENSG00000120217 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000016496 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ген Энтрез: молекула CD274 CD274» .
- ^ Хемниц Дж. М., Парри Р. В., Николс К. Е., Джун CH, Райли Дж. Л. (июль 2004 г.). «SHP-1 и SHP-2 связаны с мотивом переключения запрограммированной смерти 1 на основе тирозина иммунорецептора при первичной стимуляции Т-клеток человека, но только лигирование рецептора предотвращает активацию Т-клеток» . Журнал иммунологии . 173 (2): 945–954. дои : 10.4049/jimmunol.173.2.945 . ПМИД 15240681 .
- ^ Мюллер С.Н., Вангури В.К., Ха С.Дж., Вест Э.Э., Кейр М.Е., Гликман Дж.Н. и др. (июль 2010 г.). «PD-L1 выполняет различные функции в кроветворных и негематопоэтических клетках, регулируя ответы Т-клеток во время хронической инфекции у мышей» . Журнал клинических исследований . 120 (7): 2508–2515. дои : 10.1172/JCI40040 . ПМЦ 2898584 . ПМИД 20551512 .
- ^ Донг Х., Чжу Г., Тамада К., Чен Л. (декабрь 1999 г.). «B7-H1, третий член семейства B7, совместно стимулирует пролиферацию Т-клеток и секрецию интерлейкина-10». Природная медицина . 5 (12): 1365–1369. дои : 10.1038/70932 . ПМИД 10581077 . S2CID 21397460 .
- ^ Донг Х., Стром С.Э., Саломао Д.Р., Тамура Х., Хирано Ф., Флис Д.Б. и др. (август 2002 г.). «Связанный с опухолью B7-H1 способствует апоптозу Т-клеток: потенциальный механизм уклонения от иммунитета». Природная медицина . 8 (8): 793–800. дои : 10.1038/нм730 . ПМИД 12091876 . S2CID 27694471 .
- ^ Куриэль Т.Дж., Вэй С., Донг Х., Альварес Х., Ченг П., Моттрам П. и др. (май 2003 г.). «Блокада B7-H1 улучшает противоопухолевый иммунитет, опосредованный миелоидными дендритными клетками». Природная медицина . 9 (5): 562–567. дои : 10.1038/nm863 . ПМИД 12704383 . S2CID 12499214 .
- ^ Бьютт М.Дж., Пенья-Круз В., Ким М.Дж., Фриман Г.Дж., Шарп А.Х. (август 2008 г.). «Взаимодействие PD-L1 человека и B7-1» . Молекулярная иммунология . 45 (13): 3567–3572. дои : 10.1016/j.molimm.2008.05.014 . ПМК 3764616 . ПМИД 18585785 .
- ^ Саид Э.А., Дюпюи Ф.П., Траутманн Л., Чжан Ю., Ши Ю., Эль-Фар М. и др. (апрель 2010 г.). «Продукция моноцитами интерлейкина-10, индуцированная запрограммированной смертью-1, нарушает активацию CD4+ Т-клеток во время ВИЧ-инфекции» . Природная медицина . 16 (4): 452–459. дои : 10.1038/нм.2106 . ПМК 4229134 . ПМИД 20208540 .
- ^ Шеппард К.А., Фитц Л.Дж., Ли Дж.М., Бенандер С., Джордж Дж.А., Вутерс Дж. и др. (сентябрь 2004 г.). «PD-1 ингибирует индуцированное Т-клеточным рецептором фосфорилирование сигналосомы ZAP70/CD3zeta и передачу сигналов ниже по ходу PKCtheta». Письма ФЭБС . 574 (1–3): 37–41. Бибкод : 2004FEBSL.574...37S . дои : 10.1016/j.febslet.2004.07.083 . ПМИД 15358536 . S2CID 85034305 .
- ^ Карвач К., Бриконь С., Макдональд Д., Арсе Ф., Беннетт К.Л., Коллинз М. и др. (октябрь 2011 г.). «Костимуляция PD-L1 способствует индуцированной лигандом пониженной модуляции рецептора Т-клеток на CD8+ Т-клетках» . ЭМБО Молекулярная медицина . 3 (10): 581–592. дои : 10.1002/emmm.201100165 . ПМК 3191120 . ПМИД 21739608 .
- ^ Мухи Д.Б., Чен Л. (апрель 2007 г.). «Новые B7: играют ключевую роль в опухолевом иммунитете». Журнал иммунотерапии . 30 (3): 251–260. дои : 10.1097/CJI.0b013e31802e085a . ПМИД 17414316 .
- ^ Ли С.Дж., Чан Б.С., Ли С.В., Ян И.И., Су С.И., Пак Ю.М. и др. (февраль 2006 г.). «Регуляторный фактор интерферона-1 является предпосылкой конститутивной экспрессии и индуцированной IFN-гамма положительной регуляции B7-H1 (CD274)» . Письма ФЭБС . 580 (3): 755–762. Бибкод : 2006FEBSL.580..755L . дои : 10.1016/j.febslet.2005.12.093 . ПМИД 16413538 . S2CID 11169726 .
- ^ Ямазаки Т., Акиба Х., Иваи Х., Мацуда Х., Аоки М., Танно Ю. и др. (ноябрь 2002 г.). «Экспрессия лигандов запрограммированной смерти 1 мышиными Т-клетками и APC» . Журнал иммунологии . 169 (10): 5538–5545. дои : 10.4049/гиммунол.169.10.5538 . ПМИД 12421930 .
- ^ Локи П., Эллисон Дж.П. (апрель 2003 г.). «PD-L1 и PD-L2 по-разному регулируются клетками Th1 и Th2» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (9): 5336–5341. Бибкод : 2003PNAS..100.5336L . дои : 10.1073/pnas.0931259100 . ПМК 154346 . ПМИД 12697896 .
- ^ Бьянкини М., Дюшен Ж., Сантовито Д., Шлосс М.Дж., Эврар М., Винкельс Х. и др. (июнь 2019 г.). «Экспрессия PD-L1 на неклассических моноцитах раскрывает их происхождение и иммунорегуляторную функцию» . Наука Иммунология . 4 (36): eaar3054. doi : 10.1126/sciimmunol.aar3054 . ПМИД 31227596 . S2CID 195259881 .
- ^ Гонг А.Ю., Чжоу Р., Ху Г., Ли Х, Сплинтер П.Л., О'Хара С.П. и др. (февраль 2009 г.). «МикроРНК-513 регулирует трансляцию B7-H1 и участвует в IFN-гамма-индуцированной экспрессии B7-H1 в холангиоцитах» . Журнал иммунологии . 182 (3): 1325–1333. дои : 10.4049/jimmunol.182.3.1325 . ПМК 2652126 . ПМИД 19155478 .
- ^ Кристино А.С., Нурс Дж., Вест Р.А., Сабдиа М.Б., Лоу С.К., Гунавардана Дж. и др. (декабрь 2019 г.). «МикроРНК EBV-BHRF1-2-5p нацелена на 3'UTR лигандов иммунных контрольных точек PD-L1 и PD-L2» . Кровь . 134 (25): 2261–2270. дои : 10.1182/blood.2019000889 . ПМЦ 6923667 . ПМИД 31856276 .
- ^ Гевенслебен Х., Холмс Э.Э., Гольц Д., Дитрих Дж., Зайлер В., Эллингер Дж. и др. (ноябрь 2016 г.). «Метилирование промотора PD-L1 является прогностическим биомаркером безбиологической выживаемости у пациентов с раком простаты после радикальной простатэктомии» . Онкотаргет . 7 (48): 79943–79955. дои : 10.18632/oncotarget.13161 . ПМЦ 5346762 . ПМИД 27835597 .
- ^ Разаги А., Мансури Л., Бродин О., Бьёрнштедт М., Лундал Дж. (02.06.2022). «Экспрессия растворимого PD-L1 после внутривенного лечения онкологических больных селенитом в фазе I клинического исследования» . Границы онкологии . 12 : 906134. doi : 10.3389/fonc.2022.906134 . ПМК 9203154 . ПМИД 35720000 .
- ^ Томпсон Р.Х., Джиллетт М.Д., Чевилл Дж.К., Лозе К.М., Донг Х., Вебстер В.С. и др. (декабрь 2004 г.). «Костимулятор B7-H1 у пациентов с почечно-клеточным раком: показатель агрессивности опухоли и потенциальная терапевтическая мишень» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (49): 17174–17179. Бибкод : 2004PNAS..10117174T . дои : 10.1073/pnas.0406351101 . ПМК 534606 . ПМИД 15569934 .
- ^ Дель Рио МЛ, Перес-Симон ХА, Родригес-Барбоса ХИ (20 июня 2022 г.). «Дифференциальное приживление родительских клеток лейкемии A20 PD-L1 WT и PD-L1 KO у полуаллогенных реципиентов в контексте взаимодействия PD-L1/PD-1 и гибридной устойчивости, опосредованной NK-клетками» . Границы в иммунологии . 13 : 887348. дои : 10.3389/fimmu.2022.887348 . ПМК 9251058 . ПМИД 35795681 .
- ^ Велчети В., Шальпер К.А., Карвахал Д.Е., Анагносту В.К., Сиригос К.Н., Сзнол М. и др. (январь 2014 г.). «Экспрессия лиганда-1 запрограммированной смерти при немелкоклеточном раке легкого» . Лабораторные исследования; Журнал технических методов и патологии . 94 (1): 107–116. дои : 10.1038/labinvest.2013.130 . ПМК 6125250 . ПМИД 24217091 .
- ^ «Ингибиторы иммунных контрольных точек для лечения рака» . www.cancer.org . Проверено 27 марта 2017 г.
- ^ Влахопулос С.А. (август 2017 г.). «Аберрантный контроль NF-κB при раке обеспечивает транскрипционную и фенотипическую пластичность, чтобы уменьшить зависимость от ткани хозяина: молекулярный режим» . Биология и медицина рака . 14 (3): 254–270. дои : 10.20892/j.issn.2095-3941.2017.0029 . ПМК 5570602 . ПМИД 28884042 .
- ^ Се Ю.Дж., Дуган М., Джаилкхани Н., Ингрэм Дж., Фанг Т., Куммер Л. и др. (апрель 2019 г.). «CAR Т-клетки на основе нанотел, нацеленные на микроокружение опухоли, ингибируют рост солидных опухолей у иммунокомпетентных мышей» . Труды Национальной академии наук Соединенных Штатов Америки . 116 (16): 7624–7631. Бибкод : 2019PNAS..116.7624X . дои : 10.1073/pnas.1817147116 . ПМК 6475367 . ПМИД 30936321 .
- ^ Фабиан К.П., Пэджет М.Р., Донахью Р.Н., Солочински К., Роббинс Ю., Аллен К.Т. и др. (май 2020 г.). «PD-L1, нацеленный на NK-клетки с высоким сродством (t-haNK), индуцирует прямые противоопухолевые эффекты и нацелен на супрессивные популяции MDSC» . Журнал иммунотерапии рака . 8 (1): e000450. doi : 10.1136/jitc-2019-000450 . ПМЦ 7247398 . ПМИД 32439799 .
- ^ Казань О., Кир Г., Калпан М., Чеджикоглу Г.Е., Атис Г., Йылдырым А. (июль 2022 г.). «Связь между путями PI3K, JAK/STAT и экспрессией PDL-1 при раке простаты». Андрология . 54 (е14541): е14541. дои : 10.1111/and.14541 . ПМИД 35880672 . S2CID 251068796 .
- ^ Нирмал А.Дж., Малига З., Валлиус Т., Кваттроки Б., Чен А.А., Джейкобсон К.А. и др. (июнь 2022 г.). «Пространственный ландшафт прогрессирования и иммуноредактирования первичной меланомы при одноклеточном разрешении» . Открытие рака . 12 (6): 1518–1541. дои : 10.1158/2159-8290.CD-21-1357 . ПМЦ 9167783 . ПМИД 35404441 . S2CID 248083925 .
- ^ Заакук, М.; Ван Бокстал, М.; Галант, К.; Калладжи, Г.; Провенцано, Э.; Хант, Р.; Д'Арриго, К.; Бадр, Нью-Мексико; О'Салливан, Б.; Старчинский, Дж.; Танчел, Б.; Мир, Ю.; Льюис, П.; Шаабан, А.М. Соглашение между и внутри наблюдателей об оценке PD-L1 SP142 при карциноме молочной железы — крупное межинституциональное международное исследование. Рак 2023, 15, 1511. https://doi.org/10.3390/cancers15051511.
- ^ Со С.К., Чон ХИ, Пак С.Г., Ли С.В., Чхве И.В., Чен Л. и др. (январь 2008 г.). «Блокада эндогенного B7-H1 подавляет антибактериальную защиту после первичной инфекции Listeria monocytogenes» . Иммунология . 123 (1): 90–99. дои : 10.1111/j.1365-2567.2007.02708.x . ПМЦ 2433284 . ПМИД 17971153 .
- ^ Моммерстиг М.С., Ю Б.Т., ван ден Бош Т.П., фон дер Тюзен Дж.Х., Куйперс Э.Дж., Дукас М. и др. (октябрь 2022 г.). «Конститутивная экспрессия лиганда запрограммированной смерти 1 защищает G-клетки желудка от воспаления, вызванного Helicobacter pylori» . Хеликобактер . 27 (5): e12917. дои : 10.1111/hel.12917 . ПМЦ 9542424 . ПМИД 35899973 .
- ^ Ансари М.Дж., Салама А.Д., Читнис Т., Смит Р.Н., Ягита Х., Акиба Х. и др. (июль 2003 г.). «Путь запрограммированной смерти-1 (PD-1) регулирует аутоиммунный диабет у мышей с диабетом (NOD) без ожирения» . Журнал экспериментальной медицины . 198 (1): 63–69. дои : 10.1084/jem.20022125 . ПМК 2196083 . ПМИД 12847137 .
- ^ Мозаффариан Н., Видеман А.Е., Стивенс А.М. (сентябрь 2008 г.). «Активная системная красная волчанка связана с неспособностью антигенпрезентирующих клеток экспрессировать лиганд запрограммированной смерти-1» . Ревматология . 47 (9): 1335–1341. doi : 10.1093/ревматология/ken256 . ПМЦ 2722808 . ПМИД 18650228 .
Внешние ссылки
[ редактировать ]- CD274+белок+человек Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt : Q9NZQ7 (лиганд 1 запрограммированной гибели клеток) на PDBe-KB .



