Фотодинамическая терапия
| Фотодинамическая терапия | |
|---|---|
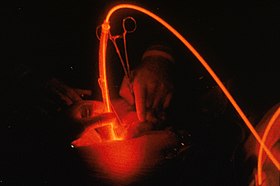 Активация света во время фотодинамической терапии, направленной на опухоль | |
| Другие имена | Фотохимиотерапия |
Фотодинамическая терапия ( ФДТ ) — это форма фототерапии, включающая свет и фотосенсибилизирующее химическое вещество, используемое в сочетании с молекулярным кислородом для вызвать гибель клеток ( фототоксичность ). [1]
ФДТ используется при лечении акне , влажной возрастной дегенерации желтого пятна , псориаза и герпеса . Его применяют для лечения злокачественных опухолей , [2] включая голову и шею, легкие, мочевой пузырь и кожу.
Преимущества уменьшают необходимость деликатного хирургического вмешательства и длительного восстановления, а также минимальное образование рубцовой ткани и уродств. Побочным эффектом является сопутствующая фотосенсибилизация тканей кожи. [3]
Основы
[ редактировать ]Приложения PDT включают три компонента: [2] фотосенсибилизатор и , источник света тканевый кислород . Длина волны источника света должна быть подходящей для возбуждения фотосенсибилизатора для производства радикалов и/или активных форм кислорода . Это свободные радикалы (тип I), образующиеся в результате отрыва или переноса электронов от молекулы субстрата и высокореактивного состояния кислорода, известного как синглетный кислород (тип II).
ФДТ – это многоэтапный процесс. Сначала фотосенсибилизатор, в идеале обладающий незначительной токсичностью, кроме фототоксичности, вводится в отсутствие света системно или местно. Когда в пораженной ткани появляется достаточное количество фотосенсибилизатора, фотосенсибилизатор активируется воздействием света в течение определенного периода времени. Световая доза обеспечивает достаточную энергию для стимуляции фотосенсибилизатора, но недостаточную для повреждения соседних здоровых тканей. Активный кислород убивает клетки-мишени. [3]
Активные формы кислорода
[ редактировать ]В воздухе и тканях молекулярный кислород (О 2 ) находится в триплетном состоянии , тогда как почти все остальные молекулы находятся в синглетном состоянии. Реакции между триплетными и синглетными молекулами запрещены квантовой механикой , что делает кислород относительно нереакционноспособным в физиологических условиях. Фотосенсибилизатор — это химическое соединение, которое может быть переведено в возбужденное состояние при поглощении света и подвергнуто межсистемному скрещиванию (ISC) с кислородом с образованием синглетного кислорода . Этот вид обладает высокой цитотоксичностью и быстро атакует любые органические соединения, с которыми сталкивается. Он быстро выводится из клеток, в среднем за 3 мкс. [4]
Фотохимические процессы
[ редактировать ]Когда фотосенсибилизатор находится в возбужденном состоянии (3Psen*), он может взаимодействовать с молекулярным триплетом кислорода ( 3 O 2 ) и производят радикалы и активные формы кислорода (АФК), имеющие решающее значение для механизма типа II. К этим видам относятся синглетный кислород ( 1 O 2 ), гидроксильные радикалы (•OH) и супероксид (O 2 − ) ионы. Они могут взаимодействовать с клеточными компонентами, включая ненасыщенные липиды, аминокислотные остатки и нуклеиновые кислоты. Если произойдет достаточное окислительное повреждение, это приведет к гибели клеток-мишеней (только в пределах освещенной области). [3]
Фотохимические механизмы
[ редактировать ]Когда молекула хромофора , такая как циклическая тетрапиррольная молекула, поглощает фотон, один из ее электронов переходит на орбиталь с более высокой энергией , переводя хромофор из основного состояния ( S0 ) в короткоживущее электронно-возбужденное состояние (S n ), составленный из колебательных подуровней (S n ′). Возбужденный хромофор может терять энергию из-за быстрого распада на этих подуровнях посредством внутренней конверсии (IC) для заполнения первого возбужденного синглетного состояния (S1), прежде чем быстро релаксировать обратно в основное состояние. [3]
Распад из возбужденного синглетного состояния (S1) в основное состояние (S0) происходит посредством флуоресценции (S1 → S0). Время жизни синглетных состояний возбужденных флуорофоров очень мало ( τ фл. = 10 −9 –10 −6 секунды), поскольку переходы между одними и теми же спиновыми состояниями (S → S или T → T) сохраняют спиновую множественность электрона и, согласно Правилам выбора спина, поэтому считаются «разрешенными» переходами. Альтернативно, электрон в возбужденном синглетном состоянии (S1) может подвергнуться инверсии спина и заселить первое возбужденное триплетное состояние с более низкой энергией (T1) посредством межкомбинационного пересечения (ISC); процесс, запрещенный по спину, поскольку спин электрона больше не сохраняется. Затем возбужденный электрон может подвергнуться второй инверсии, запрещенной по спину, и опустошить возбужденное триплетное состояние (T1) путем распада на основное состояние (S0) посредством фосфоресценции (T1 → S0). Благодаря спин-запрещенному триплетному переходу в синглет время жизни фосфоресценции ( τP = 10 −3 − 1 секунда) значительно дольше, чем время флуоресценции. [3]
Фотосенсибилизаторы и фотохимия
[ редактировать ]Тетрапиррольные фотосенсибилизаторы в возбужденном синглетном состоянии (1Psen*, S>0) относительно эффективны при межкомбинационном переходе и, следовательно, могут иметь высокий квантовый выход в триплетном состоянии. Более длительное время жизни этого вида достаточно, чтобы позволить фотосенсибилизатору в возбужденном триплетном состоянии взаимодействовать с окружающими биомолекулами, включая компоненты клеточных мембран. [3]
Фотохимические реакции
[ редактировать ]Возбужденные фотосенсибилизаторы в триплетном состоянии могут реагировать посредством процессов типа I и типа II. В процессах типа I может участвовать возбужденный синглетный или триплетный фотосенсибилизатор (1Psen*, S1; 3Psen*, T1), однако из-за короткого времени жизни возбужденного синглетного состояния фотосенсибилизатор может реагировать только в том случае, если он тесно связан с субстратом. В обоих случаях взаимодействие происходит с легко окисляемыми или восстанавливаемыми субстратами. Процессы II типа включают прямое взаимодействие возбужденного триплетного фотосенсибилизатора (3Psen*, T1) с молекулярным кислородом ( 3 Около 2 , 3 Σ г ). [3]
Процессы типа I
[ редактировать ]Процессы типа I можно разделить на типы I(i) и типа I(ii). Тип I (i) включает перенос электрона (окисление) от молекулы субстрата к фотосенсибилизатору в возбужденном состоянии (Psen*), генерируя анион-радикал фотосенсибилизатора (Psen• − ) и катион-радикал субстрата (Subs• + ). Большинство радикалов, образующихся в реакциях типа I(i), мгновенно реагируют с молекулярным кислородом (O 2 ), образуя смесь кислородных промежуточных продуктов. Например, анион-радикал фотосенсибилизатора может мгновенно реагировать с молекулярным кислородом ( 3 O 2 ) для образования анион-радикала супероксида (O 2 • − ), который может продолжать производить высокореактивный гидроксильный радикал (OH•), инициируя каскад цитотоксических свободных радикалов; этот процесс распространен при окислительном повреждении жирных кислот и других липидов. [3]
Процесс типа I (ii) включает перенос атома водорода (восстановление) в фотосенсибилизатор в возбужденном состоянии (Psen*). При этом образуются свободные радикалы, способные быстро реагировать с молекулярным кислородом и создавать сложную смесь активных промежуточных продуктов кислорода, включая реактивные пероксиды . [3]
Процессы типа II
[ редактировать ]Процессы II типа включают прямое взаимодействие фотосенсибилизатора в триплетном состоянии в возбужденном состоянии (3Psen*) с молекулярным кислородом в основном состоянии ( 3 Около 2 , 3 Σ г ); спин-разрешенный переход - фотосенсибилизатор в возбужденном состоянии и молекулярный кислород в основном состоянии имеют одно и то же спиновое состояние (T). [3]
процесс триплет-триплетной аннигиляции При столкновении возбужденного фотосенсибилизатора с молекулярным кислородом происходит (3Psen* → 1Psen и 3 O 2 → 1 О 2 ). Это инвертирует спин одной молекулы кислорода ( 3 O 2 ) крайние разрыхляющие электроны, генерирующие две формы синглетного кислорода ( 1 Δg и 1 Σ g ), одновременно опустошая возбужденное триплетное состояние фотосенсибилизатора (T1 → S0). Состояние синглетного кислорода с более высокой энергией ( 1 Σ г , 157 кДж моль-1 > 3 Σ g ) очень недолговечен ( 1 Σ g ≤ 0,33 миллисекунды (метанол), не обнаруживается в H 2 O/D 2 O) и быстро релаксирует в возбужденное состояние с более низкой энергией ( 1 Δg моль , 94 кДж −1 > 3 Σ г ). Следовательно, это форма синглетного кислорода с более низкой энергией ( 1 Δg ) , который участвует в повреждении и гибели клеток. [3]
Высокореактивные формы синглетного кислорода ( 1 O 2 ), образующиеся в процессе Типа II, действуют вблизи места их образования и в радиусе примерно 20 нм, с типичным временем жизни примерно 40 наносекунд в биологических системах. [3]
Вполне возможно, что (за период 6 мкс) синглетный кислород может диффундировать на расстояние примерно до 300 нм in vivo . Синглетный кислород теоретически может взаимодействовать только с проксимальными молекулами и структурами в пределах этого радиуса. АФК инициируют реакции со многими биомолекулами, включая аминокислотные остатки в белках, таких как триптофан ; ненасыщенные липиды, такие как холестерин , и основания нуклеиновых кислот , особенно гуанозин и производные гуанина , причем последнее основание более восприимчиво к АФК. Эти взаимодействия вызывают повреждение и потенциальное разрушение клеточных мембран и дезактивацию ферментов, что приводит к гибели клеток. [3]
Вероятно, что в присутствии молекулярного кислорода и в результате фотооблучения молекулы фотосенсибилизатора пути как I, так и II играют ключевую роль в нарушении клеточных механизмов и клеточной структуры. Тем не менее, имеются значительные данные, свидетельствующие о том, что процесс фотооксигенации типа II преобладает в индукции повреждения клеток, что является следствием взаимодействия между облученным фотосенсибилизатором и молекулярным кислородом. Клетки in vivo могут быть частично защищены от эффектов фотодинамической терапии за счет присутствия поглотителей синглетного кислорода (таких как гистидин ). Некоторые клетки кожи в некоторой степени устойчивы к ФДТ в отсутствие молекулярного кислорода; далее поддерживая предположение о том, что процесс типа II лежит в основе фотоинициируемой гибели клеток. [3]
Эффективность процессов типа II зависит от времени жизни триплетного состояния τ T и триплетного квантового выхода (ΦT) фотосенсибилизатора. Оба этих параметра влияют на эффективность фототерапии; дальнейшее подтверждение различия между механизмами типа I и типа II. Однако успех фотосенсибилизатора не зависит исключительно от процесса типа II. Множественные фотосенсибилизаторы демонстрируют возбужденное триплетное время жизни, которое слишком короткое, чтобы позволить произойти процессу типа II. Например, фотосенсибилизатор октаэтилбензохлорин, металлизированный медью, имеет время жизни в триплетном состоянии менее 20 наносекунд и до сих пор считается эффективным фотодинамическим агентом. [3]
Фотосенсибилизаторы
[ редактировать ]Существует множество фотосенсибилизаторов для ФДТ. Они делятся на порфирины , хлорины и красители . [5] Примеры включают аминолевулиновую кислоту (ALA), фталоцианин кремния Pc 4, м-тетрагидроксифенилхлорин (mTHPC) и моно-L-аспартилхлорин e6 ( NPe6 ).
Фотосенсибилизаторы, коммерчески доступные для клинического применения, включают Allumera, Photofrin , Visudyne , Levulan , Foscan , Metvix , Hexvix , Cysview и Laserphyrin , а также другие, находящиеся в разработке, например Antrin , Photochrom , Photosens , Photrex, Lumacan, Cevira , Visonac, BF-200 ALA, [5] [6] Амфинекс [7] и азадипиррометены .
Основное различие между фотосенсибилизаторами заключается в частях клетки, на которые они нацелены. В отличие от лучевой терапии , где повреждение наносится путем воздействия на клеточную ДНК, большинство фотосенсибилизаторов воздействуют на другие клеточные структуры. Например, mTHPC локализуется в ядерной оболочке. [8] Напротив, АЛК локализуется в митохондриях. [9] и метиленовый синий в лизосомах. [10]
Циклические тетрапиррольные хромофоры
[ редактировать ]Циклические тетрапиррольные молекулы являются флуорофорами и фотосенсибилизаторами. Циклические тетрапиррольные производные имеют внутреннее сходство с встречающимися в природе порфиринами, присутствующими в живом веществе.
Порфирины
[ редактировать ]Порфирины представляют собой группу встречающихся в природе ярко окрашенных соединений, название которых происходит от греческого слова porphura , что означает «фиолетовый». Эти молекулы выполняют биологически важные функции, включая транспорт кислорода и фотосинтез , и находят применение в самых разных областях: от флуоресцентной визуализации до медицины. Порфирины представляют собой тетрапиррольные молекулы, сердцевиной скелета которых является гетероциклический макроцикл, известный как порфин . Фундаментальный порфиновый каркас состоит из четырех пирроловых субъединиц, связанных на противоположных сторонах ( α -позиции, пронумерованные 1, 4, 6, 9, 11, 14, 16 и 19) через четыре метиновых (CH) мостика (5, 10, 15). и 20), известные как мезо -углеродные атомы/позиции. Образующийся сопряженный плоский макроцикл может быть замещен в мезо- и/или β -положениях (2, 3, 7, 8, 12, 13, 17 и 18): если мезо- и β -водороды замещены неводородными атомы или группы, полученные соединения известны как порфирины. [3]
Два внутренних протона порфирина свободного основания могут быть удалены сильными основаниями, такими как алкоксиды , образуя дианионную молекулу; и наоборот, два внутренних атома азота пирроленина могут быть протонированы кислотами, такими как трифторуксусная кислота, с образованием дикатионного промежуточного соединения. Тетрадентатные анионные частицы могут легко образовывать комплексы с большинством металлов. [3]
Абсорбционная спектроскопия
[ редактировать ]Сильно сопряженный скелет порфирина дает характерный ультрафиолетовый видимый (УФ-ВИД) спектр. Спектр обычно состоит из интенсивной узкой полосы поглощения ( ε > 200 000 л⋅моль-1 см-1) на длине волны около 400 нм, известной как полоса Соре или полоса B, за которой следуют четыре более длинные волны (450–700 нм). более слабые поглощения ( ε > 20000 л⋅моль-1⋅см-1 ( порфирины свободного основания )) называются Q-полосами.
Полоса Соре возникает в результате сильного электронного перехода из основного состояния во второе возбужденное синглетное состояние (S0 → S2); тогда как Q-полоса является результатом слабого перехода в первое возбужденное синглетное состояние (S0 → S1). Диссипация энергии за счет внутренней конверсии (IC) настолько быстра, что флуоресценция наблюдается только от опустошения первого возбужденного синглетного состояния до основного состояния с более низкой энергией (S1 → S0). [3]
Идеальные фотосенсибилизаторы
[ редактировать ]Ключевой характеристикой фотосенсибилизатора является способность преимущественно накапливаться в пораженных тканях и вызывать желаемый биологический эффект за счет образования цитотоксических частиц. Конкретные критерии: [11]
- Сильное поглощение с высоким коэффициентом экстинкции в красной/ближней инфракрасной области электромагнитного спектра (600–850 нм) обеспечивает более глубокое проникновение в ткани. (Ткань гораздо прозрачнее при более длинных волнах (~ 700–850 нм). Более длинные волны позволяют свету проникать глубже. [7] и обрабатывать более крупные структуры.) [7]
- Подходящие фотофизические характеристики: высокий квантовый выход образования триплетов (ΦT ≥ 0,5); высокий квантовый выход синглетного кислорода (ΦΔ ≥ 0,5); относительно большое время жизни триплетного состояния ( диапазон τ T, мкс); и высокая энергия триплетного состояния (≥ 94 кДж моль −1 ). Значения ΦT= 0,83 и ΦΔ = 0,65 (гематопорфирин); ФТ = 0,83 и ФД = 0,72 (этиопурпурин); и ΦT = 0,96 и ΦΔ = 0,82 (оловянный этиопурпурин) были достигнуты.
- Низкая темновая токсичность и незначительная цитотоксичность в отсутствие света. (Фотосенсибилизатор не должен быть вредным для ткани-мишени до тех пор, пока не будет применен лечебный луч.)
- Преимущественное накопление в пораженной/целевой ткани по сравнению со здоровой тканью.
- Быстрое выведение из организма после процедуры.
- Высокая химическая стабильность: отдельные, хорошо изученные соединения с известным и постоянным составом.
- Короткий и высокопродуктивный синтетический путь (с легким переводом в многограммовые масштабы/реакции)
- Простая и стабильная формулировка
- Растворим в биологических средах, допускает внутривенное введение. В противном случае гидрофильная система доставки должна обеспечивать эффективную и действенную транспортировку фотосенсибилизатора к месту-мишени через кровоток.
- Низкое фотообесцвечивание для предотвращения деградации фотосенсибилизатора, чтобы он мог продолжать производить синглетный кислород.
- Естественная флуоресценция (Многие методы оптической дозиметрии, такие как флуоресцентная спектроскопия , зависят от флуоресценции.) [12]
Первое поколение
[ редактировать ]Порфимер натрия
Порфимер натрия — препарат, используемый для лечения некоторых видов рака. При поглощении раковыми клетками и воздействии света порфимер натрия становится активным и убивает раковые клетки. Это тип агента фотодинамической терапии (ФДТ), также называемый Фотофрин. [13]
ФДТ был впервые обнаружен более века назад в Германии, только когда Томас Догерти [14] когда PDT стал более распространенным. До доктора Догерти у исследователей были способы использования светочувствительных соединений для лечения болезней. Догерти успешно вылечил рак с помощью ФДТ на доклинических моделях в 1975 году. Три года спустя он провел первое контролируемое клиническое исследование на людях. В 1994 году FDA одобрило ФДТ с фотосенсибилизатором порфимером натрия для паллиативного лечения распространенного рака пищевода, в частности для паллиативного лечения пациентов с полностью обструктивным раком пищевода или для пациентов с частично обструктивным раком пищевода. Порфимер натрия также одобрен FDA для лечения различных типов рака легких, в частности, для лечения микроинвазивного эндобронхиального немелкоклеточного рака легких (НМРЛ) у пациентов, которым не показаны хирургическое вмешательство и лучевая терапия, а также одобрен FDA в УЗИ на дисплазию высокой степени пищевода Барретта. [15] [16] [17]
Недостатки, связанные с фотосенсибилизаторами первого поколения, включают чувствительность кожи и поглощение при длине волны 630 нм, что допускает некоторое терапевтическое использование, но они заметно ограничивают применение в более широкой области заболеваний. Фотосенсибилизаторы второго поколения сыграли ключевую роль в развитии фотодинамической терапии. [3]
Второе поколение
[ редактировать ]5-аминолаевулиновая кислота
[ редактировать ]5-Аминолаевулиновая кислота (АЛК) — это пролекарство, используемое для лечения и визуализации множественных поверхностных раковых заболеваний и опухолей. АЛК — ключевой предшественник в биосинтезе встречающегося в природе порфирина гема . [3]
Гем синтезируется в каждой производящей энергию клетке организма и является ключевым структурным компонентом гемоглобина, миоглобина и других гемопротеинов . Непосредственным предшественником гема является протопорфирин IX (PPIX), эффективный фотосенсибилизатор. Сам по себе гем не является фотосенсибилизатором из-за координации парамагнитного иона в центре макроцикла, что приводит к значительному сокращению времени жизни возбужденного состояния. [3]
Молекула гема синтезируется из глицина и сукцинилкофермента А (сукцинил-КоА). Этап, ограничивающий скорость биосинтеза, контролируется механизмом жесткой (отрицательной) обратной связи, при котором концентрация гема регулирует выработку АЛК. Однако эту контролируемую обратную связь можно обойти, искусственно добавляя в клетки избыток экзогенной АЛК. Клетки реагируют, производя PPIX (фотосенсибилизатор) с большей скоростью, чем фермент феррохелатаза может преобразовать его в гем. [3]
АЛК, продаваемая как Левулан , показала себя многообещающе в фотодинамической терапии (опухоли) при внутривенном и пероральном введении, а также при местном применении при лечении злокачественных и доброкачественных дерматологических заболеваний, включая псориаз, болезнь Боуэна и гирсутизм (Фаза II). /III клинические испытания). [3]
АЛК накапливается быстрее по сравнению с другими сенсибилизаторами, вводящимися внутривенно. Типичные пиковые уровни накопления опухоли после введения PPIX обычно достигаются в течение нескольких часов; другим (внутривенным) фотосенсибилизаторам может потребоваться до 96 часов для достижения пикового уровня. АЛК также выводится из организма быстрее (около 24 часов), чем другие фотосенсибилизаторы, что сводит к минимуму побочные эффекты фоточувствительности. [3]
Были исследованы этерифицированные производные АЛК с улучшенной биодоступностью. Метиловый эфир АЛК ( Метвикс ) теперь доступен для лечения базальноклеточного рака и других поражений кожи. Производные бензила (Benvix) и гексилового эфира ( Hexvix ) используются при раке желудочно-кишечного тракта и для диагностики рака мочевого пузыря. [3]
Verteporfin
[ редактировать ]Производное бензопорфирина монокислотное кольцо А (БПД-МА), продаваемое под названием Визудин ( Вертепорфин , для инъекций), было одобрено органами здравоохранения во многих юрисдикциях, включая FDA США, для лечения влажной ВМД, начиная с 1999 года. Оно также прошло фазу III клинические исследования (США) по лечению немеланомного рака кожи. [3]
Хромофор БПД-МА имеет смещенные в красную сторону и усиленные максимумы длинноволнового поглощения примерно при 690 нм. Проникновение света этой длины волны в ткани на 50% больше, чем достигнутое для Фотофрина ( λ макс. = 630 нм). [3]
Вертепорфин имеет дополнительные преимущества перед сенсибилизатором первого поколения Фотофрином. Он быстро всасывается опухолью (оптимальное соотношение опухоль-нормальная ткань через 30–150 минут после внутривенной инъекции) и быстро выводится из организма, сводя к минимуму фоточувствительность пациента (1–2 дня). [3]
Пурлитин
[ редактировать ]Фотосенсибилизатор хлорина олово этиопурпурин продается как Пурлитин. Пурлитин прошел II фазу клинических испытаний при кожном метастатическом раке молочной железы и саркоме Капоши у пациентов со СПИДом (синдром приобретенного иммунодефицита). Пурлитин успешно используется для лечения доброкачественных состояний, псориаза и рестеноза . [3]
Хлорины отличаются от родительских порфиринов восстановленной экзоциклической двойной связью, снижающей симметрию сопряженного макроцикла. Это приводит к увеличению поглощения в длинноволновой части видимой области электромагнитного спектра (650–680 нм). Пурлитин представляет собой пурпурин; продукт распада хлорофилла. [3]
Пурлитин имеет атом олова, хелатированный в центральной полости, что вызывает красное смещение примерно на 20–30 нм (по отношению к Фотофрину и неметаллизированному этиопурпурину λ max.SnEt2 = 650 нм). Сообщалось, что пурлитин локализуется в коже и вызывает фотореакцию через 7–14 дней после введения. [3]
Фоскан
[ редактировать ]Тетра( м -гидроксифенил)хлорин ( м- THPC) проходит клинические испытания при раке головы и шеи под торговым названием Foscan . Его также исследовали в клинических испытаниях при раке желудка и поджелудочной железы, гиперплазии, полевой стерилизации после онкологических операций и для борьбы с бактериями, устойчивыми к антибиотикам. [3]
Фоскан имеет квантовый выход синглетного кислорода, сравнимый с другими хлориновыми фотосенсибилизаторами, но с более низкими дозами лекарственного средства и света (примерно в 100 раз более фотоактивен, чем Фотофрин). [3]
Foscan может сделать пациентов светочувствительными на срок до 20 дней после первоначального освещения. [3]
Лютекс
[ редактировать ]Тексафирин лютеция , продаваемый под торговыми марками Lutex и Lutrin, представляет собой большую порфириноподобную молекулу. Тексафирины представляют собой расширенные порфирины с ядром пентааза. Он обеспечивает сильное поглощение в области 730–770 нм. Прозрачность ткани в этом диапазоне оптимальна. В результате ФДТ на основе Лютекса может (потенциально) проводиться более эффективно на большей глубине и на более крупных опухолях. [3]
Лютекс вступил во вторую фазу клинических испытаний по оценке эффективности против рака молочной железы и злокачественной меланомы. [3]
Производное лютекса, Антрин, прошло I фазу клинических испытаний для предотвращения рестеноза сосудов после ангиопластики сердца путем фотоинактивации пенистых клеток, которые накапливаются в артериолярных бляшках. Второе производное Лютекса, Оптрин, проходит I фазу испытаний для AMD. [3]
Тексафирины также обладают потенциалом радиосенсибилизаторов ( кситрин ) и химиосенсибилизаторов. Кситрин, гадолиний-техафирин (мотексафин гадолиний), оценивался в клинических исследованиях фазы III против метастазов в головной мозг и клинических исследованиях фазы I для первичных опухолей головного мозга. [3]
АТМПн
[ редактировать ]9-Ацетокси-2,7,12,17-тетракис-( β -метоксиэтил)порфицен был оценен как средство для дерматологического применения против вульгарного псориаза и поверхностного немеланомного рака кожи. [3]
Цинк фталоцианин
[ редактировать ]Липосомальная форма фталоцианина цинка ( CGP55847 ) прошла клинические испытания (фаза I/II, Швейцария) против плоскоклеточного рака верхних отделов аэродигестивного тракта. Фталоцианины (ФЦ) родственны тетраазапорфиринам. Вместо четырех мостиковых атомов углерода в мезо- положениях, как у порфиринов, у ПК имеются четыре атома азота, связывающие пиррольные субъединицы. ПК также имеют расширенный путь конъюгата: бензольное кольцо присоединено к β -положениям каждой из четырехпирроловых субъединиц. Эти кольца усиливают поглощение хромофора на более длинных волнах (по отношению к порфиринам). Полоса поглощения ПК почти на два порядка сильнее, чем высшая Q-полоса гематопорфирина. Эти благоприятные характеристики, наряду со способностью избирательно функционализировать свою периферическую структуру, делают ПК подходящими кандидатами в фотосенсибилизаторы. [3]
Производное сульфированного алюминия ПК («Фотосенс») вступило в клинические испытания (Россия) против злокачественных новообразований кожи, молочной железы, легких и рака желудочно-кишечного тракта. Сульфирование значительно увеличивает растворимость ПК в полярных растворителях, включая воду, устраняя необходимость в альтернативных средствах доставки. [3]
PC4 представляет собой кремниевый комплекс, который исследуется для стерилизации компонентов крови против рака толстой кишки, молочной железы и яичников человека, а также против глиомы. [3]
Недостатком многих металло-ПК является их склонность к агрегации в водном буфере (рН 7,4), что приводит к снижению или полной потере их фотохимической активности. Такое поведение можно свести к минимуму при наличии моющих средств. [3]
Металлированные катионные порфиразины (PZ), включая PdPZ + , ЦПЗ + , ЦдПЗ + , МгПЗ + , АлПЗ + и ГаПЗ + , были протестированы in vitro на клетках V-79 (фибробласты легких китайского хомячка). Эти фотосенсибилизаторы обладают значительной темновой токсичностью. [3]
Нафталоцианины
[ редактировать ]Нафталоцианины (НК) представляют собой расширенные производные ПК. Они имеют дополнительное бензольное кольцо, прикрепленное к каждой изоиндольной субъединице на периферии структуры ПК. Впоследствии НК сильно поглощают даже более длинные волны (примерно 740–780 нм), чем ПК (670–780 нм). Такое поглощение в ближней инфракрасной области делает НК кандидатами для высокопигментированных опухолей, включая меланомы, которые представляют собой серьезные проблемы с поглощением видимого света. [3]
Однако проблемы, связанные с фотосенсибилизаторами NC, включают более низкую стабильность, поскольку они разлагаются в присутствии света и кислорода. Металло-НК, лишенные аксиальных лигандов, склонны к образованию H-агрегатов в растворе. Эти агрегаты фотоинактивны, что ставит под угрозу фотодинамическую эффективность НК. [3]
Нафталоцианин кремния, присоединенный к сополимеру ПЭГ-ПКЛ (поли(этиленгликоль) -блок -поли(ε-капролактон)) избирательно накапливается в раковых клетках и достигает максимальной концентрации примерно через сутки. Соединение обеспечивает флуоресцентную визуализацию в ближнем инфракрасном диапазоне (NIR) в реальном времени с коэффициентом экстинкции 2,8 × 10. 5 М −1 см −1 и комбинаторная фототерапия с двойными фототермическими и фотодинамическими терапевтическими механизмами, которые могут подходить для опухолей, устойчивых к адриамицину . Частицы имели гидродинамический размер 37,66 ± 0,26 нм (индекс полидисперсности = 0,06) и поверхностный заряд -2,76 ± 1,83 мВ. [18]
Функциональные группы
[ редактировать ]Изменение периферической функциональности хромофоров порфиринового типа может влиять на фотодинамическую активность. [3]
Диаминоплатиновые порфирины проявляют высокую противоопухолевую активность, демонстрируя комбинированное действие цитотоксичности платинового комплекса и фотодинамической активности порфириновых форм. [3]
Были исследованы положительно заряженные производные ПК. Считается, что катионные виды избирательно локализуются в митохондриях. [3]
Исследованы катионные производные цинка и меди. Положительно заряженный цинковый комплекс PC менее фотодинамически активен, чем его нейтральный аналог in vitro против клеток V-79. [3]
Водорастворимые катионные порфирины, несущие нитрофенильные , аминофенильные , гидроксифенильные и/или пиридиниумильные функциональные группы, проявляют различную цитотоксичность по отношению к раковым клеткам in vitro , в зависимости от природы иона металла (Mn, Fe, Zn, Ni), а также от количества и типа функциональные группы. Пиридиниумильное производное марганца проявило наибольшую фотодинамическую активность, тогда как никелевый аналог фотонеактивен. [3]
Другой металлопорфириновый комплекс, хелат железа, более фотоактивен (по отношению к ВИЧ и вирусу иммунодефицита обезьян в клетках МТ-4), чем комплексы марганца; производное цинка фотоинактивно. [3]
Гидрофильные сульфированные порфирины и соединения ПК (AlPorphyrin и AlPC) были протестированы на фотодинамическую активность. Дисульфированные аналоги (с соседними замещенными сульфонированными группами) проявляли большую фотодинамическую активность, чем их ди-(симметричные), моно-, три- и тетрасульфированные аналоги; Активность опухоли возрастала с увеличением степени сульфирования. [3]
Третье поколение
[ редактировать ]Многие фотосенсибилизаторы плохо растворимы в водных средах, особенно при физиологическом pH, что ограничивает их применение. [3]
Альтернативные стратегии доставки варьируются от использования эмульсий масло в воде (м/в) до носителей, таких как липосомы и наночастицы. Хотя эти системы могут усиливать терапевтический эффект, система-носитель может непреднамеренно уменьшить «наблюдаемый» квантовый выход синглетного кислорода (ΦΔ): синглетный кислород, генерируемый фотосенсибилизатором, должен диффундировать из системы-носителя; и поскольку считается, что синглетный кислород имеет узкий радиус действия, он может не достигать клеток-мишеней. Носитель может ограничивать поглощение света, снижая выход синглетного кислорода. [3]
Другой альтернативой, которая не вызывает проблемы рассеяния, является использование фрагментов . Стратегии включают прямое присоединение фотосенсибилизаторов к биологически активным молекулам, таким как антитела . [3]
Металлирование
[ редактировать ]Различные металлы образуют комплексы с макроциклами фотосенсибилизатора. Множественные фотосенсибилизаторы второго поколения содержат хелатный центральный ион металла. Основными кандидатами являются переходные металлы фотосенсибилизаторы, относящиеся к металлам 13-й (Al, AlPcS 4 ) и ) группы . 14-й (Si, SiNC и Sn, SnEt 2 , хотя были синтезированы [3]
Ион металла не придает комплексу определенной фотоактивности. Комплексы меди (II), кобальта (II), железа (II) и цинка (II) Hp фотоинактивны в отличие от безметалловых порфиринов. Однако фотосенсибилизаторы тексафирин и ПК не содержат металлов; только металлокомплексы продемонстрировали эффективную фотосенсибилизацию. [3]
Центральный ион металла, связанный с рядом фотосенсибилизаторов, сильно влияет на фотофизические свойства фотосенсибилизатора. Хелирование парамагнитных металлов с PC-хромофором, по-видимому, сокращает время жизни триплетов (вплоть до наносекундного диапазона), вызывая изменения в триплетном квантовом выходе и триплетном времени жизни фотовозбужденного триплетного состояния. [3]
Известно, что некоторые тяжелые металлы усиливают межсистемное пересечение (ISC). Как правило, диамагнитные металлы способствуют ISC и имеют длительный триплетный срок службы. Напротив, парамагнитные частицы дезактивируют возбужденные состояния, уменьшая время жизни возбужденного состояния и предотвращая фотохимические реакции. Однако исключения из этого обобщения включают октаэтилбензохлорин меди. [3]
Многие металлизированные виды парамагнитных тексафиринов демонстрируют время жизни в триплетном состоянии в наносекундном диапазоне. Эти результаты отражаются на металлических ПК. ПК, металлированные диамагнитными ионами, например Zn 2+ , Ал 3+ и Га 3+ , как правило, дают фотосенсибилизаторы с желаемыми квантовыми выходами и временем жизни (ΦT 0,56, 0,50 и 0,34 и τ T 187, 126 и 35 мкс соответственно). Фотосенсибилизатор ZnPcS 4 имеет квантовый выход синглетного кислорода 0,70; почти в два раза больше, чем у большинства других мПК (ΦΔ не менее 0,40). [3]
Расширенные металлопорфирины
[ редактировать ]Расширенные порфирины имеют большую центральную полость связывания, что увеличивает диапазон потенциальных металлов. [3]
Диамагнитные металлотексафирины проявили фотофизические свойства; высокие триплетные квантовые выходы и эффективная генерация синглетного кислорода. В частности, производные цинка и кадмия демонстрируют триплетные квантовые выходы, близкие к единице. Напротив, парамагнитные металлотексафирины Mn-Tex, Sm-Tex и Eu-Tex имеют необнаружимые триплетные квантовые выходы. Такое поведение параллельно наблюдаемому для соответствующих металлопорфиринов. [3]
Производное кадмия-тексафирина продемонстрировало in vitro фотодинамическую активность в отношении клеток лейкемии человека, а также грамположительных ( стафилококк ) и грамотрицательных ( кишечная палочка ) бактерий. Хотя последующие исследования этого фотосенсибилизатора были ограничены из-за токсичности комплексного иона кадмия. [3]
Металлизированный цинком секопорфиразин . ) имеет высокий квантовый выход синглетного кислорода (ΦΔ 0,74 Этот расширенный порфириноподобный фотосенсибилизатор продемонстрировал лучшую фотосенсибилизирующую способность к синглетному кислороду среди всех известных секопорфиразинов . Синтезированы производные платины и палладия с квантовыми выходами синглетного кислорода 0,59 и 0,54 соответственно. [3]
Металлохлорины/бактериохлорины
[ редактировать ]Пурпурины олова (IV) более активны по сравнению с аналогичными пурпуринами цинка (II) в отношении рака человека. [3]
Сульфированные производные бензохлорина продемонстрировали сниженный фототерапевтический ответ против мышиного лейкоза L1210 клеток in vitro и трансплантированной уротелиальной клеточной карциномы у крыс, тогда как бензохлорины, металлированные оловом (IV), продемонстрировали повышенный фотодинамический эффект на той же модели опухоли. [3]
Октаэтилбензохлорин меди продемонстрировал большую фотоактивность по отношению к лейкозным клеткам in vitro и на модели опухоли мочевого пузыря крыс. Это может происходить в результате взаимодействия между катионной иминиевой группой и биомолекулами. Такие взаимодействия могут позволить протекать реакциям переноса электрона через короткоживущее возбужденное синглетное состояние и приводить к образованию радикалов и ион-радикалов. Производное, не содержащее меди, проявляло опухолевую реакцию с короткими интервалами между введением лекарства и фотодинамической активностью. Повышенная активность in vivo наблюдалась при использовании аналога бензохлорина цинка. [3]
Металлофталоцианины
[ редактировать ]На свойства ПК сильно влияет центральный ион металла. Координация ионов переходных металлов дает металлокомплексы с коротким временем жизни триплетов (наносекундный диапазон), что приводит к различным квантовым выходам и времени жизни триплетов (по сравнению с неметаллическими аналогами). Диамагнитные металлы, такие как цинк, алюминий и галлий, образуют металлофталоцианины (MPC) с высокими триплетными квантовыми выходами (ΦT ≥ 0,4) и коротким временем жизни (ZnPCS 4 τ T = 490 Фс и AlPcS4 τ T = 400 Фс) и высоким содержанием синглетного кислорода. квантовые выходы (ΦΔ ≥ 0,7). В результате ZnPc и AlPc были оценены как фотосенсибилизаторы второго поколения, активные против определенных опухолей. [3]
Металлонафтоцианинсульфобензопорфиразины (М-НСБП)
[ редактировать ]Алюминий (Al 3+ ) был успешно согласован с M-NSBP. Полученный комплекс проявил фотодинамическую активность в отношении мышей Balb/c с опухолями ЕМТ-6 (дисульфированный аналог продемонстрировал большую фотоактивность, чем монопроизводное). [3]
Металлонафталоцианины
[ редактировать ]Работа с НК цинка с различными амидозаместителями выявила лучший фототерапевтический ответ ( карцинома легких Льюиса у мышей) с аналогом тетрабензамидо. Комплексы НК кремния (IV) с двумя аксиальными лигандами в ожидании лигандов минимизируют агрегацию. Дизамещенные аналоги как потенциальные фотодинамические агенты (силоксановый НК, замещенный двумя метоксиэтиленгликолевыми лигандами) являются эффективным фотосенсибилизатором против карциномы легких Льюиса у мышей. SiNC[OSi(i-Bu) 2 -nC 18 H 37 ] 2 эффективен против клеток фибросаркомы MS-2 мышей Balb/c. Силоксановые НК могут быть эффективными фотосенсибилизаторами против опухолей ЕМТ-6 у мышей Balb/c. Способность производных металло-НК (AlNc) генерировать синглетный кислород слабее, чем у аналогичных (сульфированных) металло-ПК (AlPC); как сообщается, на 1,6–3 порядка меньше. [3]
В порфириновых системах ион цинка (Zn 2+ ), по-видимому, препятствует фотодинамической активности соединения. Напротив, в более высоких/расширенных π -системах цинк-хелатные красители образуют комплексы с хорошими или высокими результатами. [3]
Обширное исследование металлизированных тексафиринов, сосредоточенное на ионах металлов лантаноидов (III), Y, In, Lu, Cd, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm и Yb, показало, что когда диамагнитный Lu (III ) в комплексе с тексафирином был получен эффективный фотосенсибилизатор (Лютекс). Однако использование парамагнитного иона Gd (III) для металла Lu не проявило фотодинамической активности. В результате исследования обнаружена корреляция между временем жизни возбужденного синглетного и триплетного состояний, скоростью ИСХ диамагнитных комплексов тексафирина Y(III), In (III) и Lu (III) и атомным номером катиона. [3]
Парамагнитные металлотексафирины продемонстрировали быстрый ISC. На время жизни триплетов сильно повлиял выбор иона металла. Диамагнитные ионы (Y, In и Lu) продемонстрировали тройное время жизни в пределах 187, 126 и 35 мкс соответственно. Сопоставимые времена жизни парамагнитных частиц (Eu-Tex 6,98 мкс , Gd-Tex 1,11, Tb-Tex < 0,2, Dy-Tex 0,44 × 10–3, Ho-Tex 0,85 × 10–3, Er-Tex 0,76 × 10–3 3, Tm-Tex 0,12 × 10-3 и Yb-Tex 0,46). [3]
Три измеренных парамагнитных комплекса показали значительно более низкую концентрацию, чем диамагнитные металлотексафирины. [3]
В целом квантовые выходы синглетного кислорода близко соответствуют квантовым выходам триплетов. [3]
Различные исследованные диамагнитные и парамагнитные тексафирины обладают независимым фотофизическим поведением по отношению к магнетизму комплекса. Диамагнитные комплексы характеризовались относительно высокими квантовыми выходами флуоресценции, временем жизни возбужденных синглетов и триплетов, а также квантовыми выходами синглетного кислорода; в отличие от парамагнитных видов. [3]
Диамагнитные частицы с зарядом +2, по-видимому, демонстрируют прямую связь между квантовыми выходами их флуоресценции, временем жизни возбужденного состояния, скоростью ISC и атомным номером иона металла. Наибольшая скорость диамагнитного ИСК наблюдалась для Lu-Tex; результат, приписываемый эффекту тяжелого атома. Эффект тяжелого атома также сохраняется для триплетных квантовых выходов и времени жизни Y-Tex, In-Tex и Lu-Tex. Триплетные квантовые выходы и времена жизни уменьшались с увеличением атомного номера. Квантовый выход синглетного кислорода коррелирует с этим наблюдением.
Фотофизические свойства парамагнитных частиц были более сложными. Наблюдаемые данные/поведение не коррелировали с количеством неспаренных электронов, расположенных на ионе металла. Например:
- Скорость ISC и время жизни флуоресценции постепенно уменьшались с увеличением атомного номера.
- Хромофоры Gd-Tex и Tb-Tex показали (несмотря на большее количество неспаренных электронов) более медленную скорость ISC и более длительное время жизни, чем Ho-Tex или Dy-Tex.
Чтобы добиться избирательного разрушения клеток-мишеней и при этом защитить нормальные ткани, можно либо нанести фотосенсибилизатор локально на целевую область, либо мишени можно локально осветить. Кожные заболевания, включая прыщи , псориаз , а также рак кожи , можно лечить местно и локально. При лечении внутренних тканей и рака внутривенно вводимые фотосенсибилизаторы можно облучать с помощью эндоскопов и оптоволоконных катетеров . [ нужна ссылка ]
Фотосенсибилизаторы могут воздействовать на виды вирусов и микробов, включая ВИЧ и MRSA . [19] С помощью ФДТ патогены, присутствующие в образцах крови и костного мозга, можно обеззаразить перед дальнейшим использованием образцов для переливания или трансплантации. [20] ФДТ также может уничтожить широкий спектр патогенов кожи и полости рта. Учитывая серьезность ситуации с патогенами, устойчивыми к лекарствам, растет число исследований ФДТ как нового противомикробного метода лечения. [21]
Приложения
[ редактировать ]Прыщи
[ редактировать ]ФДТ в настоящее время проходит клинические испытания в качестве лечения тяжелых форм акне . Первоначальные результаты показали, что он эффективен только для лечения тяжелых прыщей. [22] Систематический обзор, проведенный в 2016 году, показал, что ФДТ является «безопасным и эффективным методом лечения» прыщей. [23] У некоторых людей лечение может вызвать сильное покраснение, а также умеренную или сильную боль и ощущение жжения. (см. также: Левулан ). Одно исследование фазы II, хотя и показало улучшение, не превосходило использование только синего/фиолетового света. [24]
Рак
[ редактировать ]FDA одобрило фотодинамическую терапию для лечения актинического кератоза, распространенной Т-клеточной лимфомы кожи, пищевода Барретта, базальноклеточного рака кожи, рака пищевода (горла), немелкоклеточного рака легких и плоскоклеточного рака кожи (стадия 0). Фотодинамическая терапия также используется для облегчения симптомов некоторых видов рака, включая рак пищевода, когда он блокирует горло, и немелкоклеточный рак легких, когда он блокирует дыхательные пути. [25]
Когда клетки, поглотившие фотосенсибилизаторы, подвергаются воздействию света определенной длины волны, фотосенсибилизатор вырабатывает форму кислорода, называемую кислородным радикалом, которая убивает их. Фотодинамическая терапия (ФДТ) также может повредить кровеносные сосуды опухоли, что мешает ей получать кровь, необходимую для дальнейшего роста. ФДТ может заставить иммунную систему атаковать опухолевые клетки даже в других частях тела. [25] [26]
ФДТ — это минимально инвазивное лечение, которое используется для лечения многих заболеваний, включая прыщи, псориаз, возрастную дегенерацию желтого пятна и некоторые виды рака, такие как рак кожи, легких, [27] мозг, мезотелиома, [28] [29] мочевой пузырь, желчные протоки, [30] рак пищевода, а также рак головы и шеи. [31] [32] [33] [34]
В феврале 2019 года ученые-медики заявили, что иридий , присоединенный к альбумину , образуя фотосенсибилизированную молекулу , может проникать в раковые клетки и после облучения светом разрушать раковые клетки. [35] [36]
Офтальмология
[ редактировать ]Как указано выше [ нужна ссылка ] Вертепорфин был широко одобрен для лечения влажной AMD, начиная с 1999 года. Препарат воздействует на неоваскуляризацию, вызванную этим заболеванием.
Фотоиммунотерапия
[ редактировать ]Фотоиммунотерапия — онкологический метод лечения различных видов рака, сочетающий фотодинамическую терапию опухоли с иммунотерапевтическим лечением. Сочетание фотодинамической терапии с иммунотерапией усиливает иммуностимулирующий ответ и оказывает синергетический эффект при лечении метастатического рака. [37] [38] [39]
Нацеливание на сосуды
[ редактировать ]Некоторые фотосенсибилизаторы естественным образом накапливаются в эндотелиальных клетках сосудистой ткани, что позволяет проводить ФДТ, направленную на сосуды.
Было показано, что вертепорфин воздействует на неоваскуляризацию, возникающую в результате дегенерации желтого пятна в макуле, в течение первых тридцати минут после внутривенного введения препарата.
По сравнению с нормальными тканями, большинство типов рака особенно активны как в поглощении, так и в накоплении фотосенсибилизаторов, что делает рак особенно уязвимым для ФДТ. [40] Поскольку фотосенсибилизаторы также могут обладать высоким сродством к сосудов клеткам эндотелия . [41]
Антимикробное действие
[ редактировать ]Фотодинамическая дезинфекция кожи эффективна для уничтожения местных микробов , включая устойчивые к лекарствам бактерии , вирусы и грибки . [42] [ нужен лучший источник ] Фотодинамическая дезинфекция остается эффективной после повторных обработок без признаков формирования резистентности. [43] Метод позволяет эффективно лечить полимикробные биопленки Pseudomonas aeruginosa, устойчивые к антибиотикам, и метициллин-резистентные биопленки Staphylococcus aureus на модели полости верхнечелюстной пазухи. [44]
История
[ редактировать ]современная эпоха
[ редактировать ]В конце девятнадцатого века. Финсен успешно продемонстрировал фототерапию, используя свет с тепловой фильтрацией угольной дуговой лампы («лампа Финзена») при лечении туберкулезного заболевания кожи, известного как волчанка обыкновенная , за что он получил Нобелевскую премию по физиологии и медицине 1903 года. . [3]
В 1913 году другой немецкий ученый Мейер-Бетц описал главный камень преткновения фотодинамической терапии. После инъекции гематопорфирина (Hp, фотосенсибилизатора) он быстро почувствовал общую чувствительность кожи при воздействии солнечного света — повторяющуюся проблему со многими фотосенсибилизаторами. [3]
Первые доказательства того, что агенты, светочувствительные синтетические красители, в сочетании с источником света и кислородом могут иметь потенциальный терапевтический эффект, были получены на рубеже 20-го века в лаборатории Германа фон Таппейнера в Мюнхене, Германия. В то время Германия лидировала в мире по промышленному синтезу красителей. [3]
Изучая воздействие акридина на культуры парамеций , Оскар Рааб, ученик фон Таппейнера, заметил токсическое действие. По счастливой случайности Рааб также заметил, что для уничтожения парамеций необходим свет. [45] Последующая работа в лаборатории фон Таппейнера показала, что кислород необходим для «фотодинамического действия» — термин, придуманный фон Таппейнером. [46]
Фон Таппейнер и его коллеги провели первое исследование ФДТ у пациентов с карциномой кожи с использованием фотосенсибилизатора эозина . лица Из шести пациентов с базальноклеточной карциномой , получавших 1% раствор эозина и подвергавшихся длительному воздействию солнечного света или света дуговой лампы, у четырех пациентов наблюдалось полное разрешение опухоли и период безрецидивов в течение 12 месяцев. [47]
В 1924 году Поликард раскрыл диагностические возможности флуоресценции гематопорфиринов, когда заметил, что ультрафиолетовое излучение возбуждает красную флуоресценцию в саркомах лабораторных крыс. [48] Поликард предположил, что флуоресценция связана с накоплением эндогенного гематопорфирина.
В 1948 году Фигге и сотрудники [49] показали на лабораторных животных, что порфирины проявляют преимущественное сродство к быстро делящимся клеткам, включая злокачественные, эмбриональные и регенеративные клетки. Они предположили, что порфирины можно использовать для лечения рака.
Фотосенсибилизатор - производное гематопорфирина (HpD) был впервые охарактеризован в 1960 году Липсоном. [50] Липсон искал диагностический агент, подходящий для обнаружения опухолей. Технология HPD позволила компании Lipson стать пионером в использовании эндоскопов и флуоресценции HPD. [51] HpD представляет собой разновидность порфирина, полученную из гематопорфирина. Порфирины уже давно считаются подходящими агентами для фотодиагностики опухолей и ФДТ опухолей, поскольку раковые клетки демонстрируют значительно большее поглощение и сродство к порфиринам по сравнению с нормальными тканями. Это наблюдалось и другими исследователями до Липсона.
Томас Догерти и коллеги [52] в Комплексном онкологическом центре Розуэлл-Парк в Буффало, штат Нью-Йорк , провели клинические испытания ФДТ в 1978 году. Они пролечили 113 кожных или подкожных злокачественных опухолей с помощью HpD и наблюдали полное или частичное разрешение 111 опухолей. [53] Догерти помог расширить клинические испытания и в 1986 году основал Международную фотодинамическую ассоциацию. [ нужна ссылка ]
Джон Тот, менеджер по продукции Cooper Medical Devices Corp/Cooper Lasersonics, заметил «фотодинамический химический эффект» терапии и примерно в 1981 году написал первый официальный документ, назвав терапию «Фотодинамическая терапия» (ФДТ) с использованием первых клинических аргоновых лазеров на красителях. Компания создала 10 клинических центров в Японии, где термин «радиация» имел негативный оттенок.
HpD под торговой маркой Photofrin был первым агентом ФДТ, одобренным для клинического использования в 1993 году для лечения одной из форм рака мочевого пузыря в Канаде. В течение следующего десятилетия как ФДТ, так и использование HpD привлекли международное внимание и получили большее клиническое признание, что привело к появлению первых методов лечения ФДТ, одобренных Управлением по контролю за продуктами и лекарствами США в Японии и некоторых странах Европы для использования против некоторых видов рака пищевода и немелкоклеточных опухолей. клеточный рак легких. [3]
[54] Недостатками фотофрина были длительная фоточувствительность пациента и слабое длинноволновое поглощение (630 нм). Это привело к разработке фотосенсибилизаторов второго поколения, включая вертепорфин ( производное бензопорфирина , также известное как Визудин), а в последнее время — фотосенсибилизаторы таргетного действия третьего поколения, такие как фотосенсибилизаторы, направленные на антитела. [3]
В 1980-х годах Дэвид Дельфин, Джулия Леви и их коллеги разработали новый фотосенсибилизатор — вертепорфин. [55] [56] Вертепорфин, производное порфирина, активируется при длине волны 690 нм, что намного длиннее длины волны, чем у фотофрина. Он обладает свойством преимущественного поглощения неоваскуляризацией. Его применение при лечении рака кожи было широко протестировано, а в 2000 году он получил одобрение FDA для лечения влажной возрастной дегенерации желтого пятна. Таким образом, это был первый метод лечения этого заболевания, которое является основной причиной потери зрения.
Российские ученые первыми разработали фотосенсибилизатор под названием Photogem, который, как и HpD, был получен из гематопорфирина в 1990 году Мироновым и его коллегами. Фотогем одобрен Минздравом России и прошел клинические испытания с февраля 1992 по 1996 год. Выраженный терапевтический эффект наблюдался у 91 процента из 1500 пациентов. У 62 процентов наблюдалось полное разрешение опухоли. Еще у 29 процентов наблюдалось уменьшение опухоли более чем на 50%. При ранней диагностике у 92 процентов пациентов наблюдалось полное выздоровление. [57]
Российские ученые сотрудничали с учеными НАСА, которые рассматривали возможность использования светодиодов в качестве более подходящих источников света по сравнению с лазерами для приложений ФДТ. [58] [59] [60]
С 1990 года китайцы развивают клинический опыт ФДТ, используя фотосенсибилизаторы отечественного производства, полученные из гематопорфирина. [61] Китай известен своим опытом в лечении труднодоступных опухолей. [62]
Разное
[ редактировать ]ПУВА-терапия использует псорален в качестве фотосенсибилизатора и ультрафиолетовое излучение UVA в качестве источника света, но эту форму терапии обычно классифицируют как отдельную форму терапии от фотодинамической терапии. [63] [64]
Чтобы обеспечить лечение более глубоких опухолей, некоторые исследователи используют внутреннюю хемилюминесценцию для активации фотосенсибилизатора. [65]
См. также
[ редактировать ]- Антимикробная фотодинамическая терапия
- Лучевая терапия крови
- Лазерная медицина
- Легкие материалы для сбора урожая
- Фотоиммунотерапия
- Фотомедицина
- Фотофармакология
- Фотостатин
- Сонодинамическая терапия
- Фотосенсибилизатор
- Наногантели изучаются на предмет возможного использования в фотодинамической терапии. [66]
Ссылки
[ редактировать ]- ^ Догерти, Томас Дж. (17 июня 1998 г.). «Фотодинамическая терапия» . JNCI: Журнал Национального института рака . 90 (12): 889–905. дои : 10.1093/jnci/90.12.889 . ПМЦ 4592754 . ПМИД 9637138 .
- ^ Перейти обратно: а б Ван, СС; Джей Чен; Л. Келтнер; Дж. Кристоферсен; Ф Чжэн; М. Крууз; Сингхал (2002). «Новая технология глубокого распределения света в тканях для фототерапии». Раковый журнал . 8 (2): 154–63. дои : 10.1097/00130404-200203000-00009 . ПМИД 11999949 . S2CID 24376095 .
Лейн, Н. (январь 2003 г.). «Новый взгляд на медицину» . Научный американец . 288 (1): 38–45. Бибкод : 2003SciAm.288a..38L . doi : 10.1038/scientificamerican0103-38 . ПМИД 12506423 . - ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в ах есть также и аль являюсь а к ап ак с как в В из хорошо топор является тот нет бб до нашей эры др. быть парень бг чб с минет БК с бм млрд быть б.п. БК бр бс БТ этот бв б бх к бз что CB копия компакт-диск Йозефсен, Лиэнн Б.; Бойл, Росс В. (1 января 2008 г.). «Фотодинамическая терапия и разработка фотосенсибилизаторов на основе металлов» . Препараты на основе металлов . 2008 : 276109. doi : 10.1155/2008/276109 . ISSN 0793-0291 . ПМК 2535827 . ПМИД 18815617 .
 Эта статья содержит цитаты из этого источника, который доступен по лицензии Attribution 3.0 Unported (CC BY 3.0).
Эта статья содержит цитаты из этого источника, который доступен по лицензии Attribution 3.0 Unported (CC BY 3.0). - ^ Сковсен Эсбен, Снайдер Джон В., Ламберт Джон, округ Колумбия, Огилби Питер Р. (2005). «Время жизни и диффузия синглетного кислорода в клетке». Журнал физической химии Б. 109 (18): 8570–8573. дои : 10.1021/jp051163i . ПМИД 16852012 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Перейти обратно: а б Эллисон, РР; и др. (2004). «Фотосенсибилизаторы в клинической ФДТ» (PDF) . Фотодиагностика и фотодинамическая терапия . 1 (1): 27–42. дои : 10.1016/S1572-1000(04)00007-9 . ПМИД 25048062 .
- ^ Хуан Цзы (июнь 2005 г.). «Обзор прогресса клинической фотодинамической терапии» . Технол. Рак Рез. Обращаться . 4 (3): 283–93. дои : 10.1177/153303460500400308 . ПМЦ 1317568 . ПМИД 15896084 . Архивировано из оригинала 5 июля 2007 года . Проверено 17 апреля 2012 г.
- ^ Перейти обратно: а б с О'Коннор, Эслинг Э., Галлахер, Уильям М., Бирн, Аннетт Т. (2009). «Порфириновые и непорфириновые фотосенсибилизаторы в онкологии: доклинические и клинические достижения в фотодинамической терапии. Фотохимия и фотобиология, сентябрь/октябрь 2009 г.» . Фотохимия и фотобиология .
{{cite news}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Фостер, TH; Б.Д. Пирсон; С Митра; CE Бигелоу (2005). «Визуализация анизотропии флуоресценции выявляет локализацию мезо-тетрагидроксифенилхлорина в ядерной оболочке». Фотохимия и фотобиология . 81 (6): 1544–7. дои : 10.1562/2005-08-11-RN-646 . ПМИД 16178663 . S2CID 19671054 .
- ^ Уилсон, доктор медицинских наук; CE Бигелоу; диджей Калкинс; Т. Х. Фостер (2005). «Рассеяние света неповрежденными клетками сообщает о набухании митохондрий, вызванном окислительным стрессом» . Биофизический журнал . 88 (4): 2929–38. Бибкод : 2005BpJ....88.2929W . дои : 10.1529/biophysj.104.054528 . ПМЦ 1305387 . ПМИД 15653724 .
- ^ Меллиш, Кирсте; Р. Кокс; Д. Вернон; Дж. Гриффитс; С. Браун (2002). «Фотодинамическая активность ряда аналогов метиленового синего in vitro». Фотохимия и фотобиология . 75 (4): 392–7. doi : 10.1562/0031-8655(2002)075<0392:ivpaoa>2.0.co;2 . ПМИД 12003129 . S2CID 198157591 .
- ^ Уилсон, Брайан С; Майкл С. Паттерсон (2008). «Физика, биофизика и технология фотодинамической терапии». Физика в медицине и биологии . 53 (9): Р61–Р109. дои : 10.1088/0031-9155/53/9/R01 . ПМИД 18401068 . S2CID 4366743 .
- ^ Ли, ТК; ЭД Барон; THH Фостер (2008). «Мониторинг фотодинамической терапии Pc 4 в клинических исследованиях кожной Т-клеточной лимфомы с использованием неинвазивной спектроскопии» . Журнал биомедицинской оптики . 13 (3): 030507. Бибкод : 2008JBO....13c0507L . дои : 10.1117/1.2939068 . ПМК 2527126 . ПМИД 18601524 .
- ^ «Определение порфимера натрия» . www.cancer.gov . 2 февраля 2011 года . Проверено 6 марта 2022 г.
- ^ Кессель, Дэвид (2 октября 2019 г.). «Фотодинамическая терапия: краткая история» . Журнал клинической медицины . 8 (10): 1581. doi : 10.3390/jcm8101581 . ISSN 2077-0383 . ПМК 6832404 . ПМИД 31581613 .
- ^ Невилл, Энн (5 октября 2018 г.). «Томас Догерти, доктор философии, разработал современную терапию рака» . Новости Буффало . Проверено 6 марта 2022 г.
- ^ «В память о докторе Догерти, почетном руководителе Центра ФДТ – Американского общества фотобиологии» . Проверено 6 марта 2022 г.
- ^ «Данные доступа к вставке пакета FDA» (PDF) .
- ^ «Одноагентная система фототерапии диагностирует и уничтожает раковые клетки | KurzweilAI» . www.kurzweilai.net . 2 ноября 2015 года . Проверено 27 апреля 2016 г.
- ^ Майкл Р. Хэмблин; Тайяба Хасан (2004). «Фотодинамическая терапия: новый противомикробный подход к инфекционным заболеваниям?» . Фотохимия Фотобиология . 3 (5): 436–450. дои : 10.1039/b311900a . ПМК 3071049 . ПМИД 15122361 .
Хуанг, Л; Т Дай; Г-н Хэмблин (2010). «Противомикробная фотодинамическая инактивация и фотодинамическая терапия инфекций». Фотодинамическая терапия . Методы молекулярной биологии. Том. 635. стр. 155–173. дои : 10.1007/978-1-60761-697-9_12 . ISBN 978-1-60761-696-2 . ПМЦ 2933785 . ПМИД 20552347 . - ^ Бумедин, РС; округ Колумбия Рой (2005). «Устранение аллореактивных Т-клеток с помощью фотодинамической терапии». Цитотерапия . 7 (2): 134–143. дои : 10.1080/14653240510027109 . ПМИД 16040392 .
Малруни, CM; С. Глюк; А.Д. Хо (1994). «Применение фотодинамической терапии при очистке костного мозга». Семин Онкол . 21 (6 Приложение 15): 24–27. ПМИД 7992104 .
Окснер, М. (1997). «Фотодинамическая терапия: клиническая перспектива. Обзор применения для борьбы с различными опухолевыми и неопухолевыми заболеваниями». Арцнаймиттельфоршунг . 47 (11): 1185–94. ПМИД 9428971 . - ^ Тан, HM; г-н Хэмблин; КМ Йоу (2007). «Сравнительное исследование фотоинактивации in vitro клинических изолятов возбудителей с множественной лекарственной устойчивостью» . J Заразить химиотерапией . 13 (2): 87–91. дои : 10.1007/s10156-006-0501-8 . ПМЦ 2933783 . ПМИД 17458675 .
Майш, Т; С. Хакбарт; Дж. Регенсбургер; Фельгентрагер; В. Баумлер; М. Ландталер; Б. Родер (2011). «Фотодинамическая инактивация мультирезистентных бактерий (ПИБ) — новый подход к лечению поверхностных инфекций в 21 веке» . J Dtsch Дерматол Гес . 9 (5): 360–6. дои : 10.1111/j.1610-0387.2010.07577.x . ПМИД 21114627 . - ^ Номер клинического испытания NCT00706433 «Исследование диапазона легких доз фотодинамической терапии (ФДТ) с левуланом + синий свет по сравнению с носителем + синий свет при тяжелых прыщах на лице» на сайте ClinicalTrials.gov
- ^ Кейал, У.; Бхатта, АК; Ван, XL (июнь 2016 г.). «Фотодинамическая терапия для лечения акне различной степени тяжести: систематический обзор». Фотодиагностика и фотодинамическая терапия . 14 : 191–199. дои : 10.1016/j.pdpdt.2016.04.005 . ПМИД 27090488 .
- ^ «DUSA Pharmaceuticals (DUSA) прекращает разработку лечения акне 2-й фазы» . Биокосмос. 23 октября 2008 г. Архивировано из оригинала 6 сентября 2009 г. Проверено 30 июля 2009 г.
- ^ Перейти обратно: а б «Фотодинамическая терапия для лечения рака - Национальный институт рака» . www.cancer.gov . 6 сентября 2011 года . Проверено 6 марта 2022 г.
- ^ Голник, Сандра О.; Овчарчак, Барбара; Майер, Патрисия (июнь 2006 г.). «Фотодинамическая терапия и противоопухолевый иммунитет» . Лазеры в хирургии и медицине . 38 (5): 509–515. дои : 10.1002/lsm.20362 . ISSN 0196-8092 . ПМЦ 3683987 . ПМИД 16788921 .
- ^ Лоуэн, Грегори М.; Панди, Равиндра; Бельнье, Дэвид; Хендерсон, Барбара; Догерти, Томас (2006). «Эндобронхиальная фотодинамическая терапия рака легких» . Лазеры в хирургии и медицине . 38 (5): 364–370. дои : 10.1002/lsm.20354 . ISSN 0196-8092 . ПМИД 16788932 . S2CID 2773899 .
- ^ Онг, И Хун; Ким, Мишель М.; Финли, Джарод К.; Димофте, Андреа; Сингхал, Сунил; Глатштейн, Эли; Сенгель, Кейт А.; Чжу, Тимоти К. (29 декабря 2017 г.). «Дозиметрия дозы ФДТ для фотофрин-опосредованной плевральной фотодинамической терапии (пФДТ)» . Физика в медицине и биологии . 63 (1): 015031. doi : 10.1088/1361-6560/aa9874 . ISSN 0031-9155 . ПМЦ 5952607 . ПМИД 29106380 .
- ^ Ду, Кевин Л.; Оба, Стефан; Фридберг, Джозефи С.; Ренган, Рамеш; Хан, Стивен М.; Сенгель, Кейт А. (1 сентября 2010 г.). «Экстраплевральная пневмонэктомия, фотодинамическая терапия и лучевая терапия с модуляцией интенсивности для лечения злокачественной мезотелиомы плевры» . Биология и терапия рака . 10 (5): 425–429. дои : 10.4161/cbt.10.5.12616 . ISSN 1538-4047 . ПМИД 20699634 . S2CID 1516239 .
- ^ Патель, Джанаки; Ризк, Нада; Кедия, Прашант; Шарайха, Рим З.; Кахале, Мишель (1 апреля 2015 г.). «Фотодинамическая терапия холангиокарциномы с помощью холангиоскопии» . Желудочно-кишечная эндоскопия . 81 (4): 1012–1013. дои : 10.1016/j.gie.2014.09.060 . ISSN 0016-5107 . ПМИД 25484323 .
- ^ «Международная фотодинамическая ассоциация (IPA)» . Международная фотодинамическая ассоциация (IPA) . Проверено 6 марта 2022 г.
- ^ Биль, Меррилл А. (сентябрь 2007 г.). «Лечение раннего рака полости рта и гортани фотодинамической терапией» . Фотохимия и фотобиология . 83 (5): 1063–1068. дои : 10.1111/j.1751-1097.2007.00153.x . ISSN 0031-8655 . ПМИД 17880501 . S2CID 24183038 .
- ^ Швейцер, Ванесса Гейл; Сомерс, Мелисса Л. (январь 2010 г.). «ФОТОФРИН-опосредованная фотодинамическая терапия для лечения ранних стадий (Tis-T2N0M0) SqCCa полости рта и ротоглотки» . Лазеры в хирургии и медицине . 42 (1): 1–8. дои : 10.1002/lsm.20881 . ISSN 0196-8092 . ПМИД 20077493 . S2CID 41342278 .
- ^ Ригуал, Нестор Р.; Танкаппан, Кришнакумар; Купер, Мишель; Салливан, Морин А.; Догерти, Томас; Попат, Саурин Р.; Лори, Том Р.; Биль, Меррилл А.; Хендерсон, Барбара (август 2009 г.). «Фотодинамическая терапия дисплазии головы и шеи и рака» . Архив отоларингологии – хирургии головы и шеи . 135 (8): 784–788. дои : 10.1001/archoto.2009.98 . ISSN 0886-4470 . ПМЦ 2810853 . ПМИД 19687399 .
- ^ Университет Уорика (3 февраля 2019 г.). «Простое попадание света на металлические соединения динозавров убивает раковые клетки» . ЭврекАлерт! . Проверено 3 февраля 2019 г.
- ^ Чжан, Пинъюй; и др. (15 декабря 2018 г.). «Направленный на ядро конъюгат органоиридий-альбумин для фотодинамической терапии рака» . Ангеванде Хеми . 58 (8): 2350–2354. дои : 10.1002/anie.201813002 . ПМК 6468315 . ПМИД 30552796 .
- ^ Ван С, Сюй Л, Лян С, Сян Дж, Пэн Р, Лю Цз (2014). «Иммунологические реакции, вызванные фототермической терапией с углеродными нанотрубками в сочетании с терапией анти-CTLA-4 для подавления метастазирования рака». Адв Матер . 26 (48): 8154–62. Бибкод : 2014AdM....26.8154W . дои : 10.1002/adma.201402996 . ПМИД 25331930 . S2CID 5421261 .
- ^ Лин, З.; и др. (2015). «Фототермическая абляция костных метастазов рака молочной железы с использованием ПЭГилированных многостенных углеродных нанотрубок» . Научный представитель . 5 : 11709. Бибкод : 2015NatSR...511709L . дои : 10.1038/srep11709 . ПМК 4485034 . ПМИД 26122018 .
- ^ Чен, К.; и др. (2016). «Фототермическая терапия с использованием иммуноадъювантных наночастиц вместе с блокадой контрольных точек для эффективной иммунотерапии рака» . Нат Коммун . 7 : 13193. Бибкод : 2016NatCo...713193C . дои : 10.1038/ncomms13193 . ПМК 5078754 . ПМИД 27767031 .
- ^ Парк, С. (май 2007 г.). «Поставка фотосенсибилизаторов для фотодинамической терапии». Корейский J Гастроэнтерол . 49 (5): 300–313. ПМИД 17525518 .
Селбо, ПК; Хогсет; L Прасмицкайте; К. Берг (2002). «Фотохимическая интернализация: новая система доставки лекарств». Опухолевые биол . 23 (2): 103–112. дои : 10.1159/000059713 . ПМИД 12065848 . S2CID 46865502 .
Сильва, JN; П Филипе; П. Морлиер; Ж.К. Мазьер; Дж. П. Фрейтас; Х. Л. Сирне де Кастро; Р. Сантус (2006). «Фотодинамическая терапия: принципы и современное медицинское применение». Биомед Матер англ . 16 (4 приложения): S147–154. ПМИД 16823106 . - ^ Чен, Б; Б.В. Пог; Пи Джей Хупс; Т (2006). «Сосудистое и клеточное нацеливание для фотодинамической терапии». Crit Rev Eukaryot Gene Expr . 16 (4): 279–305. doi : 10.1615/critreveukargeneexpr.v16.i4.10 . ПМИД 17206921 .
Краммер, Б. (2001). «Сосудистые эффекты фотодинамической терапии». Противораковые рез . 21 (6Б): 4271–7. ПМИД 11908681 . - ^ «ФДТ в фотодезинфекции» . Международная фотодинамическая ассоциация . Проверено 6 марта 2022 г.
- ^ Хегер, Майкл (2015). «Антибактериальная фотодинамическая терапия: обзор перспективного подхода к борьбе с антибиотикорезистентными бактериальными инфекциями» . Журнал клинических и трансляционных исследований . 1 (3): 140–167. ПМК 6410618 . ПМИД 30873451 .
- ^ Биль, Меррилл А.; Педиго, Лиза; Гиббс, Аарон; Лебель, Николя (июнь 2013 г.). «Фотодинамическая терапия устойчивых к антибиотикам биопленок на модели верхнечелюстной пазухи» . Международный форум аллергологии и ринологии . 3 (6): 468–473. дои : 10.1002/alr.21134 . ISSN 2042-6984 . ПМЦ 3626737 . ПМИД 23307793 .
- ^ Рааб, О. (1904). «О действии люминесцентных веществ на инфузории». Журнал биологии . 39 :524-546.
- ^ Таппейнер, Х. фон; А. Йодльбауэр (1904). «О влиянии фотодинамических (флуоресцентных) веществ на простейших и ферменты». Немецкие архивы клинической медицины . 80 : 427–487.
- ^ Таппейнер, Х. фон; Х. Есионек (1903). «Терапевтические эксперименты с флуоресцентными веществами». Мюнхенский медицинский еженедельник . 50 :2042–4.
Йесионек, Х.; Х. фон Таппейнер (1905). «Для лечения рака кожи флуоресцентными веществами». Немецкие архивы клинической медицины . 82 :223–6. - ^ Поликар, А (1924). «Исследование аспектов экспериментальных опухолей, рассмотренных в свете Вуда». Отчеты заседаний Биологического общества и его филиалов . 91 : 1423–1424.
- ^ Фигге, Ф.Х.; Г.С. Вейланд; Л. О Манганьелло (август 1948 г.). «Исследования по выявлению и терапии рака; сродство неопластических, эмбриональных и травмированных тканей к порфиринам, металлопорфиринам и радиоактивному гематопорфирину цинка». Анатомическая запись . 101 (4): 657. PMID 18882442 .
- ^ Липсон, РЛ; Э. Дж. Балдес (октябрь 1960 г.). «Фотодинамические свойства конкретного производного гематопорфирина». Архив дерматологии . 82 (4): 508–516. дои : 10.1001/archderm.1960.01580040026005 . ПМИД 13762615 .
Липсон, РЛ; Э. Дж. Балдес; А. М. Олсен (январь 1961 г.). «Использование производного гематопоргирина при обнаружении опухолей». Журнал Национального института рака . 26 : 1–11. дои : 10.1093/jnci/26.1.1 . ПМИД 13762612 . - ^ Липсон, Р.Л; Э. Дж. Балдес; М. Дж. Грей (декабрь 1967 г.). «Производное гематопорфирина для обнаружения и лечения рака». Рак . 20 (12): 2255–7. doi : 10.1002/1097-0142(196712)20:12<2255::AID-CNCR2820201229>3.0.CO;2-U . ПМИД 6073903 . S2CID 8945080 .
- ^ Моан, Дж.; Ц. Пэн (2003). «Очерк истории ФДТ» (PDF) . В Тьерри Патрисе (ред.). Фотодинамическая терапия . Комплексная серия по фотохимии и фотобиологии. Том. 2. Королевское химическое общество. стр. 1–18. дои : 10.1039/9781847551658 . ISBN 978-0-85404-306-4 .
- ^ Догерти, Т.Дж.; Дж. Э. Кауфман; А. Гольдфарб; К. Р. Вейсгаупт; Д. Бойл; А. Миттлман (август 1978 г.). «Фотолучевая терапия в лечении злокачественных опухолей». Исследования рака . 38 (8): 2628–35. ПМИД 667856 .
- ^ Гольдман Л. (1990). «Лазеры на красителях в медицине». В Дуарте Ф.Дж .; Хиллман Л.М. (ред.). Принципы работы лазера на красителях . Бостон: Академическая пресса . стр. 419–32. ISBN 978-0-12-222700-4 .
- ^ Рихтер, А.; Штернберг, Э.; Уотерфилд, Э.; Дельфин, Д.; Леви, Дж. Г. (1990). «Характеристика производного бензопорфирина, нового фотосенсибилизатора». В Хасане, Тайяба (ред.). Достижения фотохимиотерапии . Том. 997. Международное общество оптической инженерии. стр. 145–150. Бибкод : 1989SPIE..997..132R . дои : 10.1117/12.960196 . S2CID 95511635 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Рихтер, А.; Уотерфилд, Э.; Джайн, АК; Штернберг, Э.; Дельфин, Д.; Леви, Дж. Г. (1990). «Фотосенсибилизирующая активность производного бензопорфирина (БПД) на модели опухоли мыши». Фотохимия и фотобиология . 52 (3): 495–500. дои : 10.1111/j.1751-1097.1990.tb01791.x . ПМИД 2284343 . S2CID 2913557 .
- ^ «Центр лазерной медицины — исторические аспекты развития фотодинамической терапии» . Проверено 5 августа 2011 г.
- ^ «Инновации (ноябрь/декабрь 97 г.) — космические исследования проливают спасительный свет» . Архивировано из оригинала 30 октября 2004 года . Проверено 5 августа 2011 г.
- ^ «Фотонные клинические испытания» . Архивировано из оригинала 3 мая 2006 года . Проверено 5 августа 2011 г.
- ^ Уилан, ХТ; Э.В. Бухман; Н. Т. Уилан; С.Г. Тернер; В. Чевенини; Х. Стинсон; Р Игнатий; Т. Мартин; Дж. Цвиклински; Г. А. Мейер; Б. Ходжсон; Л. Гулд; М. Кейн; Г Чен; Дж. Кэвинесс (2001). «Производное гематопорфирина для обнаружения и лечения рака». Международный форум космических технологий и приложений . CP552: 35–45.
- ^ Хуанг, З; Э.В. Бухман; Н. Т. Уилан; С.Г. Тернер; В. Чевенини; Х. Стинсон; Р Игнатий; Т. Мартин; Дж. Цвиклински; Г. А. Мейер; Б. Ходжсон; Л. Гулд; М. Кейн; Г Чен; Дж. Кэвинесс (2006). «Фотодинамическая терапия в Китае: Более 25 лет уникального клинического опыта: Часть первая — История и отечественные фотосенсибилизаторы». Фотодиагностика и фотодинамическая терапия . 3 (1): 3–10. дои : 10.1016/S1572-1000(06)00009-3 . ПМИД 25049020 .
Сюй, ДЯ (2007). «Исследование и разработка фотосенсибилизаторов для фотодинамической терапии в Китае». Фотодиагностика и фотодинамическая терапия . 4 (1): 13–25. дои : 10.1016/j.pdpdt.2006.09.003 . ПМИД 25047186 . - ^ Куй, ХХ; Ю Гу; Ф.Г. Лю; Нью-Йорк Хуан; Х. Х. Чен; Дж Цзэн (2007). «Клинический опыт фотодинамической терапии в Китае». Комплексная медицинская инженерия : 1181–1184.
- ^ Финлан, Ю.Л.; Кернохан, Нью-Мексико; Томсон, Г.; Битти, ЧП; Хапп, ТР; Ибботсон, С.Х. (2005). «Дифференциальное влияние фотодинамической терапии 5-аминолевулиновой кислотой и терапии псораленом + ультрафиолетом на фосфорилирование p53 в нормальной коже человека in vivo». Британский журнал дерматологии . 153 (5): 1001–1010. дои : 10.1111/j.1365-2133.2005.06922.x . ПМИД 16225614 . S2CID 35302348 .
- ^ Руководство по политике Чампвы, Глава: 2, Раздел: 30.11, Название: ФДТ (фотодинамическая терапия) и ПУВА (фотохимиотерапия). Архивировано 14 января 2012 г. в Wayback Machine Министерства по делам ветеранов США. Дата: 23.12.2011
- ^ Лаптев Р., Нисневич М., Сибони Г., Малик З., Фирер М.А. (июль 2006 г.). «Внутриклеточная хемилюминесценция активирует целенаправленное фотодинамическое разрушение лейкозных клеток» . Бр. Дж. Рак . 95 (2): 189–96. дои : 10.1038/sj.bjc.6603241 . ПМК 2360622 . ПМИД 16819545 .
- ^ Хоу, Бэйбэй; Чжэн, Бинь; Ян, Вэйтао; Донг, Чунхонг; Ван, Ханджи; Чанг, Джин (15 мая 2017 г.). «Создание наногантели ближнего инфракрасного диапазона для фотодинамической терапии рака». Журнал коллоидной и интерфейсной науки . 494 : 363–372. Бибкод : 2017JCIS..494..363H . дои : 10.1016/j.jcis.2017.01.053 . ПМИД 28167424 .