Сонодинамическая терапия

Сонодинамическая терапия (СДТ) — это неинвазивный метод лечения, часто используемый для облучения опухоли, в котором используется соносенсибилизатор и глубокое проникновение ультразвука для лечения поражений различной глубины за счет уменьшения количества клеток-мишеней и предотвращения будущего роста опухоли. [1] [2] Многие существующие стратегии лечения рака вызывают системную токсичность или не могут проникнуть в ткань достаточно глубоко, чтобы охватить всю опухоль; однако новые методы лечения, стимулированные ультразвуком, могут предложить альтернативу этим методам лечения благодаря их повышенной эффективности, большей глубине проникновения и уменьшению побочных эффектов. Сонодинамическая терапия может использоваться для лечения рака и других заболеваний, таких как атеросклероз, и снижения риска, связанного с другими стратегиями лечения, поскольку она вызывает цитотоксические эффекты только при внешней стимуляции ультразвуком и только в раковой области, в отличие от системного введения химиотерапевтические препараты. [3] [4] [5]

Активные формы кислорода (АФК) являются важным компонентом СДТ, поскольку они обеспечивают цитотоксичность сонодинамической терапии; они образуются, когда ультразвук сочетается с сенсибилизирующим лекарством и молекулярным кислородом. [1] Без УЗИ препарат не токсичен. Однако, как только препарат подвергается воздействию ультразвука и молекулярного кислорода, он становится токсичным. [1] Фотодинамическая терапия , на основе которой произошла сонодинамическая терапия, использует аналогичный механизм. Вместо ультразвука для активации препарата используется свет. [1] СДТ позволяет ультразвуку проникать глубже в ткань (примерно до 30 сантиметров) по сравнению с фотодинамической терапией (ФДТ), поскольку он может быть высоко сфокусированным. [1] Эта увеличенная глубина проникновения в конечном итоге означает, что СДТ можно использовать для лечения более глубоких и менее доступных опухолей и она более рентабельна, чем ФДТ. [6] [1] Фотодинамическая терапия может использоваться в сочетании с сонодинамической терапией и подробно описана в разделе «Применение» этой статьи. Звукодинамическую терапию можно использовать синергетически с другими терапевтическими методами, такими как микропузырьки с лекарственными средствами, наночастицы, экзосомы, липосомы и гены, для повышения эффективности. В настоящее время SDT не имеет каких-либо клинических продуктов и действует в качестве вспомогательного средства для вышеупомянутых терапевтических методов, но его исследовали для использования при лечении атеросклероза и рака для уменьшения размера опухолей молочной железы, поджелудочной железы, печени и позвоночника. [7] [3] [8] [9] [10] [11] [12] [13] [14] [15] [16]
Механизм действия
[ редактировать ]
Механизм действия сонодинамической терапии заключается в использовании ультразвука низкой интенсивности за счет использования сфокусированных механических волн для создания цитотоксического эффекта. Однако сама СДТ не является термической, нетоксичной и способна неинвазивно проникать глубоко в ткани по сравнению с другими методами доставки, такими как фотодинамическая терапия. СДТ часто проводится одновременно с использованием соносенсибилизаторов, таких как порфирин , фталоцианины , ксантены и противоопухолевые препараты. [17] Ультразвуковые волны также классифицируются как акустические волны, и воздействие, которое они оказывают на ткани применения, можно описать процессом, называемым кавитацией. Кавитация возникает как специфическое взаимодействие между ультразвуком и водной средой и вызывает разрушение пузырьков газа при воздействии определенных ультразвуковых параметров, тем самым способствуя проникновению терапевтического препарата в биологические ткани за счет образования полостей вблизи края мембраны. [18] [1] Кавитацию можно разделить на устойчивую и инерционную. При устойчивой кавитации колебания пузырьков газа вызывают перемешивание окружающей среды. [1] При инерционной кавитации пузырьки газа увеличиваются в объеме и почти достигают резонансного объема, разбухая перед агрессивным схлопыванием. [1] Схлопывание везикул приводит к резкому изменению температуры и давления, тем самым увеличивая проницаемость клеточной мембраны для различных лекарств. [1] [19] Микропузырьки создаются акустическими волнами ультразвука, которые расширяются и сжимаются, высвобождая энергию, переводя соносенсибилизатор в возбужденное состояние и генерируя АФК. Кавитация этого газового пузыря может образовывать АФК с помощью различных методов, таких как сонолюминесценция и пиролиз . [1] Апоптоз возникает в результате образования АФК и механических сил СДТ в результате разрушения мембраны в процессе, называемом перекисным окислением липидов. Некроз также является потенциальным результатом СДТ. [ нужна ссылка ]
Влияние сонолюминесценции на СДТ и АФК полностью не изучено в литературе. [1] В настоящее время понятно, что сонолюминесценция позволяет испускать свет при коллапсе пузырька, который может активировать сенсибилизаторы. Исследование Хачимина и соавт. подчеркивает использование SDT в качестве метода активации низкочувствительного соносенсибилизатора DCPH-P-Na(I) при раке, который находится слишком глубоко в тканях, чтобы бороться с использованием PDT без раздражения кожи. [1] [20] Пиролиз повышает температуру окружающей среды, усиливает процесс кавитации, разрушает сенсибилизатор, генерируя свободные радикалы, а свободные радикалы взаимодействуют в своей среде с образованием АФК. [1] Для обоих методов была подчеркнута важность синглетного кислорода по сравнению с гидроксильным радикалом для индукции цитотоксичности. [1] [20] [21] В то время как другие исследования [1] [22] [23] обнаружили, что синглетный кислород не оказывает существенного влияния. В целом, обеим этим методологиям не хватает достаточного количества литературы, чтобы полностью объяснить их роль в формировании АФК. Однако литература показала успехи в их анализе и применении. [1] [4] [24]
Сонолюминесценция
[ редактировать ]
В сонодинамической терапии существуют два основных механизма генерации АФК: сонолюминесценция и пиролиз. [1] Сонолюминесценция возникает, когда ультразвук производит свет после облучения водного раствора. [1] [25] Точный механизм образования света остается неясным. Однако предполагается, что инерционная кавитация является ключевым элементом этого процесса. [1] [26] Другие исследования также указывают на потенциальную роль стабильной кавитации. [1] [27]
Пиролиз
[ редактировать ]Считается, что пиролиз происходит, когда инерционная кавитация вызывает резкое повышение температуры, разрушает соносенсибилизаторы, образуя таким образом свободные радикалы, которые могут реагировать и в конечном итоге производить АФК, необходимые для SDT. [1] [28] Локальное повышение температуры способствует инерционной кавитации и разрушению соносенсибилизатора с целью создания АФК. Пиролиз внутри кавитационных пузырьков приведет к образованию H+ и OH- за счет слабых связей внутри молекулы растворенного вещества. [1] [19]
Перекисное окисление липидов
[ редактировать ]
Помимо химических методов, механические свойства акустической волны, генерируемой ультразвуком, могут способствовать инициированию цитотоксических эффектов. Это происходит за счет разрушения мембраны гидрофобным соносенсибилизатором. Механическое разрушение мембраны вызывает процесс, называемый перекисным окислением липидов , и изменения в клеточной мембране могут изменить проницаемость клеточных лекарств. [1] [29] Как сонохимические, так и сономеханические методологии используются для генерации АФК и высвобождения груза из везикул для таких применений, как нацеливание на опухоли. [ нужна ссылка ]
Апоптоз
[ редактировать ]В предыдущей литературе было показано, что ультразвук низкой интенсивности вызывает апоптозные эффекты в окружающих клетках. Установлено, что не исходные АФК вызывают апоптоз внутри клеток, а свободные радикалы внутри митохондрий. В исследовании Хонды и др. Было установлено, что митохондриально-каспазный путь отвечает за апоптоз посредством увеличения внутриклеточного кальция. [1] [30] Помимо апоптоза, индуцированного АФК, кавитация является еще одним фактором, участвующим в апоптозе окружающих клеток. Оба типа кавитации способны вызывать апоптоз за счет повреждения мембраны. Такие условия, как частота, рабочий цикл, пульс и интенсивность, можно манипулировать для оптимизации условий гибели клеток, таких как некроз, лизис или апоптоз. [31] [24] [32]
Аутофагия
[ редактировать ]Этот метод гибели клеток может происходить за счет захвата клеточных органелл в аутофагосомы, которые объединяются с лизосомами. Продолжение этого процесса приведет к гибели клеток, а ингибиторы или промоторы аутофагии можно контролировать, чтобы стимулировать или препятствовать гибели клеток и использованию химиотерапевтических препаратов. [1]
Соносенсибилизаторы
[ редактировать ]Соносенсибилизаторы или соносенсибилизирующие терапевтические средства являются основным элементом SDT и могут быть адаптированы для лечения различных видов рака и получения различных эффектов. [2] Эти методы лечения, часто с использованием порфирина или ксантена, инициируют токсическое действие через АФК при воздействии ультразвука. [ нужна ссылка ]
Сенсибилизаторы на основе порфиринов
[ редактировать ]
Сенсибилизаторы на основе порфирина, первоначально использовавшиеся в качестве фотосенсибилизаторов при ФДТ, представляют собой довольно гидрофобные молекулы, полученные из гематопорфирина. [1] Одиночные атомы кислорода или гидроксильные радикалы производятся сенсибилизаторами на основе порфиринов под воздействием ультразвука или света, обеспечивая цитотоксические эффекты, желаемые при сонодинамической и фотодинамической терапии. [1] Однако эффект от сенсибилизаторов на основе порфиринов не настолько локальный, как хотелось бы для сонодинамической терапии, поскольку они также расположены в нецелевой ткани между опухолью и ультразвуковым излучателем. [1]
Сенсибилизаторы на основе ксантена
[ редактировать ]

С другой стороны, сенсибилизаторы на основе ксантена продемонстрировали успешную цитотоксичность in vitro, производя активные формы кислорода после воздействия ультразвука. [1] Необходимы дополнительные исследования, чтобы улучшить его потенциал in vivo, поскольку он быстро перерабатывается печенью и выводится из организма. [1] Бенгальская роза — широко используемый соносенсибилизатор на основе ксантена. [1]
Дополнительные сенсибилизаторы
[ редактировать ]Другие сенсибилизаторы, которые были исследованы на предмет их потенциала в сонодинамической терапии (а также ранее использовались в ФДТ), включают акридиновый оранжевый , метиленовый синий , куркумин и индоцианин зеленый . [1] Исследование Suzuki et al. использовали акридиновый оранжевый, флуоресцентный катионный краситель, который может внедряться в нуклеиновые кислоты, для лечения клеток саркомы 180 с помощью ультразвука и продемонстрировали, что активные формы кислорода являются критическим элементом SDT, учитывая, что их отсутствие снижает эффективность SDT. [33] Подобно предыдущему исследованию, недавнее исследование Komori et al. использовали ультразвук в сочетании с метиленовым синим (фенотиазиновым красителем, обычно используемым при ФДТ и обладающим низкой токсичностью) для облучения клеток саркомы 180 и обнаружили, что метиленовый синий является эффективным соносенсибилизатором в снижении жизнеспособности клеток. [34] Интересно, что куркумин — это специя, которая также может действовать как сенсибилизатор ФДТ и СДТ. [1] В исследовании Ваксмана и др. куркумин способен воздействовать на макрофаги, которые важны для развития бляшек, обнаруженных у пациентов с атеросклерозом, тем самым уменьшая количество бляшек на животной модели. [35] Эти результаты наряду с другими исследованиями показывают, что сенсибилизаторы куркумина могут быть использованы в лечении рака SDT. Индоцианин зеленый — это краситель, который поглощает волны ближнего инфракрасного диапазона и является еще одним сенсибилизатором, который, как было показано, снижает жизнеспособность клеток в сочетании с ультразвуком и/или светом. [36] Исследование in vivo продемонстрировало, что обработка мышиной модели опухоли индоцианином зеленым в сочетании с ультразвуком и светом привела к уменьшению объема опухоли на 98% через 27 дней после лечения. [36]
Перевозчики
[ редактировать ]Как упоминалось выше, соносенсибилизаторы часто используются в сочетании с различными носителями лекарственных средств, такими как микропузырьки, нанопузырьки, липосомы и экзосомы, для улучшения концентрации и проникновения терапевтического агента. [18]
Липосомы
[ редактировать ]
Липосомы являются распространенным средством доставки лекарств, особенно для лечения рака. Липосомы содержат фосфолипидный бислой. Он широко распространен из-за его способности проникать в непроницаемую сосудистую сеть и плохой лимфодренаж внутри опухолей, обеспечивая повышенное сохранение проницаемости. [37] Эти носители лекарств могут инкапсулировать гидрофобные и липофильные молекулы внутри своего липидного бислоя и могут быть получены естественным или синтетическим путем. [38] [39] Кроме того, липосомы могут захватывать гидрофильные молекулы в свое гидрофильное ядро. [38] По сравнению с обычной химиотерапией для лечения рака, препараты, загруженные в липосомы, позволяют снизить системную токсичность и потенциально повысить эффективность адресной доставки. [18] Успех липосом в качестве систем доставки лекарств был продемонстрирован как in vivo, так и in vitro. [38] Исследование Лю и соавт. показали, что липосомы можно использовать вместе с СДТ, чтобы вызвать высвобождение лекарств путем окисления липидных компонентов. [40] Другое исследование Ninomiya et al. использовали капли наноэмульсии, подвергающиеся воздействию ультразвуковых волн, для образования более крупных пузырьков газа, разрушающих липосомальную мембрану и высвобождающих лекарство. Многие свойства и элементы липосом могут быть изменены для их конкретной цели и для повышения эффективности, особенно их способности перемещаться в крови и взаимодействовать с клетками и тканями организма. [38] К этим элементам относятся их диаметр, заряд, расположение, а также состав их мембран. [38] Дай и др. предложили включение соносенсибилизаторов в липосомы для повышения целевой специфичности. [18] Поскольку SDT стимулирует раковые ткани поглощать и удерживать соносентайзеры с последующей активацией экстракорпоральным ультразвуком, Dai et al. исследовали влияние препаратов, инкапсулированных в липосомы, на эффективность адресной доставки при СДТ. Они обнаружили, что, помимо удобства и практичности, СДТ является безопасным и эффективным вариантом лечения рака. [18]
Экзосомы
[ редактировать ]Экзосомы представляют собой наноносители, которые могут обеспечить адресную доставку терапевтических средств для усиления локальных цитотоксических эффектов при минимизации любого системного воздействия. Они приобретаются из клеток и используются для транспортировки внутри клетки в виде мембраносвязанных везикул. Преимущества экзосом для доставки лекарств включают в себя возможность манипулирования и конструирования, а также низкую токсичность и иммуногенность. [41] [42] Они также вдохновили на исследования неклеточных методов лечения различных видов рака и заболеваний. [41] Другие желательные аспекты экзосом включают их общую биосовместимость и стабильность. [42] Исследование Нгуена Цао и соавт. исследовали использование экзосом для доставки индоцианина зеленого (ICG), соносенсибилизатора для лечения рака молочной железы. [43] Значительное увеличение образования активных форм кислорода наблюдалось в клетках рака молочной железы, обработанных экзосомами, конъюгированными с фолиевой кислотой. [43] Это один из примеров соносенсибилизатора, используемого для лечения конкретного рака с помощью сонодинамической терапии. Другой пример сонодинамической терапии на основе экзосом был проиллюстрирован Liu et al. В этом исследовании экзосомы были украшены порфириновыми сенсибилизаторами, и эта система использовалась с внешним ультразвуковым устройством для контроля и целевой доставки лекарств посредством SDT. [40] Лю и др. представили неинвазивный метод лечения рака посредством экстракорпоральной активации экзосом с помощью ультразвука. [40]
Микропузырьки
[ редактировать ]
Благодаря своей способности колебаться под воздействием низкочастотного ультразвука микропузырьки использовались в качестве контрастных веществ для визуализации тканей, в которые проникли микропузырьки. [44] Однако, когда эти микросферы подвергаются воздействию ультразвука под высоким давлением, они могут разорваться, что может быть полезно для доставки лекарств. [44] С помощью SDT эти микропузырьки могут избирательно взрываться в микроокружении опухоли, чтобы снизить системные уровни инкапсулированного лекарства и повысить терапевтическую эффективность. При применении СДТ увеличение акустического давления приводит к инерционной кавитации – схлопыванию микропузырька и локальному высвобождению находящегося внутри него груза. Инерционная кавитация микропузырьков при воздействии SDT также называется разрушением микропузырьков, опосредованным ультразвуком (UMMD). [45] Оболочка микропузырьков может быть украшена различными компонентами, в том числе полимерами, липидами или белками, в зависимости от их назначения. [44] Микропузырьки также использовались для локализованного высвобождения прикрепленного груза. Этот груз обычно представляет собой химиотерапевтические препараты, антибиотики или гены. [12] Различные лекарства можно напрямую загружать в микропузырьки с помощью таких методов, как конъюгация и наночастицы, загрузка липосом и гены. Комбинация генов и SDT называется сонотрансфекцией. [12] Примеры модификаций внешней оболочки можно увидеть в исследовании McEwan et al. которые обнаружили, что липидные микропузырьки проявляют пониженную стабильность, когда к их оболочкам добавляют соносенсибилизаторы. [44] Однако прикрепление полимера полимолочной гликолевой кислоты (PLGA) к оболочке привело к повышенной стабильности по сравнению с липидными микропузырьками без потери других желаемых свойств, таких как адресная доставка и селективная цитотоксичность. [44] В другом исследовании McEwan et al. исследовали способность микропузырьков, переносящих кислород, увеличивать выработку активных форм кислорода, которые являются необходимым компонентом СДТ, в гипоксической среде многих солидных опухолей. [46] Эти микропузырьки стабилизировали липидами, а к их поверхности прикрепили соносенсибилизатор бенгальской розы для лечения рака поджелудочной железы. [46] Их работа показала, что сочетание нагруженных кислородом микропузырьков, чувствительных к ультразвуку, с соносенсибилизирующими препаратами может обеспечить повышенную активацию лекарства на желаемой цели, даже если присутствует гипоксия. Примерами терапевтических средств, загруженных в микропузырьки, являются гемцитабин, наночастицы паклитаксела, плазмидная ДНК и липосомы, загруженные 2,2'-азобис[2-(2-имидазолин-2-ил)пропан]дигидрохлоридом. [47] [45] [48] [49] Благодаря нацеливающему характеру лигандов, связанных с микропузырьком, это обеспечивает контролируемое и специфическое нацеливание на нужную ткань для лечения. Другое исследование, проведенное Nesbitt et al. продемонстрировал улучшение уменьшения опухоли, когда гемцитабин был загружен в микропузырек и применен к модели ксенотрансплантата рака поджелудочной железы человека с помощью SDT. [48]
Нанопузыри
[ редактировать ]Подобно микропузырькам, нанопузырьки показали эффективность при SDT. [50] Однако из-за своего меньшего размера нанопузырьки способны достигать целей, которые не могут достичь микропузырьки. Нанопузырьки могут достигать более глубоких тканей и проходить мимо сосудистой сети. Предыдущие исследования показали, что нанопузырьки более способны достигать опухоли, поскольку они могут проникать в эндотелиальные клетки и мигрировать из сосудистой сети. [51] [50] Одно исследование Nittayacharn et al. разработали нанопузырьки, нагруженные доксорубицином, и соединили их с сенсибилизаторами порфирина для использования в SDT для лечения клеток рака молочной железы и яичников in vitro. [50] Они обнаружили почти 70%-ное увеличение цитотоксичности при использовании SDT по сравнению с использованием только перфторпропановых нанопузырьков, наполненных иридием (III). [50] Кроме того, по сравнению с пустыми нанопузырьками и/или свободным иридием(III), они наблюдали наибольшую генерацию активных форм кислорода в нанопузырьках иридия(III), подвергнутых воздействию ультразвука. [50] Эти результаты показывают, что нанопузырьки, загруженные соносенсибилизатором и подвергнутые воздействию ультразвука, могут быть потенциально эффективным средством лечения рака с использованием СДТ. Как и в случае с микропузырьками, нанопузырьки также оказались многообещающими в качестве везикул, доставляющих кислород, для повышения эффективности SDT. Чтобы смягчить гипоксию ткани-мишени, Owen et al. использовали модель грызунов с раком поджелудочной железы для доставки стабилизированных фосфолипидами нанопузырьков, наполненных кислородом. [52] Мышей разделили на группы: одна получала наполненные кислородом нанопузырьки перед инъекцией соносенсибилизатора, а другая — нет. [52] Наблюдалась статистически значимая разница между уровнями кислорода в опухолях двух групп, что указывает на то, что нанопузырьки могут быть эффективным дополнением к SDT для лечения рака в гипоксической среде. [52]
Приложения
[ редактировать ]Сочетание с другими методами лечения
[ редактировать ]Звукодинамическую терапию можно комбинировать с другими терапевтическими методами для повышения эффективности лечения различных типов рака и заболеваний. СДТ можно комбинировать с фотодинамической терапией, химиотерапией, лучевой терапией, МРТ и иммунотерапией. ФДТ часто используется в сочетании с СДТ, поскольку соносенсибилизаторы также светочувствительны. [1] Во время первоначальной разработки СДТ Умемура и др. определили, что гематопорфирины способны инициировать гибель клеток аналогично ФДТ. [21] Это связано с тем, что СДТ способен инициировать сонолюминесценцию. Однако преимущество СДТ перед ФДТ заключается в том, что он может проникать глубоко и точно в целевую ткань. В исследовании Lui et al. было показано, что использование комбинации этих двух методов доставки приводит к повышенной цитотоксичности синопорфирина в модели метастатического ксенотрансплантата. [53] В другом примере сочетания SDT и PDT Borah et al. исследовали преимущества 2-(1-гексилоксиэтил)-2-девинилпирофеофорбида-а (HHPH), препарата для фотодинамической терапии, в качестве соносенсибилизатора и фотосенсибилизатора для лечения глиобластомы. [54] Сочетание этих методов лечения показало усиление реакции гибели клеток/опухоли, что, возможно, вызвано синергическими эффектами. [54]
Цель исследования Browning et al. Целью исследования было изучение потенциального повышения эффективности химиолучевой терапии за счет ее сочетания с сонодинамической терапией у пациентов с раком поджелудочной железы. В одной модели выживаемость увеличилась при использовании комбинации по сравнению с одной лишь химиолучевой терапией. Различия в результатах двух разных моделей можно объяснить различиями в организации опухоли. [6] Опухоли, которые показали наибольшее уменьшение размера, были менее васкуляризированы, что, возможно, делало их более уязвимыми для СДТ. [6] Другое исследование, проведенное Huang et al. использовали элементы мезопористых наносистем на основе кремнийорганического кремния для изготовления соносенсибилизатора, который будет использоваться с SDT под контролем МРТ. [55] Соносенсибилизаторы индуцировали повышенную гибель клеток и ингибирование роста опухоли, что указывает на высокую эффективность СДТ. [55] Это показывает, как СДТ может помочь как в удалении, так и в подавлении роста опухоли. [ нужна ссылка ]
СДТ также сочетается с иммунотерапией. Исследование Лина и соавт. целью было использование каскадной иммуносонодинамической терапии для усиления лечения опухолей с использованием антител. [56] Применение наносоносенсибилизаторов привело к высокой эффективности лекарственной нагрузки и опухолеспецифическому адаптивному иммунному ответу. Это служит примером того, как SDT может сочетаться с иммунотерапией с блокадой контрольных точек для повышения эффективности лечения рака. Другое исследование Yue et al. стремились объединить иммунотерапию с блокадой контрольных точек с неинвазивной сонодинамической терапией, дополненной наносоносенсибилизаторами. [57] Наряду с подавлением метастазирования в легкие эта комбинация способствовала противоопухолевому ответу, который подавлял рост опухоли. Это обеспечивает подтверждение концепции комбинирования СДТ с другой терапией для усиления эффекта лечения в краткосрочной и долгосрочной перспективе. [ нужна ссылка ]
Виды рака, как было показано, SDT лечит
[ редактировать ]Лечение рака
[ редактировать ]Лечение многих различных типов рака было исследовано с использованием сонодинамической терапии как in vitro, так и/или in vivo, включая глиобластому, рак поджелудочной железы, молочной железы, яичников, легких, простаты, печени, желудка и толстой кишки. [54] [6] [20] [50] [52] Исследование Гао и соавт. показали, что СДТ способен ингибировать ангиогенез за счет продукции АФК. Это препятствовало пролиферации, миграции и инвазии эндотелиальных клеток, росту опухоли, внутриопухолевой васкуляризации и экспрессии фактора роста эндотелия сосудов в опухолевых клетках на моделях ксенотрансплантатов на крысах. [58] Хачимин и др. провел большое исследование in vitro, проверяя SDT на семнадцати различных линиях раковых клеток. [20] В число включенных типов рака входили рак поджелудочной железы, молочной железы, легких, простаты, печени, желудка и толстой кишки. [20] Наиболее успешным было лечение рака легких с жизнеспособностью клеток 23,4% после терапии. [1] [20] Цюй и др. Целью компании была разработка универсальной наносенсибилизирующей платформы, запускаемой SDT, которая сочетает в себе различные диагностические и терапевтические эффекты для лечения глиобластомы. [59] В клетках глиомы был успешно индуцирован апоптоз и ингибирована митофагия. Это пример того, как SDT можно использовать с другой платформой для лечения глиобластомы. Бора и др., как упоминалось выше, также исследовали способность СДТ (и ФДТ) лечить глиобластому и обнаружили, что СДТ (в сочетании с ФДТ) способна увеличивать количество убитых опухолевых клеток. [54] Макьюэн и др. и Оуэн и др. оба продемонстрировали использование микро/нанопузырьков для повышения концентрации кислорода вблизи гипоксических опухолей поджелудочной железы, тем самым увеличивая эффективность СДТ. [46] [52]
Рак молочной железы
[ редактировать ]
У 12% женщин в США будет диагностирован рак молочной железы . [60] Метастазирование и рецидивы являются серьезной проблемой для глубоко расположенных твердотельных опухолей. [39] СДТ в настоящее время исследуется как метод лечения рака молочной железы, позволяющий избежать побочных эффектов, связанных с современными терапевтическими методами. [61] Был продемонстрирован успех использования SDT в клинических испытаниях на животных и людях для уменьшения размера опухоли за счет нацеливания на митохондрии для инициации апоптоза опухолевых клеток, а также аутофагии и регуляции иммунного ответа. [62] [39] [63] [64] [24] [53] [60] [65] [61] Тем не менее, все еще существуют осложнения при должной терапевтической эффективности при использовании в одиночку.
Глиома
[ редактировать ]
Злокачественная глиома — чрезвычайно трудно поддающаяся лечению опухоль головного мозга, которая является основной причиной смертности во всем мире и составляет половину смертей, связанных с раком. [14] Осложнения, связанные с лечением глиомы, включают нарушение гематоэнцефалического барьера (ГЭБ). [14] Этот защитный механизм для мозга также создает проблемы для доставки лекарств через плотные соединения между эндотелиальными клетками, позволяя проникать только небольшим жирорастворимым лекарствам (<400 Да). [14] Современные методы доставки — хирургическое вмешательство и химиотерапия. SDT был реализован как метод открытия ГЭБ и показал успех в открытии плотных соединений для доставки. Примерами соносенсибилизаторов, доказавших свою эффективность при лечении глиомы, являются монометиловый эфир гематопорфирина (HMME), порфимер натрия (Фотофрин), дисульфо-дифталимидометилфталолцианинцинк (ZnPcS2P2), Фотолон, 5-аминолевулиновая кислота (5-АЛК), и бенгальская роза (РБ). [14] Было показано, что они вызывают такие эффекты, как открытие ГЭБ, улучшение проницаемости сосудов и апоптоз клеток глиомы. [ нужна ссылка ]
Рак простаты
[ редактировать ]
Рак предстательной железы является второй причиной рака и наиболее распространенным злокачественным новообразованием, вызывающим смертность среди мужчин во всем мире. [66] Современные методы лечения — это инвазивная резекционная терапия, лучевая терапия и простатэктомия, которые могут вызвать такие осложнения, как недержание мочи, импотенция и повреждение окружающих органов и тканей. [67] [17] Текущие исследования показали успех в использовании СДТ в качестве самостоятельного лечения. [68] SDT использует апоптоз, связанный с митохондриями, для снижения жизнеспособности клеток. СДТ для лечения рака простаты также использовалась наряду с химиотерапевтическими средствами, такими как микропузырьки доцетаксела. [17] [67] [68] Было показано, что это усиливает эффекты доцетаксела за счет снижения перфузии опухоли и усиления некроза и апоптоза. [68] В группе SDT и доцетаксела наблюдалось снижение роста опухоли. [68] В целом, использование СДТ показало многообещающие результаты в лечении рака простаты. [ нужна ссылка ]
Артериальные заболевания
[ редактировать ]Сонодинамическая терапия может использоваться не только для лечения рака. Атеросклероз , хроническое заболевание артерий, является еще одной мишенью, наблюдаемой в литературе. [3] [5] Это заболевание возникает при скоплении жировых бляшек на внутренней поверхности артерии и может быть вызвано нарушениями липидного обмена. [3] Более конкретно, атеросклероз вызывается увеличением проницаемости эндотелия, в результате чего частицы липопротеинов низкой плотности окисляются и подвергаются седиментации. [3] Эти липопротеины вызывают увеличение количества макрофагов и приводят к усиленному образованию бляшек. В результате высокий приток макрофагов является целью лечения АС, чтобы замедлить образование бляшек. [3] Наряду с взаимосвязью между образованием бляшек и макрофагами, дифференцировка моноцитов в макрофаги усугубляет вышеупомянутый процесс, а также вызывает воспаление. [3]
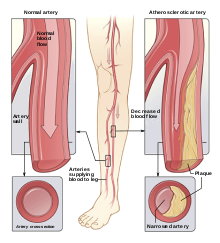
Исследование Ванга и др. Целью исследования было понять основные механизмы потенциального воздействия нелетального ТДТ на атеросклероические бляшки. Установлено, что нелетальная СДТ предотвращает развитие бляшек. [5] Исследование, проведенное Jiang et al., показало успех SDT за счет снижения воспалительных факторов макрофагов, таких как TNF-альфа, IL-12 и IL-1B. Они также показали, что SDT может ингибировать воспаление бляшек у пациентов с заболеванием периферических артерий и продолжать обеспечивать положительные результаты в течение более шести месяцев. [4] Популярными соносенсибилизаторами для лечения АС являются протопорфирин IX (PpIX) и 5-аминолевулиновая кислота (5-АЛК). [69] [3] PpIX часто используется при ФДТ и генерируется посредством 5-АЛК, компонента, не активируемого ультразвуком, за счет увеличения концентрации PpIX внутри клетки. Исследование Ченга и соавт. определили, что апоптоз макрофагов THP-1 индуцируется увеличением концентрации PpiX, что приводит к выработке большого количества АФК. [70] [13] [3] Использование SDT для лечения АС также показало успех в стимулировании репопуляции гладкомышечных клеток сосудов (VMSC) посредством индукции дальнейшей экспрессии и аутофагии для предотвращения эволюции VMSC в макрофаги, удерживающие бляшки. Исследование, проведенное Дэном и др. показали увеличение гладкомышечного a-актина, гладкомышечного 22a, фосфорилирования митоген-активируемой протеинкиназы p38. [71] [3] Хотя исследование Geng et al. продемонстрировали улучшение аутофагии VMSC. Каждый из этих факторов способствовал улучшению дифференциации и развитию VMSC. [3]
Работа in vitro и in vivo
[ редактировать ]В пробирке
[ редактировать ]Эксперименты in vitro дают большое понимание и знания, позволяющие охарактеризовать потенциал поведения соносенсибилизаторов in vivo. Кроме того, SDT продемонстрировал успех благодаря своей низкой интенсивности, позволяющей повысить проницаемость плазматической мембраны без гибели клеток. [1] Соносенсибилизаторы также использовались in vitro с различными клеточными линиями и для дальнейшего понимания механизма действия при гибели клеток. В настоящее время понятно, что ФДТ и СДТ имеют схожие механизмы образования свободных радикалов, вызывающих апоптоз и некроз. [1] Однако каждая линия клеток уникальна и может вызывать гибель клеток с разной эффективностью. [20] [1] [72] Некоторые примеры работ in vitro включают первоначальные исследования, проведенные Yumita et al., 1989, которые использовали гематопрофирин и SDT для лечения саркомы 180 мышей и асцитной гепатомы крыс (АГ), которые показали взаимосвязь между дозировкой и ультразвуком, а также микропузырьки, вызывающие кавитацию, приводящую к повреждение клеток без применения лекарств. Это исследование также подчеркнуло разницу в эффективности между клеточными линиями с помощью SDT 180, имеющими меньший лизис по сравнению с клетками AH-130. Другое исследование Hachimine et al. подчеркнул эффективность между клеточными линиями, исследовав семь различных видов рака с 17 клеточными линиями в общей сложности при использовании DCPH-P-NA(I). [1] [20] Это исследование показало, что линии рака желудка и легких MKN-28 и LU65A соответственно имели самую высокую выживаемость, но линии рака желудка и легких RERFLC-KJ и MKN-45 соответственно имели самые низкие показатели выживаемости. [20] [1] Другое исследование, проведенное Хондой и др. с использованием U937 и K562, показало, что обработка ультразвуком увеличивает внутриклеточные уровни ионов кальция и снижает концентрацию GSH соответственно. [30] Эта повышенная концентрация кальция играет важную роль в гибели клеток из-за фрагментации ДНК и разрушения митохондриальных мембран. [1] [30] В то время как снижение концентрации GSH играет важную роль в образовании большего количества свободных радикалов. [30] [1] Исследование Умемура и др. показало, что ATX-70 по сравнению с гематопорфирином обладает повышенной цитотоксической активностью. [21] [1] Текущие исследования обычно сосредоточены на использовании моделей ксенотрансплантатов опухолей для определения влияния SDT на клетки-мишени и эффективности доставки. [1]
В естественных условиях
[ редактировать ]Основываясь на исследовании Umemura et al. и ATX-70 было обнаружено, что через 24 часа после введения соносенсибилизатора эффективность при применении ультразвука улучшалась по сравнению с немедленным введением. [21] [1] Также было установлено, что большинство частот ультразвука находятся в диапазоне от 1–3 МГц до 0,5–4 Вт/см^2. Более высокие частоты при таких значениях, как 20 Вт/см^2 и 25 Вт/см^2, приводили к большим некротическим поражениям. [73] [1] Это установило связь между составом соносенсибилизатора и интенсивностью ультразвука и некрозом. Другие исследования продолжали вводить новшества в эту тему, контролируя интервал ультразвукового воздействия на лекарственные средства (DUI) для различных соносенсибилизаторов, чтобы определить оптимальный период времени для применения ультразвука для повышения эффективности. [58] [1] Кроме того, было показано, что СДТ может нарушать окружающую сосудистую сеть опухолей. [1] [58] Это было показано в исследованиях Gao et al. с 5-АЛК на мышах и линиях эндотелиальных клеток пупочной вены человека посредством ингибирования плотности микрососудов и пролиферации, миграции и инвазии клеток. [58] [1]
Вызовы и развитие
[ редактировать ]
Одним из многих преимуществ СДТ по сравнению с ФДТ является способность СДТ проникать в глубоко расположенные солидные опухоли, что позволяет расширить диапазон лечения. [1] Несмотря на этот факт, существуют ограничения SDT, которые необходимо преодолеть или оптимизировать компоненты, чтобы расширить эффект и применение SDT. [31] SDT действительно позволяет точно активировать терапевтическое средство, но ограничен в доставке и накоплении способа доставки для глубокого проникновения в желаемый участок опухоли. [74] Для этого часто используются сосуды для сквозной доставки, такие как наночастицы или липосомы. [1] Однако наномедицина ограничена повышенным эффектом проницаемости и удержания и с трудом обеспечивает доставку в целевом количестве в зависимости от пузырька доставки. [31] [74] Это можно увидеть на наночастицах, которые борются с неспецифической доставкой. Будущие исследования были сосредоточены на разработке наночастиц с высокой направленностью и проникновением для улучшения доставки и фармакокинетики. [75] [31] Из-за сложной природы опухолей и их микроокружения их трудно лечить с помощью одной терапии. Чтобы повысить часто низкую выработку активных форм кислорода для устранения гипоксической среды опухоли, SDT можно комбинировать с другими методами лечения, такими как ФДТ, химиотерапия и иммунотерапия, для улучшения результатов лечения пациентов. [2] [56] [54] [6] Сама по себе SDT не дает хорошего эффекта в гипоксических средах. Однако биоредуктивная терапия может быть использована для уменьшения влияния ограничений SDT в отношении гипоксии в опухоли, оставляя при этом здоровую/нормальную ткань в покое. [2] Соносенсибилизаторам также требуется постоянный высокий уровень кислорода для создания АФК, которые недоступны в микроокружении гипоксической опухоли. [31] Однако такие стратегии, как добавление и производство кислорода для подачи необходимого кислорода и усиления кавитации, а также истощение глутатиона, чтобы избежать уменьшения количества образующихся свободных радикалов, были реализованы наряду с соносенсибилизаторами для подачи необходимого кислорода или снижения боевой функции. [76] [74] Помимо относительно низкого образования активных форм кислорода, СДТ также может вызывать необратимое разрушение нормальных тканей. Отсутствие селективности вызвано расхождением ультразвука, приводящим к нагреву и сдвигу, воздействующему на нецелевые ткани. [2] Хотя существуют преимущества органических соносенсибилизаторов, такие как высокая воспроизводимость, биосовместимость, производство активных форм кислорода, они также имеют ограничения. [2] Факторы, которые ограничивают применение органических сенсибилизаторов для клинического применения, включают низкую растворимость в воде, сонотоксичность и нацеливаемость, а также высокую фототоксичность . [2] Другие свойства могут способствовать быстрому выведению лекарства, поэтому для транспортировки лекарства в нужное место используются различные нано- и микрочастицы. [2] Кроме того, соносенсибилизаторы при СДТ часто требуют увеличения дозы, а взаимосвязь между терапевтической дозой и токсичностью соносенсибилизаторов не была должным образом охарактеризована наряду с другими переменными, такими как тип ткани и акустическое давление. [31] Неорганические сенсибилизаторы производят активные формы кислорода, но в более низких концентрациях, чем желательно для SDT, что ограничивает их возможность использования в клинических условиях. [2] Еще одна проблема связана с работой in vitro и in vivo. Пример этого можно увидеть в исследовании с использованием бенгальской розы, ксантенового красителя. [1] Было обнаружено, что он эффективен in vitro, но in vivo показал значительно меньшую эффективность из-за секвестрации и клиренса в печени. [1] Наконец, в настоящее время не существует стандартизированного компьютерного моделирования, позволяющего предсказать характеристики различных соносенсибилизаторов в тканях, что позволило бы лучше понять, как могут вести себя соносенсибилизаторы. [16]
Текущее клиническое использование
[ редактировать ]
СДТ чаще всего исследуется для борьбы с раком и атеросклерозом, такими как рак молочной железы, рак поджелудочной железы, печени и саркомы позвоночника. [7] [3] [8] [9] [13] [12] [11] [10] [16] [15] [14] [77] В настоящее время нет одобренных FDA клинических применений SDT. Однако для ФДТ Фотофрин представляет собой гематопорфирин, одобренный FDA (PHOTOFRIN®). Тем не менее, СДТ использовалась в клинических испытаниях в сочетании с ФДТ для оценки уменьшения размера опухоли у пациентов с раком молочной железы. [1] Однако было трудно определить, является ли СДТ ФДТ или дозировка препарата основным механизмом лечения. [1] В другом тематическом исследовании этот вопрос был расширен за счет использования SDT в качестве самостоятельного лечения с гормональной терапией белком Gc с использованием 5-АЛК или хлорина е6 в качестве соносенсибилизатора. Было показано, что на фоне лечения значительно снизились опухолевые маркеры. [1] [78]
Будущие направления
[ редактировать ]
Эффективность сонодинамической терапии как метода лечения рака подтверждается многими исследованиями in vitro и in vivo. [1] Однако для внедрения в клинические условия необходимы крупномасштабные клинические испытания. Чтобы смягчить вышеупомянутые ограничения, разрабатываются новые соносенсибилизаторы, а СДТ новыми способами комбинируется с другими методами лечения. В частности, необходимо разработать органические соносенсибилизаторы с высокой растворимостью в воде, высокой сонотоксичностью, повышенной способностью воздействовать на опухоли и низкой фототоксичностью, чтобы улучшить терапевтическую эффективность СДТ и позволить использовать ее для лечения рака. [2] Кроме того, еще предстоит определить механизмы, с помощью которых АФК продуцируются соносенсибилизаторами при воздействии ультразвука, что снижает способность контролировать его функцию и результаты. В конечном итоге синергетический эффект от сочетания СДТ с другими методами лечения позволит каждому компенсировать ограничения другого, повышая их терапевтическую эффективность и увеличивая их способность разрушать опухоли. [2]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в ах есть также и аль являюсь а к ап ак с как в В из хорошо топор является тот нет бб до нашей эры др. быть парень Костли, Дэвид; Мак Юэн, Конор; Фоули, Колин; Макхейл, Энтони П.; Атчисон, Джордан; Номику, Николица; Каллан, Джон Ф. (17 февраля 2015 г.). «Лечение рака сонодинамической терапией: обзор» . Международный журнал гипертермии . 31 (2): 107–117. дои : 10.3109/02656736.2014.992484 . ISSN 0265-6736 . ПМИД 25582025 . S2CID 23665143 .
- ^ Перейти обратно: а б с д и ж г час я дж к Линь; Чжэн, Сюли; Ван, Пэнфэй (15 октября 2021 г.). Син, Сюэцзянь; Сюй, Тин; Чжан , терапия» . Обзоры координационной химии . 445 : 214087. doi : 10.1016/j.ccr.2021.214087 . ISSN 0010-8545 .
- ^ Перейти обратно: а б с д и ж г час я дж к л Гэн, Чи; Чжан, Юньлун; Хидру, Тесфальдет Хабтемариам; Чжи, Ляньюнь; Тао, Мэнсин; Цзоу, Лейксин; Чен, Чен; Ли, Хуэйхуа; Лю, Ин (15 августа 2018 г.). «Сонодинамическая терапия: потенциальное лечение атеросклероза» . Науки о жизни . 207 : 304–313. дои : 10.1016/j.lfs.2018.06.018 . ISSN 0024-3205 . ПМИД 29940244 . S2CID 49404799 .
- ^ Перейти обратно: а б с Цзян, Юнсин; Ли, Юн; Ван, Юаньци; Ван, Мэнцзяо; Ли, Цяньнань; Ван, Хуэй; Ван, Ли; Бичэн; Сунь, Фэнъюй; Чжан, Чжиго; Ли, Кан; Йе (15 февраля 2021 г.) «Быстрое уменьшение воспаления бляшек с помощью сонодинамической терапии у пациентов с симптоматическим заболеванием бедренно-подколенной периферической артерии: рандомизированное контролируемое исследование» . " . Международный журнал кардиологии . 325 : 132–139. : 10.1016 /j.ijcard.2020.09.035 . ISSN 0167-5273 . PMID 32966832. S2CID doi 221884358 .
- ^ Перейти обратно: а б с Ван, Ю; Ван, Вэй; Сюй, Хаобо; Сунь, Ян; Сунь, Цзин; Цзян, Юнсин; Яо, Цзяньтин; Тиан, Йе (2017). «Нелетальная сонодинамическая терапия ингибирует прогрессирование атеросклеротических бляшек у мышей ApoE-/- и ослабляет опосредованное ox-LDL повреждение макрофагов путем индуцирования гем-оксигеназы-1» . Клеточная физиология и биохимия . 41 (6): 2432–2446. дои : 10.1159/000475913 . ISSN 1015-8987 . ПМИД 28468003 . S2CID 32744546 .
- ^ Перейти обратно: а б с д и Браунинг, Ричард Дж.; Способен, Сара; Руан, Цзя-Лин; Бау, Лука; Аллен, Филип Д.; Керсеманс, Верле; Уоллингтон, Шина; Кинчеш, Пол; Умный, Шон; Картсонаки, Кристиана; Камила, Суканта; Логан, Кейран; Тейлор, Марк А.; Макхейл, Энтони П.; Каллан, Джон Ф.; Страйд, Элеонора; Валлис, Кэтрин А. (10 сентября 2021 г.). «Сочетание сонодинамической терапии с химиолучевой терапией в лечении рака поджелудочной железы» . Журнал контролируемого выпуска . 337 : 371–377. дои : 10.1016/j.jconrel.2021.07.020 . ISSN 0168-3659 . ПМИД 34274382 .
- ^ Перейти обратно: а б Фань, Чинг-Сян; Тинг, Чиен-Ю; Лю, Хао-Ли; Хуан, Чиунг-Инь; Се, Хан-И; Йен, Цзы-Чен; Вэй, Го-Чен; Да, Чи-Куанг (1 марта 2013 г.). «Микропузырьки с лекарственными препаратами, направленные на антиангиогенное воздействие, в сочетании с фокусированным ультразвуком для лечения глиомы» . Биоматериалы . 34 (8): 2142–2155. doi : 10.1016/j.bimaterials.2012.11.048 . ISSN 0142-9612 . ПМИД 23246066 .
- ^ Перейти обратно: а б Хади, Марым Мохаммад; Несбитт, Хизер; Масуд, Хамза; Шишоне, Фабиола; Патель, Шив; Рамеш, Бала С.; Эмбертон, Марк; Каллан, Джон Ф.; МакРоберт, Александр; Макхейл, Энтони П.; Номику, Николица (10 января 2021 г.). «Исследование эффективности новой чувствительной к pH и катепсину B наночастицы, реагирующей на стимулы, для оптимизации сонодинамической терапии при раке простаты» . Журнал контролируемого выпуска . 329 : 76–86. дои : 10.1016/j.jconrel.2020.11.040 . ISSN 0168-3659 . ПМЦ 8551370 . ПМИД 33245955 .
- ^ Перейти обратно: а б Макхейл, Энтони П.; Каллан, Джон Ф.; Номику, Николица; Фоули, Колин; Каллан, Бриджен (2016). «Сонодинамическая терапия: концепция, механизм и применение в лечении рака». Терапевтический ультразвук . Достижения экспериментальной медицины и биологии. Том. 880. стр. 429–450. дои : 10.1007/978-3-319-22536-4_22 . ISBN 978-3-319-22535-7 . ПМИД 26486350 .
- ^ Перейти обратно: а б Пан, Сюэтин; Ван, Хунъюй; Ван, Шуньхао; Сунь, Сяо; Ван, Линцзюань; Ван, Вэйвэй; Шен, Хэюн; Лю, Хуэйю (1 апреля 2018 г.). «Сонодинамическая терапия (SDT): новая стратегия нанотераностики рака» . Наука Китай Науки о жизни . 61 (4): 415–426. дои : 10.1007/s11427-017-9262-x . ISSN 1869-1889 . ПМИД 29666990 . S2CID 4937368 .
- ^ Перейти обратно: а б Сунь, Шэнцзе; У, Мэйин (1 января 2021 г.). «Сонодинамическая терапия: еще один «свет» в лечении опухолей экзогенными раздражителями» . Умные материалы в медицине . 2 : 145–149. дои : 10.1016/j.smaim.2021.05.001 . ISSN 2590-1834 . S2CID 236730960 .
- ^ Перейти обратно: а б с д Тачибана, Кацуро; Ферил, Лорето Б.; Икеда-Данцудзи, Юрика (1 августа 2008 г.). «Сонодинамическая терапия» . Ультразвук . 48 (4): 253–259. дои : 10.1016/j.ultras.2008.02.003 . ISSN 0041-624X . ПМИД 18433819 .
- ^ Перейти обратно: а б с Ван, Го-Юнь; Лю, Ян; Чен, Бо-Вэй; Лю, Юань-Юань; Ван, Инь-Сун; Чжан, Нин (сентябрь 2016 г.). «Последние достижения сонодинамической терапии в лечении рака» . Биология и медицина рака . 13 (3): 325–338. дои : 10.20892/j.issn.2095-3941.2016.0068 . ISSN 2095-3941 . ПМК 5069838 . ПМИД 27807500 .
- ^ Перейти обратно: а б с д и ж Ван, Сяобин; Цзя, Яли; Ван, Пан; Лю, Куанхон; Чжэн, Хайронг (1 июля 2017 г.). «Современное состояние и будущие перспективы сонодинамической терапии в лечении глиомы» . Ультразвуковая сонохимия . 37 : 592–599. дои : 10.1016/j.ultsonch.2017.02.020 . ISSN 1350-4177 . ПМИД 28427672 .
- ^ Перейти обратно: а б Ву, Нэн; Фань, Чинг-Сян; Да, Чи-Куанг (2 марта 2022 г.). «Ультразвукоактивируемые наноматериалы для сонодинамической тераностики рака» . Открытие наркотиков сегодня . 27 (6): 1590–1603. дои : 10.1016/j.drudis.2022.02.025 . ISSN 1359-6446 . ПМИД 35247594 . S2CID 247244458 .
- ^ Перейти обратно: а б с Чжоу, Имин; Ван, Мэнсюань; Дай, Жифэй (30 июля 2020 г.). «Молекулярный дизайн и проблемы, связанные с сенсибилизаторами для сонодинамической терапии рака» . Границы химии материалов . 4 (8): 2223–2234. дои : 10.1039/D0QM00232A . ISSN 2052-1537 . S2CID 225442575 .
- ^ Перейти обратно: а б с Ямагучи, Тошихиро; Китахара, Сюдзи; Кусуда, Каори; Окамото, Джун; Хоризе, Юки; Масамунэ, Кен; Мурагаки, Ёсихиро (8 декабря 2021 г.). «Современный ландшафт сонодинамической терапии для лечения рака» . Раки . 13 (24): 6184. doi : 10.3390/cancers13246184 . ISSN 2072-6694 . ПМЦ 8699567 . ПМИД 34944804 .
- ^ Перейти обратно: а б с д и Дай, Чжи-Цзюнь; Ли, Ша; Гао, Цзе; Сюй, Сяо-На; Лу, Ван-Фэн; Линь, Шуай; Ван, Си-Цзин (1 марта 2013 г.). «Сонодинамическая терапия (SDT): новое лечение рака, основанное на липосомах-соносенсибилизаторах в качестве нового носителя лекарств» . Медицинские гипотезы . 80 (3): 300–302. дои : 10.1016/j.mehy.2012.12.009 . ISSN 0306-9877 . ПМИД 23294609 .
- ^ Перейти обратно: а б Мишик, Владимир; Рисс, Питер (25 января 2006 г.). «Свободнорадикальные промежуточные соединения в сонодинамической терапии» . Анналы Нью-Йоркской академии наук . 899 (1): 335–348. дои : 10.1111/j.1749-6632.2000.tb06198.x . ПМИД 10863551 . S2CID 13503189 .
- ^ Перейти обратно: а б с д и ж г час я Тецуши; Асано, Рюдзи; Ямасита, Сиракуса, Куроки, Масахидэ; Хачимине, Кен, Куроки, Ямада, Кинугаса , терапия рака с использованием нового производного порфирина, DCPH-P-Na(I), лишенного фоточувствительности» . Cancer Science . 98 (6): 916–920. doi : 10.1111/j.1349-7006.2007.00468.x . ISSN 1347-9032 ПМЦ 11159730 ПМИД 17419708 .
- ^ Перейти обратно: а б с д Умемура, Син-итиро; Юмита, Нагахико; Нисигаки, Рюитиро; Умемура, Косиро (сентябрь 1990 г.). «Механизм повреждения клеток ультразвуком в сочетании с гематопорфирином» . Японский журнал исследований рака . 81 (9): 962–966. дои : 10.1111/j.1349-7006.1990.tb02674.x . ПМЦ 5918111 . ПМИД 2172198 .
- ^ Хираока, Вакако; Хонда, Хидеми; Ферил, Лорето Б.; Кудо, Нобуки; Кондо, Такаси (1 сентября 2006 г.). «Сравнение сонодинамического эффекта и фотодинамического эффекта фотосенсибилизаторов на образование свободных радикалов и уничтожение клеток» . Ультразвуковая сонохимия . 13 (6): 535–542. дои : 10.1016/j.ultsonch.2005.10.001 . ISSN 1350-4177 . ПМИД 16325451 .
- ^ Миёси, Норио; Игараси, Такаси; Рисс, Питер (1 июля 2000 г.). «Доказательства против образования синглетного кислорода при сонолизе водных насыщенных кислородом растворов гематопорфирина и бенгальского розы: механизм сонодинамической терапии» . Ультразвуковая сонохимия . 7 (3): 121–124. дои : 10.1016/S1350-4177(99)00042-5 . ISSN 1350-4177 . ПМИД 10909730 .
- ^ Перейти обратно: а б с Ляо, Ай-Хо; Ли, Ин-Кай; Ли, Вэй-Джюнн; Ву, Мин-Фан; Лю, Хао-Ли; Куо, Минь-Лян (1 ноября 2012 г.). «Оценка эффективности доставки микропузырьков с лекарственными препаратами в раковые клетки с помощью ультразвуковой и биолюминесцентной визуализации» . Ультразвук в медицине и биологии . 38 (11): 1938–1948. doi : 10.1016/j.ultrasmedbio.2012.07.013 . ISSN 0301-5629 . ПМИД 22929655 .
- ^ Пикворт, MJW; Денди, ПП; Лейтон, Т.Г.; Уолтон, AJ (1 ноября 1988 г.). «Исследование кавитационных эффектов клинического ультразвука методом сонолюминесценции: 2. Пороги сонолюминесценции от терапевтического ультразвукового луча и влияние температуры и рабочего цикла» . Физика в медицине и биологии . 33 (11): 1249–1260. Бибкод : 1988PMB....33.1249P . дои : 10.1088/0031-9155/33/11/003 . ISSN 0031-9155 . S2CID 250766457 .
- ^ Саксена, ТК; Нюборг, WL (1 сентября 1970 г.). «Сонолюминесценция стабильной кавитации» . Журнал химической физики . 53 (5): 1722–1734. Бибкод : 1970ЖЧФ..53.1722С . дои : 10.1063/1.1674249 . ISSN 0021-9606 .
- ^ Гайтан, Д. Фелипе; Крам, Лоуренс А.; Черч, Чарльз К.; Рой, Рональд А. (1 июня 1992 г.). «Сонолюминесценция и динамика пузырьков для одиночного стабильного кавитационного пузыря» . Журнал Акустического общества Америки . 91 (6): 3166–3183. Бибкод : 1992ASAJ...91.3166G . дои : 10.1121/1.402855 . ISSN 0001-4966 . S2CID 122235287 .
- ^ Кессель, Дэвид; Ло, Джули; Джефферс, Рассел; Брайан Фаулкс, судья; Каин, Чарльз (1 июня 1995 г.). «Режимы фотодинамической и сонодинамической цитотоксичности» . Журнал фотохимии и фотобиологии B: Биология . 28 (3): 219–221. дои : 10.1016/1011-1344(94)07111-Z . ISSN 1011-1344 . ПМИД 7623187 .
- ^ Юмита, Нагахико; Ивасе, Юмико; Ниши, Кодзи; Икеда, Тошихико; Умемура, Син-Ичиро; Саката, Исао; Момосе, Ясунори (1 июня 2010 г.). «Сонодинамически индуцированное повреждение клеток и перекисное окисление мембранных липидов новым производным порфирина, DCPH-P-Na (I)» . Противораковые исследования . 30 (6): 2241–2246. ISSN 0250-7005 . ПМИД 20651375 .
- ^ Перейти обратно: а б с д Хонда, Хидеми; Кондо, Такаси; Чжао, Цин-Ли; Ферил, Лорето Б; Китагава, Хироши (май 2004 г.). «Роль внутриклеточных ионов кальция и активных форм кислорода в апоптозе, индуцированном ультразвуком». Ультразвук в медицине и биологии . 30 (5): 683–692. doi : 10.1016/j.ultrasmedbio.2004.02.008 . ПМИД 15183235 .
- ^ Перейти обратно: а б с д и ж Гун, Чжуоран; Дай, Жифэй (12 марта 2021 г.). «Проектирование и проблемы системы сонодинамической терапии для тераностики рака: от оборудования до сенсибилизаторов» . Передовая наука . 8 (10): 2002178. doi : 10.1002/advs.202002178 . ISSN 2198-3844 . ПМЦ 8132157 . ПМИД 34026428 .
- ^ Араужо Мартинс, Юго; Зеферино Паван, Тео; Фонсека Вианна Лопес, Рената (15 декабря 2021 г.). «Сонодинамическая терапия: параметры ультразвука и экспериментальные конфигурации in vitro» . Международный фармацевтический журнал . 610 : 121243. doi : 10.1016/j.ijpharm.2021.121243 . ISSN 0378-5173 . ПМИД 34743959 . S2CID 240248013 .
- ^ Сузуки, Норио; Окада, Кёдзи; Чида, Шуичи; Комори, Чиё; Симада, Ёичи; Сузуки, Тошио (2007). «Противоопухолевое действие акридинового оранжевого при ультразвуковом облучении in vitro». Противораковые исследования . 27 (6Б): 4179–4184. ПМИД 18225589 .
- ^ Комори, Чиё; Окада, Кёдзи; Кавамура, Коичи; Чида, Шуичи; Сузуки, Тошио (2009). «Сонодинамический противоопухолевый эффект метиленового синего на клетки саркомы 180 in vitro». Противораковые исследования . 29 (6): 2411–2415. ПМИД 19528509 .
- ^ Ваксман, Рон; Макьюэн, Полин Э.; Мур, Трэвис И.; Пакала, Раджбабу; Колоджи, Фрэнк Д.; Хеллинга, Дэвид Г.; Сиброн, Руфус К.; Рыхновский, Стивен Дж.; Васек, Джеффри; Скотт, Роберт В.; Вирмани, Рену (16 сентября 2008 г.). «Фотодинамическая терапия PhotoPoint способствует стабилизации атеросклеротических бляшек и подавляет прогрессирование бляшек» . Журнал Американского колледжа кардиологов . 52 (12): 1024–1032. дои : 10.1016/j.jacc.2008.06.023 . ПМИД 18786486 .
- ^ Перейти обратно: а б Номику, Николица; Стерретт, Кристина; Артур, Сиара; Маккоган, Бриджен; Каллан, Джон Ф.; Макхейл, Энтони П. (август 2012 г.). «Воздействие ультразвука и света на опухолевые клетки и ткани, обработанные индоцианином-зеленым» . ХимМедХим . 7 (8): 1465–1471. дои : 10.1002/cmdc.201200233 . ПМИД 22715137 . S2CID 28851902 .
- ^ Франко, Марина Сантьяго; Гомес, Элиза Роша; Роке, Марджори Коимбра; Оливейра, Моника Кристина (2021). «Вызванное высвобождение лекарств из липосом: использование внешней и внутренней среды опухоли» . Границы онкологии . 11 : 623760. doi : 10.3389/fonc.2021.623760 . ISSN 2234-943X . ПМЦ 8008067 . ПМИД 33796461 .
- ^ Перейти обратно: а б с д и Боццуто, Джузеппина; Молинари, Аньезе (2 февраля 2015 г.). «Липосомы как наномедицинские устройства» . Международный журнал наномедицины . 10 : 975–999. дои : 10.2147/IJN.S68861 . ISSN 1176-9114 . ПМЦ 4324542 . ПМИД 25678787 .
- ^ Перейти обратно: а б с Чен, Хуацин; Лю, Ланлан; Ма, Айцин; Инь, Тин; Чен, Цзе; Лян, Жуйцзин; Цю, Южи; Чжэн, Минбин; Цай, Линтао (1 февраля 2021 г.). «Неинвазивная иммуногенная сонодинамическая терапия марганцево-протопорфириновыми липосомами против тройного негативного рака молочной железы» . Биоматериалы . 269 : 120639. doi : 10.1016/j.bimaterials.2020.120639 . ISSN 0142-9612 . ПМИД 33434714 . S2CID 231595969 .
- ^ Перейти обратно: а б с Лю, Ичэнь; Бай, Ляньмэй; Го, Кайли; Цзя, Яли; Чжан, Кун; Лю, Цюаньхун; Ван, Пан; Ван, Сяобин (9 июля 2019 г.). «Фокусированная ультразвуковая направленная доставка наносоносенсибилизаторов из гомогенных экзосом для усиленной сонодинамической терапии рака» . Тераностика . 9 (18): 5261–5281. дои : 10.7150/thno.33183 . ISSN 1838-7640 . ПМК 6691590 . ПМИД 31410214 .
- ^ Перейти обратно: а б Лян, Юцзе; Дуань, Ли; Лу, Цзяньпин; Ся, Цзян (1 января 2021 г.). «Инженерия экзосом для адресной доставки лекарств» . Тераностика . 11 (7): 3183–3195. дои : 10.7150/thno.52570 . ISSN 1838-7640 . ПМЦ 7847680 . ПМИД 33537081 .
- ^ Перейти обратно: а б Патил, Суяш М.; Савант, Шрути С.; Кунда, Нитеш К. (1 сентября 2020 г.). «Экзосомы как системы доставки лекарств: краткий обзор и обновленная информация о ходе работы» . Европейский журнал фармацевтики и биофармацевтики . 154 : 259–269. дои : 10.1016/j.ejpb.2020.07.026 . ISSN 0939-6411 . ПМИД 32717385 . S2CID 220839948 .
- ^ Перейти обратно: а б Нгуен Цао, Туи Зианг; Кан, Джи Хи; Ты, Джэ Ён; Канг, Хан Чанг; Ри, Вон Чжон; Ко, Янг Тэг; Шим, Мин Сок (9 июня 2021 г.). «Безопасная и целенаправленная сонодинамическая терапия рака с использованием биосовместимых наносоносенсибилизаторов на основе экзосом» . Прикладные материалы и интерфейсы ACS . 13 (22): 25575–25588. дои : 10.1021/acsami.0c22883 . ISSN 1944-8244 . ПМИД 34033477 . S2CID 235204026 .
- ^ Перейти обратно: а б с д и Макьюэн, Конор; Фоули, Колин; Номику, Николица; Маккоган, Бриджен; Макхейл, Энтони П.; Каллан, Джон Ф. (16 декабря 2014 г.). «Полимерные микропузырьки как средства доставки сенсибилизаторов в сонодинамической терапии» . Ленгмюр . 30 (49): 14926–14930. дои : 10.1021/la503929c . ISSN 0743-7463 . ПМИД 25409533 .
- ^ Перейти обратно: а б Син, Линси; Ши, Цюшэн; Чжэн, Кайлян; Шен, Мин; Ма, Цзин; Ли, Фан; Лю, Ян; Линь, Личжоу; Ту, Вэньчжи; Дуань, Юронг; Ду, Ляньфан (2016). «Разрушение микропузырьков с помощью ультразвука (UMMD) облегчает доставку наночастиц mPEG-PLGA-PLL, нацеленных на CA19-9 и нагруженных паклитакселом, при раке поджелудочной железы» . Тераностика . 6 (10): 1573–1587. дои : 10.7150/thno.15164 . ПМЦ 4955056 . ПМИД 27446491 .
- ^ Перейти обратно: а б с Макьюэн, Конор; Оуэн, Джошуа; Страйд, Элеонора; Фоули, Колин; Несбитт, Хизер; Кокрейн, Дэвид; Куссиос, Константин. С.; Борден, М.; Номику, Николица; Макхейл, Энтони П.; Каллан, Джон Ф. (10 апреля 2015 г.). «Кислородоносные микропузырьки для усиленной сонодинамической терапии гипоксических опухолей» . Журнал контролируемого выпуска . 203 : 51–56. дои : 10.1016/j.jconrel.2015.02.004 . ISSN 0168-3659 . ПМИД 25660073 .
- ^ Линь, Сяхуэй; Цю, Юань; Сун, Лян; Чен, Шан; Чен, Сяофэн; Хуан, Гуомин; Сон, Джибин; Чен, Сяоюань; Ян, Хуанхао (23 апреля 2019 г.). «Ультразвуковая активация липосом для улучшения ультразвуковой визуализации и синергетической газовой и сонодинамической терапии рака» . Наномасштабные горизонты . 4 (3): 747–756. Бибкод : 2019NanoH...4..747L . дои : 10.1039/C8NH00340H . ISSN 2055-6764 . S2CID 104403902 .
- ^ Перейти обратно: а б Несбитт, Хизер; Шэн, Инцзе; Камила, Суканта; Логан, Кейран; Томас, Кейт; Каллан, Бриджен; Тейлор, Марк А.; С любовью, Марк; О'Рурк, Деклан; Келли, Пол; Бегин, Эстель; Страйд, Элеонора; Макхейл, Энтони П.; Каллан, Джон Ф. (10 июня 2018 г.). «Микропузырьки с гемцитабином для таргетной химиосонодинамической терапии рака поджелудочной железы» . Журнал контролируемого выпуска . 279 : 8–16. дои : 10.1016/j.jconrel.2018.04.018 . ISSN 0168-3659 . ПМИД 29653222 . S2CID 4929495 .
- ^ Шен, ЗП; Брейман, А.А.; Чен, Л; Мяо, Швейцария (август 2008 г.). «Ультразвук с микропузырьками усиливает экспрессию генов плазмидной ДНК в печени посредством внутрипортальной доставки» . Генная терапия . 15 (16): 1147–1155. дои : 10.1038/gt.2008.51 . ПМЦ 3747825 . ПМИД 18385766 .
- ^ Перейти обратно: а б с д и ж Ниттаячарн, Пинунта; Абенохар, Эрик; Ла Деда, Массимо; Риккарди, Лоредана; Странджи, Джузеппе; Экснер, Агата А. (6 марта 2021 г.). «Перфторпропановые нанопузырьки с комплексной нагрузкой иридия (III) для усиленной сонодинамической терапии» . Биоконъюгатная химия . 33 (6): 1057–1068. doi : 10.1021/acs.bioconjchem.1c00082 . ISSN 1043-1802 . ПМЦ 10108504 . ПМИД 33677967 . S2CID 232143610 .
- ^ Перера, Решани Х.; де Леон, Ал; Ван, Синьнин; Ван, Ю; Рамамурти, Гопал; Пейрис, Пубуду; Абенохар, Эрик; Базилион, Джеймс П.; Экснер, Агата А. (1 августа 2020 г.). «Ультразвуковая молекулярная визуализация рака простаты в реальном времени с использованием нанопузырьков, нацеленных на ПСМА» . Наномедицина: нанотехнологии, биология и медицина . 28 : 102213. дои : 10.1016/j.nano.2020.102213 . ISSN 1549-9634 . ПМЦ 7605099 . PMID 32348874 .
- ^ Перейти обратно: а б с д и Оуэн, Джошуа; Логан, Кейран; Несбитт, Хизер; Способен, Сара; Васильева, Александра; Блюмке, Эмма; Керсеманс, Верле; Умный, Шон; Валлис, Кэтрин А.; Макхейл, Энтони П.; Каллан, Джон Ф.; Страйд, Элеонора (февраль 2022 г.). «Перорально вводимые кислородные нанопузырьки усиливают реакцию опухоли на сонодинамическую терапию» . Нано Селект . 3 (2): 394–401. дои : 10.1002/nano.202100038 . ISSN 2688-4011 . S2CID 237906086 .
- ^ Перейти обратно: а б Лю, Ичэнь; Ван, Пан; Лю, Цюаньхун; Ван, Сяобин (1 июля 2016 г.). «Синопорфирин натрия оказывает соно-фотодинамическое воздействие на рак молочной железы как in vitro, так и in vivo» . Ультразвуковая сонохимия . 31 : 437–448. дои : 10.1016/j.ultsonch.2016.01.038 . ISSN 1350-4177 . ПМИД 26964970 .
- ^ Перейти обратно: а б с д и Бора, Баллав М.; Какаччо, Джозеф; Дуррани, Фарух А.; Бшара, Виам; Туровски, Стивен Г.; Сперняк, Иосиф А.; Панди, Равиндра К. (11 декабря 2020 г.). «Сонодинамическая терапия в сочетании с фотодинамической терапией демонстрирует улучшение долгосрочного излечения опухоли головного мозга» . Научные отчеты . 10 (1): 21791. Бибкод : 2020NatSR..1021791B . дои : 10.1038/s41598-020-78153-0 . ISSN 2045-2322 . ПМЦ 7732989 . ПМИД 33311561 .
- ^ Перейти обратно: а б Хуан, Пин; Цянь, Сяоцинь; Чен, Ю; Ю, Луодан; Лин, Хан; Ван, Лиин; Чжу, Юфан; Ши, Цзяньлинь (25 января 2017 г.). «Инкапсулированные в металлопорфирин биоразлагаемые наносистемы для высокоэффективной сонодинамической терапии рака под контролем магнитно-резонансной томографии» . Журнал Американского химического общества . 139 (3): 1275–1284. дои : 10.1021/jacs.6b11846 . ISSN 0002-7863 . ПМИД 28024395 .
- ^ Перейти обратно: а б Линь, Сяонин; Хуан, Ронг; Хуан, Яньлинь; Ван, Кай; Ли, Хэн; Бао, Ихэн; Ву, Чаохуэй; Чжан, И; Тянь, Синьхуа; Ван, Сяоминь (5 марта 2021 г.). «Сонодинамическая терапия, усиленная наносоносенсибилизаторами, в сочетании с блокадой контрольных точек для иммунотерапии рака» . Международный журнал наномедицины . 16 : 1889–1899. дои : 10.2147/IJN.S290796 . ISSN 1176-9114 . ПМЦ 7943542 . ПМИД 33707944 .
- ^ Юэ, Венвэнь; Чен, Лян; Ю, Луодан; Чжоу, Банго; Инь, Хаохао; Рен, Вэйвэй; Лю, Чанг; Го, Лехан; Чжан, Ифэн; Сунь, Липин; Чжан, Кун; Сюй, Хусюн; Чен, Ю (2 мая 2019 г.). «Блокада контрольных точек и комбинация неинвазивной сонодинамической терапии, усиленной наносоносенсибилизатором, уменьшает рост опухоли и метастазы у мышей» . Природные коммуникации . 10 (1): 2025. Бибкод : 2019NatCo..10.2025Y . дои : 10.1038/s41467-019-09760-3 . ISSN 2041-1723 . ПМК 6497709 . ПМИД 31048681 .
- ^ Перейти обратно: а б с д Гао, Чжунсюзи; Чжэн, Цзиньхуа, Бинь; Ван, Хайся; Ли, Хайся; Цао, Вэньву (10 июля 2013 г.) . модель мыши с ксенотрансплантатом» . Cancer Letters . 335 (1): 93–99. doi : 10.1016/j.canlet.2013.02.006 . ISSN 0304-3835 . PMID 23402818 .
- ^ Цюй, Фэй; Ван, Пан; Чжан, Кун; Ши, Инь; Ли, Исян; Ли, Чэнгрен; Лу, Джунхан; Лю, Цюаньхун; Ван, Сяобин (2 августа 2020 г.). «Управление митофагией с помощью наносенсибилизатора «Все в одном» усиливает сонодинамическую терапию глиомы» . Аутофагия . 16 (8): 1413–1435. дои : 10.1080/15548627.2019.1687210 . ПМЦ 7480814 . ПМИД 31674265 .
- ^ Перейти обратно: а б Вакс, Адриенн Г.; Винер, Эрик П. (22 января 2019 г.). «Лечение рака молочной железы: обзор» . ДЖАМА . 321 (3): 288–300. дои : 10.1001/jama.2018.19323 . ISSN 0098-7484 . ПМИД 30667505 . S2CID 58580711 .
- ^ Перейти обратно: а б Цзо, Шутинг; Чжан, Ян; Ван, Чжэньюй; Ван, Цзин (5 марта 2022 г.). «Мезопористая наноплатформа диоксида титана, нацеленная на митохондрии, для синергетической газосонодинамической терапии оксида азота при раке молочной железы» . Международный журнал наномедицины . 17 : 989–1002. дои : 10.2147/IJN.S348618 . ПМЦ 8906874 . ПМИД 35280333 .
- ^ Аламолхода, Махбубе; Мохтари-Дизаджи, Манидже (24 июня 2015 г.). «Оценка фракционированной и повторной сонодинамической терапии с использованием двойной частоты для мышиной модели аденокарциномы молочной железы» . Журнал терапевтического ультразвука . 3 (1): 10. дои : 10.1186/s40349-015-0031-x . ISSN 2050-5736 . ПМЦ 4484850 . ПМИД 26124951 .
- ^ Фэн, Цяньхуа; Ян, Сюэмэй; Хао, Ютун; Ван, Нин; Фэн, Сюэбин; Хоу, Лин; Чжан, Чжэньчжун (11 сентября 2019 г.). «Мембранно-биомиметическая наноплатформа раковых клеток для усовершенствованной сонодинамической терапии рака молочной железы посредством стратегии регуляции аутофагии» . Прикладные материалы и интерфейсы ACS . 11 (36): 32729–32738. дои : 10.1021/acsami.9b10948 . ISSN 1944-8244 . ПМИД 31415145 . S2CID 201019401 .
- ^ Хуан, Биин; Чен, Сидзе; Пей, Вэньцзин; Сюй, Ян; Цзян, Цзычао; Ню, Чэнчэн; Ван, Лонг (2020). «Кислородная наноплатформа для химиосонодинамической терапии гипоксических опухолей» . Границы в химии . 8 : 358. Бибкод : 2020FrCh....8..358H . дои : 10.3389/fchem.2020.00358 . ISSN 2296-2646 . ПМК 7199163 . ПМИД 32411675 .
- ^ Чжан, Нань; Тан, Ян; Ян, Ливэй; Чжан, Чуньян; Сюй, Мин; Го, Хуанлин; Чжуан, Боуэн; Чжоу, Луяо; Се, Сяоянь (6 августа 2020 г.). «Модуляция опухолевой гипоксии с помощью pH-чувствительных липосом для ингибирования митохондриального дыхания для усиления сонодинамической терапии» . Международный журнал наномедицины . 15 : 5687–5700. дои : 10.2147/IJN.S256038 . ISSN 1176-9114 . ПМЦ 7418152 . ПМИД 32821097 .
- ^ Аксель, Мехран; Бозкурт-Гирит, Озлем; Билгин, Мехмет Динсер (1 сентября 2020 г.). «Опосредованная феофорбидом а сонодинамическая, фотодинамическая и сонофотодинамическая терапия против рака простаты» . Фотодиагностика и фотодинамическая терапия . 31 : 101909. doi : 10.1016/j.pdpdt.2020.101909 . ISSN 1572-1000 . ПМИД 32619716 . S2CID 220336627 .
- ^ Перейти обратно: а б Эванс, Эндрю Дж. (январь 2018 г.). «Эффекты лечения рака простаты» . Современная патология . 31 (1): 110–121. дои : 10.1038/modpathol.2017.158 . ISSN 1530-0285 . ПМИД 29297495 . S2CID 21337740 .
- ^ Перейти обратно: а б с д Герц, Дэвид Э.; Тодорова, Маргарита; Мортазави, Омид; Агаче, Влад; Чен, Брэнсон; Каршафян, Раффи; Хюнюнен, Куллерво (20 декабря 2012 г.). «Противоопухолевые эффекты сочетания доцетаксела (таксотера) с противососудистым действием микропузырьков, стимулированных ультразвуком» . ПЛОС ОДИН . 7 (12): е52307. Бибкод : 2012PLoSO...752307G . дои : 10.1371/journal.pone.0052307 . ISSN 1932-6203 . ПМЦ 3527530 . ПМИД 23284980 .
- ^ Цзян, Юэцин; Коу, Цзяюань; Хан, Сяобо; Ли, Сюэсун; Чжун, Чжаоюй; Лю, Чжунни; Чжэн, Инхун; Тянь, Е; Ян, Известкование (2017). «АФК-зависимая активация аутофагии через путь PI3K/Akt/mTOR индуцируется А-сонодинамической терапией гидроксисафлора желтого в макрофагах THP-1» . Окислительная медицина и клеточное долголетие . 2017 : 1–16. дои : 10.1155/2017/8519169 . ПМК 5278230 . ПМИД 28191279 .
- ^ Чэн, Цзяли; Го, Шуюань; Чэнь, Хайбо; Ли, Цяньнань; Ван, Чжоу; Ван, Чжан; Чжигуо, Вэньву; Тянь, Йе (2013). «Влияние сонодинамической терапии, опосредованной 5-аминолевулиновой кислотой, на макрофаги журнал наномедицины . 8 669–676 Международный : . . » 1176-9114. PMC 3576038. . PMID 23426386 .
- ^ Дэн, Джухуа; Сунь, Синь; Ли, Ванлу; Чжан, Юн; Ли, Сюэсун; Сюй, Хаобо; Ли, Чжитао; Тянь, Чжэнь; Го, Шуюань; Яо, Цзяньтин; Гао, Вэйдун; Тиан, Е (1 июня 2015 г.). «Сонодинамическая терапия, опосредованная 5-аминолевулиновой кислотой, способствует фенотипическому переключению от дедифференцированного к дифференцированному фенотипу посредством активных форм кислорода и митоген-активируемой протеинкиназы p38 в сосудистых гладкомышечных клетках» . Ультразвук в медицине и биологии . 41 (6): 1681–1689. doi : 10.1016/j.ultrasmedbio.2014.12.664 . ISSN 0301-5629 . ПМИД 25796412 .
- ^ Юмита, Нагахико; Нисигаки, Рюитиро; Умемура, Косиро; Умемура, Син-итиро (март 1989 г.). «Гематопорфирин как сенсибилизатор клеточно-повреждающего действия ультразвука» . Японский журнал исследований рака . 80 (3): 219–222. дои : 10.1111/j.1349-7006.1989.tb02295.x . ПМЦ 5917717 . ПМИД 2470713 .
- ^ Омура, Тадахиро; Фукусима, Такео; Сибагути, Хиротомо; Ёсидзава, Шин; Иноуэ, Тору; Куроки, Масахидэ; Сасаки, Казунари; Умемура, Син-Ичиро (1 июля 2011 г.). «Сонодинамическая терапия с использованием 5-аминолевулиновой кислоты и фокусированного ультразвука при глубоко расположенной внутричерепной глиоме у крыс» . Противораковые исследования . 31 (7): 2527–2533. ISSN 0250-7005 . ПМИД 21873170 .
- ^ Перейти обратно: а б с Чжэн, Илинь; Е, Цзиньсян; Ли, Цзыин; Чен, Хайджун; Гао, Ю (август 2021 г.). «Последний прогресс в соно-фотодинамической терапии рака: от разработки новых сенсибилизаторов к стратегиям повышения эффективности на основе нанотехнологий» . Акта Фармацевтика Синика Б. 11 (8): 2197–2219. дои : 10.1016/j.apsb.2020.12.016 . ISSN 2211-3835 . ПМЦ 8424231 . ПМИД 34522584 .
- ^ Цой, Виктор; Раджора, Маниша А.; Чжэн, Банда (15 апреля 2020 г.). «Активация лекарств звуком: механизмы сонодинамической терапии и роль наномедицины» . Биоконъюгатная химия . 31 (4): 967–989. doi : 10.1021/acs.bioconjchem.0c00029 . ISSN 1043-1802 . ПМИД 32129984 . S2CID 212416405 .
- ^ Ченг, Даньлин; Ван, Сяоин; Чжоу, Сяоцзюнь; Ли, Цзинчао (2021). «Наносоносенсибилизаторы с генерацией активных форм кислорода, индуцированной ультразвуком, для сонодинамической иммунотерапии рака» . Границы биоинженерии и биотехнологии . 9 : 761218. дои : 10.3389/fbioe.2021.761218 . ISSN 2296-4185 . ПМЦ 8514668 . ПМИД 34660560 .
- ^ Льюис, Томас Дж.; Митчелл, Дуг (июнь 2008 г.). «Туморицидный эффект сонодинамической терапии (SDT) на саркому S-180 у мышей» . Интегративная терапия рака . 7 (2): 96–102. дои : 10.1177/1534735408319065 . ISSN 1534-7354 . ПМИД 18550890 . S2CID 22303568 .
- ^ Инуи, Тосио; Макита, Каори; Миура, Хирона; Мацуда, Акико; Кучиике, Дайсуке; Кубо, Кентаро; Метте, Мартин; Уто, Ёсихиро; Нисиката, Такахито; Хори, Хитоши; Сакамото, Норихиро (1 августа 2014 г.). «Отчет из клинического случая: пациентка с раком молочной железы, получавшая лечение GcMAF, сонодинамической терапией и гормональной терапией» . Противораковые исследования . 34 (8): 4589–4593. ISSN 0250-7005 . ПМИД 25075104 .




