Бензол
 Модель заполнения пространства | |||
| |||
 Benzene at room temperature | |||
| Names | |||
|---|---|---|---|
| Preferred IUPAC name Benzene[1] | |||
| Other names Benzol (historic/German) Phenane Phenylene hydride Cyclohexa-1,3,5-triene; 1,3,5-Cyclohexatriene (theoretical resonance isomers) [6]Annulene (not recommended[1]) Phene (historic) | |||
| Identifiers | |||
3D model (JSmol) | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.685 | ||
| EC Number |
| ||
| KEGG | |||
PubChem CID | |||
| RTECS number |
| ||
| UNII | |||
CompTox Dashboard (EPA) | |||
| Properties | |||
| C6H6 | |||
| Molar mass | 78.114 g·mol−1 | ||
| Appearance | Colorless liquid | ||
| Odor | sweet aromatic | ||
| Density | 0.8765(20) g/cm3[2] | ||
| Melting point | 5.53 °C (41.95 °F; 278.68 K) | ||
| Boiling point | 80.1 °C (176.2 °F; 353.2 K) | ||
| 1.53 g/L (0 °C) 1.81 g/L (9 °C) 1.79 g/L (15 °C)[3][4][5] 1.84 g/L (30 °C) 2.26 g/L (61 °C) 3.94 g/L (100 °C) 21.7 g/kg (200 °C, 6.5 MPa) 17.8 g/kg (200 °C, 40 MPa)[6] | |||
| Solubility | Soluble in alcohol, CHCl3, CCl4, diethyl ether, acetone, acetic acid[6] | ||
| Solubility in ethanediol | 5.83 g/100 g (20 °C) 6.61 g/100 g (40 °C) 7.61 g/100 g (60 °C)[6] | ||
| Solubility in ethanol | 20 °C, solution in ethanol: 1.2 mL/L (20% v/v)[7] | ||
| Solubility in acetone | 20 °C, solution in acetone: 7.69 mL/L (38.46% v/v) 49.4 mL/L (62.5% v/v)[7] | ||
| Solubility in diethylene glycol | 52 g/100 g (20 °C)[6] | ||
| log P | 2.13 | ||
| Vapor pressure | 12.7 kPa (25 °C) 24.4 kPa (40 °C) 181 kPa (100 °C)[8] | ||
| Conjugate acid | Benzenium[9] | ||
| Conjugate base | Benzenide[10] | ||
| UV-vis (λmax) | 255 nm | ||
| −54.8·10−6 cm3/mol | |||
Refractive index (nD) | 1.5011 (20 °C) 1.4948 (30 °C)[6] | ||
| Viscosity | 0.7528 cP (10 °C) 0.6076 cP (25 °C) 0.4965 cP (40 °C) 0.3075 cP (80 °C) | ||
| Structure | |||
| Trigonal planar | |||
| 0 D | |||
| Thermochemistry | |||
Heat capacity (C) | 134.8 J/mol·K | ||
Std molar entropy (S⦵298) | 173.26 J/mol·K[8] | ||
Std enthalpy of formation (ΔfH⦵298) | 48.7 kJ/mol | ||
Std enthalpy of combustion (ΔcH⦵298) | -3267.6 kJ/mol[8] | ||
| Hazards | |||
| Occupational safety and health (OHS/OSH): | |||
Main hazards | potential occupational carcinogen, flammable | ||
| GHS labelling: | |||
     [11] [11] | |||
| Danger | |||
| H225, H302, H304, H305, H315, H319, H340, H350, H372, H410[11] | |||
| P201, P210, P301+P310, P305+P351+P338, P308+P313, P331[11] | |||
| NFPA 704 (fire diamond) | |||
| Flash point | −11.63 °C (11.07 °F; 261.52 K) | ||
| 497.78 °C (928.00 °F; 770.93 K) | |||
| Explosive limits | 1.2–7.8% | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (median dose) | 930 mg/kg (rat, oral)[13] | ||
LCLo (lowest published) | 44,000 ppm (rabbit, 30 min) 44,923 ppm (dog) 52,308 ppm (cat) 20,000 ppm (human, 5 min)[14] | ||
| NIOSH (US health exposure limits): | |||
PEL (Permissible) | TWA 1 ppm, ST 5 ppm[12] | ||
REL (Recommended) | Ca TWA 0.1 ppm ST 1 ppm[12] | ||
IDLH (Immediate danger) | 500 ppm[12] | ||
| Safety data sheet (SDS) | HMDB | ||
| Related compounds | |||
Related compounds | Toluene Borazine | ||
| Supplementary data page | |||
| Benzene (data page) | |||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |||
Бензол – органическое химическое соединение с молекулярной формулой C 6 H 6 . бензола Молекула состоит из шести атомов углерода , соединенных в плоское шестиугольное кольцо по одному атому водорода , к каждому из которых присоединено . Поскольку он содержит только атомы углерода и водорода, бензол классифицируется как углеводород .
Бензол — природный компонент нефти и один из элементарных продуктов нефтехимии . Из-за циклических непрерывных пи-связей между атомами углерода бензол классифицируется как ароматический углеводород . Бензол — бесцветная и легковоспламеняющаяся жидкость со сладким запахом, частично ответственная за аромат бензина . Он используется в первую очередь в качестве прекурсора для производства химикатов с более сложной структурой, таких как этилбензол и кумол , миллиарды килограммов которых производятся ежегодно. Хотя бензол является основным промышленным химикатом , он находит ограниченное применение в потребительских товарах из-за своей токсичности. Бензол – летучее органическое соединение . [15]
Benzene is classified as a carcinogen. Its particular affects on human health, such as the long-term results of accidental exposure, has been reported on by news organizations such as The New York Times. For instance, a 2022 article stated that benzene contamination in the Boston metropolitan area caused hazardous conditions in multiple places, with the publication noting that the compound may eventually cause leukemia in some individuals.[16]
History
[edit]Discovery
[edit]The word "benzene" derives from "gum benzoin" (benzoin resin), an aromatic resin known since ancient times in Southeast Asia, and later to European pharmacists and perfumers in the 16th century via trade routes.[17] An acidic material was derived from benzoin by sublimation, and named "flowers of benzoin", or benzoic acid. The hydrocarbon derived from benzoic acid thus acquired the name benzin, benzol, or benzene.[18] Michael Faraday first isolated and identified benzene in 1825 from the oily residue derived from the production of illuminating gas, giving it the name bicarburet of hydrogen.[19][20] In 1833, Eilhard Mitscherlich produced it by distilling benzoic acid (from gum benzoin) and lime. He gave the compound the name benzin.[21] In 1836, the French chemist Auguste Laurent named the substance "phène";[22] this word has become the root of the English word "phenol", which is hydroxylated benzene, and "phenyl", the radical formed by abstraction of a hydrogen atom from benzene.
In 1845, Charles Blachford Mansfield, working under August Wilhelm von Hofmann, isolated benzene from coal tar.[23] Four years later, Mansfield began the first industrial-scale production of benzene, based on the coal-tar method.[24][25] Gradually, the sense developed among chemists that a number of substances were chemically related to benzene, comprising a diverse chemical family. In 1855, Hofmann was the first to apply the word "aromatic" to designate this family relationship, after a characteristic property of many of its members.[26] In 1997, benzene was detected in deep space.[27]
Ring formula
[edit]| Historic proposals of benzene structures | |||||
|---|---|---|---|---|---|
 |  | 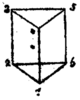 | |||
| By Adolf Karl Ludwig Claus (1867)[28] | By James Dewar (1869)[29] | By Albert Ladenburg (1869)[30] | |||
 | |||||
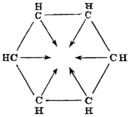
| By August Kekulé (1865/1872)[31][32] | |||||
 |  |  | |||
| By Henry Edward Armstrong (1887)[33][34] | By Adolf von Baeyer (1888)[35] | By Friedrich Karl Johannes Thiele (1899)[36] | |||
The empirical formula for benzene was long known, but its highly polyunsaturated structure, with just one hydrogen atom for each carbon atom, was challenging to determine. Archibald Scott Couper in 1858 and Johann Josef Loschmidt in 1861[37] suggested possible structures that contained multiple double bonds or multiple rings, but in these years very little was known about aromatic chemistry, and so chemists were unable to adduce appropriate evidence to favor any particular formula.
But many chemists had begun to work on aromatic substances, especially in Germany, and relevant data was coming fast. In 1865, the German chemist Friedrich August Kekulé published a paper in French (for he was then teaching in Francophone Belgium) suggesting that the structure contained a ring of six carbon atoms with alternating single and double bonds. The next year he published a much longer paper in German on the same subject.[31][38] Kekulé used evidence that had accumulated in the intervening years—namely, that there always appeared to be only one isomer of any monoderivative of benzene, and that there always appeared to be exactly three isomers of every disubstituted derivative—now understood to correspond to the ortho, meta, and para patterns of arene substitution—to argue in support of his proposed structure.[39] Kekulé's symmetrical ring could explain these curious facts, as well as benzene's 1:1 carbon-hydrogen ratio.
- Kekulé's 1872 modification of his 1865 theory, illustrating rapid alternation of double bonds[note 1]
The new understanding of benzene, and hence of all aromatic compounds, proved to be so important for both pure and applied chemistry that in 1890 the German Chemical Society organized an elaborate appreciation in Kekulé's honor, celebrating the twenty-fifth anniversary of his first benzene paper. Here Kekulé spoke of the creation of the theory. He said that he had discovered the ring shape of the benzene molecule after having a reverie or day-dream of a snake biting its own tail (a symbol in ancient cultures known as the ouroboros).[40] This vision, he said, came to him after years of studying the nature of carbon-carbon bonds. This was seven years after he had solved the problem of how carbon atoms could bond to up to four other atoms at the same time. Curiously, a similar, humorous depiction of benzene had appeared in 1886 in a pamphlet entitled Berichte der Durstigen Chemischen Gesellschaft (Journal of the Thirsty Chemical Society), a parody of the Berichte der Deutschen Chemischen Gesellschaft, only the parody had monkeys seizing each other in a circle, rather than snakes as in Kekulé's anecdote.[41] Some historians have suggested that the parody was a lampoon of the snake anecdote, possibly already well known through oral transmission even if it had not yet appeared in print.[18] Kekulé's 1890 speech[42] in which this anecdote appeared has been translated into English.[43] If the anecdote is the memory of a real event, circumstances mentioned in the story suggest that it must have happened early in 1862.[44]
In 1929, the cyclic nature of benzene was finally confirmed by the crystallographer Kathleen Lonsdale using X-ray diffraction methods.[45][46] Using large crystals of hexamethylbenzene, a benzene derivative with the same core of six carbon atoms, Lonsdale obtained diffraction patterns. Through calculating more than thirty parameters, Lonsdale demonstrated that the benzene ring could not be anything but a flat hexagon, and provided accurate distances for all carbon-carbon bonds in the molecule.[47]
Nomenclature
[edit]The German chemist Wilhelm Körner suggested the prefixes ortho-, meta-, para- to distinguish di-substituted benzene derivatives in 1867; however, he did not use the prefixes to distinguish the relative positions of the substituents on a benzene ring.[48][49] It was the German chemist Carl Gräbe who, in 1869, first used the prefixes ortho-, meta-, para- to denote specific relative locations of the substituents on a di-substituted aromatic ring (viz, naphthalene).[50] In 1870, the German chemist Viktor Meyer first applied Gräbe's nomenclature to benzene.[51]
Early applications
[edit]In 1903, Ludwig Roselius popularized the use of benzene to decaffeinate coffee. This discovery led to the production of Sanka. This process was later discontinued. Benzene was historically used as a significant component in many consumer products such as liquid wrench, several paint strippers, rubber cements, spot removers, and other products. Manufacture of some of these benzene-containing formulations ceased in about 1950, although Liquid Wrench continued to contain significant amounts of benzene until the late 1970s.[52]
Occurrence
[edit]Trace amounts of benzene are found in petroleum and coal. It is a byproduct of the incomplete combustion of many materials. For commercial use, until World War II, much of benzene was obtained as a by-product of coke production (or "coke-oven light oil") for the steel industry. However, in the 1950s, increased demand for benzene, especially from the growing polymers industry, necessitated the production of benzene from petroleum. Today, most benzene comes from the petrochemical industry, with only a small fraction being produced from coal.[53] Benzene has been detected on Mars.[54][55][56]
Structure
[edit]
X-ray diffraction shows that all six carbon-carbon bonds in benzene are of the same length, at 140 picometres (pm).[57] The C–C bond lengths are greater than a double bond (135 pm) but shorter than a single bond (147 pm). This intermediate distance is caused by electron delocalization: the electrons for C=C bonding are distributed equally between each of the six carbon atoms. Benzene has 6 hydrogen atoms, fewer than the corresponding parent alkane, hexane, which has 14. Benzene and cyclohexane have a similar structure, only the ring of delocalized electrons and the loss of one hydrogen per carbon distinguishes it from cyclohexane. The molecule is planar.[58] The molecular orbital description involves the formation of three delocalized π orbitals spanning all six carbon atoms, while the valence bond description involves a superposition of resonance structures.[59][60][61][62] It is likely that this stability contributes to the peculiar molecular and chemical properties known as aromaticity. To reflect the delocalized nature of the bonding, benzene is often depicted with a circle inside a hexagonal arrangement of carbon atoms.
Derivatives of benzene occur sufficiently often as a component of organic molecules, so much so that the Unicode Consortium has allocated a symbol in the Miscellaneous Technical block with the code U+232C (⌬) to represent it with three double bonds,[63] and U+23E3 (⏣) for a delocalized version.[64]
Benzene derivatives
[edit]Many important chemical compounds are derived from benzene by replacing one or more of its hydrogen atoms with another functional group. Examples of simple benzene derivatives are phenol, toluene, and aniline, abbreviated PhOH, PhMe, and PhNH2, respectively. Linking benzene rings gives biphenyl, C6H5–C6H5. Further loss of hydrogen gives "fused" aromatic hydrocarbons, such as naphthalene, anthracene, phenanthrene, and pyrene. The limit of the fusion process is the hydrogen-free allotrope of carbon, graphite.
In heterocycles, carbon atoms in the benzene ring are replaced with other elements. The most important variations contain nitrogen. Replacing one CH with N gives the compound pyridine, C5H5N. Although benzene and pyridine are structurally related, benzene cannot be converted into pyridine. Replacement of a second CH bond with N gives, depending on the location of the second N, pyridazine, pyrimidine, or pyrazine.[65]
Production
[edit]Four chemical processes contribute to industrial benzene production: catalytic reforming, toluene hydrodealkylation, toluene disproportionation, and steam cracking etc. According to the ATSDR Toxicological Profile for benzene, between 1978 and 1981, catalytic reformates accounted for approximately 44–50% of the total U.S. benzene production.[53]
Catalytic reforming
[edit]In catalytic reforming, a mixture of hydrocarbons with boiling points between 60 and 200 °C is blended with hydrogen gas and then exposed to a bifunctional platinum chloride or rhenium chloride catalyst at 500–525 °C and pressures ranging from 8–50 atm. Under these conditions, aliphatic hydrocarbons form rings and lose hydrogen to become aromatic hydrocarbons. The aromatic products of the reaction are then separated from the reaction mixture (or reformate) by extraction with any one of a number of solvents, including diethylene glycol or sulfolane, and benzene is then separated from the other aromatics by distillation. The extraction step of aromatics from the reformate is designed to produce aromatics with lowest non-aromatic components. Recovery of the aromatics, commonly referred to as BTX (benzene, toluene and xylene isomers), involves such extraction and distillation steps.
In similar fashion to this catalytic reforming, UOP and BP commercialized a method from LPG (mainly propane and butane) to aromatics.
Toluene hydrodealkylation
[edit]толуола Гидродеалкилирование превращает толуол в бензол. В этом водородоемком процессе толуол смешивается с водородом, затем пропускается через хрома , молибдена или платины оксид при температуре 500–650 °C и давлении 20–60 атм. Иногда вместо катализатора используют более высокие температуры (при аналогичных условиях реакции). В этих условиях толуол подвергается деалкилированию до бензола и метана :
Эта необратимая реакция сопровождается равновесной побочной реакцией, в результате которой образуется бифенил (он же дифенил) при более высокой температуре:
- 2 С
66Ч
6 ⇌ Ч
2 + С
66Ч
5 –С
66Ч
5
Если поток сырья содержит много неароматических компонентов (парафинов или нафтенов), они, вероятно, разлагаются до низших углеводородов, таких как метан, что увеличивает потребление водорода.
Типичный выход реакции превышает 95%. Иногда ксилолы вместо толуола используются и более тяжелые ароматические соединения с аналогичной эффективностью.
Эту методику производства бензола часто называют «специальной» по сравнению с традиционными процессами экстракции БТХ (бензол-толуол-ксилол).
Диспропорционирование толуола
[ редактировать ]толуола Диспропорционирование ( TDP ) представляет собой превращение толуола в бензол и ксилол . [66]
Учитывая, что потребность в пара -ксилоле ( п -ксилоле усовершенствованный процесс TDP, называемый селективным TDP ) существенно превышает потребность в других изомерах ксилола, можно использовать (STDP). В этом процессе поток ксилола, выходящий из установки TDP, содержит примерно 90% п -ксилола. В некоторых системах даже соотношение бензола и ксилолов изменяется в пользу ксилолов.
Паровой крекинг
[ редактировать ]Паровой крекинг — процесс получения этилена и других алкенов из алифатических углеводородов . В зависимости от сырья, используемого для производства олефинов, паровой крекинг может привести к образованию богатого бензолом жидкого побочного продукта, называемого пиролизным бензином . Пиролизный бензин можно смешивать с другими углеводородами в качестве добавки к бензину или направлять в процесс экстракции для извлечения ароматических соединений БТХ (бензола, толуола и ксилолов).
Другие методы
[ редактировать ]Хотя это и не имеет коммерческого значения, существует множество других путей получения бензола. Фенол и галогенбензолы можно восстанавливать металлами. Бензойная кислота и ее соли подвергаются декарбоксилированию до бензола. Реакция соединения диазония, полученного из анилина, с гипофосфорной кислотой дает бензол. Алкинная тримеризация ацетилена дает бензол. Полное декарбоксилирование меллитовой кислоты дает бензол.
Использование
[ редактировать ]Бензол используется главным образом в качестве промежуточного продукта для производства других химических веществ, прежде всего этилбензола (и других алкилбензолов ), кумола , циклогексана и нитробензола . В 1988 году сообщалось, что две трети всех химических веществ в Американского химического общества содержали по крайней мере одно бензольное кольцо. списках [67] Более половины всего производимого бензола перерабатывается в этилбензол, предшественник стирола , который используется для производства полимеров и пластмасс, таких как полистирол . Около 20% производимого бензола используется для производства кумола, который необходим для производства фенола и ацетона для смол и клеев. Циклогексан потребляет около 10% мирового производства бензола; в основном он используется при производстве нейлоновых волокон, которые перерабатываются в текстиль и конструкционные пластмассы. Меньшие количества бензола используются для производства некоторых видов каучуков , смазочных материалов , красителей , моющих средств , лекарств , взрывчатых веществ и пестицидов . В 2013 году крупнейшей страной-потребителем бензола был Китай, за ним следовали США. Производство бензола в настоящее время расширяется на Ближнем Востоке и в Африке, тогда как производственные мощности в Западной Европе и Северной Америке находятся в стагнации. [68]
Толуол сейчас часто используется в качестве заменителя бензола, например, в качестве присадки к топливу. Свойства растворителя у этих двух веществ схожи, но толуол менее токсичен и имеет более широкий диапазон жидкостей. Толуол также перерабатывается в бензол. [69]

Компонент бензина
[ редактировать ]Являясь присадкой к бензину (бензину), бензол повышает октановое число и уменьшает детонацию . Как следствие, бензин часто содержал несколько процентов бензола до 1950-х годов, когда тетраэтилсвинец заменил его в качестве наиболее широко используемой антидетонационной присадки. С глобальным отказом от этилированного бензина в некоторых странах бензол снова стал использоваться в качестве добавки к бензину. В Соединенных Штатах обеспокоенность по поводу его негативного воздействия на здоровье и возможности попадания бензола в грунтовые воды привела к строгому регулированию содержания бензола в бензине, обычно с ограничениями на уровне около 1%. [70] Европейские спецификации бензина теперь содержат тот же предел содержания бензола в 1%. В 2011 году Агентство по охране окружающей среды США ввело новые правила, которые снизили содержание бензола в бензине до 0,62%. [71]
В некоторых европейских языках слово «нефть» или «бензин» является точным родственным словом «бензол». Например, в каталонском языке слово «бензина» может использоваться для обозначения бензина, хотя сейчас оно встречается относительно редко.
Реакции
[ редактировать ]Наиболее распространенные реакции бензола связаны с замещением протона другими группами. [72] Электрофильное ароматическое замещение является общим методом получения бензола. Бензол настолько нуклеофилен , что подвергается замещению ионами ацилия и алкилкарбокатионами с образованием замещенных производных.
Наиболее широко практикуемым примером этой реакции является этилирование бензола.
В 1999 году было произведено около 24 700 000 тонн. [73] Весьма поучительно, но имеет гораздо меньшее промышленное значение по Фриделю-Крафтсу алкилирование бензола (и многих других ароматических колец) с использованием алкилгалогенида в присутствии сильного катализатора - кислоты Льюиса. Точно так же ацилирование Фриделя-Крафтса является родственным примером электрофильного ароматического замещения . Реакция включает ацилирование бензола (или многих других ароматических колец) ацилхлоридом с использованием сильного на основе кислоты Льюиса, катализатора такого как хлорид алюминия или хлорид железа (III) .

Сульфирование, хлорирование, нитрование
[ редактировать ]С помощью электрофильного ароматического замещения в бензольный каркас вводятся многие функциональные группы. Сульфирование бензола предполагает использование олеума — смеси серной кислоты с триоксидом серы . Сульфированные производные бензола являются полезными моющими средствами . При нитровании бензол реагирует с ионами нитрония (NO 2 + ), который является сильным электрофилом, образующимся при соединении серной и азотной кислот. Нитробензол является предшественником анилина . Хлорирование осуществляется хлором с образованием хлорбензола в присутствии катализатора на основе кислоты Льюиса, такого как трихлорид алюминия.
гидрирование
[ редактировать ]Бензол и его производные путем гидрирования превращаются в циклогексан и производные. Эта реакция достигается за счет использования высокого давления водорода в присутствии гетерогенных катализаторов , например мелкодисперсного никеля . В то время как алкены могут гидрироваться при температуре около комнатной, бензол и родственные соединения являются более трудными субстратами, требующими температуры >100 °C. Эту реакцию практикуют в промышленных масштабах. В отсутствие катализатора бензол непроницаем для водорода. Гидрирование нельзя остановить, чтобы получить циклогексен или циклогексадиены, поскольку они являются превосходными субстратами. Восстановление Берча , некаталитический процесс, однако селективно гидрирует бензол до диена.
Металлические комплексы
[ редактировать ]Бензол является отличным лигандом в металлоорганической химии низковалентных металлов. Важными примерами являются сэндвич- и полусэндвич-комплексы соответственно Cr(C 6 H 6 ) 2 и [RuCl 2 (C 6 H 6 )] 2 .
Влияние на здоровье
[ редактировать ]
Бензол классифицируется как канцероген , который увеличивает риск развития рака и других заболеваний, а также является печально известной причиной недостаточности костного мозга . Значительное количество эпидемиологических, клинических и лабораторных данных связывает бензол с апластической анемией, острым лейкозом , аномалиями костного мозга и сердечно-сосудистыми заболеваниями. [74] [75] [76] Конкретные гематологические злокачественные новообразования, с которыми связан бензол, включают: острый миелоидный лейкоз (ОМЛ), апластическую анемию, миелодиспластический синдром (МДС), острый лимфобластный лейкоз (ОЛЛ) и хронический миелолейкоз (ХМЛ). [77]
Американский институт нефти (API) еще в 1948 году заявил, что «обычно считается, что единственная абсолютно безопасная концентрация бензола равна нулю». [78] Не существует безопасного уровня воздействия; даже небольшие количества могут причинить вред. [79] Министерство здравоохранения и социальных служб США (DHHS) классифицирует бензол как канцероген для человека. Длительное воздействие чрезмерного уровня бензола в воздухе вызывает лейкемию, потенциально смертельный рак органов кроветворения. В частности, острый миелоидный лейкоз или острый нелимфоцитарный лейкоз (ОМЛ и АНЛЛ). бензол вызывает [80] МАИР оценило бензол как «известный как канцерогенный для человека» ( Группа 1 ).
Поскольку бензол повсеместно присутствует в бензине и углеводородном топливе, которые используются повсеместно, воздействие бензола на человека является глобальной проблемой здравоохранения. Бензол воздействует на печень, почки, легкие, сердце и мозг и может вызывать ДНК разрывы цепей хромосом и повреждение , следовательно, является тератогенным и мутагенным . Бензол вызывает рак у животных, включая человека. Было показано, что бензол вызывает рак у обоих полов у нескольких видов лабораторных животных, подвергшихся воздействию различными путями. [81] [82]
Воздействие бензола
[ редактировать ]По данным Агентства по регистрации токсичных веществ и заболеваний (ATSDR) (2007), бензол является как синтетическим, так и естественным химическим веществом, возникающим в результате процессов, которые включают: извержения вулканов, лесные пожары, синтез химических веществ, таких как фенол , производство синтетических волокон , и производство каучуков , смазочных материалов , пестицидов , лекарств и красителей . Основными источниками воздействия бензола являются табачный дым, автосервисы, выхлопы автомобилей и промышленные выбросы; однако проглатывание и всасывание бензола через кожу могут также произойти при контакте с загрязненной водой. Бензол метаболизируется в печени и выводится с мочой . Измерение уровня бензола в воздухе и воде осуществляется путем сбора через трубки с активированным углем , которые затем анализируются с помощью газового хроматографа . Измерение бензола у людей может быть выполнено с помощью тестов мочи , крови и дыхания ; однако все они имеют свои ограничения, поскольку бензол быстро метаболизируется в организме человека. [83]
Воздействие бензола может постепенно привести к апластической анемии , лейкемии и множественной миеломе . [84]
OSHA регулирует уровень бензола на рабочем месте. [85] Максимально допустимое количество бензола в воздухе рабочих помещений при 8-часовом рабочем дне, 40-часовой рабочей неделе составляет 1 ppm. Поскольку бензол может вызвать рак , NIOSH рекомендует всем работникам носить специальное дыхательное оборудование , если они могут подвергнуться воздействию бензола в концентрациях, превышающих рекомендуемый (8-часовой) предел воздействия в 0,1 частей на миллион. [86]
Пределы воздействия бензола
[ редактировать ]Агентство по охране окружающей среды США установило максимальный уровень загрязнения бензола в питьевой воде на уровне 0,0005 мг/л (5 частей на миллиард), как это предусмотрено Национальными правилами США по первичной питьевой воде. [87] Эта регуляция основана на предотвращении бензольного лейкемогенеза . Цель по максимальному уровню загрязнения ( MCLG ), не имеющая принудительного исполнения цель для здоровья, которая обеспечивает адекватный запас безопасности для предотвращения неблагоприятных последствий, — это нулевая концентрация бензола в питьевой воде. Агентство по охране окружающей среды требует сообщать о разливах или случайных выбросах в окружающую среду 10 фунтов (4,5 кг) или более бензола.
США Управление по охране труда (OSHA) установило допустимый предел воздействия в размере 1 части бензола на миллион частей воздуха (1 ppm) на рабочем месте в течение 8-часового рабочего дня и 40-часовой рабочей недели. Кратковременный предел воздействия бензола в воздухе составляет 5 частей на миллион в течение 15 минут. [88] Эти правовые ограничения были основаны на исследованиях, демонстрирующих убедительные доказательства риска для здоровья работников, подвергающихся воздействию бензола. Риск воздействия 1 ppm в течение всей трудовой жизни оценивается как 5 дополнительных случаев смерти от лейкемии на 1000 подвергшихся воздействию работников. (Эта оценка предполагает отсутствие порога канцерогенного воздействия бензола.) OSHA также установило уровень действия 0,5 частей на миллион, чтобы стимулировать еще более низкое воздействие на рабочем месте. [89]
США Национальный институт безопасности и гигиены труда (NIOSH) изменил непосредственно опасную для жизни и здоровья концентрацию бензола, (IDLH), до 500 частей на миллион. Текущее определение NIOSH состояния IDLH, приведенное в Логике выбора респиратора NIOSH, представляет собой такое определение, которое представляет угрозу воздействия переносимых по воздуху загрязнителей, когда это воздействие может привести к смерти или немедленным или отсроченным постоянным неблагоприятным последствиям для здоровья или предотвратить побег от таких загрязнителей. окружающая среда. [90] Целью установления значения IDLH является (1) обеспечение того, чтобы работник мог покинуть данную загрязненную среду в случае отказа средств защиты органов дыхания и (2) считается максимальным уровнем, выше которого может работать только высоконадежный дыхательный аппарат. допускается обеспечение максимальной защиты работников. [90] [91] В сентябре 1995 года NIOSH опубликовал новую политику разработки рекомендуемых пределов воздействия (REL) для веществ, включая канцерогены. Поскольку бензол может вызвать рак, NIOSH рекомендует всем работникам носить специальное дыхательное оборудование, когда они могут подвергнуться воздействию бензола на уровнях, превышающих REL (10-часовой) в 0,1 ppm. [92] Предел кратковременного воздействия NIOSH (STEL – 15 мин) составляет 1 ppm.
Американская конференция правительственных специалистов по промышленной гигиене (ACGIH) приняла пороговые предельные значения (TLV) для бензола при 0,5 ppm TWA и 2,5 ppm STEL. [88]
Токсикология
[ редактировать ]Биомаркеры воздействия
[ редактировать ]Несколько тестов могут определить воздействие бензола. Сам бензол можно измерить в выдыхаемом воздухе, крови или моче, но такое тестирование обычно ограничивается первыми 24 часами после воздействия из-за относительно быстрого удаления химического вещества путем выдыхания или биотрансформации. Большинство людей в развитых странах имеют в крови измеримые базовые уровни бензола и других ароматических нефтяных углеводородов. В организме бензол ферментативно превращается в ряд продуктов окисления, включая муконовую кислоту , фенилмеркаптуровую кислоту , фенол , катехол , гидрохинон и 1,2,4-тригидроксибензол . Большинство этих метаболитов имеют определенную ценность в качестве биомаркеров воздействия на человека, поскольку они накапливаются в моче пропорционально степени и продолжительности воздействия и могут все еще присутствовать в течение нескольких дней после прекращения воздействия. Текущие пределы биологического воздействия ACGIH для профессионального воздействия составляют 500 мкг/г креатинина для муконовой кислоты и 25 мкг/г креатинина для фенилмеркаптуровой кислоты в образце мочи в конце смены. [93] [94] [95] [96]
Биотрансформации
[ редактировать ]Даже если бензол не является обычным субстратом метаболизма, он может окисляться как бактериями , так и эукариотами . У бактерий фермент диоксигеназа может добавлять кислород к кольцу, и нестабильный продукт немедленно восстанавливается ( НАДН ) до циклического диола с двумя двойными связями, разрушая ароматичность. Затем диол вновь восстанавливается НАДН до катехола . Затем катехол метаболизируется до ацетил-КоА и сукцинил-КоА , которые используются организмами в основном в цикле лимонной кислоты для производства энергии.
Путь метаболизма бензола сложен и начинается в печени. В этом участвуют несколько ферментов. К ним относятся цитохром P450 2E1 (CYP2E1), хининоксидоредуктаза (NQ01 или DT-диафораза или НАД(P)H-дегидрогеназа (хинон 1) ), GSH и миелопероксидаза (МПО). CYP2E1 участвует в нескольких этапах: превращении бензола в оксепин (оксид бензола), фенола в гидрохинон и гидрохинона в бензолтриол и катехол . Гидрохинон, бензолтриол и катехол превращаются в полифенолы. В костном мозге МПО превращает эти полифенолы в бензохиноны. Эти промежуточные соединения и метаболиты вызывают генотоксичность за счет множества механизмов, включая ингибирование топоизомеразы II (которая поддерживает структуру хромосом), разрушение микротрубочек (которые поддерживают клеточную структуру и организацию), образование свободных радикалов кислорода (нестабильных видов), которые могут привести к точечным мутациям, увеличению окислительный стресс, вызывающий разрывы цепей ДНК и изменяющий метилирование ДНК (что может повлиять на экспрессию генов). NQ01 и GSH уводят метаболизм от токсичности. NQ01 метаболизирует бензохинон по отношению к полифенолам (противодействуя эффекту МПО). GSH участвует в образовании фенилмеркаптуровой кислоты . [77] [97]
Генетический полиморфизм этих ферментов может вызывать потерю или усиление функции. Например, мутации CYP2E1 повышают активность и приводят к увеличению образования токсичных метаболитов. Мутации NQ01 приводят к потере функции и могут привести к снижению детоксикации. Мутации миелопероксидазы приводят к потере функции и могут привести к снижению образования токсичных метаболитов. Мутации или делеции GSH приводят к потере функции и снижению детоксикации. Эти гены могут быть мишенью генетического скрининга на восприимчивость к токсичности бензола. [98]
Молекулярная токсикология
[ редактировать ]Парадигма токсикологической оценки бензола смещается в сторону молекулярной токсикологии, поскольку она позволяет лучше понять фундаментальные биологические механизмы. Глутатион, по-видимому, играет важную роль, защищая от разрывов ДНК, вызванных бензолом, и его идентифицируют как новый биомаркер воздействия и эффекта. [99] Бензол вызывает хромосомные аберрации в лейкоцитах периферической крови и костном мозге, что объясняет более высокую заболеваемость лейкемией и множественной миеломой, вызванными хроническим воздействием. Эти отклонения можно отслеживать с помощью флуоресцентной гибридизации in situ (FISH) с ДНК-зондами для оценки воздействия бензола наряду с гематологическими тестами в качестве маркеров гематотоксичности. [100] В метаболизме бензола участвуют ферменты, кодируемые полиморфными генами. Исследования показали, что генотип этих локусов может влиять на восприимчивость к токсическому воздействию бензола. У лиц, несущих вариант NAD(P)H:хиноноксидоредуктазы 1 (NQO1), микросомальной эпоксидгидролазы (EPHX) и делеции глутатион S-трансферазы T1 (GSTT1), наблюдалась более высокая частота одноцепочечных разрывов ДНК. [101]
Биологическое окисление и канцерогенная активность
[ редактировать ]Один из способов понять канцерогенное действие бензола — изучить продукты биологического окисления. Чистый бензол, например, окисляется в организме с образованием эпоксида, оксида бензола , который нелегко выводится из организма и может взаимодействовать с ДНК, вызывая вредные мутации.
Пути воздействия
[ редактировать ]Вдыхание
[ редактировать ]Наружный воздух может содержать небольшое количество бензола от автозаправочных станций, древесного дыма, табачного дыма, перекачиваемого бензина, выхлопных газов автомобилей и промышленных выбросов. [102] Около 50% всего воздействия бензола по всей стране (США) является результатом курения табака или воздействия табачного дыма. [103] Выкуривая 32 сигареты в день, курильщик потребляет около 1,8 миллиграммов (мг) бензола. Это количество примерно в 10 раз превышает среднесуточное потребление бензола некурящими. [104]
Вдыхаемый бензол в основном выводится в неизмененном виде при выдохе. В исследовании на людях от 16,4 до 41,6% задержанного бензола выводилось через легкие в течение пяти-семи часов после двух-трехчасового воздействия 47-110 частей на миллион, и только от 0,07 до 0,2% оставшегося бензола выводилось в неизмененном виде через легкие. моча. После воздействия от 63 до 405 мг/м 3 бензола в течение 1–5 часов, от 51 до 87% выводится с мочой в виде фенола в течение периода от 23 до 50 часов. В другом исследовании на людях 30% абсорбированного бензола, нанесенного на кожу, который в первую очередь метаболизируется в печени, выводилось в виде фенола с мочой. [105]
Воздействие безалкогольных напитков
[ редактировать ]В определенных условиях и в присутствии других химических веществ бензойная кислота (консервант) и аскорбиновая кислота (витамин С) могут взаимодействовать с образованием бензола. В марте 2006 года официальное агентство по пищевым стандартам Великобритании . провело исследование 150 марок безалкогольных напитков Было обнаружено, что в четырех из них уровень бензола превышал пределы Всемирной организации здравоохранения . Затронутые партии были сняты с продажи. Об аналогичных проблемах сообщило FDA в США. [106]
Загрязнение водоснабжения
[ редактировать ]В 2005 году водоснабжение города Харбина в Китае с населением почти девять миллионов человек было прекращено из-за значительного воздействия бензола. [107] Бензол попал в реку Сунгари , которая снабжает город питьевой водой, после взрыва на заводе Китайской национальной нефтяной корпорации (CNPC) в городе Цзилинь 13 ноября 2005 года.
Когда пластиковые водопроводные трубы подвергаются сильному нагреву, вода может быть загрязнена бензолом. [108]
Геноцид
[ редактировать ]Правительство нацистской Германии использовало бензол, вводимый посредством инъекций , как один из многочисленных методов убийства . [109] [110]
См. также
[ редактировать ]- БТЕКС
- 1,2,3-Циклогексатриен
- Департамент промышленного профсоюза против Американского нефтяного института
- Шестичленные ароматические кольца с заменой одного углерода на другой элемент: борабензол , силабензол , германбензол , оловобензол , пиридин , фосфорин , арсабензол , бисмабензол , пирилий , тиопирилий , селенопирилий , теллуропирилий.
Пояснительные примечания
[ редактировать ]- ↑ Критики указали на проблему с первоначальной структурой бензола Кекуле (1865 г.): всякий раз, когда бензол подвергался замещению в орто-положении, должны были образовываться два различимых изомера, в зависимости от того, существовала ли двойная или одинарная связь между атомами углерода, с которыми были присоединены заместители; однако таких изомеров обнаружено не было. В 1872 году Кекуле предположил, что бензол имеет две комплементарные структуры и что эти формы быстро превращаются друг в друга, так что, если бы между какой-либо парой атомов углерода в один момент существовала двойная связь, эта двойная связь в следующий момент стала бы одинарной связью (и наоборот). Чтобы объяснить механизм процесса преобразования, Кекуле предположил, что валентность атома определяется частотой, с которой он сталкивается со своими соседями в молекуле. Когда атомы углерода в бензольном кольце сталкивались друг с другом, каждый атом углерода дважды сталкивался с одним соседом в течение данного интервала, а затем дважды со своим другим соседом в течение следующего интервала. Таким образом, двойная связь будет существовать с одним соседом в течение первого интервала и с другим соседом в течение следующего интервала. Поэтому между атомами углерода бензола не было фиксированных (т. е. постоянных) и четко выраженных одинарных или двойных связей; вместо этого связи между атомами углерода были идентичными. Видеть страницы 86–89. Архивировано 20 марта 2020 г. в Wayback Machine Огюста Кекуле (1872 г.) «О некоторых продуктах конденсации альдегидов», Анналы химии и фармации Либиха , 162 (1): 77–124, 309–320. Из стр. 89: «Простейшее среднее значение всех столкновений атома углерода получается из суммы столкновений первых двух единиц времени, которые затем периодически повторяются... Таким образом, можно видеть, что каждый атом углерода взаимодействует с двумя другими,... ...что эта разница лишь кажущаяся, но не настоящая». (Простейшее среднее значение всех столкновений атома углерода [в бензоле] получается из суммы столкновений в течение первых двух единиц времени, которые затем периодически повторяются. … таким образом, можно увидеть, что каждый атом углерода одинаково часто сталкивается с двумя другие, с которыми он сталкивается, [и] таким образом находится в точно таком же отношении с двумя своими соседями. Обычная структурная формула бензола выражает, конечно, только те столкновения, которые происходят при этом. в одну единицу времени, то есть в течение одной фазы, и таким образом приходят к мнению, [что] дважды замещенные производные [бензола] должны быть разными в положениях 1,2 и 1,6 [бензольного кольца]. Если только что изложенную идею — или подобную — можно считать правильной, то из этого следует, что это различие [между связями в позициях 1,2 и 1,6] является лишь кажущимся [одним из них]. ], не настоящий [один].)
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Фавр, Анри А.; Пауэлл, Уоррен Х. (2014). Номенклатура органической химии: рекомендации ИЮПАК и предпочтительные названия 2013 г. (Синяя книга) . Кембридж: Королевское химическое общество . стр. 10, 22, 204, 494, 577. doi : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 .
- ^ Лиде, Д.Р., изд. (2005). Справочник CRC по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5 .
- ^ Арнольд, Д.; Планк, К.; Эриксон, Э.; Пайк, Ф. (1958). «Растворимость бензола в воде». Промышленная и инженерная химия. Серия химических и инженерных данных . 3 (2): 253–256. дои : 10.1021/i460004a016 .
- ^ Бреслоу, Р.; Го, Т. (1990). «Измерения поверхностного натяжения показывают, что хаотропные денатурирующие вещества являются не просто разрушителями структуры воды» . Труды Национальной академии наук Соединенных Штатов Америки . 87 (1): 167–9. Бибкод : 1990PNAS...87..167B . дои : 10.1073/pnas.87.1.167 . ПМК 53221 . ПМИД 2153285 .
- ^ Кокер, А. Кайоде; Людвиг, Эрнест Э. (2007). Прикладное проектирование процессов Людвига для химических и нефтехимических заводов . Том. 1. Эльзевир. п. 114. ИСБН 978-0-7506-7766-0 . Архивировано из оригинала 12 марта 2016 г. Проверено 31 мая 2012 г.
- ^ Перейти обратно: а б с д и «Бензол» . Архивировано из оригинала 29 мая 2014 г. Проверено 29 мая 2014 г.
- ^ Перейти обратно: а б Атертон Сейделл; Уильям Ф. Линке (1952). Растворимость неорганических и органических соединений: подборка данных о растворимости из периодической литературы. Добавка . Ван Ностранд. Архивировано из оригинала 11 марта 2020 г. Проверено 27 июня 2015 г.
- ^ Перейти обратно: а б с Бензол в Линстреме, Питере Дж.; Маллард, Уильям Г. (ред.); Интернет-книга NIST по химии , справочная база данных стандартов NIST № 69 , Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд) (получено 29 мая 2014 г.)
- ^ «Бензений (CID 12533897» . PubChem . 8 февраля 2007 г. Проверено 18 сентября 2022 г. ).
- ^ «Бензенид (CID 5150480)» . ПабХим . 24 июня 2005 года . Проверено 18 сентября 2022 г.
- ^ Перейти обратно: а б с Sigma-Aldrich Co., Бензол. Архивировано 1 декабря 2016 г. в Wayback Machine . Проверено 29 мая 2014 г.
- ^ Перейти обратно: а б с Карманный справочник NIOSH по химическим опасностям. «#0049» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Паспорт безопасности
- ^ «Бензол» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Информационный бюллетень по бензолу» . CDC . 2 сентября 2021 г. Проверено 16 августа 2023 г.
- ^ https://www.nytimes.com/2022/06/28/climate/natural-gas-home-токсические-химические вещества.html
- ^ Слово «бензоин» происходит от арабского выражения « лубан джави », или « ладан Явы » . Моррис, Эдвин Т. (1984). Аромат: история парфюмерии от Клеопатры до Шанель . Сыновья Чарльза Скрибнера. п. 101. ИСБН 978-0684181950 .
- ^ Перейти обратно: а б Рок, Эй Джей (1985). «Гипотеза и эксперимент в раннем развитии теории бензола Кекуле». Анналы науки . 42 (4): 355–81. дои : 10.1080/00033798500200411 .
- ^ Фарадей, М. (1825). «О новых соединениях углерода и водорода и о некоторых других продуктах, полученных при термическом разложении нефти» . Философские труды Королевского общества . 115 : 440–466. дои : 10.1098/rstl.1825.0022 . JSTOR 107752 . Архивировано из оригинала 21 ноября 2020 г. Проверено 15 января 2012 г. На страницах 443–450 Фарадей обсуждает «бикарбюратор водорода» (бензол). На страницах 449–450 он показывает, что эмпирическая формула бензола — C 6 H 6 , хотя и не осознает этого, поскольку (как и большинство химиков того времени) использовал неверную атомную массу углерода (6 вместо 12).
- ^ Кайзер, Р. (1968). «Бикарбюратор водорода. Переоценка открытия бензола в 1825 году с помощью аналитических методов 1968 года». Angewandte Chemie International Edition на английском языке . 7 (5): 345–350. дои : 10.1002/anie.196803451 .
- ^ Мичерлих, Э. (1834). «О бензоле и масляных и жирных видах кислот». Анналы аптеки . 9 (1): 39–48. дои : 10.1002/jlac.18340090103 . Архивировано из оригинала 23 ноября 2015 г. Проверено 27 июня 2015 г. В сноске на странице 43 Либих, редактор журнала, предложил изменить первоначальное название бензола, данное Мичерлихом (а именно, «бензин») на «бензол», поскольку суффикс «-ин» предполагал, что это алкалоид (например, хинин ( хинин)), которым бензол не является, тогда как суффикс «-ол» предполагал, что он был маслянистым, а бензол и есть. Так, на странице 44 Мичерлих заявляет: «Поскольку эта жидкость получается из бензойной кислоты и, вероятно, связана с бензоильными соединениями, лучше всего дать ей название бензол, поскольку название бензоин уже относится к соединению, изомерному горькому миндалю. нефтью были избраны Либих и Вёлер». (Поскольку эта жидкость [бензол] получается из бензойной кислоты и, вероятно, связана с бензоильными соединениями, лучшее название для нее — «бензол», поскольку название «бензоин» уже было выбрано Либихом и Вёлером для соединения, которое изомерен маслу горького миндаля [бензальдегиду].)
- ^ Лоран, (1836) «О хлорфенизе, а также хлорфениновых и хлорфенезовых кислотах», Annales de Chemie et de Physique , vol. 63, с. 27–45, см . с. 44. Архивировано 20 марта 2015 г. в Wayback Machine : «Я даю название фен фундаментальному радикалу предшествующих кислот (φαινω, я просвещаю), поскольку бензин содержится в осветительном газе». (Я даю название «фен» (φαινω, я освещаю) основному радикалу предшествующих кислот, потому что бензол содержится в освещающем газе.)
- ^ Хофманн, AW (1845 г.). «О надежном тесте на бензол». Анналы химии и фармации (на немецком языке). 55 (2): 200–205, особенно 204–205. дои : 10.1002/jlac.18450550205 . Архивировано из оригинала 22 ноября 2015 г.
- ^ Мэнсфилд Чарльз Блачфорд (1849). «Исследование угольной промышленности» . Анналы химии и фармации . 69 (2): 162–180. дои : 10.1002/jlac.18490690203 . Архивировано из оригинала 27 октября 2015 г. Проверено 27 июня 2015 г.
- ^ Чарльз Мэнсфилд подал заявку (11 ноября 1847 г.) и получил (май 1848 г.) патент (№ 11960) на фракционную перегонку каменноугольной смолы.
- ^ Хоффман, Огастес В. (1856). «Об инсолиновой кислоте». Труды Королевского общества . 8 : 1–3. дои : 10.1098/rspl.1856.0002 . S2CID 97105342 .
Существование и способ образования инсолиновой кислоты доказывают, что к ряду одноосновных ароматических кислот C n2 H n2-8 O 4 , низшим известным членом которого является бензойная кислота, … .
[Примечание: эмпирические формулы органических соединений, приведенные в статье Хофмана (стр. 3), основаны на атомной массе углерода 6 (вместо 12) и атомной массе кислорода 8 (вместо 16).] - ^ Черничаро, Хосе; и др. (1997), «Открытие Инфракрасной космической обсерваторией C 4 H 2 , C 6 H 2 и бензола в CRL 618», Astrophysical Journal Letters , 546 (2): L123–L126, Бибкод : 2001ApJ...546L.123C , дои : 10.1086/318871
- ^ Клаус, Адольф К.Л. (1867) «Теоретические соображения и их приложения к классификационной схеме органической химии», отчеты о переговорах Naturforschenden Gesellschaft zu Freiburg im Breisgau ( Отчеты о трудах Научного общества Фрайбурга в Брайсгау), 4 : 116–381. В разделе «Ароматические соединения» , стр. 315–347, Клаус представляет гипотетическую структуру бензола Кекуле ( стр. 317 ), представляет возражения против нее, представляет альтернативную геометрию ( стр. 320 ) и приходит к выводу, что его альтернатива верна ( стр. 320). 326 ). См. также рисунки на стр. 354 или с. 379.
- ^ Дьюар Джеймс (1869). «Об окислении фенилового спирта и механическом устройстве, адаптированном для иллюстрации структуры ненасыщенных углеводородов» . Труды Королевского общества Эдинбурга . 6 : 82–86. дои : 10.1017/S0370164600045387 . Архивировано из оригинала 24 ноября 2015 г. Проверено 27 июня 2015 г.
- ^ Ладенбург Альберт (1869). «Наблюдения по ароматической теории» . Отчеты Немецкого химического общества . 2 : 140-142. дои : 10.1002/cber.18690020171 . Архивировано из оригинала 22 ноября 2015 г. Проверено 27 июня 2015 г.
- ^ Перейти обратно: а б Кекуле, Ф.А. (1865). «О строении ароматических веществ» . Бюллетень Парижского химического общества . 3 :98–110. Архивировано из оригинала 14 ноября 2015 г. Проверено 27 июня 2015 г. Мы п. 100, Кекуле предполагает, что атомы углерода бензола могут образовывать «замкнутую цепь».
- ^ Август Кекуле (1872 г.), «О некоторых продуктах конденсации альдегидов» (PDF) , Annals of Chemistry and Pharmacy (на немецком языке), том. 162, № 1, стр. 77–124, номер документа : 10.1002/jlac.18721620110.
- ^ Армстронг Генри Э. (1887). «Объяснение законов замещения в случае бензоидных соединений» . Журнал Химического общества . 51 : 258–268 [264]. дои : 10.1039/ct8875100258 . Архивировано из оригинала 22 октября 2015 г. Проверено 27 июня 2015 г.
- ↑ В своей статье 1890 года Армстронг представил ядра бензола в полициклических бензооидах, поместив внутри ядер бензола букву «C», аббревиатуру слова «центрический». Центрическое сродство (т.е. связи) действовало внутри определенного цикла атомов углерода. Из стр. 102: «…бензол, согласно этой точке зрения, фактически может быть представлен двойным кольцом». Видеть:
- Армстронг, HE (1890). «Строение циклоидных углеводородов» . Труды Химического общества . 6 : 101–105. Архивировано из оригинала 16 ноября 2021 г. Проверено 17 февраля 2018 г.
- Армит, Джеймс Уилсон; Робинсон, Роберт (1925). «Полиядерные гетероциклические ароматические типы. Часть II. Некоторые ангидрониевые основания». Журнал Химического общества, Сделки . 127 : 1604–1618. дои : 10.1039/ct9252701604 .
- Балабан Александру Т.; Шлейер, Пол против Р.; Рзепа, Генри С. (2005). «Крокер, а не Армит и Робинсон породил шесть ароматических электронов» . Химические обзоры . 105 (10): 3436–3447. дои : 10.1021/cr0300946 . ПМИД 16218557 .
- ^ Адольф Байер (1888), «О составе бензола» , «Анналы химии» Юстуса Либиха (на немецком языке), том. 245, № 1–2, стр. 103–190, номер документа : 10.1002/jlac.18882450110.
- ^ Тиле, Йоханнес (1899) «О наших знаниях о ненасыщенных соединениях», «Анналы химии» Юстуса Либиха 306 : 87–142; см.: «VIII. Ароматические соединения. Бензол». (VIII. Ароматические соединения. Бензол.), стр. 125–129. Архивировано 10 марта 2020 г. в Wayback Machine. См. далее: Тиле (1901) «О знаниях о ненасыщенных соединениях». Архивировано 26 декабря 2021 г. в Wayback Machine. Анналы химии Юстуса Либиха , 319 : 129–143.
- ^ Лошмидт, Дж. (1861). Chemische Studien (на немецком языке). Вена, Австро-Венгрия: Зон Карла Герольда. стр. 30, 65. Архивировано из оригинала 7 мая 2016 г. Проверено 27 июня 2015 г.
- ^ Кекуле, Ф.А. (1866). «Исследования ароматических соединений» . «Анналы химии и фармации» Либиха . 137 (2): 129–36. дои : 10.1002/jlac.18661370202 . Архивировано из оригинала 26 декабря 2021 г. Проверено 25 декабря 2021 г.
- ^ Рок, Эй Джей (2010). Образ и реальность: Кекуле, Копп и научное воображение . Издательство Чикагского университета. стр. 186–227. ISBN 978-0226723358 . Архивировано из оригинала 27 июля 2020 г. Проверено 15 мая 2020 г.
- ^ Прочтите, Джон (1995). От алхимии к химии . Нью-Йорк: Dover Publications. стр. 179–180 . ISBN 9780486286907 .
- ^ Английский перевод Уилкокс, Дэвид Х.; Гринбаум, Фредерик Р. (1965). «Теория бензольных колец Кекуле: предмет для беззаботных шуток». Журнал химического образования . 42 (5): 266–67. Бибкод : 1965JChEd..42..266W . дои : 10.1021/ed042p266 .
- ^ Кекуле, Ф.А. (1890). «Бензольный фестиваль: Выступление» . Отчеты Немецкого химического общества . 23 :1302–11. дои : 10.1002/cber.189002301204 . Архивировано из оригинала 16 мая 2007 г. Проверено 12 марта 2007 г.
- ^ Бенфей ОТ (1958). «Август Кекуле и рождение структурной теории органической химии в 1858 году». Журнал химического образования . 35 (1): 21–23. Бибкод : 1958ЖЧЭд..35...21Б . дои : 10.1021/ed035p21 .
- ^ Гиллис Джин (1966). «Огюст Кекуле и его работы, созданные в Генте с 1858 по 1867 год». Мемуары научного класса - Королевская академия наук, литературы и изящных искусств Бельгии . 37 (1): 1–40.
- ^ Лонсдейл, К. (1929). «Строение бензольного кольца в гексаметилбензоле» . Труды Королевского общества . 123А (792): 494–515. Бибкод : 1929RSPSA.123..494L . дои : 10.1098/rspa.1929.0081 .
- ^ Лонсдейл, К. (1931). «Рентгеноструктурный анализ структуры гексахлорбензола методом Фурье» . Труды Королевского общества . 133А (822): 536–553. Бибкод : 1931RSPSA.133..536L . дои : 10.1098/rspa.1931.0166 . Архивировано из оригинала 19 марта 2021 г. Проверено 12 марта 2007 г.
- ^ Рамос-Фигероа, Жослин (21 мая 2021 г.). «Познакомьтесь с Кэтлин Лонсдейл, физиком и тюремным реформатором, которая взломала код бензола» . Массивная наука . Проверено 1 марта 2022 г.
- ^ Вильгельм Кёрнер (1867) «Факты, которые будут использоваться при определении химического положения в ароматическом ряду». Архивировано 7 июля 2017 г. в Wayback Machine (Факты, которые будут использоваться при определении химического положения в ароматическом ряду), Бюллетени Королевской академии. наук, литературы и изящных искусств Бельгии , 2-я серия, 24 : 166–185; см. особенно стр. 169. Со с. 169: «Эти три ряда, в которых бигидроксильные производные имеют соответствующие термины, легко отличить по приставкам орто-, пара- и мета-». (Эти три серии, в которых дигидроксипроизводные имеют соответствующие термины, легко отличить по префиксам орто-, пара- и мета-.)
- ^ Герман фон Фелинг, изд., Новый краткий химический словарь (Брауншвейг, Германия: Фридрих Видег и Зон, 1874), том. 1, с. 1142.
- ^ Гребе (1869) «Ueber die Конституции де Нафталин». Архивировано 28 ноября 2015 г. в archive.today (О структуре нафталина), Annalen der Chemie und Pharmacie , 149 : 20–28; см. особенно стр. 26.
- ^ Виктор Мейер (1870) «Исследования строения дизамещенных бензолов». Архивировано 23 октября 2015 г. в archive.today (Исследования структуры дизамещенных бензолов), Annals of Chemistry and Pharmacie , 156 : 265–301; особенно см. стр. 299–300.
- ^ Уильямс, PRD; Кнутсен, Дж.С.; Аткинсон, К.; Мадл, АК; Паустенбах, диджей (2007). «Концентрации бензола в воздухе, связанные с историческим использованием некоторых составов жидкого гаечного ключа». Журнал гигиены труда и окружающей среды . 4 (8): 547–561. дои : 10.1080/15459620701446642 . ПМИД 17558801 . S2CID 32311057 .
- ^ Перейти обратно: а б Хиллис О. Фолкинс (2005). "Бензол". Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a03_475 . ISBN 978-3527306732 .
- ^ Чанг, Кеннет (7 июня 2018 г.). «Жизнь на Марсе? Последнее открытие марсохода ставит ее «на стол» » . Нью-Йорк Таймс . Архивировано из оригинала 28 мая 2019 года . Проверено 8 июня 2018 г.
Идентификация органических молекул в горных породах на Красной планете не обязательно указывает на жизнь там, в прошлом или настоящем, но указывает на то, что некоторые строительные блоки присутствовали.
- ^ тен Кейт, Инге Лоес (8 июня 2018 г.). «Органические молекулы на Марсе». Наука . 360 (6393): 1068–1069. Бибкод : 2018Sci...360.1068T . дои : 10.1126/science.aat2662 . ПМИД 29880670 . S2CID 46952468 .
- ^ Эйгенброде, Дженнифер Л.; и др. (8 июня 2018 г.). «Органическое вещество сохранилось в аргиллитах возрастом 3 миллиарда лет в кратере Гейла на Марсе» (PDF) . Наука . 360 (6393): 1096–1101. Бибкод : 2018Sci...360.1096E . дои : 10.1126/science.aas9185 . ПМИД 29880683 . S2CID 46983230 . Архивировано (PDF) из оригинала 25 августа 2021 г. Проверено 4 января 2021 г.
- ^ Бэкон, GE; Карри, Н.; Уилсон, С. (12 мая 1964 г.). «Кристаллографическое исследование твердого бензола методом нейтронографии» . Труды Лондонского королевского общества, серия A. 279 (1376): 98–110. Бибкод : 1964RSPSA.279...98B . дои : 10.1098/rspa.1964.0092 . ISSN 2053-9169 . JSTOR 2414835 . S2CID 94432897 .
- ^ Моран Д., Симмонетт А.С., Лич Ф.Е., Аллен В.Д., Шлейер П.В., Шефер Х.Ф. (2006). «Популярные теоретические методы предсказывают, что бензол и арены неплоские». Журнал Американского химического общества . 128 (29): 9342–3. дои : 10.1021/ja0630285 . ПМИД 16848464 .
- ^ Купер, Дэвид Л.; Герратт, Джозеф; Раймонди, Марио (1986). «Электронное строение молекулы бензола». Природа . 323 (6090): 699–701. Бибкод : 1986Natur.323..699C . дои : 10.1038/323699a0 . S2CID 24349360 .
- ^ Полинг, Лайнус (1987). «Электронное строение молекулы бензола» . Природа . 325 (6103): 396. Бибкод : 1987Natur.325..396P . дои : 10.1038/325396d0 . S2CID 4261220 .
- ^ Мессмер, Ричард П.; Шульц, Питер А. (1987). «Электронное строение молекулы бензола» . Природа . 329 (6139): 492. Бибкод : 1987Natur.329..492M . дои : 10.1038/329492a0 . S2CID 45218186 .
- ^ Харкорт, Ричард Д. (1987). «Электронное строение молекулы бензола». Природа . 329 (6139): 491–492. Бибкод : 1987Natur.329..491H . дои : 10.1038/329491b0 . S2CID 4268597 .
- ^ «Символ Юникода 'БЕНЗОЛОВОЕ КОЛЬЦО' (U+232C)» . fileformat.info . Архивировано из оригинала 19 февраля 2009 г. Проверено 16 января 2009 г.
- ^ «Символ Юникода 'БЕНЗОЛОВОЕ КОЛЬЦО С КРУГОМ' (U+23E3)» . fileformat.info . Архивировано из оригинала 3 июля 2009 г. Проверено 16 января 2009 г.
- ^ «Гетероциклическая химия: гетероциклические соединения» . Мичиганский государственный университет , химический факультет. Архивировано из оригинала 6 апреля 2016 г. Проверено 8 июля 2016 г.
- ^ Али, Массачусетс; Хаджи, Шейкер; Аль-Хайят, Мохаммед; Абуталеб, Ахмед; Ахмед, Шакил (01 декабря 2022 г.). «Кинетическое моделирование и термодинамический анализ реакции диспропорционирования толуола на катализаторах на основе ZSM-5» . Катализные коммуникации . 172 : 106541. doi : 10.1016/j.catcom.2022.106541 . ISSN 1566-7367 .
- ^ Браун, Малкольм В. (16 августа 1988 г.), «Всепроникающая молекула запечатлена на фотографии» , The New York Times , заархивировано из оригинала 12 августа 2021 г. , получено 13 августа 2021 г.
- ^ «Исследование рынка: бензол (2-е издание), Ceresana, август 2014 г.» . ceresana.com. Архивировано из оригинала 21 декабря 2017 г. Проверено 10 февраля 2015 г.
- ^ «Исследование рынка: Толуол, Церезана, январь 2015 г.» . ceresana.com. Архивировано из оригинала 29 апреля 2017 г. Проверено 10 февраля 2015 г.
- ^ Кольмец, Джентри, Рекомендации по модернизации BTX, Весенняя конференция AIChE 2007 г.
- ^ «Контроль за опасными загрязнителями воздуха из мобильных источников» . Агентство по охране окружающей среды США. 29 марта 2006 г. п. 15853. Архивировано из оригинала 5 декабря 2008 г. Проверено 27 июня 2008 г.
- ^ Стрэнкс, ДР; М.Л. Хеффернан; К.С. Ли Доу; П.Т. Мактиг; ГРА Уизерс (1970). Химия: структурный взгляд . Карлтон, Виктория : Издательство Мельбурнского университета. п. 347. ИСБН 978-0-522-83988-3 .
- ^ Уэлч, Винсент А.; Фэллон, Кевин Дж.; Гельбке, Хайнц-Петер (2005). «Этилбензол». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a10_035.pub2 . ISBN 3527306730 .
- ^ Каспер, Деннис Л. и др. (2004) Принципы внутренней медицины Харрисона , 16-е изд., McGraw-Hill Professional, стр. 618, ISBN 0071402357 .
- ^ Руководство Merck, домашнее издание. Архивировано 29 сентября 2011 г. в Wayback Machine , «Обзор лейкемии».
- ^ Бард, Д. (2014). «Загрязнение воздуха, связанное с дорожным движением, и начало инфаркта миокарда: раскрытие бензола как триггера? Перекрестное исследование на небольшой территории» . ПЛОС ОДИН . 9 (6): 6. Бибкод : 2014PLoSO...9j0307B . дои : 10.1371/journal.pone.0100307 . ПМК 4059738 . ПМИД 24932584 .
- ^ Перейти обратно: а б Смит, Мартин Т. (2010). «Достижения в понимании воздействия бензола на здоровье и восприимчивости» . Анну Рев Общественное здравоохранение . 31 : 133–48. doi : 10.1146/annurev.publhealth.012809.103646 . ПМК 4360999 . ПМИД 20070208 .
- ^ Американский институт нефти, Токсикологический обзор API, Бензол, сентябрь 1948 г. , Агентство по регистрации токсичных веществ и заболеваний, Министерство здравоохранения и социальных служб.
- ^ Смит, Мартин Т. (1 января 2010 г.). «Достижения в понимании воздействия бензола на здоровье и восприимчивости» . Ежегодный обзор общественного здравоохранения . 31 (1): 133–148. doi : 10.1146/annurev.publhealth.012809.103646 . ПМК 4360999 . ПМИД 20070208 .
- ^ ВОЗ. Международное агентство по исследованию рака , Монографии IARC по оценке канцерогенных рисков для человека, Общие оценки канцерогенности: обновление монографий IARC, заархивировано 6 марта 2008 г. в Wayback Machine , тома с 1 по 42, Приложение 7
- ^ Хафф Дж (2007). «Рак, вызванный бензолом: краткая история и влияние на профессиональное здоровье» . Int J Occup Environ Health . 13 (2): 213–21. дои : 10.1179/oeh.2007.13.2.213 . ПМК 3363002 . ПМИД 17718179 .
- ^ Рана С.В.; Верма Ю. (2005). «Биохимическая токсичность бензола». J Энвайрон Биол . 26 (2): 157–68. ПМИД 16161967 .
- ^ Агентство по регистрации токсичных веществ и заболеваний. (2007) Бензол: информационный листок для пациента. Архивировано 15 декабря 2014 г. в Wayback Machine.
- ^ Ярдли-Джонс, А.; Андерсон, Д.; Парк, Д.В. (1991). «Токсичность бензола, его метаболизм и молекулярная патология в оценке риска для человека» . Британский журнал промышленной медицины . 48 (7): 437–44. дои : 10.1136/oem.48.7.437 . ПМЦ 1035396 . ПМИД 1854646 .
- ^ Стандарты безопасности и гигиены труда, токсичные и опасные вещества, 1910.1028. Архивировано 29 июня 2015 г. в Wayback Machine . Оша.гов. Проверено 23 ноября 2011 г.
- ^ Заявление общественного здравоохранения о бензоле, Агентство по регистрации токсичных веществ и заболеваний. (август 2007 г.). Бензол: информационный листок для пациента. Архивировано 28 мая 2010 г. в Wayback Machine . Atsdr.cdc.gov (03.03.2011). Проверено 23 ноября 2011 г.
- ^ «Загрязнители питьевой воды | Органические химикаты | Бензол» . Агентство по охране окружающей среды США (EPA). Архивировано из оригинала 2 февраля 2015 года . Проверено 17 апреля 2014 г.
- ^ Перейти обратно: а б «Информация о химических пробах бензола» . Управление по охране труда (OSHA). Архивировано из оригинала 29 июня 2015 года . Проверено 23 ноября 2011 г.
- ^ «Токсичность бензола: стандарты и правила» . Агентство по регистрации токсичных веществ и заболеваний (ATSDR); Экологическая медицина и образование в области гигиены окружающей среды – CSEM. 30 июня 2000 года. Архивировано из оригинала 10 июня 2010 года . Проверено 9 октября 2010 г.
- ^ Перейти обратно: а б «Логика выбора респиратора NIOSH» (PDF) . Цинциннати, Огайо: Министерство здравоохранения и социальных служб США (DHHS), Служба общественного здравоохранения, Центры по контролю заболеваний (CDC), Национальный институт безопасности и гигиены труда (NIOSH). Октябрь 2004 г. Архивировано из оригинала (PDF) 29 августа 2017 г. Публикация № 2005-100.
- ^ «Документация по концентрациям, непосредственно опасным для жизни или здоровья (IDLH): Введение» . Центры по контролю заболеваний (CDC). Архивировано из оригинала 22 июля 2012 года . Проверено 23 ноября 2011 г.
- ^ «Заявление общественного здравоохранения о бензоле» . Агентство по регистрации токсичных веществ и заболеваний . Министерство здравоохранения и социальных служб США, Служба общественного здравоохранения, Центры по контролю заболеваний, Национальный институт охраны труда. Август 2007 г. Архивировано из оригинала 20 января 2012 г. Получено 23 ноября 2011 г. - через Atsdr.cdc.gov.
- ^ Эшли, DL; Бонин, Массачусетс; Кардинали, Флорида; МакКроу, Дж. М.; Вутен, СП (1994). «Концентрация летучих органических соединений в крови у населения США, не подвергавшегося профессиональному воздействию, и в группах с подозрением на воздействие» (PDF) . Клиническая химия . 40 (7 Пт 2): 1401–4. дои : 10.1093/клинчем/40.7.1401 . ПМИД 8013127 . Архивировано (PDF) из оригинала 22 ноября 2011 г. Проверено 25 августа 2010 г.
- ^ Фустинони С., Буратти М., Кампо Л., Коломби А., Консонни Д., Песатори А.С., Бонзини М., Фармер П., Гарте С., Валерио Ф., Мерло Д.Ф., Бертацци П.А. (2005). «Мочевая т, т-муконовая кислота, S-фенилмеркаптуровая кислота и бензол как биомаркеры низкого воздействия бензола». Химико-биологические взаимодействия . 153–154: 253–6. дои : 10.1016/j.cbi.2005.03.031 . ПМИД 15935823 .
- ^ ACGIH (2009). TLV и BEI 2009 г. Американская конференция правительственных специалистов по промышленной гигиене, Цинциннати, Огайо.
- ^ Базелт, Р. (2008) Утилизация токсичных лекарств и химических веществ в организме человека , 8-е издание, Biomedical Publications, Фостер-Сити, Калифорния, стр. 144–148, ISBN 0962652377 .
- ^ Снайдер, Р; Хедли, CC (1996). «Обзор метаболизма бензола» . Перспектива здоровья окружающей среды . 104 (Приложение 6): 1165–1171. дои : 10.1289/ehp.96104s61165 . ПМЦ 1469747 . ПМИД 9118888 .
- ^ Догерти, Д; Гарте, С; Барчовский, А; Змуда, Дж; Тайоли, Э (2008). «Полиморфизмы NQO1, MPO, CYP2E1, GSTT1 и STM1 и биологические эффекты воздействия бензола - обзор литературы». Письма по токсикологии . 182 (1–3): 7–17. дои : 10.1016/j.toxlet.2008.09.008 . ПМИД 18848868 .
- ^ Фракассо М.Э., Дориа Д., Бартолуччи ГБ, Каррьери М., Ловреглио П., Баллини А., Солео Л., Транфо Г., Манно М. (2010). «Низкий уровень бензола в воздухе: корреляция между биомаркерами воздействия и генотоксическими эффектами». Токсикол Летт . 192 (1): 22–8. дои : 10.1016/j.toxlet.2009.04.028 . ПМИД 19427373 .
- ^ Истмонд, Д.А.; Рупа, Д.С.; Хасэгава, Л.С. (2000). «Обнаружение гипердиплоидии и разрыва хромосом в интерфазных лимфоцитах человека после воздействия метаболита бензола гидрохинона с использованием многоцветной флуоресценции in situ гибридизации с ДНК-зондами». Мутат Рес . 322 (1): 9–20. дои : 10.1016/0165-1218(94)90028-0 . ПМИД 7517507 .
- ^ Гарте, С; Тайоли, Э; Попов Т; Болоньези, К; Фермер, П; Мерло, Ф (2000). «Генетическая восприимчивость к токсичности бензола у человека». J Токсикол Здоровье окружающей среды A . 71 (22): 1482–1489. дои : 10.1080/15287390802349974 . ПМИД 18836923 . S2CID 36885673 .
- ^ Часто задаваемые вопросы ToxFAQ по бензолу , Агентство по регистрации токсичных веществ и заболеваний, Министерство здравоохранения и социальных служб.
- ^ ToxGuide для бензола. Архивировано 28 мая 2010 г. в Wayback Machine , Агентство по регистрации токсичных веществ и заболеваний, Министерство здравоохранения и социальных служб.
- ^ Заявление об общественном здравоохранении. Бензол. Архивировано 27 мая 2010 г. в Wayback Machine , Отдел токсикологии и экологической медицины, август 2007 г.
- ^ Бензол, CASRN: 71-43-2. Архивировано 22 октября 2011 г. в Wayback Machine . Банк данных об опасных веществах, Национальная медицинская библиотека США. Национальные институты здравоохранения.
- ^ «FDA: слишком много бензола в некоторых напитках». Архивировано 18 февраля 2007 г. в Wayback Machine , CBS News , 19 мая 2006 г. Проверено 11 июля 2006 г.
- ^ «100 тонн загрязняющих веществ вылились в китайскую реку» . Хранитель . 25 ноября 2005 г. Архивировано из оригинала 10 марта 2020 г. . Проверено 7 января 2020 г.
- ^ Исааксон, Кристофер П.; Проктор, Кейтлин Р.; Ван, К. Эрика; Эдвардс, Итан Ю.; Нет, Юраэ; Шах, Амиша Д.; Велтон, Эндрю Дж. (2021). «Загрязнение питьевой воды в результате термического разложения пластмасс: последствия для лесных пожаров и реагирования на пожары» . Наука об окружающей среде: водные исследования и технологии . 7 (2): 274–284. дои : 10.1039/D0EW00836B .
- ^ «Отборы и смертельные инъекции» . Государственный музей Освенцим-Биркенау . Архивировано из оригинала 9 мая 2020 года . Проверено 15 мая 2020 г.
- ^ «Бывший нацистский трудовой лагерь в Австрии, теперь объявленный туристическим объектом» . Гаарец . 3 мая 2019 года. Архивировано из оригинала 11 мая 2019 года . Проверено 11 мая 2019 г.
Внешние ссылки
[ редактировать ]- Бензол в Периодической таблице видео (Ноттингемский университет)
- Международная карта химической безопасности 0015
- Обзор USEPA о токсичности бензола
- Карманный справочник NIOSH по химическим опасностям
- Бензол от PubChem
- Департамент здравоохранения и социальных служб: TR-289: Исследования токсикологии и канцерогенеза бензола.
- Видеоподкаст сэра Джона Кадогана, читающего лекцию о бензоле со времен Фарадея в 1991 году.
- Профиль вещества
- Банк данных по опасным веществам NLM – бензол
- Бензол
- Отменено
- Ароматические углеводороды
- Ароматические растворители
- Канцерогены
- Товарная химия
- Положительные аллостерические модуляторы ГАМКА-рецепторов
- Опасные загрязнители воздуха
- Углеводородные растворители
- Канцерогены группы 1 IARC
- Иммунотоксины
- Мутагенез
- Химические опасности
- Нефтехимия
- Простые ароматические кольца
- Шестичленные кольца
- Загрязнение почвы
- Сладко пахнущие химикаты
- тератогенный



![Kekulé's 1872 modification of his 1865 theory, illustrating rapid alternation of double bonds[note 1]](http://upload.wikimedia.org/wikipedia/commons/thumb/f/f8/Historic_Benzene_Formulae_Kekul%C3%A9_%28original%29.png/519px-Historic_Benzene_Formulae_Kekul%C3%A9_%28original%29.png)



