Мононитрид серы
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК мононитрид серы | |||
| Систематическое название ИЮПАК Азаниумилсульфанидилилидин | |||
Другие имена
| |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| Сокращения | (НС)(.) | ||
| ЧЭБИ | |||
| ХимическийПаук | |||
| 660 | |||
ПабХим CID | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| Н С | |||
| Молярная масса | 46.07 g·mol −1 | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Мононитрид серы — неорганическое соединение с молекулярной формулой SN. Это серный аналог NO, изоэлектронный радикального оксида азота . Первоначально он был обнаружен в 1975 году в космическом пространстве в гигантских молекулярных облаках, а затем в коме комет. [1] Это стимулировало дальнейшие лабораторные исследования соединения. Синтетически его получают электрическим разрядом в смесях соединений азота и серы или сжиганием в газовой фазе и фотолизом в растворе. [2]
Синтез
[ редактировать ]NS Радикал представляет собой весьма непостоянный вид, время жизни которого составляет порядка миллисекунд, но его можно наблюдать спектроскопически в течение коротких периодов времени с помощью нескольких методов генерации. NS слишком реакционноспособен, чтобы его можно было изолировать в твердом или жидком виде, и его получали только в виде пара в матрицах низкого давления или низкой температуры из-за его склонности к быстрой олигомеризации с образованием более стабильных диамагнитных частиц. [3]
Выброс паров азота и серы
[ редактировать ]Пропускание электрического разряда через стеклянную трубку с кварцевыми окнами, содержащую смесь паров азота и серы (строго лишенную кислорода), приводит к появлению в спектре излучаемых полос светоприема, соответствующих образованию НС. [4]
Пропускание смеси газообразных N 2 и S 2 Cl 2 через боковое плечо абсорбционной ячейки, подвергающейся микроволновому разряду, дает НС. Инфракрасная диодная лазерная спектроскопия, проведенная с использованием этого метода, позволила получить равновесную константу вращения и, следовательно, рассчитать равновесную длину связи как 1,4940 Å. [5]
При микроволновом разряде элементарного азота и серы при низком давлении с последующим низкотемпературным захватом в аргоновых матрицах получается смесь продуктов, включающая НС, ННС, СНС и НСС. Путем добавления избытка серы также получают SSNS. [6]
Горение пламенем, легированным серой и азотом.
[ редактировать ]Метан предварительно смешивали с топливом в форме O 2 , N 2 O или воздуха и сжигали при атмосферном давлении. Источник азота вводили добавлением 1-5 мол.% газообразного NH 3 и серы 0,01-0,5 мол.% газообразного H 2 S или SF 6 . Стационарная концентрация НС внутри фронта пламени наблюдается по спектру лазерно-индуцированной флуоресценции (ЛИФ). [7]
Флэш-лазерный фотолиз тетрасульфида тетраазота
[ редактировать ]Радикал NS был обнаружен по спектру ЛИФ как продукт фотолиза газа тетраазота тетрасульфида (N 4 S 4 ) лазером с длиной волны 248 нм. [8]
Мгновенный и непрерывный фотолиз Cr(CH 3 CN) 5 (NS) 2+
[ редактировать ]Аэрированные растворы Cr(CH 3 CN) 5 (NS) 2+ обладают высокой фотоактивностью и склонны к быстрому разложению. Деаэрированные растворы Cr(CH 3 CN) 5 (NS) 2+ в ацетонитриле стабильны до тех пор, пока их хранят в темноте. Непрерывный фотолиз с использованием света с длиной волны 366 нм происходит медленно, а использование импульсного лазера с длиной волны 355 нм приводит к более быстрой лабилизации NS. [9]
Реактивность
[ редактировать ]Олигомеризация
[ редактировать ]Имеющиеся данные свидетельствуют о том, что NS могут реагировать сами с собой с образованием N 2 S 2 , N 4 S 4 и полимеров формы (NS) x . (NS) x образуется в результате полимеризации цикло-N 2 S 2 . [3]



Транс -NSSN возникает в результате прямой димеризации NS. [3]

N 3 S 3 наблюдался посредством фотоэлектронной спектроскопии паров полимера (SN) x , но еще не охарактеризован далее. Попытки получить N 3 S 3 окислением [ППН] [S 3 N 3 ] не увенчались успехом. [10] Предполагается, что быстрая димеризация до (N 3 S 3 ) 2 будет необратимо диспропорциональна N 4 S 4 и N 2 S 2 . [3]

Продукты распада с NO 2
[ редактировать ]Время радикального распада только НС составляет порядка 1-3 мс. Как видно из отсутствия изменения времени затухания при добавлении NO или O 2 при температуре окружающей среды, радикал NS не реагирует с NO и O 2 . Однако при добавлении NO 2 наблюдается быстрый распад первого порядка . Предполагается, что эта реакция протекает через различные промежуточные продукты, в конечном итоге достигая конечных продуктов N 2 и SO 2 . [8] Эта быстрая реакция протекает с константой скорости k = (2,54 ± 0,12) × 10. −11 см 3 молекулы −1 с −1 при 295 К. С помощью вычислительных расчетов, основанных на теории функционала плотности , были предсказаны минимумы и переходные состояния поверхности потенциальной энергии этой реакции. [8]
Астрономическая реактивность
[ редактировать ]Предполагается, что во внутренней коме комет многие реакции связаны с образованием и реакционной способностью NS-радикала. [11]
Металл-тионитрозильные комплексы
[ редактировать ]В качестве лиганда НС действует как σ-донор и π-акцептор, образуя металл-тионитрозильные комплексы. Тионитрозильные комплексы переходных металлов получали по следующим методикам: [12]
- Перенос серы в нитридокомплексы металлов
- Пример: Рефлюкс (Ph 4 P)[OsNCl 4 ] и (Ph 4 P)NCS дает зелено-коричневое твердое вещество [Ph 4 P] 2 [Os(NS)(NCS) 5 ] [13]
- Реакция тритиазилтрихлорида с комплексами переходных металлов
- NSCl 3 + OsCl 3 > [Os(NS)Cl 3 ]
- Отщепление галогенидов от координированных тиазильных комплексов
- Отщепление фтора, связанного с серой, от [(η 5 - C 5 H 5 )Cr(NO) 2 (NSF)]-[AsF 6 ] посредством AsF 5 > [(η 5 -C 5 H 5 )Cr(NO) 2 (NS)]-[AsF 6 ] 2
- Реакция НС + соли с комплексами переходных металлов
- НС + SbFСбФ6 − + [М(СО) 5 Br] > [М(СО) 5 (NS)] 2+ , М=Мн, Ре [14]
- НС + АсФ 6 − + [(ч 5 -C 5 H 5 )Fe(CO) 2 (SO 2 )] + > [(ч 5 -C 5 H 5 )Fe(CO) 2 (NS)] [AsF 6 ] 2
- Реакция тетранитрида тетрасеры с галогенидами или нитридами металлов
Из рентгеновской кристаллографии многих таких комплексов металл-тионитрозил можно наблюдать, что валентный угол MNS почти линейный, что указывает на sp- гибридизацию вокруг N. Короткие расстояния MN и длинные расстояния NS отражают резонансную структуру M = N = S, имеющую больший вклад, чем MN≡S. [12]
Типичные частоты ИК-растягивания v (NS) составляют примерно 1065 см-1. −1 для комплексов низковалентных переходных металлов и около 1390 см-1. −1 в высоковалентных случаях, тогда как свободный радикал газовой фазы имеет длину 1204 см-1. −1 сигнал. [3]
Электронная структура Fe(S 2 CNMe 2 ) 2 (NS)
[ редактировать ]Электронные структуры Fe(S 2 CNMe 2 ) 2 (NE), где E=O, S или Se, рассчитаны методами теории функционала плотности . Было обнаружено, что большая спиновая плотность Малликена оставалась сосредоточенной на ядре Fe(NE), а расстояния Fe-N мало менялись по сравнению с используемым атомом халькогена . В ВЗМО как нитрозильного, так и тионитрозильного комплексов сохранились 1a 1 (d z 2 ) характер. Небольшие изменения энергий спин-орбиталей комплексов, в частности уменьшение энергетической щели между 2b 2 и 1b 1 и 2b 1 и 1b 1 орбиталями, объясняются тем, что NS является более слабым π-акцептором, чем NO. [9]
Фотоиндуцированный перенос NS от хрома к железу
[ редактировать ]Когда агент захвата спина, такой как Fe(S 2 CNEt 2 ) 2 , присутствует во время фотолиза Cr(CH 3 CN) 5 (NS) 2+ наблюдаются новые полосы ЭПР S=1/2, связанные с образованием Fe(S 2 CNEt 2 ) 2 (NS), и сигнал от Cr(CH 3 CN) 5 (NS) 2+ исчезает. Это говорит о том, что радикал NS перешел из комплекса хрома в комплекс железа. [9]

Это было особенно важно, поскольку это была первая контролируемая и хорошо охарактеризованная реакционная способность NS в растворе. Кроме того, он показал потенциал аналогичной реакционной способности в известных реакциях с NO, таких как использование этого комплекса дитиокарбамата железа. [3]
Склеивание
[ редактировать ]
Валентные электроны этого соединения соответствуют электронам оксида азота . Мононитрид серы можно охарактеризовать как некое среднее из набора резонансных структур . Односвязная структура (показана первая резонансная структура) вносит небольшой вклад. Формальный порядок облигаций считается равным 2,5.

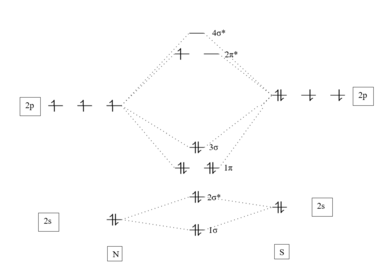
Против НЕТ
[ редактировать ]Уменьшение электроотрицательности со все более тяжелыми халькогенидами приводит к изменению направления диполя. В NO кислород является более электроотрицательным элементом. В НС азот более электроотрицательен. Радикал NS значительно более нестабилен и склонен к катации, чем NO. [3]
| НЕТ | НС | НСе | |
|---|---|---|---|
| △ f H°, кДж·моль −1 | +90.24 | +283.4 | - |
| △ f G°, кДж·моль −1 | +86.57 | +217.2 | - |
| S° 273, Дж/град | +207,5/273 К | +222.093/298 К | - |
| БДЭ | 627.6 | 463±24 | 370 Кал |
| d (NE), Å | 1.1517 | 1.4938 | 1.6634 |
| Ордер на облигации | 2.5 | 2.5 | 2.5 |
В астрономии
[ редактировать ]Молекулы в далеких астрономических регионах можно идентифицировать по их уникальным вращательным переходам, соответствующие микроволновые частоты которых обнаруживаются антеннами на Земле. О присутствии межзвездного мононитрида серы впервые было сообщено в 1975 году в двух письмах, опубликованных в Astrophysical Journal.
Межзвездная НЗ была впервые идентифицирована в гигантском молекулярном облаке Стрелец B2 (Sgr B2). О его присутствии сообщалось в двух параллельных статьях. Измерения, проведенные с помощью телескопа Национальной радиоастрономической обсерватории в Китт-Пик, штат Аризона, зарегистрировали миллиметровое излучение в Sgr B2, приписываемое переходам c- состояний NS в 2 Состояние Π 1/2 от J=5/2 до J=3/2 на частоте 115,16 ГГц. [15] -состояния от J = 5/2 до J = 3/2 Это назначение было подтверждено измерениями, проведенными в обсерватории миллиметровых волн Техасского университета на горе Локк, демонстрирующими переходы c -состояния и d на частотах 115,16 ГГц и 115,6 ГГц соответственно. Сверхтонкие взаимодействия возникают в результате 14 N магнитного и электроквадрупольного моментов. [16]
NS был обнаружен в регионах, ответственных за формирование массивных звезд, таких как гигантские молекулярные облака, такие как Sg B2, и холодные темные облака, такие как L134N и TMC-1. Одно исследование обнаружило NS в 12 из 14 изученных GMC, дополнительно наблюдая переходы от J=7/2 к J=5/2 и от J=3/2 к J=1/2 на частотах 161 и 69 ГГц соответственно. Численность NS в этих регионах была аппроксимирована на основе соотношения наблюдаемой и собственной силы сверхтонких линий, а также моделирования с использованием программы статистического равновесия, в результате чего было обнаружено низкое содержание во всех, кроме молекулярного облака Ориона. [17]
NS наблюдался также в коме комет Хякутакэ и Хейла-Боппа . Считается, что наблюдаемая численность выше, чем в газофазных ионно-молекулярных моделях, из-за фотодиссоциации неизвестного вида X-NS с высвобождением NS. [11]
Промышленное применение
[ редактировать ]Обнаружение НС при стационарной концентрации в зоне реакции горения метана, допированного аммиаком, и серой топлива, такой как H 2 S, позволяет предположить, что НС могут быть важным реакционноспособным промежуточным продуктом при горении углеводородного пламени в восстановительной атмосфере, что актуально. для пиролиза и сжигания угля. [7]
Ископаемое топливо содержит связанный азот, который при сгорании выделяет повышенные уровни выбросов оксида азота . Выбросы NO x можно контролировать путем денитрификации источника топлива, модификации камеры сгорания или того и другого. Одной из развивающихся технологий является повторное сжигание NOx , который восстанавливается до N2 . Эти виды топлива также содержат переменное количество серы, которая окисляется до SO 2 . Поэтому понимание реакционной способности NO и SO 2 имеет решающее значение для процесса повторного сжигания. Экспериментальная установка для проверки этого использовала первичное пламя для производства продуктов сгорания, которые были смешаны с NO и SO 2 для имитации побочных продуктов горения угля. Эту смесь подавали в горелку при атмосферном давлении. Снижение концентрации NO x на 1-2% наблюдается при различных процентах общего расхода топлива (коэффициенте догорания) в присутствии 0,1% SO 2 , что объясняется образованием H 2 S, HS и возникающей в результате реакцией с NO. , порождая НС. Реакция: HS + NO > NS + OH. [18]
Родственные соединения
[ редактировать ]- Тритиазил трихлорид (НСЦл) 3
- Нитрид серы
Ссылки
[ редактировать ]- ^ Канавес, М.В.; де Алмейда, А.А.; Бойс, округ Колумбия; Санзово, GC (март 2002 г.). «Сульфид азота в кометах Хьякутаке (C/1996 B2) и Хейла-Боппа (C/1995 O1)». Земля, Луна и планеты . 90 (1): 335–347. Бибкод : 2002EM&P...90..335C . дои : 10.1023/А:1021582300423 . S2CID 189898818 .
- ^ Берр, Дж. Г. (1985). Хеми- и биолюминесценция . Клинический и биохимический анализ. Том. 16. ЦРК Пресс. п. 99. ИСБН 0-8247-7277-6 .
- ^ Jump up to: а б с д и ж г Боре, RT; Рёммеле, ТЛ (2013). «Халькоген-азотные радикалы» . Комплексная неорганическая химия . 1 : 375–411. дои : 10.1016/B978-0-08-097774-4.00117-0 . ISBN 9780080965291 .
- ^ Фаулер, А.; Баккер, CJ (2 мая 1932 г.). «Зончатый спектр сульфида азота (НС)» . Труды Лондонского королевского общества. Серия А, содержащая статьи математического и физического характера . 136 (829): 28–36. Бибкод : 1932RSPSA.136...28F . дои : 10.1098/rspa.1932.0064 . ISSN 0950-1207 . S2CID 94966018 .
- ^ Мацумара, Кейджи; Кавагути, Кентаро; Джагай, Кейчи; Ямада, Чикаши; Хирота, Эйзи (1980). «Инфракрасная диодная лазерная спектроскопия радикала NS». Журнал молекулярной спектроскопии . 84 (84): 68–73. Бибкод : 1980JMoSp..84...68M . дои : 10.1016/0022-2852(80)90239-8 .
- ^ Гасанзаде, Парвиз; Эндрюс, Лестер (1992). «Инфракрасные спектры новых форм серы и азота в твердом аргоне». Дж. Ам. хим. Соц . 114 : 83–91. дои : 10.1021/ja00027a012 .
- ^ Jump up to: а б Джеффрис, Джей; Кросли, Дэвид (1986). «Лазерно-индуцированная флуоресценция NS-радикала в пламени метана, легированного серой и азотом» . Горение и пламя . 64 (64): 55–64. Бибкод : 1986CoFl...64...55J . дои : 10.1016/0010-2180(86)90098-2 .
- ^ Jump up to: а б с Блиц, Марк; Макки, Кеннет; Пиллинг, Майкл; Винсент, Марк; Хиллиер, Ян (2002). «Экспериментальные измерения скорости NS + NO, O2 и NO2 и расчеты электронной структуры путей реакций NS + NO2» . Дж. Физ. Хим . 106 (36): 8406–841С. дои : 10.1021/jp025508y .
- ^ Jump up to: а б с Детлефсен, Йоханнес; Хедегард, Эрик; Раймер, Р. Дейл; Форд, Питер; Доссинг, Андерс (2009). «Исследование флэш- и непрерывного фотолиза тионитрозильного комплекса Cr(CH3CN)5(NS)2+ и аналогов оксида азота: реакции моносульфида азота в растворе» . Неорганическая химия . 48 (1): 231–238. дои : 10.1021/ic8016936 . ПМИД 19032042 .
- ^ Фриц, HP; Бруххаус, Р.; Мьюс, Р.; Хофс, Х.У. (1985). «Электрохимические синтезы. XXIII. Электрохимическое и ЭПР-спектроскопическое исследование окислительно-восстановительного поведения (SN)+ и [S3N3]?». З. Анорг. Генерал Хим . 525 (6): 214–220. дои : 10.1002/zaac.19855250625 .
- ^ Jump up to: а б Канавес, Маркус В.; Де Алмейда, Амори А.; Бойс, Дэниел К.; Санзово, Жилберто К. (2002), «Сульфид азота в кометах Хьякутаке (C/1996 B2) и Хейла-Боппа (C/1995 O1)» , Кометная наука после Хейла-Боппа , Дордрехт: Springer Нидерланды, стр. 335–347 , doi : 10.1007/978-94-017-1088-6_33 , ISBN 978-90-481-6156-0 , получено 15 декабря 2022 г.
- ^ Jump up to: а б Панди, Кришна (1992). «Координационная химия тионитрозила (NS), тиазата (NSO-), дисульфидотионитрата (S3N-), монооксида серы (SO) и дисульфурмоноксида (S2O) лигандов». Прогресс неорганической химии . 40 : 445–502.
- ^ Райт, Майкл; Гриффит, Уильям (1982). «Исследования нитридо и оксокомплексов переходных металлов. Часть VII (1). Замещенные нитридные комплексы осмия и рутения». Переходный мет. Хим . 7 : 53–58. дои : 10.1007/BF00623810 . S2CID 95282271 .
- ^ Хартманн, Г.; Мьюс, Р.; Шелдрик, генеральный менеджер (16 августа 1983 г.). «Катионные комплексы переходных металлов тиазилбис-трифторметилнитроксида» . Журнал металлоорганической химии . 252 (2): 195–200. дои : 10.1016/0022-328X(83)80083-7 .
- ^ Койпер, честно говоря; Какар, РК; Родригес Койпер, EN; Цукерман, Б. (сентябрь 1975 г.). «Обнаружение 2,6-миллиметрового излучения, вероятно, связано с сульфидом азота» . Астрофизический журнал . 200 : Л151. Бибкод : 1975ApJ...200L.151K . дои : 10.1086/181919 . ISSN 0004-637X .
- ^ Готлиб, Калифорния; Болл, Дж.А.; Готлиб, EW; Лада, CJ; Пенфилд, Х. (сентябрь 1975 г.). «Обнаружение межзвездного сульфида азота» . Астрофизический журнал . 200 : Л147. Бибкод : 1975ApJ...200L.147G . дои : 10.1086/181918 . ISSN 0004-637X .
- ^ МакГонагл, Дуглас; Ирвин, Уильям М. (10 марта 1997 г.). «Сульфид азота в гигантских молекулярных облаках» . Астрофизический журнал . 477 (2): 711–721. Бибкод : 1997ApJ...477..711M . дои : 10.1086/303749 . ISSN 0004-637X . ПМИД 11539871 . S2CID 39674849 .
- ^ Чаггер, Харнит; Годдард, Филип; Мердок, Патрисия; Уильямс, Алан (1991). «Влияние SO2 на снижение NOx путем дожигания метаном» . Топливо . 70 (10): 1137–1142. дои : 10.1016/0016-2361(91)90233-Z .


