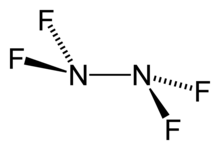
Тетрафторгидразин
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 1,1,2,2-тетрафторгидразин | |
| Другие имена Тетрафторгидразин, перфторгидразин, ООН 1955. | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.030.091 |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Н 2 Ж 4 | |
| Молярная масса | 104.008 g·mol −1 |
| Появление | Бесцветный газ |
| Температура плавления | -164,5 ° C (-264,1 ° F; 108,6 К) [1] |
| Точка кипения | -73 ° C (-99 ° F; 200 К) [1] |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Взрыв |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 10 мл/кг (крыса, внутрибрюшинно) [2] |
ЛК 50 ( средняя концентрация ) |
|
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Тетрафторгидразин или перфторгидразин , N 2 F 4 , бесцветное, негорючее, [2] реактивный неорганический газ . Это фторированный аналог гидразина .
Синтез
[ редактировать ]Тетрафторгидразин первоначально был получен из трифторида азота с использованием меди в качестве акцептора атома фтора: [3]
- 2NF 3 + Cu → N 2 F 4 + CuF 2
Можно использовать ряд акцепторов атома F, включая углерод, другие металлы и оксид азота . В этих реакциях используется относительно слабая связь NF в NF 3 . [4]
Характеристики
[ редактировать ]Тетрафторгидразин находится в равновесии со своим радикальным мономером дифторидом азота . [5]
- Н 2 Ж 4 ⇌ 2 •НФ 2
При комнатной температуре N 2 F 4 в основном связан лишь с 0,7% в виде НФ 2 при давлении 5 мм рт.ст. При повышении температуры до 225°С большая часть диссоциирует (99%) в виде НФ 2 . [6]
Энергия, необходимая для разрыва связи N-N в N 2 F 4 моль, с изменением энтропии 38,6 е.е. составляет 20,8 ккал / [6] Для сравнения, энергия диссоциации связи N-N составляет 14,6 ккал/моль (61 кДж/моль) в N 2 O 4 , 10,2 ккал/моль (43 кДж/моль) в N 2 O 2 и 60 ккал/моль (250 кДж/моль) в Н 2 Ч 4 . Энтальпия образования N 2 F 4 (Δ f H °) составляет 34,421 кДж/моль. [7]
Использование
[ редактировать ]Тетрафторгидразин используется в органическом синтезе и некоторых рецептурах ракетного топлива . [2] Он присоединяется по двойным связям с образованием вицинальных ди(дифтораминов). [8] В химическом синтезе в качестве предшественника или катализатора . В 1959 году его рассматривали для использования в качестве высокоэнергетического жидкого окислителя , которые никогда не летали в некоторых рецептурах ракетного топлива . [9]
Безопасность
[ редактировать ]Тетрафторгидразин — очень опасное химическое вещество, которое взрывается в присутствии органических материалов. [2]
Это токсичное химическое вещество, раздражающее кожу, глаза и легкие. Это нейротоксин , который может вызывать метгемоглобинемию . Может быть смертельным при вдыхании или попадании через кожу. Пары могут вызывать раздражение и коррозию. Это сильный окислитель . Контакт с этим химическим веществом может вызвать ожоги и серьезные травмы. При пожаре выделяются раздражающие, едкие и токсичные газы. Пары сжиженного газа изначально тяжелее воздуха и распространяются по земле. [2]
Тетрафторгидразин взрывается или воспламеняется при контакте с восстановителями при комнатной температуре , включая водород , углеводороды , спирты , тиолы , амины , аммиак , гидразины , дицианоген , нитроалканы , алкилбериллии , силаны , бораны или порошкообразные металлы . Длительное воздействие высокой температуры на контейнер с тетрафторгидразином может привести к его резкому разрыву и взрыву. Сам тетрафторгидразин может взорваться при высоких температурах или от удара или взрыва под давлением. При нагревании до разложения на воздухе выделяет высокотоксичные пары фтора и оксидов азота . [2]
Известен фатальный случай: во время открытия клапанов для проверки давления баллон взорвался, в результате чего один человек погиб, а другой был ранен. [2]
Ссылки
[ редактировать ]- ^ Jump up to: а б Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Jump up to: а б с д и ж г час «Тетрафторгидразин» . pubchem.ncbi.nlm.nih.gov . Национальная медицинская библиотека . Проверено 26 марта 2023 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Рафф, Джон К. (1967). «Производные фторидов азота». Химические обзоры . 67 (6): 665–680. дои : 10.1021/cr60250a004 .
- ^ Кларк, Джон Друри (1972). Зажигание! . Нью-Брансуик, Нью-Джерси: Рутгерс UP. п. 82. ИСБН 0-8135-0725-1 . LCCN 72-185390 .
- ^ Хантер, Сюзанна; Жуанн, Йорн; Келлер-Рудек, Ханнелор; Кошель, Дитер; Кун, Питер; Мерле, Питер; Рупечт, Сигрид; Ванечек, Ганс; Вагнер, Иоахим (1986). Кошель, Дитер; Кун, Питер; Мерле, Питер; Рупрехт, Сигрид; Вагнер, Иоахим (ред.). F Фтор: соединения с кислородом и азотом . Гмелин Справочник по неорганической химии. Том 4. Берлин: Шпрингер. п. 162. дои : 10.1007/978-3-662-06339-2 . ISBN 978-3-662-06341-5 . Проверено 29 августа 2015 г.
- ^ Jump up to: а б Бон, Роберт К.; Бауэр, Саймон Харви (февраль 1967 г.). «Электронографическое исследование структур NF 2 и N 2 F 4 ». Неорганическая химия . 6 (2): 304–309. дои : 10.1021/ic50048a024 . размеры и углы молекул
- ^ «Дифторид азота NF 2 (г)» . www.chem.msu.su.
- ^ Кларк 1972 , стр. 167–168.
- ↑ Тетрафторгидразин на DTIC.mil, архивировано 12 марта 2007 г.