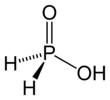
Гипофосфористая кислота
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК
Фосфиновая кислота
| |||
| Другие имена
Гидрокси(оксо)- λ 5 -фосфан
Гидрокси- λ 5 -фосфанон | |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| КЭБ | |||
| ХЭМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.026.001 | ||
| КЕГГ | |||
ПабХим CID
|
| ||
| НЕКОТОРЫЙ | |||
| Число | И 3264 | ||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| H3POH3PO2 | |||
| Молярная масса | 66.00 g/mol | ||
| Появление | бесцветные, расплывающиеся кристаллы или маслянистая жидкость | ||
| Плотность | 1,493 г/см 3 [ 2 ]
1,22 г/см 3 (50% водный раствор) | ||
| Температура плавления | 26,5 ° С (79,7 ° F; 299,6 К) | ||
| Точка кипения | 130 ° C (266 ° F; 403 К) разлагается. | ||
| смешиваемый | |||
| Растворимость | очень растворим в спирте , эфире | ||
| Кислотность ( pKa ) | 1.2 | ||
| Сопряженная база | фосфинат | ||
| Структура | |||
| псевдотетраэдрический | |||
| Опасности | |||
| точка возгорания | Невоспламеняющийся | ||
| Паспорт безопасности (SDS) | Джей Ти Бейкер | ||
| Родственные соединения | |||
Родственные фосфора оксокислоты
|
Фосфористая кислота Фосфорная кислота | ||
Родственные соединения
|
Гипофосфит натрия Гипофосфит бария | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Гипофосфористая кислота ( ГФК ), или фосфиновая кислота , представляет собой фосфора оксикислоту и мощный восстановитель с молекулярной формулой H 3 PO 2 . Это бесцветное легкоплавкое соединение, растворимое в воде, диоксане. и спирты. Формула этой кислоты обычно обозначается H 3 PO 2 , но более наглядным вариантом является HOP(O)H 2 , что подчеркивает ее монопротонный характер. Соли, образующиеся из этой кислоты, называются гипофосфитами . [ 3 ]
HOP(O)H 2 находится в равновесии с минорным таутомером HP(OH) 2 . Иногда минорный таутомер называют гипофосфорной кислотой, а основной таутомер называют фосфиновой кислотой.
Подготовка и доступность
[ редактировать ]Гипофосфористая кислота была впервые получена в 1816 году французским химиком Пьером Луи Дюлонгом (1785–1838). [ 4 ]
Кислоту получают промышленным путем в два этапа: во-первых, элементарный белый фосфор реагирует с щелочных и щелочноземельных металлов гидроксидами с образованием водного раствора гипофосфитов:
- Р 4 + 4 ОН − + 4 Н 2 О → 4 Н
2 ПО −
2 + 2 Ч 2
Любые фосфиты , полученные на этом этапе, можно избирательно осаждать обработкой солями кальция . Затем очищенный материал обрабатывают сильной неокисляющей кислотой (часто серной кислотой ) с получением свободной фосфорноватистой кислоты:
- ЧАС
2 ПО −
2 + Ч + → POH3PO2
HPA обычно поставляется в виде 50% водного раствора. Безводную кислоту невозможно получить простым выпариванием воды, так как кислота легко окисляется до фосфористой кислоты и фосфорной кислоты , а также диспропорционируется до фосфористой кислоты и фосфина . Чистую безводную гипофосфористую кислоту можно получить путем непрерывной экстракции водных растворов диэтиловым эфиром . [ 5 ]
Характеристики
[ редактировать ]Молекула демонстрирует таутомерию от P(=O)H до P–OH, аналогичную таутомерии фосфористой кислоты ; форма P(=O) является весьма предпочтительной. [ 6 ]
HPA обычно поставляется в виде 50%-ного водного раствора, и нагревание при низких температурах (до примерно 90°C) приводит к его реакции с водой с образованием фосфористой кислоты и газообразного водорода.
- Н 3 ПО 2 + Н 2 О → Н 3 ПО 3 + Н 2
При нагревании выше 110°C гипофосфористая кислота диспропорционируется с образованием фосфористой кислоты и фосфина . [ 7 ]
- 3H3PO2 PO2 → 2H3PO3 PO3 + PH3
Реакции
[ редактировать ]Неорганический
[ редактировать ]Гипофосфористая кислота может восстанавливать оксид хрома (III) до оксида хрома (II):
- H 3 PO 2 + 2 Cr 2 O 3 → 4 CrO + H 3 PO 4
Неорганические производные
[ редактировать ]Большинство металл-гипофосфитных комплексов нестабильны из-за склонности гипофосфитов восстанавливать катионы металлов обратно в основной объем металла. Охарактеризованы некоторые примеры, [ 8 ] [ 9 ] включая важную соль никеля [Ni(H 2 O) 6 ](H 2 PO 2 ) 2 . [ 10 ]
Химический статус списка I DEA
[ редактировать ]Поскольку гипофосфористая кислота может восстанавливать элементарный йод с образованием иодистоводородной кислоты , которая является реагентом, эффективным для восстановления эфедрина или псевдоэфедрина до метамфетамина , [ 11 ] внесло Управление по борьбе с наркотиками США гипофосфористую кислоту (и ее соли) в список химических прекурсоров Списка I. С 16 ноября 2001 года [ 12 ] Соответственно, лица, работающие с гипофосфористой кислотой или ее солями в Соединенных Штатах, подлежат строгому нормативному контролю, включая требования к регистрации, ведению учета, отчетности и импорту/экспорту в соответствии с Законом о контролируемых веществах и 21 CFR , §§ 1309 и 1310. [ 12 ] [ 13 ] [ 14 ]
Органический
[ редактировать ]В органической химии H 3 PO 2 можно использовать для восстановления солей арендиазония , превращая ArN +
2 к Ar–H. [ 15 ] [ 16 ] [ 17 ] При диазотировании в концентрированном растворе фосфорноватистой кислоты из аминный аренов можно удалить заместитель.
Благодаря своей способности действовать как мягкий восстановитель и поглотитель кислорода, его иногда используют в качестве добавки в реакциях этерификации Фишера , где он предотвращает образование окрашенных примесей.
Его используют для получения производных фосфиновой кислоты. [ 18 ]
Приложения
[ редактировать ]Гипофосфористая кислота (и ее соли) используются для восстановления солей металлов обратно в объемные металлы. Он эффективен для ионов различных переходных металлов (например, Co, Cu, Ag, Mn, Pt), но чаще всего используется для восстановления никеля . [ 19 ] Это составляет основу химического никелирования (Ni–P), которое является крупнейшим промышленным применением гипофосфитов. Для этого применения он в основном используется в виде соли ( гипофосфита натрия ). [ 20 ]
Источники
[ редактировать ]- Коттон, Ф. Альберт ; Уилкинсон, Джеффри ; Мурильо, Карлос А.; Бохманн, Манфред (1999), Передовая неорганическая химия (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 0-471-19957-5
- Листинг ChemicalLand21
- Корбридж, Декабрь (1995). Фосфор: очерк химии, биохимии и технологии (5-е изд.). Амстердам: Эльзевир. ISBN 0-444-89307-5 .
- Попик В.В.; Райт, АГ; Хан, Т.А.; Мерфи, Дж. А. (2004). «Гипофосфористая кислота». В Пакетте, Л. (ред.). Энциклопедия реагентов для органического синтеза . Нью-Йорк: Дж. Уайли и сыновья. дои : 10.1002/047084289X . hdl : 10261/236866 . ISBN 978-0-471-93623-7 .
- Рич, Д.В.; Смит, MC (1971). Химическое осаждение никеля, кобальта и железа . Покипси, Нью-Йорк: Корпорация IBM.
Ссылки
[ редактировать ]- ^ Петруччи, Ральф Х. (2007). Общая химия (9-е изд.). п. 946.
- ^ Прадьот Патнаик. Справочник неорганических химикатов . МакГроу-Хилл, 2002 г., ISBN 0-07-049439-8
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Дюлонг получил кислый гипофосфорекс , добавив фосфид бария (Ba 3 P 2 ) к воде, в результате чего получился газообразный фосфин (PH 3 ), фосфат бария и гипофосфит бария. Поскольку газообразный фосфин покинул раствор и фосфат бария выпал в осадок, в растворе остался только гипофосфит бария. Гипофосфористую кислоту затем можно было получить из фильтрата путем добавления серной кислоты, которая осаждала сульфат бария, оставляя гипофосфористую кислоту в растворе. Видеть:
- Дюлонг (1816) «Отрывок из мемуаров о соединениях фосфора с кислородом» , Annales de Chimie et de Physique , 2 : 141–150. [на французском языке]
- Грэм, Томас, Элементы неорганической химии , 2-е изд. (Филадельфия, Пенсильвания: Бланшар и Леа, 1858 г.), с. 316.
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 513. ИСБН 978-0-08-037941-8 .
- ^ Янеско, Бенджамин Г.; Фишер, Генри К.; Уздечка, Марк Дж.; Моншан, Жан-Люк (29 сентября 2015 г.). «Таутомерия P (=O) H в P – OH: теоретическое и экспериментальное исследование». Журнал органической химии . 80 (20). Американское химическое общество (ACS): 10025–10032. дои : 10.1021/acs.joc.5b01618 . ISSN 0022-3263 .
- ^ Шечков, Г.Т.; Певнева И.А.; Мешкова О.А. (август 2003 г.). «Термическое диспропорционирование гипофосфорной кислоты». Российский журнал прикладной химии . 76 (8): 1354–1355. дои : 10.1023/B:RJAC.0000008318.22178.07 . S2CID 96861842 .
- ^ Куратьева Наталья Владимировна; Наумова Марина Ивановна; Подберезская Нина В.; Наумов Дмитрий Ю. (15 февраля 2005 г.). «Гипофосфиты двухвалентных металлов Sr(H 2 PO 2 ) 2 , Pb(H 2 PO 2 ) 2 и Ba(H 2 PO 2 ) 2». Acta Crystallographica Раздел C. Связь с кристаллической структурой . 61 (2): i14–i16. дои : 10.1107/S010827010403166X . ПМИД 15695880 .
- ^ Naumova, Marina I.; Kuratieva, Natalia V.; Podberezskaya, Nina V.; Naumov, Dmitry Yu. (2004-05-15). "The alkali hypophosphites KH 2 PO 2 , RbH 2 PO 2 and CsH 2 PO 2". Acta Crystallographica Section C Crystal Structure Communications . 60 (5): i53–i55. doi : 10.1107/S0108270104002409 . PMID 15131359 .
- ^ Kuratieva, Natalia V.; Naumova, Marina I.; Naumov, Dmitry Yu.; Podberezskaya, Nina V. (2003-01-15). "Hexaaquanickel(II) bis(hypophosphite)". Acta Crystallographica Section C Crystal Structure Communications . 59 (1): i1–i3. doi : 10.1107/S0108270102018541 . PMID 12506208 .
- ^ Гордон, ЧП; Фрай, Эй Джей; Хикс, LD (23 августа 2005 г.). «Дальнейшие исследования по восстановлению бензиловых спиртов фосфорноватистой кислотой/йодом» (PDF) . Аркивок . 2005 (vi): 393–400. ISSN 1424-6376 .
- ^ Перейти обратно: а б 66 ФР 52670–52675. 17 октября 2001 г.
- ^ «21 CFR 1309» . Архивировано из оригинала 3 мая 2009 г. Проверено 2 мая 2007 г.
- ^ 21 USC, Глава 13 (Закон о контролируемых веществах)
- ^ Уильям Х. Браун; Брент Л. Айверсон; Эрик Анслин; Кристофер С. Фут (2013). Органическая химия . Cengage Обучение. п. 1003. ИСБН 978-1-133-95284-8 .
- ^ Робисон, ММ; Робисон Б.Л. «2,4,6-трибромбензойная кислота» . Органические синтезы . 36:94 ; Сборник томов , т. 4 .
- ^ Корнблюм, Н. (1941). «3,3'-Диметоксибифенил и 3,3'-Диметилбифенил». Органические синтезы . 21:30 . дои : 10.15227/orgsyn.021.0030 .
- ^ Карла Браво-Альтамирано; Жан-Люк Моншан (2008). «Катализируемое палладием дегидратирующее аллилирование фосфорноватистой кислоты аллиловыми спиртами» . Орг. Синтез . 85 : 96. дои : 10.15227/orgsyn.085.0096 .
- ^ Гийон, Кэрол; Метэ, Эстель; Попович, Флоренция; Лемэр, Марк (2015). «Синтетическое применение производных гипофосфита в восстановлении». Органическая и биомолекулярная химия . 13 (29): 7879–7906. дои : 10.1039/C5OB01032B . ПМИД 26083977 .
- ^ Абрантес, LM (1994). «О механизме химического никелевого покрытия». Журнал Электрохимического общества . 141 (9): 2356–2360. Бибкод : 1994JElS..141.2356A . дои : 10.1149/1.2055125 .