Гипофосфорная кислота
 | |
| Имена | |
|---|---|
| Название ИЮПАК Гиподифосфорная кислота | |
| Другие имена Дифосфорная кислота | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
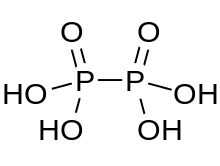
| Н 4 П 2 О 6 | |
| Молярная масса | 161.98 g/mol |
| Появление | Белое твердое вещество (дигидрат) |
| Температура плавления | 54 ° С (129 ° F; 327 К) |
| Кислотность ( pKa ) | 2.2, 2.8, 7.3, 10.0 [1] |
| Сопряженная база | Гипофосфат |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Гипофосфорная кислота — минеральная кислота с формулой H 4 P 2 O 6 , с фосфором в формальной степени окисления +4. В твердом состоянии он находится в виде дигидрата H 4 P 2 O 6 ·2H 2 O. В гипофосфорной кислоте атомы фосфора одинаковы и соединены непосредственно связью P-P. Изогипофосфорная кислота представляет собой структурный изомер гипофосфорной кислоты, в котором один фосфор имеет водород, непосредственно связанный с ним, и этот атом фосфора связан с другим кислородным мостиком, образуя фосфористой кислоты и фосфорной кислоты смешанный ангидрид . Два атома фосфора находятся в степенях окисления +3 и +5 соответственно.
Препарат и реакции
[ редактировать ]Гипофосфорную кислоту можно получить реакцией красного фосфора с хлоритом натрия при комнатной температуре. [2]
- 2 P + 2 NaClO 2 + 2 H 2 O → Na 2 H 2 P 2 O 6 + 2 HCl
Смесь гипофосфорной кислоты, фосфористой кислоты (H 3 PO 3 ) и фосфорной кислоты (H 3 PO 4 ) образуется при окислении белого фосфора на воздухе при частичном погружении в воду. [2]
Тетранатриевая соль Na 4 P 2 O 6 ·10H 2 O кристаллизуется при pH 10, а динатриевая соль Na 2 H 2 PO 6 ·6H 2 O при pH 5,2. [1] Динатриевую соль можно пропустить через ионообменную колонку с образованием дигидрата кислоты H 4 P 2 O 6 ·2H 2 O. [2]
Безводная кислота может быть образована вакуумной дегидратацией над P 4 O 10 или реакцией H 2 S с гипофосфатом свинца Pb 2 P 2 O 6 . [1]
Гипофосфорная кислота является тетрапротонной с константами диссоциации p K a1 = 2,2, p K a2 = 2,8, p K a3 = 7,3 и p K a4 = 10,0. [1]
При стоянии безводная кислота претерпевает перегруппировку и диспропорционирование с образованием смеси изогипофосфорной кислоты HPO(OH)-O-PO 2 (OH); пирофосфорная кислота H 2 P 2 O 7 и пирофосфорная кислота. [1]
Гипофосфорная кислота нестойка в горячей соляной кислоте , в 4 М HCl гидролизуется с образованием H 3 PO 3 + H 3 PO 4 . [1]
Структура
[ редактировать ]Гипофосфорная кислота содержит ионы оксония и лучше всего формулируется [H 3 O + ] 2 [Н 2 Р 2 О 6 ] 2− . Кислота изоструктурна диаммониевой соли, которая содержит [HOPO 2 PO 2 OH] 2− анион с длиной связи P-P 219 пм. [2]
HOPO 2 PO 2 OH 2− Анион в Na 2 H 2 P 2 O 6 ·6H 2 O имеет симметричную, шахматную этаноподобную структуру со связью P-P длиной 219 пм. Каждый атом фосфора имеет две связи P-O длиной 151 пм и связь P-OH длиной 159 пм. [3]
Гипофосфатные соли
[ редактировать ]Известны многие гипофосфатные соли, например, K 4 P 2 O 6 ·8H 2 O, Ca 2 P 2 O 6 ·2H 2 O, K 3 HP 2 O 6 ·3H 2 O, K 2 H 2 P 2 O 6 ·2H 2 O, KH 3 P 2 O 6 .
На воздухе гипофосфаты имеют тенденцию окисляться до пирофосфатов, содержащих Р.
22О 4−
Ион 7 , где P имеет формальную степень окисления +5. Гипофосфаты устойчивы к гидроксидам щелочных металлов. В конденсированном гидроксиде натрия они быстро превращаются в ортофосфат, содержащий PO. 3−
4 . [2]
Полигипофосфаты
[ редактировать ]Известны полигипофосфаты, содержащие линейные анионы, например Na 5 P 3 O 8 , содержащие О(РО 2 ) 3 О 5− с цепью P-P-P и Na 6 P 4 O 10 ·2H 2 O, содержащими О(РО 2 ) 4 О 6− , с цепочкой P−P−P−P. Циклический анион (PO
2 ) 6−
6 , (гипогексаметафосфат [4] ), где каждый атом фосфора имеет степень окисления +3, образуется при окислении суспензии красного фосфора в КОН бромом. [2]
См. также
[ редактировать ]- Дитионовая кислота , эквивалент серы.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж Гринвуд, Норман Н .; Эрншоу, Алан (1984). Химия элементов . Оксфорд: Пергамон Пресс . стр. 515–516. ISBN 978-0-08-022057-4 .
- ^ Перейти обратно: а б с д и ж Фосфор: химия, биохимия и технология, шестое издание, 2013 г., DEC Corbridge, CRC Pres, Taylor Francisco Group, ISBN 978-1-4398-4088-7
- ^ Коллин, РЛ; Уиллис, М. (1971). «Кристаллическая структура гексагидрата дигидрогипофосфата динатрия (Na 2 H 2 P 2 O 6 ·6H 2 O) и гексагидрата дигидропирофосфата динатрия (Na 2 H 2 P 2 O 7 ·6H 2 O)». Acta Crystallographica Раздел B. 27 (2): 291–302. дои : 10.1107/S0567740871002127 . ISSN 0567-7408 .
- ^ Холлеман, Арнольд Фредерик; Виберг, Эгон (2001), Виберг, Нильс (ред.), Неорганическая химия , перевод Иглсона, Мэри; Брюэр, Уильям, Сан-Диего/Берлин: Academic Press/De Gruyter, стр. 715, ISBN 0-12-352651-5