Гелицена

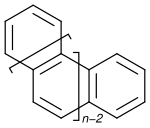
В органической химии гелицены представляют собой орто-конденсированные полициклические ароматические соединения , в которых бензольные кольца или другие ароматические соединения соединены под углом с образованием спиральной формы хиральных молекул . [1] Химия гелиценов привлекает постоянное внимание из-за их уникальных структурных, спектральных и оптических особенностей. [2] [3] [4] [5] [6] [7] [8]
Структура и свойства
[ редактировать ]Систематическое наименование этого класса соединений основано на количестве колец: [ n ]гелицен представляет собой структуру, состоящую из n колец. Согласно ИЮПАК , гелиценами считаются только структуры, где n равно 5. [1] Некоторые конкретные соединения также имеют альтернативные или тривиальные названия . По мере увеличения количества колец, начиная с четырех, структура становится неплоской, но вместо этого плоскости последовательных колец наклоняются, чтобы предотвратить стерические столкновения. Для гелиценов с шестью бензольными звеньями совершается поворот на 360°. В ряду гелицена двугранные углы между концами увеличиваются при переходе от [4] гелицена (26°) к [6] гелицину (58°), а затем снова уменьшаются, например, в [7] гелицене (30°).
Гелицены отличаются хиральностью, несмотря на отсутствие как асимметричных атомов углерода , так и хиральных центров . Вместо этого существует осевая хиральность , которая является результатом направленности самой спиральности. Спирали, вращающиеся по часовой стрелке и против часовой стрелки, несовместимы. По соглашению левая спираль имеет минус и обозначается ( M ) , правая спираль имеет плюс и обозначается ( P ) . Данные спектроскопии КД позволяют предположить, что левовращающие спирали являются левовращающими , а правовращающие - правовращающими .
Стабильность двух дополнительных спиральных энантиомеров относительно взаимного превращения и механизм их взаимного превращения зависят от n . [9]
Синтез
[ редактировать ]О первой гелиценовой структуре сообщил Якоб Мейзенхаймер в 1903 году как продукт восстановления 2-нитронафталина . [10] [5]гелицен был синтезирован в 1918 году Вайценбёком и Клинглером. [11] Первый [6] гелицен (также называемый гексагелиценом ) был синтезирован и М. С. Ньюманом Д. Леднисером в 1955 году по схеме, которая замыкала два центральных кольца путем циклизации Фриделя-Крафтса соединений карбоновых кислот . [12] [13] несколько методов синтеза гелиценов с разной длиной и заместителями С тех пор используется окислительная фотоциклизация предшественника стильбенового типа . В качестве ключевой стадии чаще всего используется . Самым длинным гелиценом, полученным этим методом, является [16]гелицен 2015 года. [14]
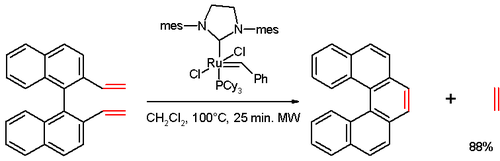
В одном исследовании [15] [5]гелицен был синтезирован в реакции метатезиса олефинов дивинильного соединения (полученного из 1,1'-би-2-нафтола (БИНОЛ) в несколько стадий) с катализатором Граббса второго поколения :
Другой подход также нефотохимический и основан на сборке бифенилнафталинов и их двойной циклоизомеризации, катализируемой платиной, приводящей к различным [6]гелиценам: [16]
- [4] Гелицена
- [5] Гелицена
- [6] Гелицена
- [6] Гелицен, другая хиральность
- [7] Гелицена
- [7]Гелицен, другая хиральность
- [8] Гелицена
- [9] Гелицена
- [10] Гелицена
- [11] Гелицена
- [12] Гелицена
- [13] Гелицена
- [14] Гелицена
- [15] Гелицена
- [16] Гелицена
- [18] Гелицена
Приложения
[ редактировать ]Гелицены изучались в рамках нелинейной оптики . [17] КПЛ , [18] [19] органокатализ , [20] конформационный анализ, [21] ощущение хиральности , [22] химические датчики [23] и замещение гетероатома. [24] [25] [26] [27]
См. также
[ редактировать ]- Другие конфигурации последовательно конденсированных бензольных колец:
Ссылки
[ редактировать ]- ^ Перейти обратно: а б ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Гелицены ». дои : 10.1351/goldbook.H02762
- ^ Мартин, Р.Х. (1974), Геликены . Энджью. хим. Межд. Эд. англ., 13: 649–660. два : 10.1002/anie.197406491
- ^ Гелицены: синтез и применение Юн Шен и Чуан-Фэн Чен Статья химических обзоров как можно скорее дои : 10.1021/cr200087r
- ^ Добавления Дильса-Альдера бензинов в скелеты гелицена Дэвид Чжиган Ван, Томас Дж. Кац, Джеймс Голен и Арнольд Л. Рейнгольд J. Org. хим.; 2004 г .; 69(22) стр. 7769–7771 дои : 10.1021/jo048707h
- ^ Сто лет химии гелицена. Часть 1: Нестереоселективный синтез карбогелиценов Marc Gingras Chem. Соц. Ред., 2013, 42, 968-1006. дои : 10.1039/C2CS35154D
- ^ Сто лет химии гелицена. Часть 2: стереоселективный синтез и хиральное разделение карбогелиценов Марк Гинграс, Ги Феликс и Ромен Пересутти Chem. Соц. Ред., 2013, 42, 1007-1050. дои : 10.1039/C2CS35111K
- ^ Сто лет химии гелицена. Часть 3: Применение и свойства карбогелиценов Marc Gingras Chem. Соц. Ред., 2013, 42, 1051-1095. два : 10.1039/C2CS35134J
- ^ Недавнее развитие синтеза гелицена Кен Камикава Журнал синтетической органической химии, Япония Том. 72 (2014) № 1 с. 58-67 дои : 10.5059/yukigoseikyokaishi.72.58
- ^ Фрейшас, Виктор М.; Руксель, Жереми Р.; Нам, Ёнсиг; Третьяк, Сергей; Говинд, Ниранджан; Мукамель, Шауль (2023). «Рентгеновский и оптический круговой дихроизм как локальные и глобальные сверхбыстрые киральные зонды [12] гелиценовой рацемизации». Дж. Ам. хим. Соц . 145 (38): 21012–21019. дои : 10.1021/jacs.3c07032 .
- ^ Майзенхаймер Дж. и Витте К. (1903), Восстановление 2-нитронафталина . Отчеты Немецкого химического общества, 36: 4153–4164. два : 10.1002/cber.19030360481
- ^ Синтез изомерных углеводородов 1, 2–5, 6-дибензантрацена и 3, 4–5, 6-дибензфенантрена Ричард Вайценбок и Альберт Клинглер Monathefte für Chemie / Chemical Monthly Volume 39, номер 5, 315–323, два : 10.1007/BF01524529
- ^ Новый реагент для разрешения путем комплексообразования; разрешение фенантро-[3,4-c] фенантрена Мелвин С. Ньюман, Уилсон Б. Лутц и Дэниел Леднисер Журнал Американского химического общества 1955 77 (12), 3420–3421 два : 10.1021/ja01617a097
- ^ Синтез и разделение гексагелицена Мелвин С. Ньюман и Дэниел Леднисер Журнал Американского химического общества 1956 78 (18), 4765–4770 два : 10.1021/ja01599a060
- ^ Мори, Казуюки; Мурасе, Такаши; Фудзита, Макото (2015). «Одноэтапный синтез [16] гелицена». Энджью. хим. Межд. Эд . 54 (23): 6847–6851. дои : 10.1002/anie.201502436 .
- ^ Получение гелиценов посредством метатезиса олефинов Шон К. Коллинз, Ален Гранбуа, Мартин П. Вашон, Жюли Коте Angewandte Chemie International Edition , том 45, выпуск 18, страницы 2923–2926, 2006 г. два : 10.1002/anie.200504150
- ^ Синтез гексагелицена и 1-метоксигексагелицена путем циклоизомеризации производных бифенилнафталина. Сторх Й., Сикора Й., Чермак Й., Карбан Й., Цисаржова И., Ружичка А. Й. Org. хим. 2009 , 74 , 3090. два : 10.1021/jo900077j
- ^ Красители Helquat: гелиценоподобные двухтактные системы с большими нелинейными оптическими откликами второго порядка Бенджамин Дж. Коу, Даниэла Русанова, Вишвас Д. Джоши, Серхио Санчес, Ян Вавра, Душант Хобрагаде, Лукаш Севера, Ивана Цисаржова, Давид Шаман, Радек Пол, Коэн Клейс, Грит Депоттер, Брюс С. Бруншвиг и Филип Теплый Журнал органической химии 2016 81 (5), 1912-1920 гг. два : 10.1021/acs.joc.5b02692
- ^ Синтетический контроль динамики возбужденного состояния и циркулярно поляризованной люминесценции флуоресцентных «тяни-толкай» тетратиа [9] гелиценов Ю. Ямамото, Х. Сакаи, Дж. Юаса, Ю. Араки, Т. Вада, Т. Саканоуэ, Т. Такенобу, Т. Каваи, Т. Хасобе, Chem. Евро. Дж. 2016, 22, 4263. doi : 10.1002/chem.201504048
- ^ Контролируемая динамика возбужденного состояния и повышенная флуоресцентная способность тетрасульфона [9] гелицена с помощью простого синтетического процесса Юки Ямамото, Хаято Сакаи, Дзюнпей Юаса, Ясуюки Араки, Такехико Вада, Томо Саканоуэ, Тайши Такенобу, Цуёси Каваи и Таку Хасобе Журнал Физической химии С 2016 120 (13), 7421-7427 doi : 10.1021/acs.jpcc.6b01123
- ^ Производные тетратиа [7] гелицена фосфора: экспериментальные и теоретические исследования электронных свойств и предварительное применение в качестве органокализаторов Д. Дова, Л. Вильянти, П. Р. Муссини, С. Прагер, А. Дреу, А. Войтурье, Э. Ликандро, С. Каутеручио, Азиатская J. Org. хим. 2016, 5, 537. два : 10.1002/ajoc.201600025
- ^ Синтез и структурные особенности четверных гелиценов: сильно искаженные π-системы, возникающие за счет накопления спиральных отталкиваний Такао Фудзикава, Ясутомо Сегава и Кенитиро ИтамиЖурнал Американского химического общества, 2016 г., 138 (10), 3587-3595. дои : 10.1021/jacs.6b01303
- ^ По своей сути хиральная азония [6] гелицен-модифицированный β-циклодекстрин: синтез, характеристика и определение хиральности недооцененных аминокислот в воде Циньфэй Хуан, Лянвэй Цзян, Вентинг Лян, Цзяньчан Гуй, Динго Сюй, Ванхуа Ву, Ёсито Накаи, Масаки Нисидзима , Гаку Фукухара, Тадаши Мори, Ёсихиса Иноуэ и Ченг Ян Журнал органической химии 2016 81 (8), 3430-3434 два : 10.1021/acs.joc.6b00130
- ^ Электрохимический емкостной K + Химический сенсор EMIS на основе дибромоаза[7]гелицена в качестве ионофора для обнаружения ионов калия М. Тунси, М. БенБрайек, А. Баракет, М. Ли, Н. Зин, М. Забала, Дж. Бауселлс, Ф. Алуи, Б. БенХассин, А. Маареф, А. Эррашид, Электроанализ 2016, 28, 2892. два : 10.1002/elan.201600104
- ^ Катион-радикал и нейтральный радикал аза-тиа [7] гелицена с инверсией энергетических уровней SOMO-HOMO Ин Ван, Хуэй Чжан, Марен Пинк, Арнон Оланкитванит, Сухада Райка и Анджей Райка Журнал Американского химического общества, 2016, 138 (23) , 7298-7304 дои : 10.1021/jacs.6b01498
- ^ Синтез и исследование структурных свойств производных окса[5]гелицена М. Шьям Сундара, Сибапрасад Сахуб, Ашутош В. Бедекара, Тетраэдр: Асимметрия, том 27, выпуск 16, 1 сентября 2016 г., страницы 777–781 дои : 10.1016/j.tetasy.2016.06.020
- ^ Синтез и фотофизические свойства аза[n]гелиценов Гурав М. Упадьяй, Хариш Р. Талеле и Ашутош В. Бедекар Журнал органической химии 2016 81 (17), 7751-7759 два : 10.1021/acs.joc.6b01395
- ^ Гетеро[5]гелицен на основе сультама: синтез, структура и усиление эмиссии, вызванное кристаллизацией. Тарунприт С. Вирк, Ниранджан В. Илаве, Госян Чжан, Крейг П. Ю, Брайан М. Вонг, Джулиан М.В. Чан. САУ Омега 2016 ; 1 (6), 1336–1342 гг. дои : 10.1021/acsomega.6b00335
- Общие ссылки
- Чуан-Фэн; Юн Шен (2017). Гелиценовая химия: от синтеза к приложениям . Спрингер. дои : 10.1007/978-3-662-53168-6 . ISBN 978-3-662-53168-6 . S2CID 199492403 .

![[4] Гелицена](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ee/Tetrahelicene.jpg/120px-Tetrahelicene.jpg)
![[5] Гелицена](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7c/Pentahelicene.jpg/120px-Pentahelicene.jpg)
![[6] Гелицена](http://upload.wikimedia.org/wikipedia/commons/thumb/9/95/Hexahelicene.jpg/120px-Hexahelicene.jpg)
![[6] Гелицен, другая хиральность](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e2/Hexahelicene2.jpg/119px-Hexahelicene2.jpg)
![[7] Гелицена](http://upload.wikimedia.org/wikipedia/commons/thumb/2/29/Heptahelicene.jpg/120px-Heptahelicene.jpg)
![[7]Гелицен, другая хиральность](http://upload.wikimedia.org/wikipedia/commons/thumb/9/9f/Heptahelicene2.jpg/120px-Heptahelicene2.jpg)
![[8] Гелицена](http://upload.wikimedia.org/wikipedia/commons/thumb/6/64/Octahelicene.jpg/120px-Octahelicene.jpg)
![[9] Гелицена](http://upload.wikimedia.org/wikipedia/commons/thumb/5/57/Nonahelicene.jpg/120px-Nonahelicene.jpg)
![[10] Гелицена](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Decahelicene.jpg/90px-Decahelicene.jpg)
![[11] Гелицена](http://upload.wikimedia.org/wikipedia/commons/thumb/2/2e/Undecahelicene.jpg/120px-Undecahelicene.jpg)
![[12] Гелицена](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e5/Dodecahelicene.jpg/111px-Dodecahelicene.jpg)
![[13] Гелицена](http://upload.wikimedia.org/wikipedia/commons/thumb/0/08/Tridecahelicene.jpg/99px-Tridecahelicene.jpg)
![[14] Гелицена](http://upload.wikimedia.org/wikipedia/commons/thumb/8/86/Tetradecahelicene.jpg/120px-Tetradecahelicene.jpg)
![[15] Гелицена](http://upload.wikimedia.org/wikipedia/commons/thumb/c/cc/Pentadecahelicene.jpg/120px-Pentadecahelicene.jpg)
![[16] Гелицена](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e6/Hexadecahelicene.jpg/112px-Hexadecahelicene.jpg)
![[18] Гелицена](http://upload.wikimedia.org/wikipedia/commons/thumb/0/04/Octadecahelicene.jpg/97px-Octadecahelicene.jpg)