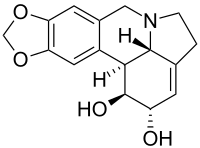
Ликорин
| |
| Имена | |
|---|---|
| Название ИЮПАК
3,12-Дидегидро-2'H- [ 1,3]диоксоло[4',5':9,10]галантан-1α,2β-диол
| |
| Систематическое название ИЮПАК
(1 С , 2 С , 3а 1 С ,12б С )-2,3а 1 ,4,5,7,12b-гексагидро-1 H ,10 H -[1,3]диоксоло[4,5- j ]пирроло[3,2,1 -де ]фенантридин-1,2-диол | |
| Другие имена
Галантидин, Амариллин, Нарциссин, Ликорин, Беламарин
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.006.822 |
| КЕГГ | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 16 Н 17 Н О 4 | |
| Молярная масса | 287.315 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Ликорин — токсичный кристаллический алкалоид , обнаруженный в различных видах Amaryllidaceae , таких как культивируемая кустовая лилия ( Clivia miniata ), лилии-сюрпризы ( Lycoris ) и нарциссы ( Narcissus ). При попадании в организм в определенных количествах он может быть очень ядовитым или даже смертельным. [ 1 ] Несмотря на это, его иногда используют в медицинских целях, поэтому некоторые группы могут собирать очень популярную Clivia miniata .
Источник
[ редактировать ]Ликорин содержится в различных видах Amaryllidaceae, включая цветы и луковицы нарцисса, подснежника ( Galanthus ) или паутинной лилии ( Lycoris ). Ликорин — наиболее распространенный алкалоид Amaryllidaceae. [ 2 ]
Самая ранняя диверсификация Amaryllidaceae, скорее всего, произошла в Северной Африке и на Пиренейском полуострове, и ликорин является одним из старейших на пути биосинтеза алкалоидов Amaryllidaceae. [ 3 ]
Механизм действия
[ редактировать ]В настоящее время очень мало известно о механизме действия ликорина, хотя были выдвинуты некоторые предварительные гипотезы относительно метаболизма алкалоида, основанные на экспериментах, проведенных на собаках породы бигль . [ 4 ]
Ликорин подавляет синтез белка . [ 5 ] и может ингибировать аскорбиновой кислоты биосинтез , хотя исследования последнего спорны и неубедительны. В настоящее время это представляет определенный интерес для изучения некоторых дрожжей , основного организма, на котором тестируется ликорин. [ 6 ]
Известно, что ликорин слабо ингибирует биосинтез ацетилхолинэстеразы (АХЭ) и аскорбиновой кислоты. [ 7 ] ликорина Было обнаружено, что IC50 различается у разных видов, у которых он встречается, но общий вывод из экспериментов с ликорином заключался в том, что он оказал некоторое влияние на ингибирование АХЭ. [ 8 ]
Ликорин проявляет цитостатические эффекты, воздействуя на актиновый цитоскелет , а не индуцируя апоптоз раковых клеток, хотя было обнаружено, что ликорин индуцирует апоптоз или останавливает клеточный цикл в разных точках различных клеточных линий. [ 9 ]
Токсичность
[ редактировать ]Отравление ликорином чаще всего происходит при употреблении в пищу луковиц нарциссов. Луковицы нарциссов иногда путают с луком , что приводит к случайному отравлению. [ 10 ]
При исследовании дозировки, применяемой на собаках породы бигль, первые признаки тошноты наблюдались уже при дозе 0,5 мг/кг и возникали в течение 2,5 часов. Эффективная доза, вызывающая рвоту у собак, составляла 2,0 мг/кг и продолжалась не более 2,5 часов после введения. [ 11 ]
Симптомы
[ редактировать ]Симптомами отравления ликорином являются тошнота , [ 12 ] рвота , диарея и судороги . [ 13 ]
Текущие исследования
[ редактировать ]Было замечено, что ликорин обладает многообещающей биологической и фармакологической активностью, такой как антибактериальное, противовирусное или противовоспалительное действие, и может обладать противораковыми свойствами. [ 14 ] Он продемонстрировал различные ингибирующие свойства в отношении нескольких линий раковых клеток, включая лимфому, карциному, множественную миелому, меланому, лейкемию, немелкоклеточный рак легких человека A549, рак пищевода человека OE21 и другие. [ 15 ]
Ликорин имеет множество производных, используемых в противораковых исследованиях, таких как гидрохлорид ликорина (ЛГ), который является новым средством против рака яичников, и данные показали, что ЛГ эффективно ингибирует митотическое пролиферацию клеток Hey1B с очень низкой токсичностью. В будущем этот препарат может быть использован для эффективной терапии рака яичников. [ 16 ]
Ссылки
[ редактировать ]- ^ «T3DB: Ликорин» . www.t3db.ca. Проверено 12 ноября 2018 г.
- ^ Ян, Сандра; Зайверт, Беттина; Крецинг, Саша; Авраам, Гету; Регенталь, Ральф; Карст, Уве (2012). «Метаболические исследования амариллидных алкалоидов галантамина и ликорина на основе электрохимического моделирования в дополнение к моделям in vivo и in vitro» . Аналитика Химика Акта . 756 (756): 60–72. дои : 10.1016/j.aca.2012.10.042 . ПМИД 23176740 . Проверено 25 апреля 2017 г.
- ^ Берков, Страхил; Мартинес-Фрэнсис, Ванесса; Бастида, Жауме; Кодина, Карлес; Риос, Секундо (2014). «Эволюция биосинтеза алкалоидов у рода Narcissus» . Фитохимия . 99 (99): 95–106. doi : 10.1016/j.phytochem.2013.11.002 . ПМИД 24461780 .
- ^ Крецинг, Саша; Авраам, Гету; Зайверт, Беттина; Унгемах, Фриц Руперт; Кругель, Юте; Регенталь, Ральф (2011). «Дозозависимые рвотные эффекты амариллидного алкалоида ликорина у собак породы бигль» . Токсикон . 57 (57): 117–124. дои : 10.1016/j.токсикон.2010.10.012 . ПМИД 21055413 . Проверено 25 апреля 2017 г.
- ^ Врейсен Р., Ванден Берге Д.А., Влитинк А.Дж., Бойе А. (1986). «Ликорин: ингибитор терминации эукариот?» . Ж. Биол. Хим . 261 (2): 505–7. дои : 10.1016/S0021-9258(17)36118-5 . ПМИД 3001065 .
- ^ Гаруччо I, Арригони О (1989). «[Различная чувствительность дрожжей к ликорину]». Болл. Соц. Итал. Биол. Спер. (на итальянском языке). 65 (6): 501–8. ПМИД 2611011 .
- ^ Ян, Сандра; Зайверт, Беттина; Крецинг, Саша; Авраам, Гету; Регенталь, Ральф; Карст, Уве (2012). «Метаболические исследования амариллидных алкалоидов галантамина и ликорина на основе электрохимического моделирования в дополнение к моделям in vivo и in vitro» . Аналитика Химика Акта . 756 (756): 60–72. дои : 10.1016/j.aca.2012.10.042 . ПМИД 23176740 . Проверено 25 апреля 2017 г.
- ^ Элиша, Иллинойс; Эльгораши, Э.Э.; Хусейн, А.А.; Дункан, Дж.; Элофф, Дж. Н. (2013). «Ингибирующее действие ацелихолинэстеразы луковицы Ammocharis coranica (Amaryllidaceae) и ее активного компонента ликорина» . Южноафриканский журнал ботаники . 85 (85): 44–47. дои : 10.1016/j.sajb.2012.11.008 .
- ^ Ван, Пэн; Юань, Хуэй-Хуэй; Чжан, Сюэ; Ли, Юн-Пин; Шан, Лу-Цин; Инь, Чжэн (21 февраля 2014 г.). «Новые производные ликорина как противораковые средства: синтез и биологическая оценка in vitro» . Молекулы . 19 (2): 2469–2480. дои : 10.3390/molecules19022469 . ПМК 6271160 . ПМИД 24566315 .
- ↑ Ученики заболели после того, как луковицу положили в суп , BBC News , 3 мая 2009 г.
- ^ Крецинг, Саша; Авраам, Гету; Зайверт, Беттина; Унгемах, Фриц Руперт; Кругель, Юте; Регенталь, Ральф (2011). «Дозозависимые рвотные эффекты амариллидного алкалоида ликорина у собак породы бигль» . Токсикон . 57 (57): 117–124. дои : 10.1016/j.токсикон.2010.10.012 . ПМИД 21055413 . Проверено 25 апреля 2017 г.
- ^ Крецинг, Саша; Авраам, Гету; Зайверт, Беттина; Унгемах, Фриц Руперт; Кругель, Юте; Регенталь, Ральф (2011). «Дозозависимые рвотные эффекты амариллидного алкалоида ликорина у собак породы бигль» . Токсикон . 57 (57): 117–124. дои : 10.1016/j.токсикон.2010.10.012 . ПМИД 21055413 . Проверено 25 апреля 2017 г.
- ^ Ликорин , определение на сайте mercksource.com.
- ^ Ян, Сандра; Зайверт, Беттина; Крецинг, Саша; Авраам, Гету; Регенталь, Ральф; Карст, Уве (2012). «Метаболические исследования амариллидных алкалоидов галантамина и ликорина на основе электрохимического моделирования в дополнение к моделям in vivo и in vitro» . Аналитика Химика Акта . 756 (756): 60–72. дои : 10.1016/j.aca.2012.10.042 . ПМИД 23176740 . Проверено 25 апреля 2017 г.
- ^ Ван, Пэн; Юань, Хуэй-Хуэй; Чжан, Сюэ; Ли, Юн-Пин; Шан, Лу-Цин; Инь, Чжэн (21 февраля 2014 г.). «Новые производные ликорина как противораковые средства: синтез и биологическая оценка in vitro» . Молекулы . 19 (2): 2469–2480. дои : 10.3390/molecules19022469 . ПМК 6271160 . ПМИД 24566315 .
- ^ Цао, Чжифэй; Фу, Чжан, Гаочуань; Бао, Ту, Цзянь; Ян, Чжоу, Цюаньшэн (2013) . избирательно ингибирует пролиферацию клеток рака яичников человека и неоваскуляризацию опухоли с очень низкой токсичностью» . Токсикологические письма . 218 (2): 174–185. doi : 10.1016/j.toxlet.2013.01.018 . PMID 23376478. Проверено 25 апреля 2017 г.
Внешние ссылки
[ редактировать ]- Хилл, РК; Джоуль, Дж.А.; Леффлер, LJ (1962). «Стереоселективный синтез d, l-α- и β-ликоранов». Журнал Американского химического общества . 84 (24): 4951–4956. дои : 10.1021/ja00883a064 .
- Вольфганг Оппольцер; Алан С. Спиви и Кристиан Г. Боше (1994). «Супрафациальность термической циклизации N-4-алкенилгидроксиламина: синтез (±)-α-ликорана и (+)-тиантина» (PDF) . Дж. Ам. хим. Соц . 116 (7): 3139–3140. дои : 10.1021/ja00086a060 . Архивировано из оригинала (PDF) 14 июня 2011 г. Проверено 4 ноября 2009 г.