Экзонный соединительный комплекс
Комплекс соединения экзонов ( EJC ) представляет собой белковый комплекс , который образуется на цепи пре-мессенджера РНК в месте соединения двух экзонов , которые были соединены вместе во время сплайсинга РНК . EJC оказывает большое влияние на трансляцию , надзор , локализацию сплайсированной мРНК и мРНК. 6 Метилирование . [1] [2] Сначала он откладывается на мРНК во время сплайсинга, а затем транспортируется в цитоплазму . Там он играет важную роль в посттранскрипционной регуляции мРНК. Считается, что комплексы соединения экзонов обеспечивают специфичную для положения память о событии сплайсинга. EJC состоит из стабильного ядра гетеротетрамера, которое служит платформой связывания для других факторов, необходимых для пути мРНК. [2] Ядро EJC содержит белок эукариотического фактора инициации 4A-III ( eIF4A-III ; DEAD-box РНК- хеликаза ), связанный с аналогом аденозинтрифосфата ( АТФ ), а также дополнительные белки Magoh и Y14 . [3] Связывание этих белков с ядерными крапчатыми доменами было недавно измерено и может регулироваться сигнальными путями PI3K/AKT/mTOR . [4] Для того чтобы произошло связывание комплекса с мРНК, фактор eIF4AIII ингибируется, останавливая гидролиз АТФ. [3] Это позволяет признать EJC как АТФ-зависимый комплекс. EJC также взаимодействует с большим количеством дополнительных белков; в первую очередь белки SR. [5] Предполагается, что эти взаимодействия важны для компактизации мРНК. [5] Роль EJC в экспорте мРНК противоречива.
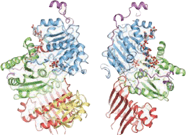
Белковые компоненты
[ редактировать ]EJC состоит из нескольких ключевых белковых компонентов: RNPS1 , Y14, SRm160 , Aly/REF и Magoh и других. [6] [7] [8] RNPS1 может функционировать как коактиватор сплайсинга, но наряду с Y14 он также принимает участие в процессе нонсенс-опосредованного распада у эукариот. [9] [10] SRm160 является еще одним коактиватором, который, как предполагается, усиливает процессинг 3'-конца мРНК. [11] [12] Считается, что белковый компонент Magoh облегчает субцитоплазматическую локализацию мРНК, в то время как Aly участвует в экспорте ядерной мРНК. [13] [14] [15] Считается, что Aly рекрутируется в комплекс соединения экзонов с помощью белка UAP56 . [16] UAP56 распознается как РНК-хеликаза, но действует как фактор сплайсинга, необходимый для ранней сборки сплайсосом. [17] Другим фактором, участвующим в пути EJC, является DEK . Известно, что этот компонент принимает участие во множестве функций: от сплайсинга до регуляции транскрипции и структуры хроматина . [18] [19] [20]
Структура
[ редактировать ]Кристаллизация . комплекса экзонов выявила структурную организацию его белковых компонентов Ядро комплекса имеет удлиненную форму с общими размерами 99х67х54х. [21] Он организован вокруг фактора eIF4AIII. Сам фактор состоит из двух разных типов конформаций вокруг мРНК: закрытой и открытой. В закрытом состоянии два домена eIF4AIII образуют сложные сайты связывания для 5'-аденилил-β,γ-имидодифосфата (ADPNP) и мРНК. [21] В открытой конформации два домена повернуты на 160 градусов относительно закрытого состояния. [18] Белковые компоненты Magoh и Y14 связываются вместе, образуя гетеродимер, расположенный на 5'-полюсе EJC. [22] [23] [24] Magoh связывается с доменом eIF4AIII посредством взаимодействия между остатками его двух С-концевых спиралей и одного конца большого β-листа . [21] Консервативные остатки в линкере между двумя доменами eIF4AIII образуют солевые мостики или водородные связи со специфическими остатками в Magoh. [21] Другая связь происходит между второй петлей β-листа Magoh и двумя доменами eIF4AIII и их линкером. [21] Между Y14 и eIF4AIII образуется только одна частичная связь. Он состоит из солевого мостика между консервативными остатками Y14 Arg108 и eIF4AIII Asp401 . [21] Если бы произошли мутации в обоих этих остатках, ассоциации Magoh-Y14 с EJC не было бы. [25]
Механизм
[ редактировать ]Во время второго этапа сплайсинга в эукариотических клетках EJC откладывается примерно на 20-24 нуклеотида от 5'-конца выше места сплайсинга (где соединяются два экзона), когда образуется лариат и экзоны лигируются вместе. [26] [27] Связывание EJC с мРНК происходит независимым от последовательности образом с образованием зрелого информационного рибонуклеопротеина (мРНП). [28] EJC остается стабильно связанным с этой мРНП, поскольку он экспортируется из ядра в цитоплазму. Белковые компоненты либо связываются с EJC, либо высвобождаются им во время транспортировки. Для того чтобы произошла транслокация мРНК через комплекс ядерных пор, гетеродимер, состоящий из NXF1 /TAP и NXT1 / p15 . с транскриптами должен связываться [29] NXF1/TAP является основным рецептором экспорта мРНК в цитоплазму. Это связано с тем, что он взаимодействует как с РНК-связывающими адаптерными белками, так и с компонентами комплекса ядерных пор . [30]
Распознавание кодона преждевременной терминации происходит во время трансляции в цитоплазме. Изображение, показанное ниже, подразумевает, что это событие является ядерным, вопреки общему мнению в этой области. Читатели должны знать, что перевод в ядре — весьма спорный вопрос, недостаточно подтвержденный данными. [ нужна ссылка ]

В бессмысленном распаде
[ редактировать ]Комплексы соединения экзонов играют важную роль в наблюдении за мРНК . Более конкретно, они обнаруживаются в нонсенс-опосредованном пути распада (NMD), при котором транскрипты мРНК с преждевременными стоп-кодонами разрушаются. При нормальной трансляции мРНК рибосома связывается с транскриптом и начинает удлинение аминокислотной цепи. Это продолжается до тех пор, пока не достигнет места соединения экзонов, которое затем смещается. Далее трансляция завершается, когда рибосома достигает терминирующего кодона . При НМД транскрипт мРНК содержит кодон преждевременной терминации (PTC) из-за нонсенс-мутации . Если этот кодон находится до сайта EJC, EJC останется связанным, вызывая распад мРНК . [31] EJC и его положение служат своего рода регулятором, определяющим, является ли транскрипт дефектным или нет.
Известно, что EJC принимают участие в НПРО и другим способом; набор факторов наблюдения UPF1 , UPF2 и UPF3 . [32] Эти белки являются наиболее важными компонентами механизма NMD. Белок EJC MAGOH, Y14 и eIF4AIII обеспечивают связывание UPF3, который действует как мост между UPF2 и UPF1, образуя тримерный комплекс. [33] Внутри этого комплекса UPF2 и UPF3 действуют совместно, стимулируя АТФазу и РНК-хеликазу UPF1. [33] Ядро EJC стабильно закрепляет комплекс UPF на мРНК и способствует регуляции основного белка UPF1. [33] Рибосомы, которые застряли на PTC, рекрутируют UPF1 посредством взаимодействия с факторами высвобождения eRF1 и eRF3 . [33] Вместе с белком SMG1 eRF1, eRF3 и UPF1 образуют комплекс SURF. Этот комплекс образует мост между рибосомой и нижележащим EJC, который связан с UPF3 и UPF2. [33] Это взаимодействие запускает фосфорилирование UPF1 с помощью SMG1, вызывая диссоциацию eRF1 и eRF3. [33] Образующийся комплекс состоит из EJC, UPF3, UPF2, фосфорилированных UPF1 и SMG1 и, в свою очередь, запускает деградацию мРНК. [33]
Примечания и ссылки
[ редактировать ]- ^ Хэ, П. Цзянбо, Сяоян; Чжан, Цзы Цзе, Лю, Чжан, Ли-шэн; Ван, Цзоу, Чжунъюй; Чен, Мэнцзе; Хэ, Чуан (февраль 2023 m6A . экзонов генов контролирует » г. ; Архитектура и экспрессию подавление мРНК ) « .
- ^ Jump up to: а б Танге, ТО; Нотт, А; Мур, MJ (июнь 2004 г.). «Постоянно растущие сложности комплекса экзонных соединений». Современное мнение в области клеточной биологии . 16 (3): 279–84. дои : 10.1016/j.ceb.2004.03.012 . ПМИД 15145352 .
- ^ Jump up to: а б Баллю Л., Маршадье Б., Баге А., Томасетто С., Серафин Б., Ле Хир Х. (2005). «Ядерный комплекс соединения экзонов фиксируется на РНК путем ингибирования активности АТФазы eIF4AIII». Нат. Структура. Мол. Биол . 12 (10): 861–9. дои : 10.1038/nsmb990 . ПМИД 16170325 . S2CID 1359792 .
- ^ Куарежма, Александр Ж.; Никерсон, Джеффри А. (2013), «Регуляция экспорта мРНК с помощью пути передачи сигнала киназы PI3/AKT», Mol Biol Cell , 24 (8): 1208–21, doi : 10.1091/mbc.E12-06-0450 , ПМК 3623641 , ПМИД 23427269
- ^ Jump up to: а б Сингх Г., Кучукурал А., Ченик С., Лешик Дж.Д., Шаффер С.А., Венг З., Мур М.Дж. (2012). «Клеточный интерактом EJC обнаруживает структуру мРНП более высокого порядка и связь белка EJC-SR» . Клетка . 151 (4): 750–64. дои : 10.1016/j.cell.2012.10.007 . ПМЦ 3522173 . ПМИД 23084401 .
- ^ Катаока, Н.; Йонг, Дж.; Ким, В.Н.; Веласкес, Ф.; Перкинсон, РА; Ван, Ф.; Дрейфус, Г. (2000). «Сплайсинг пре-мРНК отпечатывает мРНК в ядре с помощью нового РНК-связывающего белка, который персистирует в цитоплазме» . Мол Клетка . 6 (3): 673–682. дои : 10.1016/s1097-2765(00)00065-4 . ПМИД 11030346 .
- ^ Ле Хир Х., Гатфилд Д., Изаурральд Э., Мур М.Дж. (2001). «Комплекс соединения экзон-экзон обеспечивает платформу связывания для факторов, участвующих в экспорте мРНК и нонсенс-опосредованном распаде мРНК» . ЭМБО Дж . 20 (17): 4987–97. дои : 10.1093/emboj/20.17.4987 . ПМК 125616 . ПМИД 11532962 .
- ^ Ле Хир, Х.; Изаурральде, Э.; Макват, Луизиана; Мур, MJ (2000). «Сплайсосома откладывает множество белков на 20–24 нуклеотида выше экзон-экзонных соединений мРНК» . ЭМБО Дж . 19 (24): 6860–6869. дои : 10.1093/emboj/19.24.6860 . ПМК 305905 . ПМИД 11118221 .
- ^ Люкке-Андерсен, Дж.; Шу, доктор медицинских наук; Стейтц, Дж. А. (2001). «Передача положения экзон-экзонных соединений в аппаратуру наблюдения за мРНК с помощью белка RNPS1». Наука . 293 (5536): 1836–1839. Бибкод : 2001Sci...293.1836L . дои : 10.1126/science.1062786 . ПМИД 11546874 . S2CID 389385 .
- ^ Лежен, Ф.; Исигаки, Ю.; Ли, Х.; Макват, Ле (2002). «Комплекс соединения экзонов обнаруживается на мРНК, связанной с CBP80, но не связанной с eIF4E, в клетках млекопитающих: динамика ремоделирования мРНП» . ЭМБО Дж . 21 (13): 3536–3545. дои : 10.1093/emboj/cdf345 . ПМК 126094 . ПМИД 12093754 .
- ^ Маеда, А.; Бадолато, Дж.; Кобаяши, Р.; Чжан, MQ; Гардинер, Э.М.; Крайнер, Арканзас (1999). «Очистка и характеристика человеческого RNPS1: общий активатор сплайсинга пре-мРНК» . ЭМБО Дж . 18 (16): 4560–4570. дои : 10.1093/emboj/18.16.4560 . ПМК 1171530 . ПМИД 10449421 .
- ^ Маккракен, С.; Ламбермон, М.; Бленкоу, Би Джей (2002). «Коактиватор сплайсинга SRm160 способствует расщеплению 3'-конца транскрипта» . Мол. Клетка. Биол . 22 (1): 148–160. дои : 10.1128/mcb.22.1.148-160.2002 . ПМК 134228 . ПМИД 11739730 .
- ^ Ле Хир, Х.; Гатфилд, Д.; Браун, IC; Форлер, Д.; Изаурральде, Э. (2001). «Белок Mago обеспечивает связь между сплайсингом и локализацией мРНК» . Представитель ЭМБО . 2 (12): 1119–1124. doi : 10.1093/embo-reports/kve245 . ПМЦ 1084163 . ПМИД 11743026 .
- ^ Чжоу, З.; Луо, М.-Дж.; Штрассер, К.; Катахира, Дж.; Хёрт, Э.; Рид, Р. (2000). «Белок Aly связывает сплайсинг пре-мессенджерной РНК с ядерным экспортом у многоклеточных животных». Природа . 407 (6802): 401–405. Бибкод : 2000Natur.407..401Z . дои : 10.1038/35030160 . ПМИД 11014198 . S2CID 312262 .
- ^ Родригес, JP; Роде, М.; Гатфилд, Д.; Бленкоу, Би Джей; Кармо-Фонсека, М.; Изаурральде, Э. (2001). «Белки REF опосредуют экспорт сплайсированных и несплайсированных мРНК из ядра» . Учеб. Натл. акад. наук. США . 98 (3): 1030–1035. Бибкод : 2001ПНАС...98.1030Р . дои : 10.1073/pnas.98.3.1030 . ПМК 14703 . ПМИД 11158589 .
- ^ Каллен, БР (2003). «Экспорт ядерной РНК» . Дж. Клеточная наука . 116 (4): 587–597. дои : 10.1242/jcs.00268 . ПМИД 12538759 .
- ^ Гатфилд, Д.; Изаурральде, Э. (2002). «REF1/Aly и дополнительные белки комплекса экзонов необязательны для экспорта ядерной мРНК» . Дж. Клеточная Биол . 159 (4): 579–588. дои : 10.1083/jcb.200207128 . ПМК 2173090 . ПМИД 12438415 .
- ^ Jump up to: а б Алексиадис В., Вальдманн Т., Андерсен Дж., Манн М., Книпперс Р., Грусс С. (2000). «Белок, кодируемый протоонкогеном DEK, изменяет топологию хроматина и снижает эффективность репликации ДНК хроматин-специфичным образом» . Генс Дев . 14 (11): 1308–12. дои : 10.1101/gad.14.11.1308 . ПМК 316669 . ПМИД 10837023 .
- ^ МакГарви, Т.; Розонина Е.; Маккракен, С.; Ли, К.; Арнаут, Р.; Мьентес, Э.; Никерсон, Дж.А.; Оури, Д.; Гринблатт, Дж.; Гросвельд, Г.; Бленкоу, Би Джей (2000). «Белок, связанный с острым миелолейкозом, DEK, образует зависимое от сплайсинга взаимодействие с комплексами экзон-продукт» . Дж. Клеточная Биол . 150 (2): 309–320. дои : 10.1083/jcb.150.2.309 . ПМК 2180225 . ПМИД 10908574 .
- ^ Фолкнер, штат Невада; Хилфингер, Дж. М.; Марковиц, DM (2001). «Протеинфосфатаза 2А активирует промотор ВИЧ-2 посредством энхансерных элементов, включающих сайт домашних животных» . Ж. Биол. Хим . 276 (28): 25804–25812. дои : 10.1074/jbc.m006454200 . ПМИД 11320078 .
- ^ Jump up to: а б с д и ж Андерсен CB, Баллют Л., Йохансен Дж.С., Шамие Х., Нильсен К.Х., Оливейра К.Л., Педерсен Дж.С., Серафин Б., Ле Хир Х., Андерсен Г.Р. (2006). «Структура ядра соединения экзонов с захваченной АТФазой DEAD-бокса, связанной с РНК». Наука . 313 (5795): 1968–72. Бибкод : 2006Sci...313.1968A . дои : 10.1126/science.1131981 . ПМИД 16931718 . S2CID 26409491 .
- ^ Лау, СК; Дим, доктор медицины; Дрейфус, Г.; Ван Дуйн, Грузия (2003). «Структура ядра Y14-Маго экзонного соединительного комплекса» . Курс. Биол . 13 (11): 933–941. Бибкод : 2003CBio...13..933L . дои : 10.1016/s0960-9822(03)00328-2 . ПМИД 12781131 .
- ^ Фрибур, С.; Гатфилд, Д.; Изаурральде, Э. Конти (2003). «Новый способ распознавания RBD-белка в комплексе Y14-Mago». Нат. Структура. Биол . 10 (6): 433–439. дои : 10.1038/nsb926 . ПМИД 12730685 . S2CID 40116577 .
- ^ Ши Х, Сюй РМ (2003). «Кристаллическая структура комплекса Drosophila Mago nashi-Y14» . Генс Дев . 17 (8): 971–6. дои : 10.1101/gad.260403 . ЧВК 196043 . ПМИД 12704080 .
- ^ Геринг, Нильс Х.; Кунц, Иоахим Б.; Ной-Йилик, Габриэле; Брейт, Стивен; Вьегас, Марсело Х.; Хентце, Матиас В.; Кулозик, Андреас Э. (2005). «Компоненты комплекса экзон-соединение определяют различные пути нонсенс-опосредованного распада мРНК с дифференциальными требованиями к кофакторам» . Молекулярная клетка . 20 (1): 65–75. doi : 10.1016/j.molcel.2005.08.012 . ISSN 1097-2765 . ПМИД 16209946 .
- ^ Райхерт, В.Л.; Ле Хир, Х.; Юрица, М.С.; Мур, MJ (2002). «Взаимодействия 5'-экзонов внутри сплайсосомы создают основу для сложной структуры и сборки экзонных соединений» . Генс Дев . 16 (21): 2778–2791. дои : 10.1101/gad.1030602 . ПМК 187475 . ПМИД 12414731 .
- ^ Сибуя, Т.; Танге, ТО; Зоненберг, Н.; Мур, MJ (2004). «eIF4AIII связывает сплайсированную мРНК в комплексе экзонов и необходим для бессмысленно-опосредованного распада ». Нат. Структура. Мол. Биол . 11 (4): 346–351. дои : 10.1038/nsmb750 . ПМИД 15034551 . S2CID 30171314 .
- ^ Ле Хир, Х.; Изаурральде, Э.; Макват, Луизиана; Мур, MJ (2000). «Сплайсосома откладывает множество белков на 20–24 нуклеотида выше экзон-экзонных соединений мРНК» . ЭМБО Дж . 19 (24): 6860–6869. дои : 10.1093/emboj/19.24.6860 . ПМК 305905 . ПМИД 11118221 .
- ^ Рид, Р.; Хёрт, Э. (2002). «Консервативный механизм экспорта мРНК в сочетании со сплайсингом пре-мРНК» . Клетка . 108 (4): 523–531. дои : 10.1016/s0092-8674(02)00627-x . ПМИД 11909523 .
- ^ Изаурральде, Э (2002). «Новое семейство ядерных транспортных рецепторов опосредует экспорт информационной РНК в цитоплазму. Eur». Дж. Клеточная Биол . 81 (11): 577–584. дои : 10.1078/0171-9335-00273 . ПМИД 12498157 .
- ^ Чанг Ю.Ф., Имам Дж.С., Уилкинсон М.Ф. (2007). «Путь наблюдения за распадом РНК, опосредованный нонсенсом». Анну Рев Биохим . 76 : 51–74. doi : 10.1146/annurev.biochem.76.050106.093909 . ПМИД 17352659 .
- ^ Конти, Э.; Изаурральде, Э. (2005). «Бессмысленный распад мРНК: молекулярные знания и механические вариации у разных видов». Курс. Мнение. Клеточная Биол . 17 (3): 316–325. дои : 10.1016/j.ceb.2005.04.005 . ПМИД 15901503 .
- ^ Jump up to: а б с д и ж г Шамие, Хала; Баллут, Лайонел; Бонно, Фабьен; Ле Хир, Эрве (2007). «Факторы NMD UPF2 и UPF3 соединяют UPF1 с комплексом соединения экзонов и стимулируют его активность РНК-хеликазы». Структурная и молекулярная биология природы . 15 (1): 85–93. дои : 10.1038/nsmb1330 . ISSN 1545-9993 . ПМИД 18066079 . S2CID 6268216 .