ДНК-микрочип
ДНК -микрочип (также известный как ДНК- чип или биочип ) представляет собой набор микроскопических пятен ДНК, прикрепленных к твердой поверхности. Ученые используют микрочипы ДНК для измерения уровней экспрессии большого количества генов одновременно или для генотипирования нескольких областей генома. Каждое пятно ДНК содержит пикомоли (10 −12 моли ) определенной последовательности ДНК, известной как зонды (или репортеры , или олигонуклеотиды ). Это может быть короткий участок гена или который используется для гибридизации образца кДНК другой элемент ДНК , или кРНК (также называемого антисмысловой РНК) (называемого мишенью ) в условиях высокой строгости. Гибридизацию зонда-мишени обычно выявляют и количественно определяют путем обнаружения мишеней, меченных флуорофором , серебром или хемилюминесценцией , для определения относительного содержания последовательностей нуклеиновых кислот в мишени. Первоначальные массивы нуклеиновых кислот представляли собой макроматрицы размером примерно 9 см × 12 см, а первый анализ на основе компьютерных изображений был опубликован в 1981 году. [1] Его изобрел Патрик О. Браун . Примером его применения являются массивы SNP для полиморфизмов при сердечно-сосудистых заболеваниях, раке, патогенах и анализ GWAS. Он также используется для идентификации структурных вариаций и измерения экспрессии генов.
Принцип [ править ]
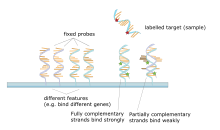
Основным принципом микрочипов является гибридизация между двумя нитями ДНК, свойство комплементарных последовательностей нуклеиновых кислот специфически спариваться друг с другом путем образования водородных связей между комплементарными парами нуклеотидных оснований . Большое количество комплементарных пар оснований в нуклеотидной последовательности означает более прочную нековалентную связь между двумя цепями. После отмывания неспецифических связующих последовательностей гибридизованными останутся только сильно спаренные цепи. Флуоресцентно меченные целевые последовательности, которые связываются с последовательностью зонда, генерируют сигнал, который зависит от условий гибридизации (например, температуры) и отмывки после гибридизации. Общая сила сигнала от пятна (объекта) зависит от количества связывания целевого образца с зондами, присутствующими в этом пятне. В микрочипах используется относительный количественный анализ, при котором интенсивность признака сравнивается с интенсивностью того же признака в других условиях, а идентичность признака определяется по его положению.

Использование и типы [ править ]

Существует множество типов массивов, и самое широкое различие заключается в том, расположены ли они пространственно на поверхности или на закодированных шариках:
- Традиционный твердофазный массив представляет собой набор упорядоченных микроскопических «пятен», называемых элементами, каждое из которых состоит из тысяч идентичных и специфических зондов, прикрепленных к твердой поверхности, такой как стеклянный , пластиковый или кремниевый биочип (широко известный как геномный чип , ДНК). чип или генный массив ). Тысячи этих особенностей можно разместить в известных местах на одном микрочипе ДНК.
- Альтернативный набор шариков представляет собой набор микроскопических полистироловых шариков, каждый из которых имеет определенный зонд и соотношение двух или более красителей, которые не мешают флуоресцентным красителям, используемым в целевой последовательности.
Микрочипы ДНК можно использовать для обнаружения ДНК (как при сравнительной геномной гибридизации ) или обнаружения РНК (чаще всего в виде кДНК после обратной транскрипции ), которая может транслироваться или не транслироваться в белки. Процесс измерения экспрессии генов с помощью кДНК называется анализом экспрессии или профилированием экспрессии .
Приложения включают в себя:
| Применение или технология | Краткое содержание |
|---|---|
| Профилирование экспрессии генов | В по профилированию мРНК или экспрессии генов эксперименте уровни экспрессии тысяч генов одновременно контролируются для изучения влияния определенных методов лечения, заболеваний и стадий развития на экспрессию генов. Например, профилирование экспрессии генов на основе микрочипов можно использовать для идентификации генов, экспрессия которых изменяется в ответ на патогены или другие организмы, путем сравнения экспрессии генов в инфицированных клетках и неинфицированных тканях. [2] |
| Сравнительная геномная гибридизация | Оценка содержания генома в различных клетках или близкородственных организмах, как первоначально описано Патриком Брауном , Джонатаном Поллаком, Эшем Ализаде и коллегами из Стэнфорда . [3] [4] |
| GeneID | Небольшие микрочипы для проверки идентификации организмов в пищевых продуктах и кормах (например, ГМО [1] ), микоплазм в культуре клеток или патогенов для выявления заболеваний, в основном сочетающие ПЦР и технологию микрочипов. |
| Иммунопреципитация хроматина на чипе | Последовательности ДНК, связанные с определенным белком, могут быть выделены путем иммунопреципитации этого белка ( ChIP ), затем эти фрагменты могут быть гибридизованы с микрочипом (например, с плиточным массивом ), что позволяет определить занятость сайта связывания белка по всему геному. Примером белка для иммунопреципитации являются модификации гистонов ( H3K27me3 , H3K4me2, H3K9me3 и т. д.), белок группы Polycomb (PRC2:Suz12, PRC1:YY1) и белок группы триторакса (Ash1) для изучения эпигенетического ландшафта или РНК-полимераза II для изучения. Транскрипционный ландшафт . |
| ID плотины | Аналогично ChIP , геномные области, связанные с интересующим белком, могут быть выделены и использованы для зондирования микроматрицы для определения занятости сайта связывания. В отличие от ChIP, DamID не требует антител, но использует метилирование аденина вблизи сайтов связывания белка для избирательной амплификации этих областей, введенных путем экспрессии небольших количеств интересующего белка, слитого с бактериальной ДНК-аденин-метилтрансферазой . |
| Обнаружение SNP | Выявление однонуклеотидного полиморфизма среди аллелей внутри или между популяциями. [5] В нескольких приложениях микрочипов используется обнаружение SNP, включая генотипирование , судебно-медицинский анализ, измерение предрасположенности к заболеванию, выявление кандидатов на лекарственные средства, оценку мутаций зародышевой линии у людей или соматических мутаций при раке, оценку потери гетерозиготности или анализ генетического сцепления . |
| Альтернативное обнаружение сплайсинга | используются В конструкции массива соединений экзонов зонды, специфичные для ожидаемых или потенциальных сайтов сплайсинга предсказанных экзонов гена. Он имеет промежуточную плотность или охват по сравнению с типичным массивом экспрессии генов (с 1–3 зондами на ген) и массивом геномных плиток (с сотнями или тысячами зондов на ген). Он используется для анализа экспрессии альтернативных форм сплайсинга гена. Массивы экзонов имеют другую конструкцию, в них используются зонды, предназначенные для обнаружения каждого отдельного экзона известных или предсказанных генов, и их можно использовать для обнаружения различных изоформ сплайсинга. |
| слитых генов Микроматрица | Микрочип генов Fusion может обнаруживать транскрипты слияния, например , из образцов рака. В основе этого лежит принцип альтернативного сращивания микрочипов. Стратегия дизайна олигонуклеотидов позволяет комбинированные измерения соединений химерных транскриптов с измерениями экзонов отдельных партнеров слияния. |
| Мозаичный массив | Массивы тайлов генома состоят из перекрывающихся зондов, предназначенных для плотного представления интересующей геномной области, иногда размером с всю хромосому человека. Цель состоит в том, чтобы эмпирически обнаружить экспрессию транскриптов или альтернативно сплайсированных форм , которые, возможно, не были ранее известны или предсказаны. |
| Двухцепочечные микрочипы B-ДНК | Правосторонние двухцепочечные микрочипы B-ДНК можно использовать для характеристики новых лекарств и биологических препаратов, которые можно использовать для связывания определенных участков иммобилизованной интактной двухцепочечной ДНК. Этот подход можно использовать для ингибирования экспрессии генов. [6] [7] Они также позволяют охарактеризовать их структуру в различных условиях окружающей среды. |
| Двухцепочечные микрочипы Z-ДНК | Микрочипы левосторонней двухцепочечной Z-ДНК можно использовать для идентификации коротких последовательностей альтернативной структуры Z-ДНК, расположенных внутри более длинных участков правосторонних генов B-ДНК (например, усиление транскрипции, рекомбинация, редактирование РНК). [6] [7] Микрочипы также позволяют охарактеризовать их структуру в различных условиях окружающей среды. |
| Микрочипы многоцепочечной ДНК (микрочипы триплексной ДНК и микрочипы квадруплексной ДНК) | Микрочипы многоцепочечной ДНК и РНК можно использовать для идентификации новых лекарств, которые связываются с этими последовательностями многоцепочечных нуклеиновых кислот. Этот подход можно использовать для открытия новых лекарств и биологических препаратов, способных ингибировать экспрессию генов. [6] [7] [8] [9] Эти микрочипы также позволяют охарактеризовать их структуру в различных условиях окружающей среды. |
Специализированные массивы, адаптированные к конкретным культурам, становятся все более популярными в приложениях молекулярной селекции . В будущем их можно будет использовать для проверки сеянцев на ранних стадиях, чтобы снизить количество ненужных саженцев, опробованных в селекционных операциях. [10]
Изготовление [ править ]
Микроматрицы могут быть изготовлены по-разному, в зависимости от количества исследуемых зондов, затрат, требований к настройке и типа задаваемого научного вопроса. Массивы коммерческих поставщиков могут содержать от 10 до 5 миллионов и более датчиков микрометрового масштаба.
Обнаруженные in массивы situ синтезированные и
Микрочипы могут быть изготовлены с использованием различных технологий, включая печать тонкозаостренными иголками на предметных стеклах, фотолитографию с использованием готовых масок, фотолитографию с использованием динамических микрозеркальных устройств, струйную печать, [11] [12] или электрохимия на микроэлектродных матрицах.
В пятнистых микрочипах зондами являются олигонуклеотиды , кДНК или небольшие фрагменты продуктов ПЦР , соответствующие мРНК . Зонды синтезируются перед нанесением на поверхность матрицы, а затем «наносятся» на стекло. Распространенный подход использует набор тонких штифтов или игл, управляемых роботизированной рукой, которую погружают в лунки, содержащие зонды ДНК, а затем помещают каждый зонд в определенные места на поверхности массива. Полученная «сетка» зондов представляет собой профили нуклеиновых кислот приготовленных зондов и готова к приему комплементарных «мишеней» кДНК или кРНК, полученных из экспериментальных или клинических образцов.Этот метод используется учеными-исследователями по всему миру для производства печатных микроматриц в собственных лабораториях. Эти массивы можно легко настроить для каждого эксперимента, поскольку исследователи могут выбирать зонды и места печати на массивах, синтезировать зонды в своей собственной лаборатории (или сотрудничающем учреждении) и обнаруживать массивы. Затем они могут генерировать собственные меченые образцы для гибридизации, гибридизировать образцы с массивом и, наконец, сканировать массивы с помощью собственного оборудования. Это обеспечивает относительно недорогую микроматрицу, которую можно настроить для каждого исследования, и позволяет избежать затрат на приобретение часто более дорогих коммерческих матриц, которые могут представлять огромное количество генов, не представляющих интереса для исследователя.Существуют публикации, в которых указывается, что точечные микрочипы собственного производства могут не обеспечивать тот же уровень чувствительности, что и коммерческие олигонуклеотидные матрицы. [13] возможно, из-за небольших размеров партий и снижения эффективности печати по сравнению с промышленным производством олигомассивов.
В олигонуклеотидных микрочипах зонды представляют собой короткие последовательности, сконструированные так, чтобы соответствовать частям последовательности известных или предсказанных открытых рамок считывания . Хотя олигонуклеотидные зонды часто используются в «пятнистых» микрочипах, термин «матрица олигонуклеотидов» чаще всего относится к конкретной технологии производства. Массивы олигонуклеотидов производятся путем печати коротких олигонуклеотидных последовательностей, предназначенных для представления одного гена или семейства вариантов сплайсинга генов, путем синтеза этой последовательности непосредственно на поверхности массива вместо депонирования неповрежденных последовательностей. Последовательности могут быть длиннее (60-мерные зонды, такие как конструкция Agilent ) или короче (25-мерные зонды, производимые Affymetrix ) в зависимости от желаемой цели; более длинные зонды более специфичны для отдельных генов-мишеней, более короткие зонды можно обнаружить в более высокой плотности по всему массиву, и их дешевле производить.Один из методов, используемых для создания массивов олигонуклеотидов, включает фотолитографический синтез (Affymetrix) на кремнеземной подложке, где свет и светочувствительные маскирующие агенты используются для «построения» последовательности по одному нуклеотиду за раз по всему массиву. [14] Каждый применимый зонд избирательно «демаскируется» перед погружением массива в раствор одного нуклеотида, затем происходит реакция маскировки, и следующий набор зондов демаскируется при подготовке к воздействию другого нуклеотида. После многих повторений последовательности каждого зонда становятся полностью построенными. Совсем недавно технология Maskless Array Synthesis от NimbleGen Systems объединила гибкость с большим количеством датчиков. [15]
Двухканальное и одноканальное обнаружение [ править ]

Двухцветные микрочипы или двухканальные микрочипы обычно гибридизируются с кДНК, полученной из двух образцов для сравнения (например, пораженной ткани и здоровой ткани), и которые мечены двумя разными флуорофорами . [16] Флуоресцентные красители, обычно используемые для мечения кДНК, включают Cy 3, который имеет длину волны излучения флуоресценции 570 нм (что соответствует зеленой части светового спектра), и Cy 5 с длиной волны излучения флуоресценции 670 нм (что соответствует красной части спектра света). световой спектр). который затем сканируют в сканере микрочипов для визуализации флуоресценции двух флуорофоров после возбуждения лазерным Два образца кДНК, меченных Cy, смешивают и гибридизуют в один микрочип , лучом определенной длины волны. Относительные интенсивности каждого флуорофора затем можно использовать в анализе на основе соотношений для идентификации генов с повышающей и понижающей регуляцией. [17]
Олигонуклеотидные микрочипы часто содержат контрольные зонды, предназначенные для гибридизации с шипами РНК . Степень гибридизации между вставками и контрольными зондами используется для нормализации результатов гибридизации для целевых зондов. Хотя абсолютные уровни экспрессии генов могут быть определены в двухцветной матрице в редких случаях, относительные различия в экспрессии между различными пятнами внутри образца и между образцами являются предпочтительным методом анализа данных для двухцветной системы. Примеры поставщиков таких микрочипов включают Agilent с их платформой Dual-Mode, Eppendorf с их платформой DualChip для колориметрического мечения Silverquant и TeleChem International с Arrayit .
В одноканальных микрочипах или одноцветных микрочипах матрицы предоставляют данные об интенсивности для каждого зонда или набора зондов, указывающие на относительный уровень гибридизации с меченой мишенью. Однако на самом деле они не указывают уровни распространенности гена, а скорее относительную численность по сравнению с другими образцами или условиями при обработке в том же эксперименте. Каждая молекула РНК сталкивается с ошибками протокола и конкретной партии на этапах амплификации, мечения и гибридизации эксперимента, что делает сравнение между генами для одного и того же микрочипа неинформативным. Сравнение двух условий для одного и того же гена требует двух отдельных гибридизаций с одним красителем. Несколько популярных одноканальных систем — это Affymetrix «Gene Chip», Illumina «Bead Chip», одноканальные массивы Agilent, массивы Applied Microarrays «CodeLink» и Eppendorf «DualChip & Silverquant». Одно из преимуществ системы с одним красителем заключается в том, что аберрантный образец не может повлиять на необработанные данные, полученные из других образцов, поскольку каждый чип массива подвергается воздействию только одного образца (в отличие от двухцветной системы, в которой один -качественная выборка может существенно повлиять на общую точность данных, даже если другая выборка была высокого качества). Еще одним преимуществом является то, что данные легче сравнивать с массивами из разных экспериментов, если учтены групповые эффекты.
В некоторых ситуациях одноканальная микроматрица может быть единственным выбором. Предполагать необходимо сравнивать образцы: тогда количество экспериментов, требуемых с использованием двухканальных массивов, быстро становится невыполнимым, если только образец не используется в качестве эталона.
| количество образцов | одноканальный микрочип | двухканальный микрочип | двухканальный микрочип (со ссылкой) |
|---|---|---|---|
| 1 | 1 | 1 | 1 |
| 2 | 2 | 1 | 1 |
| 3 | 3 | 3 | 2 |
| 4 | 4 | 6 | 3 |
Типичный протокол [ править ]

Это пример эксперимента с микрочипом ДНК , который включает детали для конкретного случая, чтобы лучше объяснить эксперименты с микрочипом ДНК, а также перечисляет модификации для РНК или других альтернативных экспериментов.
- Два образца, подлежащие сравнению (парное сравнение), выращивают/приобретают. В этом примере обработанный образец ( случай ) и необработанный образец ( контроль ).
- Нуклеиновая кислота, представляющая интерес, очищается: это может быть РНК для профилирования экспрессии , ДНК для сравнительной гибридизации или ДНК/РНК, связанная с определенным белком, который подвергается иммунопреципитации ( ChIP-на-чипе ) для эпигенетических или регуляторных исследований. В этом примере общая РНК выделяется (как ядерная, так и цитоплазматическая ) с помощью экстракции тиоцианатом гуанидиния, фенола и хлороформа (например, Тризол ), которая изолирует большую часть РНК (в то время как колоночные методы имеют отсечение 200 нуклеотидов) и, если все сделано правильно, имеет лучшую чистоту.
- Очищенную РНК анализируют на качество (путем капиллярного электрофореза ) и количество (например, с помощью NanoDrop или NanoPhotometer спектрометра ). Если материал приемлемого качества и присутствует в достаточном количестве (например, >1 мкг , хотя необходимое количество зависит от платформы микрочипа), эксперимент можно продолжить.
- Меченый продукт получают посредством обратной транскрипции с последующей необязательной ПЦР- амплификацией. РНК подвергается обратной транскрипции либо с помощью полиТ-праймеров (которые амплифицируют только мРНК ), либо с помощью случайных праймеров (которые амплифицируют всю РНК, большая часть которой представляет собой рРНК ). Микрочипы микроРНК лигируют олигонуклеотид с очищенной малой РНК (выделенной с помощью фракционатора), которая затем подвергается обратной транскрипции и амплификации.
- Метка добавляется либо на этапе обратной транскрипции, либо после амплификации, если она проводится. Смысловая ; маркировка зависит от микрочипа например, если метка добавляется к смеси RT, кДНК является антисмысловой, а зонд микрочипа является смысловым, за исключением случаев отрицательного контроля.
- Этикетка обычно флуоресцентная ; только одна машина использует радиометки .
- Маркировка может быть прямой (не используется) или косвенной (требуется этап сопряжения). Для двухканальных массивов стадия связывания происходит перед гибридизацией с использованием ( аминоаллилуридинтрифосфата аминоаллил- UTP или aaUTP) и амино-реактивных красителей NHS (таких как цианиновые красители ); для одноканальных массивов стадия связывания происходит после гибридизации с использованием биотина и меченого стрептавидина . Модифицированные нуклеотиды (обычно в соотношении 1 aaUTP: 4 TTP ( тимидинтрифосфат )) добавляются ферментативно в низком соотношении к нормальным нуклеотидам, что обычно приводит к образованию 1 на каждые 60 оснований. Затем ааДНК очищают на колонке (с использованием фосфатного буферного раствора, поскольку Трис содержит аминогруппы). Аминоаллильная группа представляет собой аминогруппу на длинном линкере, прикрепленном к нуклеиновому основанию, которое реагирует с реактивным красителем.
- Форма репликации, известная как переворот красителя, может быть использована для контроля артефактов красителя в двухканальных экспериментах; для переворота красителя используется второй слайд с поменянными местами метками (образец, который был помечен Cy3 на первом слайде, помечен Cy5, и наоборот). В этом примере аминоаллил -UTP присутствует в обратно транскрибируемой смеси.
- Затем меченые образцы смешивают с запатентованным раствором для гибридизации , который может состоять из SDS , SSC , декстрансульфата , блокирующего агента (например, ДНК Cot-1 , ДНК спермы лосося, ДНК тимуса теленка, PolyA или PolyT), раствора Денхардта , или формамин .
- Смесь денатурируют и добавляют в отверстия микрочипа. Отверстия герметизируют и микрочип гибридизируют либо в гибридной печи, где микрочип перемешивают вращением, либо в смесителе, где микрочип перемешивают путем переменного давления в точечных отверстиях.
- После ночной гибридизации все неспецифическое связывание смывается (SDS и SSC).
- Микрочип высушивается и сканируется с помощью аппарата, который использует лазер для возбуждения красителя и измеряет уровни излучения с помощью детектора.
- На изображение нанесена сетка с помощью шаблона, и интенсивность каждого признака (состоящего из нескольких пикселей) определяется количественно.
- Необработанные данные нормализуются; Самый простой метод нормализации — вычесть фоновую интенсивность и масштаб так, чтобы общие интенсивности признаков двух каналов были равны, или использовать интенсивность эталонного гена для расчета t-значения для всех интенсивностей. Более сложные методы включают z-отношение , регрессию лесса и лоуэсса и RMA (робастный многочиповый анализ) для чипов Affymetrix (одноканальный кремниевый чип, in situ ). короткие олигонуклеотиды, синтезированные
Микрочипы и биоинформатика [ править ]

Появление недорогих экспериментов на микрочипах создало несколько конкретных проблем биоинформатики: [19] множественные уровни репликации в экспериментальном дизайне ( Experimental design ); количество платформ и независимых групп и формат данных ( Стандартизация ); статистическая обработка данных ( анализ данных ); сопоставление каждого зонда с транскриптом мРНК , который он измеряет ( Аннотация ); огромный объем данных и возможность поделиться ими ( хранилище данных ).
Экспериментальный дизайн [ править ]
Из-за биологической сложности экспрессии генов соображения по поводу планирования эксперимента, которые обсуждаются в статье о профилировании экспрессии, имеют решающее значение, если на основе данных можно сделать статистически и биологически обоснованные выводы.
При планировании эксперимента с микрочипом следует учитывать три основных элемента. Во-первых, репликация биологических образцов необходима для того, чтобы сделать выводы из эксперимента. Во-вторых, технические повторы (например, два образца РНК, полученные из каждой экспериментальной единицы) могут помочь количественно оценить точность. Биологические повторы включают независимые экстракции РНК. Технические реплики могут представлять собой две аликвоты одного и того же экстракта. В-третьих, пятна каждого клона кДНК или олигонуклеотида присутствуют в виде реплик (по крайней мере, дубликатов) на предметном стекле микрочипа, чтобы обеспечить определенную техническую точность при каждой гибридизации. Крайне важно обсудить информацию о подготовке и обращении с пробами, чтобы помочь идентифицировать независимые единицы в эксперименте и избежать завышенных оценок статистической значимости . [20]
Стандартизация [ править ]
Данными микроматриц трудно обмениваться из-за отсутствия стандартизации в изготовлении платформ, протоколов анализа и методов анализа. Это представляет собой проблему совместимости в биоинформатике . Различные массовые проекты с открытым исходным кодом пытаются облегчить обмен и анализ данных, полученных с помощью непатентованных чипов:
Например, контрольный список «Минимальная информация об эксперименте с микрочипами» ( MIAME ) помогает определить уровень детализации, который должен существовать, и принимается многими журналами в качестве требования для подачи статей, включающих результаты микрочипов. Но MIAME не описывает формат информации, поэтому, хотя многие форматы могут поддерживать требования MIAME, по состоянию на 2007 г. [update] ни один формат не позволяет проверить полное семантическое соответствие. США (FDA) реализует «Проект контроля качества MicroArray (MAQC)» Управление по санитарному надзору за качеством пищевых продуктов и медикаментов с целью разработки стандартов и показателей контроля качества, которые в конечном итоге позволят использовать данные MicroArray при разработке лекарств, клинической практике и принятии нормативных решений. . [21] Общество MGED разработало стандарты представления результатов экспериментов по экспрессии генов и соответствующие аннотации.
Анализ данных [ править ]

Наборы данных микрочипов обычно очень велики, и на точность анализа влияет ряд переменных. Статистические задачи включают учет влияния фонового шума и соответствующую нормализацию данных. Методы нормализации могут подходить для конкретных платформ, а в случае коммерческих платформ анализ может быть запатентованным. [22] Алгоритмы, влияющие на статистический анализ, включают:
- Анализ изображения: привязка к сетке, точечное распознавание сканированного изображения (алгоритм сегментации), удаление или маркировка некачественных и малоинтенсивных признаков (так называемое маркирование ).
- Обработка данных: вычитание фона (на основе глобального или локального фона), определение интенсивностей пятен и отношений интенсивностей, визуализация данных (например, см. график MA ) и логарифмическое преобразование отношений, глобальная или локальная нормализация отношений интенсивностей и сегментация на различные области количества копий с использованием алгоритмов обнаружения шагов . [23]
- Анализ обнаружения классов. Этот аналитический подход, иногда называемый неконтролируемой классификацией или обнаружением знаний, пытается определить, группируются ли в группы микрочипы (объекты, пациенты, мыши и т. д.) или гены. Идентификация естественно существующих групп объектов (микрочипов или генов), которые группируются вместе, может позволить обнаружить новые группы, о существовании которых ранее не было известно. Во время анализа обнаружения знаний с данными микрочипов ДНК можно использовать различные методы классификации без присмотра для идентификации новых кластеров (классов) массивов. [24] Этот тип подхода не основан на гипотезах, а скорее основан на итеративном распознавании образов или статистических методах обучения для поиска «оптимального» количества кластеров в данных. Примеры методов неконтролируемого анализа включают самоорганизующиеся карты, нейронный газ, кластерный анализ k-средних, [25] иерархический кластерный анализ, кластеризация на основе обработки геномных сигналов и кластерный анализ на основе моделей. Для некоторых из этих методов пользователю также необходимо определить меру расстояния между парами объектов. Хотя обычно используется коэффициент корреляции Пирсона, в литературе было предложено и оценено несколько других показателей. [26] Входные данные, используемые в анализе обнаружения классов, обычно основаны на списках генов, имеющих высокую информативность (низкий уровень шума), основанную на низких значениях коэффициента вариации или высоких значениях энтропии Шеннона и т. д. Определение наиболее вероятного или оптимального количества кластеры, полученные в результате неконтролируемого анализа, называется валидностью кластера. Некоторыми часто используемыми показателями достоверности кластера являются индекс силуэта, индекс Дэвиса-Булдина, [27] Индекс Данна или Гильберта статистика.
- Анализ прогнозирования классов. Этот подход, называемый контролируемой классификацией, создает основу для разработки прогнозирующей модели, в которую могут быть введены будущие неизвестные тестовые объекты, чтобы предсказать наиболее вероятное членство тестовых объектов в классе. Контролируемый анализ [24] для прогнозирования классов включает использование таких методов, как линейная регрессия, k-ближайший сосед, квантование вектора обучения, анализ дерева решений, случайные леса, наивный Байес, логистическая регрессия, ядерная регрессия, искусственные нейронные сети, машины опорных векторов, сочетание экспертов и контролируемый нервный газ. Кроме того, используются различные метаэвристические методы, такие как генетические алгоритмы , самоадаптация ковариационной матрицы, оптимизация роя частиц и оптимизация муравьиных колоний . Входные данные для прогнозирования класса обычно основаны на отфильтрованных списках генов, предсказывающих класс, определяемых с использованием классических тестов гипотез (следующий раздел), индекса разнообразия Джини или прироста информации (энтропии).
- Статистический анализ, основанный на гипотезах: выявление статистически значимых изменений в экспрессии генов обычно осуществляется с помощью t-критерия , ANOVA , байесовского метода. [28] Методы испытаний Манна-Уитни , адаптированные к наборам данных микрочипов и учитывающие множественные сравнения. [29] или кластерный анализ . [30] Эти методы оценивают статистическую мощность на основе вариаций данных и количества повторов эксперимента и могут помочь свести к минимуму ошибки типа I и типа II в анализе. [31]
- Уменьшение размеров. Аналитики часто уменьшают количество измерений (генов) перед анализом данных. [24] Это может включать в себя линейные подходы, такие как анализ главных компонентов (PCA) или нелинейное обучение многообразию (дистанционное метрическое обучение) с использованием PCA ядра, карт диффузии, собственных карт Лапласа, локального линейного встраивания, локально сохраняющих проекций и отображения Сэммона.
- Сетевые методы: статистические методы, которые принимают во внимание основную структуру генных сетей, представляя либо ассоциативные, либо причинные взаимодействия или зависимости между генными продуктами. [32] Анализ сети взвешенной совместной экспрессии генов широко используется для идентификации модулей совместной экспрессии и внутримодульных генов-концентраторов. Модули могут соответствовать типам клеток или путям. Внутримодульные концентраторы с высокой степенью связи лучше всего представляют соответствующие модули.
Данные микрочипов могут потребовать дальнейшей обработки, направленной на уменьшение размерности данных, чтобы облегчить их понимание и более целенаправленный анализ. [33] Другие методы позволяют анализировать данные, состоящие из небольшого количества биологических или технических повторов ; например, тест Local Pooled Error (LPE) объединяет стандартные отклонения генов с одинаковыми уровнями экспрессии, чтобы компенсировать недостаточную репликацию. [34]
Аннотация [ править ]
Связь между зондом и мРНК , которую он должен обнаружить, нетривиальна. [35] Некоторые мРНК могут перекрестно гибридизовать зонды в массиве, которые должны обнаруживать другую мРНК. Кроме того, мРНК могут испытывать систематическую ошибку амплификации, специфичную для последовательности или молекулы. В-третьих, зонды, предназначенные для обнаружения мРНК определенного гена, могут полагаться на геномную информацию EST , которая неправильно связана с этим геном.
Хранилище данных [ править ]
Данные микрочипов оказались более полезными по сравнению с другими аналогичными наборами данных. Огромный объем данных, специализированные форматы (такие как MIAME ) и усилия по курированию, связанные с наборами данных, требуют специализированных баз данных для хранения данных. Ряд решений для хранения данных с открытым исходным кодом, таких как InterMine и BioMart , были созданы специально для интеграции различных наборов биологических данных, а также для поддержки анализа.
Альтернативные технологии [ править ]
Достижения в области массового параллельного секвенирования привели к разработке технологии RNA-Seq , которая позволяет использовать комплексный подход к транскриптому для характеристики и количественной оценки экспрессии генов. [36] [37] В отличие от микрочипов, для которых необходимо наличие эталонного генома и транскриптома, прежде чем можно будет разработать сам микрочип, RNA-Seq также можно использовать для новых модельных организмов, геном которых еще не секвенирован. [37]
Глоссарий [ править ]
- Массив пространственно или слайд — это набор объектов, расположенных в двумерной сетке, расположенных в столбцах и строках.
- Блок или подмассив : группа пятен, обычно создаваемая за один цикл печати; несколько подмассивов/блоков образуют массив.
- Случай/контроль : парадигма экспериментального дизайна, особенно подходящая для двухцветной системы массивов, в которой состояние, выбранное в качестве контроля (например, здоровая ткань или состояние), сравнивается с измененным состоянием (например, больная ткань или состояние).
- Канал : выход флуоресценции , записанный в сканере для отдельного флуорофора , может быть даже ультрафиолетовым.
- Переворот красителя , замена красителя или флюора обращение : взаимное мечение мишеней ДНК двумя красителями для учета систематической ошибки красителя в экспериментах.
- Сканер : прибор, используемый для обнаружения и количественной оценки интенсивности флуоресценции пятен на предметном стекле микрочипа путем избирательного возбуждения флуорофоров лазером и измерения флуоресценции с помощью фильтрующей (оптической) системы фотоумножителя .
- Пятно или особенность : небольшая область на предметном стекле, содержащая пикомоли определенных образцов ДНК.
- Другие соответствующие термины см.:
См. также [ править ]
- Транскриптомные технологии
- MAGICчип
- Методы микроматричного анализа
- Базы данных микрочипов
- Цианиновые красители, такие как Cy3 и Cy5, обычно используются в качестве флуорофоров с микрочипами.
- Анализ генных чипов
- Анализ значимости микрочипов
- Микрочип олигонуклеотидов, специфичных к метилированию
- Микрофлюидика или лаборатория на чипе
- Патогеномика
- Фенотипический микрочип
- Системная биология
- Полногеномное секвенирование
Ссылки [ править ]
- ^ Тауб, Флойд (1983). «Лабораторные методы: последовательные сравнительные гибридизации, анализируемые с помощью компьютерной обработки изображений, могут идентифицировать и количественно определять регулируемые РНК». ДНК . 2 (4): 309–327. дои : 10.1089/dna.1983.2.309 . ПМИД 6198132 .
- ^ Адомас А; Хеллер Г; Олсон А; Осборн Дж; Карлссон М; Нахалкова Ю; Ван Зил Л; Седеров Р; Стенлид Дж; Финли Р; Асьегбу ФО (2008). «Сравнительный анализ количества транскриптов у Pinus sylvestris после заражения сапротрофным, патогенным или мутуалистическим грибом». Физиол дерева . 28 (6): 885–897. дои : 10.1093/treephys/28.6.885 . ПМИД 18381269 .
- ^ Поллак-младший; Перу CM; Ализаде А.А.; Эйзен М.Б.; Пергаменщиков А; Уильямс CF; Джеффри СС; Ботштейн Д; Браун ПО (1999). «Полногеномный анализ изменений числа копий ДНК с использованием микрочипов кДНК» . Нат Жене . 23 (1): 41–46. дои : 10.1038/12640 . ПМИД 10471496 . S2CID 997032 .
- ^ Моран Дж; Стоукс С; Тьюс С; Хубе Б; Коулман, округ Колумбия; Салливан Д. (2004). «Сравнительная геномика с использованием микрочипов ДНК Candida albicans выявила отсутствие и расхождение генов, связанных с вирулентностью, у Candida dubliniensis» . Микробиология . 150 (Часть 10): 3363–3382. дои : 10.1099/mic.0.27221-0 . hdl : 2262/6097 . ПМИД 15470115 .
- ^ Хасиа Дж.Г.; Фан Джей Би; Райдер О; Джин Л; Эджмон К; Гандур Дж; Майер Р.А.; Солнце Б; Се Л; Роббинс CM; Броды LC; Ван Д; Лендер ES; Липшуц Р; Фодор СП; Коллинз Ф.С. (1999). «Определение предковых аллелей однонуклеотидных полиморфизмов человека с использованием массивов олигонуклеотидов высокой плотности». Нат Жене . 22 (2): 164–167. дои : 10.1038/9674 . ПМИД 10369258 . S2CID 41718227 .
- ↑ Перейти обратно: Перейти обратно: а б с Ганья, Клод Э.; Ламберт, В. Кларк (1 мая 2009 г.). «Новые многоцепочечные альтернативные микрочипы плазмидной и спиральной переходной ДНК и РНК: значение для терапии». Фармакогеномика . 10 (5): 895–914. дои : 10.2217/стр.09.27 . ISSN 1744-8042 . ПМИД 19450135 .
- ↑ Перейти обратно: Перейти обратно: а б с Ганья, Клод Э.; Кларк Ламберт, В. (1 марта 2007 г.). «Клеточная биология, хемогеномика и хемопротеомика - применение к открытию лекарств». Мнение экспертов об открытии лекарств . 2 (3): 381–401. дои : 10.1517/17460441.2.3.381 . ISSN 1746-0441 . ПМИД 23484648 . S2CID 41959328 .
- ^ Мукерджи, Анирбан; Васкес, Карен М. (1 августа 2011 г.). «Триплексная технология в исследованиях повреждений ДНК, репарации ДНК и мутагенезе» . Биохимия . 93 (8): 1197–1208. дои : 10.1016/j.biochi.2011.04.001 . ISSN 1638-6183 . ПМЦ 3545518 . ПМИД 21501652 .
- ^ Родос, Даниэла; Липпс, Ханс Дж. (15 октября 2015 г.). «G-квадруплексы и их регуляторная роль в биологии» . Исследования нуклеиновых кислот . 43 (18): 8627–8637. дои : 10.1093/nar/gkv862 . ISSN 1362-4962 . ПМК 4605312 . ПМИД 26350216 .
- ^ Рашид, Авайс; Хао, Юаньфэн; Ся, Сяньчунь; Хан, Авайс; Сюй, Юнби; Варшни, Раджив К.; Он, Чжунху (2017). «Чипы селекции сельскохозяйственных культур и платформы генотипирования: прогресс, проблемы и перспективы» (PDF) . Молекулярный завод . 10 (8). Chin Acad Sci + Chin Soc Plant Bio + Shanghai Inst Bio Sci ( Elsevier ): 1047–1064. дои : 10.1016/j.molp.2017.06.008 . ISSN 1674-2052 . ПМИД 28669791 . S2CID 33780984 .
- ^ Методы J Biochem Biophys. 2000, 16 марта; 42(3): 105–10. ДНК-печать: использование стандартного струйного принтера для переноса нуклеиновых кислот на твердые носители. Гольдманн Т., Гонсалес Дж.С.
- ^ Прославленный C; и др. (2004). «POSaM: быстрый, гибкий, струйный синтезатор олигонуклеотидов и микрочип с открытым исходным кодом» . Геномная биология . 5 (8): 58 р. дои : 10.1186/gb-2004-5-8-r58 . ПМК 507883 . ПМИД 15287980 .
- ^ Баммлер Т., Бейер Р.П.; Консорциум, участники исследований в области токсикогеномики; Керр, X; Цзин, LX; Лапидус, С; Лазарев Д.А.; Паулес, РС; Ли, Дж.Л.; Филлипс, Т.О. (2005). «Стандартизация глобального анализа экспрессии генов между лабораториями и между платформами». Нат-методы . 2 (5): 351–356. дои : 10.1038/nmeth754 . ПМИД 15846362 . S2CID 195368323 .
- ^ Пиз переменного тока; Солас Д; Салливан Э.Дж.; Кронин МТ; Холмс КП; Фодор С.П. (1994). «Светогенерируемые олигонуклеотидные массивы для быстрого анализа последовательностей ДНК» . ПНАС . 91 (11): 5022–5026. Бибкод : 1994PNAS...91.5022P . дои : 10.1073/pnas.91.11.5022 . ПМК 43922 . ПМИД 8197176 .
- ^ Нувайсир EF; Хуан В; Альберт Т.Дж.; Сингх Дж; Нувайсир К; Питас А; Ричмонд Т; Горский Т; Берг Дж.П.; Баллин Дж; Маккормик М; Нортон Дж; Поллок Т; Сумвальт Т; Мясник Л; Портер Д; Молла М; Зал С; Блаттнер Ф; Суссман М.Р.; Уоллес Р.Л.; Серрина Ф; Грин РД (2002). «Анализ экспрессии генов с использованием массивов олигонуклеотидов, полученных с помощью безмасочной фотолитографии» . Геном Рез . 12 (11): 1749–1755. дои : 10.1101/гр.362402 . ПМК 187555 . ПМИД 12421762 .
- ^ Шалон Д; Смит С.Дж.; Браун ПО (1996). «Система микрочипов ДНК для анализа сложных образцов ДНК с использованием гибридизации двухцветных флуоресцентных зондов» . Геном Рез . 6 (7): 639–645. дои : 10.1101/гр.6.7.639 . ПМИД 8796352 .
- ^ Тан Т; Франсуа Н; Глатиньи А; Агьер Н; Муччелли М.Х.; Аггербек Л; Делакруа Х (2007). «Оценка коэффициента экспрессии в экспериментах с двухцветными микрочипами значительно улучшается за счет исправления несовпадения изображений» . Биоинформатика . 23 (20): 2686–2691. doi : 10.1093/биоинформатика/btm399 . ПМИД 17698492 .
- ^ Шафи, Томас; Лоу, Рохан (2017). «Строение генов эукариот и прокариот» . Викижурнал медицины . 4 (1). дои : 10.15347/wjm/2017.002 . ISSN 2002-4436 .
- ^ Тинкер, Анна В.; Буссютас, Алекс; Боутелл, Дэвид Д.Л. (2006). «Проблемы использования микрочипов экспрессии генов для изучения рака человека» . Раковая клетка . 9 (5): 333–339. дои : 10.1016/j.ccr.2006.05.001 . ISSN 1535-6108 .
- ^ Черчилль, Джорджия (2002). «Основы экспериментального проектирования микрочипов кДНК» (PDF) . Природная генетика . добавка. 32 : 490–5. дои : 10.1038/ng1031 . ПМИД 12454643 . S2CID 15412245 . Архивировано из оригинала (PDF) 8 мая 2005 года . Проверено 12 декабря 2013 г.
- ^ Центр токсикоинформатики НКТР - Проект MAQC
- ^ «Просигна | Алгоритм Просигны» . prosigna.com . Проверено 22 июня 2017 г.
- ^ Литтл, Массачусетс; Джонс, Н.С. (2011). «Обобщенные методы и решатели для кусочно-постоянных сигналов: Часть I» (PDF) . Труды Королевского общества А. 467 (2135): 3088–3114. дои : 10.1098/rspa.2010.0671 . ПМК 3191861 . ПМИД 22003312 .
- ↑ Перейти обратно: Перейти обратно: а б с Петерсон, Лейф Э. (2013). Классификационный анализ ДНК-микрочипов . Джон Уайли и сыновья. ISBN 978-0-470-17081-6 .
- ^ Де Соуто М и др. (2008)Кластеризация данных об экспрессии генов рака: сравнительное исследование, BMC Bioinformatics, 9 (497).
- ^ Ясковяк, Пабло А; Кампелло, Рикардо Дж.Г.Б.; Коста, Иван Г (2014). «О выборе подходящих расстояний для кластеризации данных об экспрессии генов» . БМК Биоинформатика . 15 (Приложение 2): S2. дои : 10.1186/1471-2105-15-S2-S2 . ПМК 4072854 . ПМИД 24564555 .
- ^ Большакова Н, Азуахе Ф (2003) Методы кластерной проверки данных экспрессии генома, Signal Processing, Vol. 83, стр. 825–833.
- ^ Бен Гал, И.; Шани, А.; Гор, А.; Грау, Дж.; Арвив, С.; Шмилович, А.; Пош, С.; Гросс, И. (2005). «Идентификация сайтов связывания транскрипционных факторов с помощью байесовских сетей переменного порядка». Биоинформатика . 21 (11): 2657–2666. doi : 10.1093/биоинформатика/bti410 . ISSN 1367-4803 . ПМИД 15797905 .
- ^ Юк Фай Люнг и Дуччио Кавальери, Основы анализа данных микрочипов кДНК. Тенденции в генетике, том 19, № 11, ноябрь 2003 г.
- ^ Принс И.; Маймон О.; Бен-Гал И. (2007). «Оценка кластеризации экспрессии генов с помощью меры взаимного информационного расстояния» . БМК Биоинформатика . 8 (1): 111. дои : 10.1186/1471-2105-8-111 . ПМЦ 1858704 . ПМИД 17397530 .
- ^ Вэй С; Ли Дж; Бумгарнер Р.Э. (2004). «Размер выборки для обнаружения дифференциально экспрессируемых генов в экспериментах на микрочипах» . БМК Геномика . 5:87 . дои : 10.1186/1471-2164-5-87 . ПМЦ 533874 . ПМИД 15533245 .
- ^ Эммерт-Страйб Ф. и Демер М. (2008). Сетевой подход Анализ данных микрочипов . . Вайли-ВЧ. ISBN 978-3-527-31822-3 .
- ^ Воутерс Л; Гюльманн Х.В.; Бийненс Л; Касс СУ; Моленбергс Г; Леви П.Дж. (2003). «Графическое исследование данных об экспрессии генов: сравнительное исследование трех многомерных методов». Биометрия . 59 (4): 1131–1139. CiteSeerX 10.1.1.730.3670 . дои : 10.1111/j.0006-341X.2003.00130.x . ПМИД 14969494 . S2CID 16248921 .
- ^ Джайн Н; Татт Дж; Брасиале Т; Лей К; О'Коннелл М; Ли Дж. К. (2003). «Тест локальных объединенных ошибок для идентификации дифференциально экспрессируемых генов с помощью небольшого количества реплицированных микрочипов» . Биоинформатика . 19 (15): 1945–1951. doi : 10.1093/биоинформатика/btg264 . ПМИД 14555628 .
- ^ Барбоза-Морайс, Нидерланды; Даннинг, MJ; Самараджива, ЮАР; Дарот, JFJ; Ричи, Мэн; Линч, AG; Таваре, С. (18 ноября 2009 г.). «Конвейер повторных аннотаций для Illumina BeadArrays: улучшение интерпретации данных об экспрессии генов» . Исследования нуклеиновых кислот . 38 (3): е17. дои : 10.1093/nar/gkp942 . ПМЦ 2817484 . ПМИД 19923232 .
- ^ Мортазави, Али; Брайан А. Уильямс; Кеннет МакКью; Лориан Шеффер; Барбара Уолд (июль 2008 г.). «Картирование и количественная оценка транскриптомов млекопитающих с помощью RNA-Seq». Нат-методы . 5 (7): 621–628. дои : 10.1038/nmeth.1226 . ISSN 1548-7091 . ПМИД 18516045 . S2CID 205418589 .
- ↑ Перейти обратно: Перейти обратно: а б Ван, Чжун; Марк Герштейн; Майкл Снайдер (январь 2009 г.). «RNA-Seq: революционный инструмент для транскриптомики» . Нат преподобный Жене . 10 (1): 57–63. дои : 10.1038/nrg2484 . ISSN 1471-0056 . ПМЦ 2949280 . ПМИД 19015660 .
Внешние ссылки [ править ]
- Экспрессия генов в Curlie
- Микромасштабные продукты и услуги для биохимии и молекулярной биологии в Curlie
- Продукты и услуги для экспрессии генов в Curlie
- Онлайн-сервисы для анализа экспрессии генов в Curlie
- Анимация микрочипов 1Lec.com
- Учебник по биологии PLoS: анализ микрочипов
- Краткое изложение технологии микрочипов
- ArrayMining.net – бесплатный веб-сервер для онлайн-анализа микрочипов.
- Микроматрица – как это работает?
- Комментарий PNAS: открытие принципов природы на основе математического моделирования данных микрочипов ДНК
- Виртуальный эксперимент с ДНК-микроматрицей



