trp оперон
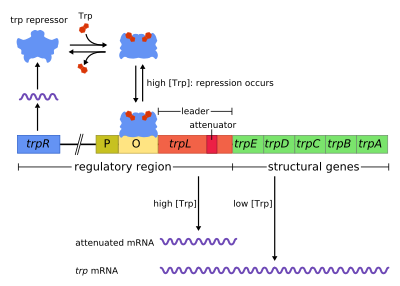
Оперон trp представляет собой группу генов, которые транскрибируются вместе и кодируют ферменты, вырабатывающие аминокислоту триптофан у бактерий. Оперон trp был впервые охарактеризован у Escherichia coli , а с тех пор он был обнаружен у многих других бактерий. [1] Оперон регулируется таким образом, что при наличии триптофана в окружающей среде гены синтеза триптофана подавляются.
Оперон trp содержит пять структурных генов: trpE , trpD , trpC , trpB и trpA , которые кодируют ферменты, необходимые для синтеза триптофана. Он также содержит репрессивный ген-регулятор, называемый trpR . Когда присутствует триптофан, белок trpR связывается с оператором , блокируя транскрипцию оперона trp с помощью РНК-полимеразы.
Этот оперон является примером поддающейся подавлению негативной регуляции экспрессии генов. Белок -репрессор связывается с оператором в присутствии триптофана (репрессируя транскрипцию ) и высвобождается из оперона, когда триптофан отсутствует (позволяя продолжить транскрипцию). Оперон trp дополнительно использует затухание для управления экспрессией оперона , второго механизма управления отрицательной обратной связью .
Оперон trp хорошо изучен и широко используется в качестве примера регуляции генов у бактерий наряду с lac опероном .
Гены
[ редактировать ]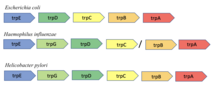
Оперон trp содержит пять структурных генов. Роли их продуктов:
- TrpE ( P00895 ): Антранилатсинтаза производит антранилат .
- TrpD ( P00904 ): Взаимодействует с TrpE.
- TrpC ( P00909 ): Домен фосфорибозилантранилат-изомеразы сначала превращает N- (5-фосфо-β- D -рибозил)антранилат в 1-(2-карбоксифениламино)-1-дезокси- D -рибулозо-5-фосфат. Индол -3-глицеринфосфатсинтаза того же белка затем превращает продукт в ( 1S,2R )-1- C- (индол-3-ил)глицерин-3-фосфат.
- TrpA ( P0A877 ), TrpB ( P0A879 ): две субъединицы триптофансинтетазы . Сочетает продукт TrpC с серином для производства триптофана.

Репрессии
[ редактировать ]
Оперон действует по механизму отрицательной поддающейся подавлению обратной связи. Репрессор оперона trp вырабатывается выше гена trpR, который конститутивно экспрессируется на низком уровне. Синтезированные мономеры trpR объединяются в димеры. Когда триптофан присутствует , эти димеры репрессора триптофана связываются с триптофаном, вызывая изменение конформации репрессора, позволяя репрессору связываться с оператором . Это предотвращает связывание РНК-полимеразы с опероном и его транскрипцию, поэтому триптофан не вырабатывается из его предшественника. Когда триптофан отсутствует, репрессор находится в неактивной конформации и не может связываться с операторной областью, поэтому репрессор не ингибирует транскрипцию.
Затухание
[ редактировать ]
Затухание — второй механизм отрицательной обратной связи в опероне trp . Система репрессии нацелена на внутриклеточную концентрацию trp, тогда как затухание реагирует на концентрацию заряженной тРНК. трп . [2] Таким образом, репрессор trpR снижает экспрессию генов, изменяя начало транскрипции, тогда как аттенуация делает это, изменяя уже идущий процесс транскрипции. [2] В то время как репрессор TrpR снижает транскрипцию в 70 раз, аттенуация может еще больше снизить ее в 10 раз, что позволяет накапливать репрессию примерно в 700 раз. [3] Ослабление становится возможным благодаря тому, что у прокариот (у которых нет ядра ) рибосомы начинают трансляцию мРНК , в то время как РНК-полимераза все еще транскрибирует последовательность ДНК. Это позволяет процессу трансляции напрямую влиять на транскрипцию оперона.
В начале транскрибируемых генов оперона trp находится последовательность длиной не менее 130 нуклеотидов, называемая лидерным транскриптом (trpL; P0AD92 ). [4] Ли и Янофски (1977) обнаружили, что эффективность ослабления коррелирует со стабильностью вторичной структуры, встроенной в trpL, [5] а две составляющие шпильки структуры терминатора были позже выяснены Oxender et al. (1979). [6] Этот транскрипт включает четыре короткие последовательности, обозначенные 1–4, каждая из которых частично комплементарна следующей. три отдельные вторичные структуры ( шпильки Таким образом, могут образовываться ): 1–2, 2–3 или 3–4. Гибридизация последовательностей 1 и 2 с образованием структуры 1–2 встречается редко, поскольку РНК-полимераза ожидает прикрепления рибосомы, прежде чем продолжить транскрипцию после последовательности 1, однако если бы образовалась шпилька 1–2, это предотвратило бы образование Структура 2–3 (но не 3–4). Образование шпильки между последовательностями 2–3 предотвращает образование шпильки между последовательностями 1–2 и 3–4. Структура 3–4 представляет собой последовательность терминации транскрипции (обильная в G/C и сразу за которой следуют несколько остатков урацила), как только она образует РНК-полимераза диссоциирует от ДНК, и транскрипция структурных генов оперона не может произойти (см. ниже). для более подробного объяснения). Функциональная важность 2-й шпильки для терминации транскрипции иллюстрируется снижением частоты терминации транскрипции, наблюдаемой в экспериментах по дестабилизации центрального спаривания G+C этой шпильки. [5] [7] [8] [9]
Часть лидерного транскрипта кодирует короткий полипептид из 14 аминокислот, называемый лидерным пептидом. Этот пептид содержит два соседних остатка триптофана, что необычно, поскольку триптофан — довольно редкая аминокислота (примерно один из ста остатков в типичном белке E. coli — это триптофан). Цепь 1 в trpL охватывает область, кодирующую замыкающие остатки лидерного пептида: Trp, Trp, Arg, Thr, Ser; [2] В этих 5 кодонах наблюдается консервация, тогда как мутация вышележащих кодонов не меняет экспрессию оперона. [2] [10] [11] [12] Если рибосома попытается транслировать этот пептид при низком уровне триптофана в клетке, она остановится на любом из двух кодонов trp. Пока он остановлен, рибосома физически экранирует последовательность 1 транскрипта, предотвращая образование вторичной структуры 1–2. Последовательность 2 затем может гибридизоваться с последовательностью 3 с образованием структуры 2–3, которая затем предотвращает образование терминационной шпильки 3–4, поэтому структура 2–3 называется антитерминационной шпилькой. При наличии структуры 2–3 РНК-полимераза может продолжать транскрипцию оперона. Мутационный анализ и исследования комплементарных олигонуклеотидов показывают, что стабильность структуры 2–3 соответствует уровню экспрессии оперона. [10] [13] [14] [15] Если уровни триптофана в клетке высоки, рибосома будет транслировать весь лидерный пептид без перерыва и остановится только во время терминации трансляции на стоп-кодоне . В этот момент рибосома физически защищает обе последовательности 1 и 2. Таким образом, последовательности 3 и 4 могут свободно формировать структуру 3–4, которая завершает транскрипцию. Эта структура терминатора формируется, когда рибосома не останавливается вблизи тандема Trp (т.е. кодона Trp или Arg): либо лидерный пептид не транслируется, либо трансляция протекает гладко вдоль цепи 1 с большим количеством заряженной тРНКtrp. [2] [10] Более того, предполагается, что рибосома блокирует только около 10 нуклеотидов ниже по ходу транскрипции, таким образом, остановка рибосомы либо в вышележащем Gly, либо в дальнейшем нижележащем Thr, по-видимому, не влияет на образование терминирующей шпильки. [2] [10] Конечным результатом является то, что оперон будет транскрибироваться только тогда, когда триптофан недоступен для рибосомы, в то время как транскрипт trpL экспрессируется конститутивно.
Этот механизм затухания подтверждается экспериментально. Во-первых, прямо доказано, что трансляция лидерного пептида и остановка рибосом необходимы для ингибирования терминации транскрипции. [13] Более того, мутационный анализ, дестабилизирующий или разрушающий спаривание оснований шпильки-антитерминатора, приводит к усилению терминации нескольких складок; В соответствии с моделью аттенуации эта мутация не может уменьшить аттенуацию даже при голодании Trp. [10] [13] Напротив, комплементарные олигонуклеотиды, нацеленные на цепь 1, увеличивают экспрессию оперона, способствуя образованию антитерминатора. [10] [14] Более того, в гистидиновом опероне компенсаторная мутация показывает, что способность к спариванию цепей 2–3 имеет большее значение, чем их первичная последовательность, в ингибировании затухания. [10] [15]
При аттенуации, когда транслирующая рибосома останавливается, определяется, будет ли сформирована терминационная шпилька. [10] Чтобы транскрибирующая полимераза одновременно захватывала альтернативную структуру, временной масштаб структурной модуляции должен быть сопоставим с временным масштабом транскрипции. [2] Чтобы гарантировать, что рибосома связывается и начинает трансляцию лидерного транскрипта сразу после его синтеза, в последовательности trpL существует сайт паузы. Достигнув этого сайта, РНК-полимераза приостанавливает транскрипцию и, по-видимому, ожидает начала трансляции. Этот механизм позволяет синхронизировать транскрипцию и трансляцию, что является ключевым элементом аттенуации.
Подобный механизм ослабления регулирует синтез гистидина , фенилаланина и треонина .
Регуляция оперона trp у Bacillus subtilis
[ редактировать ]Расположение оперона trp у E. coli и Bacillus subtilis различается. имеется 5 структурных генов В E. coli , которые находятся в одной транскрипционной единице. У Bacillus subtilis имеется 6 структурных генов, расположенных внутри супраоперона. Три из этих генов расположены выше оперона trp, а три других — ниже него. [16] седьмой ген, В опероне Bacillus subtilis имеется называемый trpG или pabA, который отвечает за синтез белка триптофана и фолата . [17] Регуляция оперонов trp у обоих организмов зависит от количества trp, присутствующего в клетке. Однако основная регуляция биосинтеза триптофана у B. subtilis осуществляется посредством ослабления, а не репрессии транскрипции. [18] У B. subtilis триптофан связывается с одиннадцатисубъединичным триптофан-активируемым РНК-связывающим аттенуационным белком (TRAP), который активирует способность TRAP связываться с лидерной РНК trp. [19] [20] Связывание trp-активируемого TRAP с лидерной РНК приводит к образованию терминаторной структуры, вызывающей терминацию транскрипции. [18] Кроме того, активированный TRAP ингибирует инициацию трансляции генов trpP, trpE, trpG и ycbK. Ген trpP играет роль в транспортировке trp, ген trpG используется в фолатном опероне, а ген ycbK участвует в синтезе эффлюксного белка. Активированный белок TRAP регулируется белком анти-TRAP и синтезом АТ. АТ может неактивировать TRAP, чтобы снизить транскрипцию триптофана. [21]
Ссылки
[ редактировать ]- ^ Мерино Э., Дженсен Р.А., Янофски С. (апрель 2008 г.). «Эволюция бактериальных trp-оперонов и их регуляция» . Современное мнение в микробиологии . 11 (2): 78–86. дои : 10.1016/j.mib.2008.02.005 . ПМК 2387123 . ПМИД 18374625 .
- ^ Jump up to: а б с д и ж г Янофски С. (февраль 1981 г.). «Ослабление контроля экспрессии бактериальных оперонов». Природа . 289 (5800): 751–8. Бибкод : 1981Natur.289..751Y . дои : 10.1038/289751a0 . ПМИД 7007895 . S2CID 4364204 .
- ^ Ленинджер А.Л., Нельсон Д.Л., Кокс М.М. (2008). Принципы биохимии (5-е изд.). Нью-Йорк, штат Нью-Йорк: WH Freeman and Company. п. 1128 . ISBN 978-0-7167-7108-1 .
- ^ Бертран К., Сквайрс С., Янофски С. (май 1976 г.). «Терминация транскрипции in vivo в лидерной области триптофанового оперона Escherichia coli». Журнал молекулярной биологии . 103 (2): 319–37. дои : 10.1016/0022-2836(76)90315-6 . ПМИД 781269 .
- ^ Jump up to: а б Ли Ф., Янофски С. (октябрь 1977 г.). «Терминация транскрипции на аттенюаторах оперона trp Escherichia coli и Salmonella typhimurium: вторичная структура РНК и регуляция терминации» . Труды Национальной академии наук Соединенных Штатов Америки . 74 (10): 4365–9. Бибкод : 1977PNAS...74.4365L . дои : 10.1073/pnas.74.10.4365 . ПМК 431942 . ПМИД 337297 .
- ^ Оксендер Д.Л., Журавски Г., Янофски С. (ноябрь 1979 г.). «Аттенуация триптофанового оперона Escherichia coli: роль вторичной структуры РНК, включающей область кодона триптофана» . Труды Национальной академии наук Соединенных Штатов Америки . 76 (11): 5524–8. Бибкод : 1979PNAS...76.5524O . дои : 10.1073/pnas.76.11.5524 . ПМК 411681 . ПМИД 118451 .
- ^ Стройновский И, Янофский С (июль 1982 г.). «Вторичные структуры транскрипта регулируют терминацию транскрипции на аттенюаторе триптофанового оперона S. marcescens». Природа . 298 (5869): 34–8. Бибкод : 1982Natur.298...34S . дои : 10.1038/298034a0 . ПМИД 7045685 . S2CID 4347442 .
- ^ Журавски Г., Янофски С. (сентябрь 1980 г.). «Лидерные мутации триптофанового оперона Escherichia coli, которые облегчают терминацию транскрипции, являются цис-доминантными по отношению к лидерным мутациям trp, которые усиливают терминацию транскрипции». Журнал молекулярной биологии . 142 (1): 123–9. дои : 10.1016/0022-2836(80)90210-7 . ПМИД 6159477 .
- ^ Стауффер Г.В., Журавски Г., Янофски С. (октябрь 1978 г.). «Изменения в одной паре оснований в лидерной области оперона trp Escherichia coli, которые облегчают терминацию транскрипции в аттенюаторе trp» . Труды Национальной академии наук Соединенных Штатов Америки . 75 (10): 4833–7. Бибкод : 1978PNAS...75.4833S . дои : 10.1073/pnas.75.10.4833 . ПМК 336215 . ПМИД 368800 .
- ^ Jump up to: а б с д и ж г час Колтер Р., Янофски С. (1982). «Аттенуация оперонов биосинтеза аминокислот». Ежегодный обзор генетики . 16 : 113–34. дои : 10.1146/annurev.ge.16.120182.000553 . ПМИД 6186194 .
- ^ Ли Ф., Бертран К., Беннетт Г., Янофски С. (май 1978 г.). «Сравнение нуклеотидных последовательностей исходных транскрибируемых областей триптофановых оперонов Escherichia coli и Salmonella typhimurium». Журнал молекулярной биологии . 121 (2): 193–217. дои : 10.1016/s0022-2836(78)80005-9 . ПМИД 351195 .
- ^ Миоццари Г., Янофски С. (ноябрь 1978 г.). «Естественно встречающаяся понижающая мутация промотора: нуклеотидная последовательность промоторной/операторной/лидерной области trp Shigella Dysenteriae 16» . Труды Национальной академии наук Соединенных Штатов Америки . 75 (11): 5580–4. Бибкод : 1978PNAS...75.5580M . дои : 10.1073/pnas.75.11.5580 . ПМК 393010 . ПМИД 364484 .
- ^ Jump up to: а б с Журавски Г., Эльзевирс Д., Стауффер Г.В., Янофски С. (декабрь 1978 г.). «Трансляционный контроль терминации транскрипции на аттенюаторе триптофанового оперона Escherichia coli» . Труды Национальной академии наук Соединенных Штатов Америки . 75 (12): 5988–92. Бибкод : 1978PNAS...75.5988Z . дои : 10.1073/pnas.75.12.5988 . ПМЦ 393102 . ПМИД 366606 .
- ^ Jump up to: а б Винклер М.Е., Муллис К., Барнетт Дж., Стройновски И., Янофски С. (апрель 1982 г.). «Терминация транскрипции на аттенюаторе триптофанового оперона снижается in vitro с помощью олигомера, комплементарного сегменту лидерного транскрипта» . Труды Национальной академии наук Соединенных Штатов Америки . 79 (7): 2181–5. Бибкод : 1982PNAS...79.2181W . дои : 10.1073/pnas.79.7.2181 . ПМЦ 346154 . ПМИД 6179092 .
- ^ Jump up to: а б Джонстон Х.М., Рот-младший (февраль 1981 г.). «Изменения последовательности ДНК в результате мутаций, изменяющих контроль ослабления гистидинового оперона Salmonella typhimurium». Журнал молекулярной биологии . 145 (4): 735–56. дои : 10.1016/0022-2836(81)90312-0 . ПМИД 6167727 .
- ^ Янофски С. (август 2004 г.). «Различные роли РНК-переносчика триптофана в регуляции экспрессии оперона trp в E. coli и B. subtilis». Тенденции в генетике . 20 (8): 367–374. дои : 10.1016/j.tig.2004.06.007 . ПМИД 15262409 .
- ^ Ян В.Дж., Янофски С. (март 2005 г.). «Влияние триптофанового голодания на уровни аттенуационного белка, связывающего РНК trp (TRAP) и регуляторного белка анти-TRAP, и их влияние на экспрессию оперона trp в Bacillus subtilis» . Журнал бактериологии . 187 (6): 1884–1891. дои : 10.1128/JB.187.6.1884-1891.2005 . ПМК 1064063 . ПМИД 15743934 .
- ^ Jump up to: а б Голлник П., Бабицке П., Антсон А., Янофски С. (14 ноября 2005 г.). «Сложность регуляции биосинтеза триптофана у Bacillus subtilis». Ежегодный обзор генетики . 39 (1): 47–68. дои : 10.1146/annurev.genet.39.073003.093745 . ПМИД 16285852 .
- ^ Эллиотт М.Б., Готлиб П.А., Голлник П. (январь 2001 г.). «Механизм связывания РНК с TRAP: инициация и кооперативные взаимодействия» . РНК . 7 (1): 85–93. дои : 10.1017/S135583820100173X . ПМК 1370072 . ПМИД 11214184 .
- ^ Антсон А.А., Отридж Дж., Бжозовский А.М., Додсон Э.Дж., Додсон Г.Г., Уилсон К.С. и др. (апрель 1995 г.). «Структура аттенуационного белка, связывающего trp РНК». Природа . 374 (6524): 693–700. Бибкод : 1995Natur.374..693A . дои : 10.1038/374693a0 . ПМИД 7715723 . S2CID 4340136 .
- ^ Круз-Вера Л.Р., Гонг М., Янофски С. (март 2008 г.). «Физиологические эффекты активности белка анти-TRAP и зарядки тРНК (Trp) на экспрессию оперона trp в Bacillus subtilis» . Журнал бактериологии . 190 (6): 1937–1945. дои : 10.1128/JB.01820-07 . ПМК 2258860 . ПМИД 18178730 .
Дальнейшее чтение
[ редактировать ]- Морс Д.Е., Мостеллер Р.Д., Янофски С. (1969). «Динамика синтеза, трансляции и деградации информационной РНК оперона trp в E. coli». Симпозиумы Колд-Спринг-Харбор по количественной биологии . 34 : 725–40. дои : 10.1101/sqb.1969.034.01.082 . ПМИД 4909527 .
- Янофски С. (февраль 1981 г.). «Ослабление контроля экспрессии бактериальных оперонов». Природа . 289 (5800): 751–8. Бибкод : 1981Natur.289..751Y . дои : 10.1038/289751a0 . ПМИД 7007895 . S2CID 4364204 .