ЭЖ2
| ЭЖ2 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | EZH2 , ENX-1, ENX1, EZH1, EZH2b, KMT6, KMT6A, WVS, WVS2, энхансер 2-субъединицы полисотового репрессивного комплекса zeste 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 601573 ; МГИ : 107940 ; Гомологен : 37926 ; Генные карты : EZH2 ; ОМА : ЭЖ2 - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Энхансер гомолога 2 zeste (EZH2) — гистон-лизин N-метилтрансфераза фермент ( EC 2.1.1.43 ), кодируемый EZH2 геном , который участвует в метилировании гистонов и, в конечном итоге, в репрессии транскрипции . [ 5 ] EZH2 катализирует присоединение метильных групп к гистону H3 по лизину 27, [ 6 ] с использованием кофактора S-аденозил-L-метионина . Активность метилирования EZH2 облегчает образование гетерохроматина , тем самым подавляя функцию гена. [ 5 ] Ремоделирование хромосомного гетерохроматина с помощью EZH2 также необходимо во время митоза клеток.
EZH2 является функциональным ферментативным компонентом репрессивного комплекса Polycomb 2 ( PRC2 ), который отвечает за здоровое эмбриональное развитие посредством эпигенетического поддержания генов, ответственных за регуляцию развития и дифференцировки . [ 7 ] EZH2 отвечает за активность метилирования PRC2, а комплекс также содержит белки, необходимые для оптимального функционирования ( EED , SUZ12 , JARID2 , AEBP2 , RbAp46/48 и PCL ). [ 8 ]
Мутация или сверхэкспрессия EZH2 связана со многими формами рака. [ 9 ] EZH2 ингибирует гены, ответственные за подавление развития опухоли, а блокирование активности EZH2 может замедлить рост опухоли. EZH2 стал целью ингибирования, поскольку его активация повышается при множестве видов рака, включая, помимо прочего, рак молочной железы, [ 10 ] простата , [ 11 ] меланома , [ 12 ] и рак мочевого пузыря. [ 13 ] Мутации в гене EZH2 также связаны с синдромом Уивера , редким врожденным заболеванием. [ 14 ] EZH2 участвует в возникновении нейродегенеративных симптомов при расстройстве нервной системы, атаксии -телеангиэктазии . [ 15 ]
Функция
[ редактировать ]| Гистон-лизин N-метилтрансфераза | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 2.1.1.43 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
EZH2 является каталитической субъединицей репрессивного комплекса Polycomb 2 (PRC2). [ 16 ] Каталитическая активность EZH2 основана на образовании комплекса по крайней мере с двумя другими компонентами PRC2, SUZ12 и EED . [ 17 ]
как гистон-метилтрансферазы Основная функция EZH2 (HMTase) заключается в метилировании Lys-27 на гистоне 3 (H3K27me) путем переноса метильной группы от кофактора S-аденозил-L-метионина (SAM). EZH2 способен к моно-, ди- и триметилированию H3K27 и связан с множеством биологических функций, включая регуляцию транскрипции в гемопоэзе , развитии и дифференцировке клеток . [ 17 ] [ 18 ] [ 19 ] [ 20 ]
EZH2 также был идентифицирован как способный метилировать негистоновые белки . [ 17 ] [ 18 ]
Репрессия транскрипции
[ редактировать ]EZH2, как часть PRC2, катализирует триметилирование H3K27 ( H3K27me3 ), который представляет собой модификацию гистонов, охарактеризованную как часть гистонового кода . [ 16 ] [ 20 ] [ 21 ] [ 22 ] Код гистонов — это теория, согласно которой химические модификации, такие как метилирование , ацетилирование и убиквитинирование , гистоновых белков играют особую роль в эпигенетической генов регуляции транскрипции . EZH2-опосредованный катализ H3K27me3 связан с долгосрочной репрессией транскрипции. [ 16 ] [ 20 ] [ 21 ]
EZH2, как и другие белки группы Polycomb, участвуют в установлении и поддержании репрессии генов посредством деления клеток . [ 17 ] [ 20 ] Считается, что это транскрипционно-репрессивное состояние обусловлено PRC2/EZH2-EED-опосредованным метилированием H3K27 и последующим рекрутированием PRC1 , который облегчает конденсацию хроматина и образование гетерохроматина . [ 20 ] Гетерохроматин представляет собой плотно упакованный хроматин, который ограничивает доступ транскрипционных механизмов к лежащей в основе ДНК, тем самым подавляя транскрипцию. [ 23 ]
Во время деления клеток образование гетерохроматина необходимо для правильного разделения хромосом . [ 24 ] Комплекс PRC2/EED-EZH2 также может участвовать в рекрутировании ДНК-метилтрансфераз ( DNMT ), что приводит к усилению метилирования ДНК , еще одному эпигенетическому уровню репрессии транскрипции. [ 16 ] [ 17 ] Конкретные гены, которые были идентифицированы как мишени репрессии транскрипции, опосредованной EZH2, включают HOXA9 , HOXC8 , MYT1 , CDKN2A и гены-мишени ретиноевой кислоты . [ 16 ]
Активация транскрипции
[ редактировать ]При раке EZH2 может играть роль в активации транскрипции независимо от PRC2 . [ 17 ] Было продемонстрировано, что в клетках рака молочной железы EZH2 активирует гены-мишени NF-κB , которые участвуют в реакциях на стимулы. [ 17 ] Функциональная роль этой активности и ее механизм до сих пор неизвестны.
Развитие и дифференцировка клеток
[ редактировать ]EZH2 играет важную роль в развитии. В частности, он помогает контролировать репрессию транскрипции генов, которые регулируют дифференцировку клеток. [ 17 ] [ 18 ] [ 20 ] [ 21 ] В эмбриональных стволовых клетках EZH2-опосредованное триметилирование H3K27me3 в регионах, содержащих гены развития, по-видимому, важно для поддержания нормальной дифференцировки клеток. [ 20 ] H3K27me3 также важен для управления Х-инактивацией , подавлением одной Х-хромосомы у самок во время развития. [ 22 ] Считается, что во время X-инактивации EZH2 участвует в инициации образования гетерохроматина путем триметилирования H3K27 и что другие гистоновые метилтрансферазы и метки гистонов могут участвовать в поддержании состояния молчания. [ 25 ]
Кроме того, EZH2 был идентифицирован как важный белок, участвующий в развитии и дифференцировке В-клеток и Т-клеток . [ 18 ] H3K27me3 участвует в подавлении генов, способствующих дифференцировке, поддерживая тем самым недифференцированное состояние В- и Т-клеток и играя важную роль в регуляции кроветворения . [ 18 ] [ 26 ] [ 27 ]
Регуляция активности EZH2
[ редактировать ]Активность EZH2 регулируется посттрансляционным фосфорилированием треонина серина и остатков на EZH2. [ 28 ] В частности, фосфорилирование T350 связано с увеличением активности EZH2, тогда как фосфорилирование T492 и S21 связано со снижением активности EZH2. [ 21 ] [ 28 ] Было высказано предположение, что фосфорилирование T492 нарушает контакты между EZH2 человека и его партнерами по связыванию в комплексе PRC2, тем самым препятствуя его каталитической активности. [ 21 ]
Помимо фосфорилирования, также было показано, что активности PRC2/EZH2-EED противодействуют активирующие транскрипцию метки гистонов, такие как ацетилирование H3K27 ( H3K27ac ) и метилирование H3K36 ( H3K36me ). [ 21 ] [ 29 ]
Экспрессия EZH2 регулируется передачей сигналов эстрогена в нормальном эпителии молочной железы человека и раке молочной железы человека. [ 30 ]
Ферментативная активность
[ редактировать ]Функция EZH2 сильно зависит от его рекрутирования комплексом PRC2. В частности, белок-повтор WD40 развития эмбриональной эктодермы (EED) и белок-супрессор белка цинковых пальцев zeste 12 (SUZ12) необходимы для стабилизации взаимодействия EZH2 с его гистоновым субстратом. [ 31 ] [ 32 ] две изоформы EZH2, образующиеся в результате альтернативного сплайсинга : EZH2α и EZH2β. Недавно у человека были идентифицированы [ 33 ] Обе изоформы содержат элементы, которые были идентифицированы как важные для функции EZH2, включая сигнал ядерной локализации , сайты связывания EED и SUZ12, а также консервативный домен SET. [ 33 ] Большинство исследований до сих пор были сосредоточены на более длинной изоформе EZH2α, но EZH2β, у которой отсутствуют экзоны 4 и 8, активен. было показано, что [ 33 ] Более того, комплексы PRC2/EZH2β действуют на гены, отличные от генов его аналога PRC2/EZH2α, что позволяет предположить, что каждая изоформа может действовать, регулируя определенное подмножество генов. [ 33 ] Дополнительные данные свидетельствуют о том, что EZH2 также может быть способен к метилированию лизина независимо от ассоциации с PRC2, когда EZH2 сильно активируется. [ 17 ]
Метилирование лизина
[ редактировать ]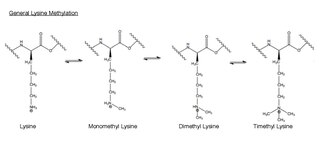
Метилирование – это присоединение -CH 3 или метильной группы к другой молекуле. В биологии метилирование обычно катализируется ферментами, а метильные группы обычно добавляются либо к белкам, либо к нуклеиновым кислотам. При метилировании, катализируемом EZH2, аминокислота лизин в гистоне h3 метилируется. Этот аминокислотный остаток может быть метилирован до трех раз по концевой аммониевой группе. Эти метилированные лизины важны для контроля экспрессии генов млекопитающих и играют функциональную роль в формировании гетерохроматина , инактивации Х-хромосомы и регуляции транскрипции. [ 34 ] В хромосомах млекопитающих метилирование лизина гистонов может либо активировать, либо подавлять гены в зависимости от места метилирования. Недавняя работа показала, что по крайней мере часть функции молчания комплекса EZH2 заключается в метилировании гистона H3 по лизину 27. [ 35 ] Метилирование и другие модификации происходят в гистонах. Метильные модификации могут влиять на связывание белков с этими гистонами и либо активировать, либо ингибировать транскрипцию . [ 24 ]
Механизм катализа
[ редактировать ]
EZH2 является членом семейства доменов SET лизинметилтрансфераз , функция которых заключается в добавлении метильных групп к лизиновым боковым цепям белков- субстратов . [ 36 ] SET-метилтрансферазы зависят от кофактора S-аденозилметионина (SAM), который действует как донор метила для их каталитической активности. Белки домена SET отличаются от других SAM-зависимых метилтрансфераз тем, что они связывают свой субстрат и кофактор SAM на противоположных сторонах активного центра фермента. Такая ориентация субстрата и кофактора позволяет SAM диссоциировать, не нарушая связывания субстрата, и может привести к множественным циклам метилирования лизина без диссоциации субстрата. [ 36 ]
Хотя ни связанная с субстратом, ни связанная с SAM кристаллическая структура EZH2 не была определена, выравнивание структуры STAMP с метилтрансферазой SET7/9 человека показывает консервативные остатки тирозина в почти идентичных положениях в предполагаемом активном сайте EZH2.

Ранее предполагалось, что тирозин 726 в активном центре EZH2 действует как общее основание для депротонирования субстрата лизина, но кинетические изотопные эффекты показали, что остатки активного центра не участвуют напрямую в химии реакции метилтрансферазы. [ 37 ] Вместо этого эти эксперименты подтверждают механизм, при котором остатки снижают pKa остатка лизина субстрата, одновременно обеспечивая канал для воды для доступа к боковой цепи лизина внутри активного центра. Затем объемная вода-растворитель может легко депротонировать боковую цепь лизина, активируя ее для нуклеофильной атаки кофактора SAM в реакции, подобной S N 2 , что приводит к переносу метильной группы от SAM к боковой цепи лизина. [ 37 ]

EZH2 в первую очередь катализирует моно- и диметилирование H3K27, но клинически значимая мутация остатка тирозина 641 на фенилаланин (Y641F) приводит к более высокой активности триметилирования H3K27. [ 37 ] [ 38 ] Предполагается, что удаление гидроксильной группы на Y641 устраняет стерические препятствия и позволяет разместить третью метильную группу на субстрате лизине.
Клиническое значение
[ редактировать ]Рак
[ редактировать ]EZH2 является привлекательной мишенью для противораковой терапии, поскольку он помогает раковым клеткам делиться и пролиферировать. Он обнаруживается в больших количествах, чем в здоровых клетках, при широком спектре видов рака, включая рак молочной железы, простаты, мочевого пузыря, матки и почек , а также меланому и лимфому . EZH2 является геном- супрессором, поэтому, когда он становится сверхэкспрессированным, многие гены-супрессоры опухолей, которые обычно включены, выключаются. Подавление функции EZH2 в некоторых зарегистрированных случаях приводит к уменьшению злокачественных опухолей , поскольку эти гены-супрессоры опухолей не подавляются EZH2. [ 39 ] EZH2 обычно не экспрессируется у здоровых взрослых; он обнаружен только в активно делящихся клетках, подобных тем, которые активны во время развития плода. [ 40 ] Из-за этой характеристики сверхэкспрессия EZH2 может использоваться в качестве диагностического маркера рака и некоторых нейродегенеративных заболеваний. [ 15 ] Однако бывают случаи, когда трудно сказать, является ли сверхэкспрессия EZH2 причиной заболевания или просто следствием. Если это всего лишь последствие, то воздействие на EZH2 для ингибирования может не вылечить заболевание. Одним из примеров пути развития рака, в котором играет роль EZH2, является путь pRB-E2F. Он находится ниже пути pRB-E2F , и сигналы этого пути приводят к сверхэкспрессии EZH2. [ 41 ] Другой важной характеристикой EZH2 является то, что при сверхэкспрессии EZH2 он может активировать гены без образования PRC2 . Это проблема, поскольку это означает, что активность метилирования фермента не опосредована образованием комплекса. В клетках рака молочной железы EZH2 активирует гены, которые способствуют пролиферации и выживанию клеток. [ 17 ] Он также может активировать регуляторные гены, такие как c-myc и циклин D1, взаимодействуя с сигнальными факторами Wnt . [ 42 ] Важно отметить, что мутация тирозина 641 в активном домене SET на ряд различных аминокислот является общей чертой некоторых В-клеточных лимфом. [ 43 ]
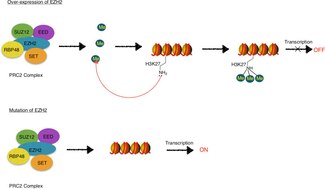
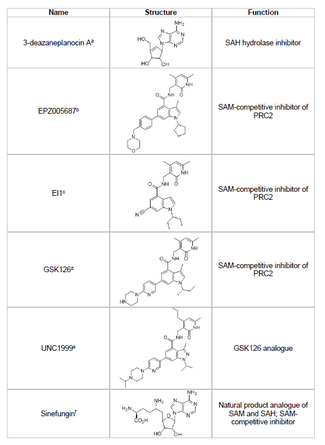
Ингибиторы
[ редактировать ]Разработка ингибитора EZH2 и предотвращение нежелательного метилирования гистонов генов-супрессоров опухолей является жизнеспособной областью исследований рака. Разработка ингибитора EZH2 была сосредоточена на воздействии на активный сайт домена SET белка. По состоянию на 2015 год было разработано несколько ингибиторов EZH2, в том числе 3-деазанепланоцин А (DZNep), EPZ005687, EI1, GSK126 и UNC1999.
- ДЗНеп
- DZNep обладает потенциальными противовирусными и противораковыми свойствами, поскольку снижает уровень EZH2 и индуцирует апоптоз в клетках рака молочной железы и толстой кишки. [ 44 ] DZNep ингибирует гидролиз S-аденозил-L-гомоцистеина (SAH), который является ингибитором всех протеин-метилтрансфераз на основе продукта, что приводит к увеличению клеточной концентрации SAH, что, в свою очередь, ингибирует EZH2. Однако DZNep не специфичен для EZH2, а также ингибирует другие ДНК-метилтрансферазы.
- EPZ005687
- В 2012 году компания Epizyme представила EPZ005687, конкурентный ингибитор S-аденозилметионина ( SAM ), который более селективен, чем DZNep; он имеет 50-кратное увеличение селективности в отношении EZH2 по сравнению с EZH1 . Препарат блокирует активность EZH2 путем связывания с активным сайтом домена SET фермента. EPZ005687 также может ингибировать мутанты EZH2 Y641 и A677, что может быть применимо для лечения неходжкинской лимфомы. [ 45 ]
- Таземетостат
- В 2013 году компания Epizyme начала I фазу клинических испытаний другого ингибитора EZH2, таземетостата (EPZ-6438), для пациентов с В-клеточной лимфомой. [ 49 ] В 2020 году таземетостат под торговым названием Тазверик получил ускоренное одобрение FDA для лечения метастатической или местно-распространенной эпителиоидной саркомы. [ нужна ссылка ] и ускоренное одобрение лечения пациентов с рецидивирующей фолликулярной лимфомой позднее в том же году. [ 50 ]
- Синефунгин
- Синефунгин — еще один SAM-конкурентный ингибитор, однако, как и DZNep, он не специфичен для EZH2. [ 48 ] Он действует путем связывания в кармане связывания кофактора ДНК-метилтрансфераз, блокируя перенос метила. EI1 — еще один ингибитор, разработанный Novartis , который показал ингибирующую активность EZH2 в опухолевых клетках лимфомы, включая клетки с мутацией Y641. [ 46 ] Механизм действия этого ингибитора также включает конкуренцию с кофактором SAM за связывание с EZH2. [ 46 ]
- ГСК126
- GSK126 представляет собой мощный SAM-конкурентный ингибитор EZH2, разработанный GlaxoSmithKline , который имеет 150-кратную селективность по сравнению с EZH1 и K i 0,5–3 нМ. [ 47 ] UNC1999 был разработан как аналог GSK126 и стал первым биодоступным пероральным ингибитором EZH2, проявившим активность. Однако он менее селективен, чем его аналог GSK126, и также связывается с EZH1, увеличивая вероятность нецелевых эффектов.
Комбинированные методы лечения изучаются как возможные методы лечения, когда основные методы лечения начинают неэффективны. Этопозид , ингибитор топоизомеразы , в сочетании с ингибитором EZH2 становится более эффективным при немелкоклеточном раке легких с мутациями BRG1 и EGFR . [ 39 ] Однако метилирование EZH2 и лизина может оказывать подавляющее опухоль действие, например, при миелодиспластическом синдроме . [ 51 ] что указывает на то, что ингибирование EZH2 может быть полезным не во всех случаях.
Развитие скелета
[ редактировать ]EZH2 имеет решающее значение для эпигенетической регуляции специфического паттерна во время остеохондрогенеза. [ 52 ] или развитие костей и хрящей элементов черепно-лицевого скелета. Подавляя ингибиторы, EZH2 способствует образованию костей и хрящей в особенностях лицевого скелета, возникающих из нервного гребня. Экспрессия EZH2 выше среднего стала биологическим маркером наиболее агрессивной формы рака молочной железы, известной как воспалительный рак молочной железы (ВРМЖ). Но в 2013 году исследование, проведенное Чжаомеем Му и его коллегами, пришло к выводу, что нокдаун-ген EZH2 ингибирует как миграцию, так и инвазию клеток IBC. Также in vivo его нокдаун-ген подавлял рост опухоли, скорее всего, за счет наличия меньшего количества кровеносных сосудов или снижения ангиогенеза в нокдаун-опухолях EZH2 по сравнению с опухолями EZH2. [ 53 ]
Синдром Уивера
[ редактировать ]Мутации в гене EZH2 связаны с синдромом Уивера — редким заболеванием, характеризующимся старением костного возраста, макроцефалией и гипертелоризмом . [ 14 ] Остаток гистидина в активном сайте EZH2 дикого типа был мутирован на тирозин у пациентов с диагнозом синдрома Уивера. [ 14 ] Мутация, вероятно, мешает связыванию кофактора и вызывает нарушение естественной функции белка. [ 14 ]
Таксономическое распространение
[ редактировать ]
Усилитель zeste (E(z)) был первоначально идентифицирован у Drosophila melanogaster , а его гомологи у млекопитающих были впоследствии идентифицированы и названы EZH1 (энхансер гомолога zeste 1) и EZH2 (энхансер гомолога zeste 2). [ 55 ] EZH2 высоко консервативен в процессе эволюции . Он и его гомологи играют важную роль в развитии, дифференцировке и делении клеток у растений, насекомых, рыб и млекопитающих. [ 17 ] [ 21 ] [ 56 ] [ 57 ] Следующее таксономическое дерево отражает распространение EZH2 среди самых разных видов. [ 58 ] [ 59 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Ensembl выпуск 89: ENSG00000106462 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000029687 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Перейти обратно: а б Вире Э., Бреннер С., Деплюс Р., Бланшон Л., Фрага М., Дидело С. и др. (февраль 2006 г.). «Белок группы Polycomb EZH2 напрямую контролирует метилирование ДНК». Природа . 439 (7078): 871–874. Бибкод : 2006Natur.439..871V . дои : 10.1038/nature04431 . ПМИД 16357870 . S2CID 4409726 .
- ^ Цао Р., Ван Л., Ван Х., Ся Л., Эрджюмент-Бромаж Х., Темпст П. и др. (ноябрь 2002 г.). «Роль метилирования лизина 27 гистона H3 в молчании группы Polycomb». Наука . 298 (5595): 1039–1043. Бибкод : 2002Sci...298.1039C . дои : 10.1126/science.1076997 . ПМИД 12351676 . S2CID 6265267 .
- ^ Мори Л., Хелин К. (июнь 2010 г.). «Репрессия транскрипции, опосредованная белками группы Polycomb». Тенденции биохимических наук . 35 (6): 323–332. дои : 10.1016/j.tibs.2010.02.009 . ПМИД 20346678 .
- ^ Маргерон Р., Рейнберг Д. (январь 2011 г.). «Комплекс Polycomb PRC2 и его след в жизни» . Природа . 469 (7330): 343–349. Бибкод : 2011Natur.469..343M . дои : 10.1038/nature09784 . ПМЦ 3760771 . ПМИД 21248841 .
- ^ Ким К.Х., Робертс CW (февраль 2016 г.). «Нацеливание на EZH2 при раке» . Природная медицина . 22 (2): 128–134. дои : 10.1038/нм.4036 . ПМЦ 4918227 . ПМИД 26845405 .
- ^ Ю К.Х., Хеннигхаузен Л. (2012). «Метилтрансфераза EZH2 и метилирование H3K27 при раке молочной железы» . Международный журнал биологических наук . 8 (1): 59–65. дои : 10.7150/ijbs.8.59 . ПМК 3226033 . ПМИД 22211105 .
- ^ Варамбалли С., Дханасекаран С.М., Чжоу М., Барретт Т.Р., Кумар-Синха С., Санда М.Г. и др. (октябрь 2002 г.). «Белок группы поликомб EZH2 участвует в прогрессировании рака простаты». Природа . 419 (6907): 624–629. Бибкод : 2002Natur.419..624V . дои : 10.1038/nature01075 . hdl : 2027.42/62896 . ПМИД 12374981 . S2CID 4414767 .
- Грэм С. (10 октября 2002 г.). «Ученые идентифицируют ген, который отмечает самую смертельную форму рака простаты» . Научный американец . Архивировано из оригинала 23 февраля 2015 г. Проверено 23 февраля 2015 г.
- ^ Зингг Д., Деббаш Дж., Шефер С.М., Танцер Э., Фроммель С.С., Ченг П. и др. (январь 2015 г.). «Эпигенетический модификатор EZH2 контролирует рост и метастазирование меланомы посредством подавления отдельных супрессоров опухоли» . Природные коммуникации . 6 : 6051. Бибкод : 2015NatCo...6.6051Z . дои : 10.1038/ncomms7051 . ПМИД 25609585 .
- «25 января Эпигенетический контрольный белок позволяет клеткам меланомы метастазировать» . Медицинские исследования . 25 января 2015 г. Архивировано из оригинала 23 февраля 2015 г. Проверено 23 февраля 2015 г.
- ^ Арисан С., Буюктунсер Э.Д., Палаван-Унсал Н., Чашкурлу Т., Чакир О.О., Эргенекон Э. (2005). «Повышенная экспрессия EZH2, белка группы полисот, при карциноме мочевого пузыря». Международная урология . 75 (3): 252–257. дои : 10.1159/000087804 . ПМИД 16215315 . S2CID 26843362 .
- ^ Перейти обратно: а б с д Гибсон В.Т., Худ Р.Л., Жан Ш., Булман Д.Е., Фейес А.П., Мур Р. и др. (январь 2012 г.). «Мутации в EZH2 вызывают синдром Уивера» . Американский журнал генетики человека . 90 (1): 110–118. дои : 10.1016/j.ajhg.2011.11.018 . ПМК 3257956 . ПМИД 22177091 .
- ^ Перейти обратно: а б Ли Дж., Харт Р.П., Маллимо Э.М., Свердел М.Р., Кушнецов А.В., Херруп К. (декабрь 2013 г.). «EZH2-опосредованное триметилирование H3K27 опосредует нейродегенерацию при атаксии-телеангиэктазии» . Природная неврология . 16 (12): 1745–1753. дои : 10.1038/nn.3564 . ПМЦ 3965909 . ПМИД 24162653 .
- ^ Перейти обратно: а б с д и Универсальный белковый ресурс, номер доступа Q15910 в UniProt .
- ^ Перейти обратно: а б с д и ж г час я дж к Тан JZ, Ян Ю, Ван XX, Цзян Ю, Сюй Хе (февраль 2014 г.). «EZH2: биология, болезни и открытие лекарств на основе структуры» . Акта Фармакологика Синика . 35 (2): 161–174. дои : 10.1038/aps.2013.161 . ПМЦ 3914023 . ПМИД 24362326 .
- ^ Перейти обратно: а б с д и Лунд К., Адамс П.Д., Копленд М. (январь 2014 г.). «ЭЖ2 в нормальном и злокачественном кроветворении» . Лейкемия . 28 (1): 44–49. дои : 10.1038/leu.2013.288 . ПМИД 24097338 . S2CID 736796 .
- ^ «РефСек» . RefSeq Ген EZH2 . Архивировано из оригинала 23 февраля 2015 года . Проверено 1 февраля 2015 г.
- ^ Перейти обратно: а б с д и ж г Дин X, Ван X, Зонтаг С., Цинь Дж., Ванек П., Лин К. и др. (май 2014 г.). «Белок полисоты Ezh2 влияет на индуцируемую генерацию плюрипотентных стволовых клеток» . Стволовые клетки и развитие . 23 (9): 931–940. дои : 10.1089/scd.2013.0267 . ПМЦ 3996971 . ПМИД 24325319 .
- ^ Перейти обратно: а б с д и ж г О'Мира М.М., Саймон Дж.А. (июнь 2012 г.). «Внутренняя работа и регуляторные факторы, управляющие репрессивным комплексом Поликомба 2» . Хромосома . 121 (3): 221–234. дои : 10.1007/s00412-012-0361-1 . ПМЦ 3351537 . ПМИД 22349693 .
- ^ Перейти обратно: а б «Гистон H3K27» . ЭпиГений . Архивировано из оригинала 23 февраля 2015 г. Проверено 23 февраля 2015 г.
- ^ Гревал С.И., Цзя С. (январь 2007 г.). «Возвращение к гетерохроматину» . Обзоры природы. Генетика . 8 (1): 35–46. дои : 10.1038/nrg2008 . ПМИД 17173056 . S2CID 31811880 . Архивировано из оригинала 27 июня 2021 г. Проверено 4 ноября 2018 г.
- ^ Перейти обратно: а б Стюарт, доктор медицинских наук, Ли Дж., Вонг Дж. (апрель 2005 г.). «Связь между метилированием лизина 9 гистона H3, репрессией транскрипции и рекрутированием белка 1 гетерохроматина» . Молекулярная и клеточная биология . 25 (7): 2525–2538. дои : 10.1128/MCB.25.7.2525-2538.2005 . ПМЦ 1061631 . ПМИД 15767660 .
- ^ Жантер П. (2008). Эпигенетика и хроматин . Спрингер. ISBN 9783540852360 . Архивировано из оригинала 22 апреля 2024 г. Проверено 12 октября 2020 г.
- ^ Нео В.Х., Бут К.А., Аццони Э., Чи Л., Дельгадо-Олгин П., де Брёйн М.Ф. и др. (май 2018 г.). «Внеклеточное гемопоэтическое влияние инактивации Ezh2 в эндотелиальных клетках печени плода» . Кровь . 131 (20): 2223–2234. doi : 10.1182/blood-2017-10-811455 . ПМК 5960588 . ПМИД 29555646 .
- ^ Нео В.Х., Менг Ю., Родригес-Мейра А., Фадлуллах М.З., Бут К.А., Аццони Э. и др. (декабрь 2021 г.). «Ezh2 необходим для генерации функциональных эритромиелоидных предшественников, происходящих из желточного мешка» . Природные коммуникации . 12 (1): 7019. Бибкод : 2021NatCo..12.7019N . дои : 10.1038/s41467-021-27140-8 . hdl : 10281/339795 . ПМК 8640066 . ПМИД 34857757 .
- ^ Перейти обратно: а б Канеко С., Ли Г., Сон Дж., Сюй К.Ф., Маргерон Р., Нойберт Т.А. и др. (декабрь 2010 г.). «Фосфорилирование компонента PRC2 Ezh2 регулируется клеточным циклом и усиливает его связывание с нкРНК» . Гены и развитие . 24 (23): 26:15–26:20. дои : 10.1101/gad.1983810 . ПМК 2994035 . ПМИД 21123648 .
- ^ Тай Ф., Банерджи Р., Страттон К.А., Прасад-Синха Дж., Степаник В., Злобин А. и др. (сентябрь 2009 г.). «CBP-опосредованное ацетилирование гистона H3 лизина 27 противодействует молчанию Polycomb у дрозофилы» . Разработка . 136 (18): 3131–3141. дои : 10.1242/dev.037127 . ПМК 2730368 . ПМИД 19700617 .
- ^ Осако Т., Ли Х., Турашвили Г., Чиу Д., МакКинни С., Йостен С.Е. и др. (май 2020 г.). «Возрастная экспрессия белков и транскриптов при раке молочной железы и нормальных тканях молочной железы определяется эндокринными эффектами хозяина». Природа Рак . 1 (5): 518–532. дои : 10.1038/s43018-020-0060-4 . ПМИД 35121983 . S2CID 218955089 .
- ^ Цао Р., Чжан И (июль 2004 г.). «SUZ12 необходим как для активности гистон-метилтрансферазы, так и для функции молчания комплекса EED-EZH2» . Молекулярная клетка . 15 (1): 57–67. doi : 10.1016/j.molcel.2004.06.020 . ПМИД 15225548 .
- ^ Денисенко О., Шнырева М., Сузуки Х., Бомштык К. (октябрь 1998 г.). «Точечные мутации в домене WD40 Eed блокируют его взаимодействие с Ezh2» . Молекулярная и клеточная биология . 18 (10): 5634–5642. дои : 10.1128/MCB.18.10.5634 . ПМК 109149 . ПМИД 9742080 .
- ^ Перейти обратно: а б с д Грзенда А., Ломберк Г., Свинген П., Мэтисон А., Кальво Э., Йованна Дж. и др. (февраль 2013 г.). «Функциональная характеристика EZH2β показывает повышенную сложность изоформ EZH2, участвующих в регуляции экспрессии генов млекопитающих» . Эпигенетика и хроматин . 6 (1): 3. дои : 10.1186/1756-8935-6-3 . ПМК 3606351 . ПМИД 23448518 .
- ^ Мартин С., Чжан Ю (ноябрь 2005 г.). «Разнообразные функции метилирования лизина гистонов». Обзоры природы. Молекулярно-клеточная биология . 6 (11): 838–849. дои : 10.1038/nrm1761 . ПМИД 16261189 . S2CID 31300025 .
- ^ Брайен Г.Л., Гамберо Г., О'Коннелл Д.Д., Джерман Э., Тернер С.А., Иган К.М. и др. (декабрь 2012 г.). «Polycomb PHF19 связывает H3K36me3 и привлекает PRC2 и деметилазу NO66 к генам эмбриональных стволовых клеток во время дифференцировки». Структурная и молекулярная биология природы . 19 (12): 1273–1281. дои : 10.1038/nsmb.2449 . hdl : 2262/97536 . ПМИД 23160351 . S2CID 1017805 .
- ^ Перейти обратно: а б Диллон СК, Чжан Х, Тривел Р.К., Ченг Х (2005). «Суперсемейство белков SET-домена: протеинлизинметилтрансферазы» . Геномная биология . 6 (8): 227. doi : 10.1186/gb-2005-6-8-227 . ПМЦ 1273623 . ПМИД 16086857 .
- ^ Перейти обратно: а б с Кипп Д.Р., Куинн К.М., Фортин П.Д. (октябрь 2013 г.). «Фермент-зависимое депротонирование лизина в катализе EZH2». Биохимия . 52 (39): 6866–6878. дои : 10.1021/bi400805w . ПМИД 24000826 .
- ^ Яп Д.Б., Чу Дж., Берг Т., Шапира М., Ченг С.В., Морадиан А. и др. (февраль 2011 г.). «Соматические мутации EZH2 Y641 действуют преимущественно через механизм избирательно измененной каталитической активности PRC2, увеличивая триметилирование H3K27» . Кровь . 117 (8): 2451–2459. дои : 10.1182/кровь-2010-11-321208 . ПМК 3062411 . ПМИД 21190999 .
- ^ Перейти обратно: а б «Окно уязвимости» . Гарвардская медицинская школа . 28 января 2015 года. Архивировано из оригинала 23 февраля 2015 года . Проверено 23 февраля 2015 г.
- ^ Перейти обратно: а б Конзе К.Д., Ма А., Ли Ф., Барсайт-Лавджой Д., Партон Т., Макневин С.Дж. и др. (2013). «Биодоступный при пероральном приеме химический зонд лизинметилтрансфераз EZH2 и EZH1» . АКС Химическая биология . 8 (6): 1324–1334. дои : 10.1021/cb400133j . ПМЦ 3773059 . ПМИД 23614352 .
- ^ Бракен А.П., Пасини Д., Капра М., Просперини Э., Колли Э., Хелин К. (октябрь 2003 г.). «EZH2 находится ниже пути pRB-E2F, необходим для пролиферации и усиливается при раке» . Журнал ЭМБО . 22 (20): 5323–5335. дои : 10.1093/emboj/cdg542 . ПМК 213796 . ПМИД 14532106 .
- ^ Ши Б., Лян Дж., Ян Х., Ван Ю., Чжао Ю., Ву Х. и др. (июль 2007 г.). «Интеграция сигнальных цепей эстрогена и Wnt белком группы поликомб EZH2 в клетках рака молочной железы» . Молекулярная и клеточная биология . 27 (14): 5105–5119. дои : 10.1128/MCB.00162-07 . ЧВК 1951944 . ПМИД 17502350 .
- ^ Морин Р.Д., Джонсон Н.А., Северсон Т.М., Мангалл А.Дж., Ан Дж., Гойя Р. и др. (февраль 2010 г.). «Соматические мутации, изменяющие EZH2 (Tyr641) при фолликулярных и диффузных крупных B-клеточных лимфомах герминативного происхождения» . Природная генетика . 42 (2): 181–185. дои : 10.1038/ng.518 . ПМК 2850970 . ПМИД 20081860 .
- ^ Перейти обратно: а б Тан Дж., Ян Х, Чжуан Л., Цзян Х., Чен В., Ли П.Л. и др. (май 2007 г.). «Фармакологическое нарушение репрессии генов, опосредованной поликомб-репрессивным комплексом 2, избирательно индуцирует апоптоз в раковых клетках» . Гены и развитие . 21 (9): 1050–1063. дои : 10.1101/gad.1524107 . ПМК 1855231 . ПМИД 17437993 .
- ^ Перейти обратно: а б Кнутсон С.К., Вигл Т.Дж., Уорхолик Н.М., Снерингер С.Дж., Аллен С.Дж., Клаус С.Р. и др. (ноябрь 2012 г.). «Селективный ингибитор EZH2 блокирует метилирование H3K27 и убивает мутантные клетки лимфомы». Химическая биология природы . 8 (11): 890–896. дои : 10.1038/nchembio.1084 . ПМИД 23023262 .
- ^ Перейти обратно: а б с Ци В, Чан Х, Тенг Л, Ли Л, Чуай С, Чжан Р и др. (декабрь 2012 г.). «Селективное ингибирование Ezh2 низкомолекулярным ингибитором блокирует пролиферацию опухолевых клеток» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (52): 21360–21365. Бибкод : 2012PNAS..10921360Q . дои : 10.1073/pnas.1210371110 . ПМЦ 3535655 . ПМИД 23236167 .
- ^ Перейти обратно: а б Маккейб М.Т., Отт Х.М., Ганджи Г., Коренчук С., Томпсон С., Ван Аллер Г.С. и др. (декабрь 2012 г.). «Ингибирование EZH2 как терапевтическая стратегия лимфомы с мутациями, активирующими EZH2». Природа . 492 (7427): 108–112. Бибкод : 2012Natur.492..108M . дои : 10.1038/nature11606 . ПМИД 23051747 . S2CID 4385729 .
- ^ Перейти обратно: а б Кутюр Дж. Ф., Хаук Дж., Томпсон М. Дж., Блэкберн Г. М., Тривел Р. К. (июль 2006 г.). «Каталитическая роль углеродно-кислородных водородных связей в лизинметилтрансферазах домена SET» . Журнал биологической химии . 281 (28): 19280–19287. дои : 10.1074/jbc.M602257200 . ПМИД 16682405 .
- ^ Epizyme объявила о клинических данных фазы 1 исследования ингибитора EZH2 EPZ-6438 (E7438), которые будут представлены на симпозиуме EORTC-NCI-AACR. (2014, 1 октября).
- ^ «FDA предоставило ускоренное одобрение таземетостату для лечения фолликулярной лимфомы» . FDA . 18 июня 2020 года. Архивировано из оригинала 1 августа 2020 года . Проверено 27 июля 2020 г.
- ^ Николоски Г., Лангемейер С.М., Койпер Р.П., Кнопс Р., Массоп М., Тонниссен Э.Р. и др. (август 2010 г.). «Соматические мутации гена гистон-метилтрансферазы EZH2 при миелодиспластических синдромах». Природная генетика . 42 (8): 665–667. дои : 10.1038/ng.620 . ПМИД 20601954 . S2CID 5814891 .
- ^ Дудакович А., Камиллери Э.Т., Сюй Ф., Ристер С.М., МакГи-Лоуренс М.Э., Брэдли Э.В. и др. (ноябрь 2015 г.). «Эпигенетический контроль развития скелета с помощью гистонов метилтрансферазы Еж2» . Журнал биологической химии . 290 (46): 27604–27617. дои : 10.1074/jbc.M115.672345 . ПМК 4646012 . ПМИД 26424790 .
- ^ Му З, Ли Х, Фернандес С.В., Алпо К.Р., Чжан Р., Кристофанилли М. (сентябрь 2013 г.). «Нокдаун EZH2 подавляет рост и инвазию воспалительных клеток рака молочной железы человека» . Журнал экспериментальных и клинических исследований рака . 32 (1): 70. дои : 10.1186/1756-9966-32-70 . ПМК 3850122 . ПМИД 24294976 .
- ^ «Ансамбль» . Генное дерево ЭЖ2 . Архивировано из оригинала 23 февраля 2015 года . Проверено 19 февраля 2015 г.
- ^ Лайбле Г., Вольф А., Дорн Р., Рейтер Г., Нислоу С., Леберсоргер А. и др. (июнь 1997 г.). «Гомологи млекопитающих гена группы Polycomb. Усилитель zeste опосредует молчание генов в гетерохроматине дрозофилы и в теломерах S. cerevisiae» . Журнал ЭМБО . 16 (11): 3219–3232. дои : 10.1093/emboj/16.11.3219 . ПМЦ 1169939 . ПМИД 9214638 .
- ^ «НЦБИ ЮниДжин» . Усилитель гомолога 2 zeste (дрозофилы) (EZH2) . Проверено 1 февраля 2015 г.
- ^ «Генные карты» . Усилитель гомолога Zeste 2 (дрозофила) . Архивировано из оригинала 23 февраля 2015 года . Проверено 1 февраля 2015 г.
- ^ «Ансамбль» . Генное дерево ЭЖ2 . Архивировано из оригинала 22 апреля 2024 года . Проверено 1 февраля 2015 г.
- ^ Фличек П., Амод М.Р., Баррелл Д., Бил К., Биллис К., Брент С. и др. (январь 2014 г.). «Ансамбль 2014» . Исследования нуклеиновых кислот . 42 (Проблема с базой данных): D749–D755. дои : 10.1093/nar/gkt1196 . ПМЦ 3964975 . ПМИД 24316576 .
Дальнейшее чтение
[ редактировать ]- Зейдлер М., Клир К.Г. (сентябрь 2006 г.). «Усилитель белка группы Polycomb Zeste 2: его связь с восстановлением ДНК и раком молочной железы». Журнал молекулярной гистологии . 37 (5–7): 219–223. дои : 10.1007/s10735-006-9042-9 . ПМИД 16855786 . S2CID 2332105 .
- Де Хаан Г., Герритс А. (июнь 2007 г.). «Эпигенетический контроль старения гемопоэтических стволовых клеток на примере Еж2». Анналы Нью-Йоркской академии наук . 1106 (1): 233–239. Бибкод : 2007NYASA1106..233D . дои : 10.1196/анналы.1392.008 . ПМИД 17332078 . S2CID 25177748 .
- Хоберт О, Джаллал Б, Ульрих А (июнь 1996 г.). «Взаимодействие Vav с ENX-1, предполагаемым регулятором транскрипции экспрессии генов гомеобокса» . Молекулярная и клеточная биология . 16 (6): 3066–3073. дои : 10.1128/MCB.16.6.3066 . ПМК 231301 . ПМИД 8649418 .
- Бональдо М.Ф., Леннон Дж., Соарес М.Б. (сентябрь 1996 г.). «Нормализация и вычитание: два подхода к открытию генов» . Геномные исследования . 6 (9): 791–806. дои : 10.1101/гр.6.9.791 . ПМИД 8889548 .
- Абель К.Дж., Броди Л.К., Вальдес Х.М., Эрдос М.Р., МакКинли Д.Р., Кастилья Л.Х. и др. (октябрь 1996 г.). «Характеристика EZH1, человеческого гомолога дрозофилы, усилителя цедры рядом с BRCA1» . Геномика . 37 (2): 161–171. дои : 10.1006/geno.1996.0537 . ПМИД 8921387 .
- Лайбле Г., Вольф А., Дорн Р., Рейтер Г., Нислоу С., Леберсоргер А. и др. (июнь 1997 г.). «Гомологи млекопитающих гена группы Polycomb. Усилитель zeste опосредует молчание генов в гетерохроматине дрозофилы и в теломерах S. cerevisiae» . Журнал ЭМБО . 16 (11): 3219–3232. дои : 10.1093/emboj/16.11.3219 . ПМЦ 1169939 . ПМИД 9214638 .
- Кардосо С., Тимсит С., Виллар Л., Крещатиский М., Фонтес М., Колло Л. (апрель 1998 г.). «Специфическое взаимодействие между продуктом гена XNP/ATR-X и доменом SET человеческого белка EZH2» . Молекулярная генетика человека . 7 (4): 679–684. дои : 10.1093/hmg/7.4.679 . ПМИД 9499421 .
- ван Лохейзен М., Таймс М., Вонкен Дж.В., Шумахер А., Магнусон Т., Вьентйенс Э. (июнь 1998 г.). «Взаимодействие белков мышиной поликомб-группы (Pc-G) Enx1 и Enx2 с Eed: указание на отдельные комплексы Pc-G» . Молекулярная и клеточная биология . 18 (6): 3572–3579. дои : 10.1128/MCB.18.6.3572 . ПМЦ 108938 . ПМИД 9584197 .
- Севальт Р.Г., ван дер Влаг Дж., Гюнстер М.Дж., Хамер К.М., ден Блаувен Дж.Л., Сатин Д.П. и др. (июнь 1998 г.). «Характеристика взаимодействий между белками группы полисот млекопитающих Enx1 / EZH2 и EED предполагает существование различных белковых комплексов группы полисот млекопитающих» . Молекулярная и клеточная биология . 18 (6): 3586–3595. дои : 10.1128/mcb.18.6.3586 . ПМК 108940 . ПМИД 9584199 .
- Денисенко О., Шнырева М., Сузуки Х., Бомштык К. (октябрь 1998 г.). «Точечные мутации в домене WD40 Eed блокируют его взаимодействие с Ezh2» . Молекулярная и клеточная биология . 18 (10): 5634–5642. дои : 10.1128/MCB.18.10.5634 . ПМК 109149 . ПМИД 9742080 .
- ван дер Влаг Дж., Отте А.П. (декабрь 1999 г.). «Репрессия транскрипции, опосредованная белком EED группы полисот человека, включает деацетилирование гистонов». Природная генетика . 23 (4): 474–478. дои : 10.1038/70602 . ПМИД 10581039 . S2CID 6748531 .
- Кардозо С, Миньон С, Хетет Ж, Граншам Б, Фонтес М, Колло Л (март 2000 г.). «Ген EZH2 человека: геномная организация и пересмотренное картирование в 7q35 в критической области злокачественных миелоидных заболеваний» . Европейский журнал генетики человека . 8 (3): 174–180. дои : 10.1038/sj.ejhg.5200439 . ПМИД 10780782 .
- Раапхорст Ф.М., Отте А.П., ван Кеменаде Ф.Дж., Блокзейл Т., Фирет Э., Хамер К.М. и др. (май 2001 г.). «Различные закономерности экспрессии BMI-1 и EZH2 в тимоцитах и зрелых Т-клетках позволяют предположить роль генов Polycomb в дифференцировке Т-клеток человека» . Журнал иммунологии . 166 (10): 5925–5934. дои : 10.4049/jimmunol.166.10.5925 . ПМИД 11342607 .
- О'Коннелл С., Ван Л., Роберт С., Джонс Калифорния, Сэйнт Р., Джонс Р.С. (ноябрь 2001 г.). «Поликомбоподобные пальцы PHD опосредуют консервативное взаимодействие с усилителем белка цедры» . Журнал биологической химии . 276 (46): 43065–43073. дои : 10.1074/jbc.M104294200 . ПМИД 11571280 .
- Варамбалли С., Дханасекаран С.М., Чжоу М., Барретт Т.Р., Кумар-Синха С., Санда М.Г. и др. (октябрь 2002 г.). «Белок группы поликомб EZH2 участвует в прогрессировании рака простаты». Природа . 419 (6907): 624–629. Бибкод : 2002Natur.419..624V . дои : 10.1038/nature01075 . hdl : 2027.42/62896 . ПМИД 12374981 . S2CID 4414767 .
- Клеер К.Г., Као К., Варамбалли С., Шен Р., Ота И., Томлинс С.А. и др. (сентябрь 2003 г.). «EZH2 является маркером агрессивного рака молочной железы и способствует неопластической трансформации эпителиальных клеток молочной железы» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (20): 11606–11611. Бибкод : 2003PNAS..10011606K . дои : 10.1073/pnas.1933744100 . ПМК 208805 . ПМИД 14500907 .