Флуоресценция в науках о жизни

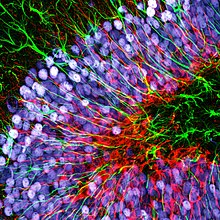

Флуоресценция обычно используется в науках о жизни как неразрушающий способ отслеживания или анализа биологических молекул.Некоторые белки или небольшие молекулы в клетках естественным образом флуоресцируют, что называется собственной флуоресценцией или автофлуоресценцией (например, НАДН , триптофан или эндогенный хлорофилл , фикоэритрин или зеленый флуоресцентный белок ). Альтернативно, специфические или общие белки, нуклеиновые кислоты , липиды или небольшие молекулы могут быть «помечены» внешним флуорофором , флуоресцентным красителем , который может представлять собой небольшую молекулу, белок или квантовую точку . Существует несколько методов использования дополнительных свойств флуорофоров , таких как резонансная передача энергии флуоресценции , при которой энергия передается безызлучательно к определенному соседнему красителю, что позволяет обнаружить близость или активацию белка; другой — изменение свойств, таких как интенсивность, некоторых красителей в зависимости от их окружения, что позволяет использовать их в структурных исследованиях. [1] [2] [3]
флуоресценция
[ редактировать ]
Принцип флуоресценции заключается в том, что флуоресцентная часть содержит электроны , которые могут поглощать фотон и ненадолго переходить в возбужденное состояние, прежде чем либо рассеять энергию безызлучательно, либо испустить ее в виде фотона , но с более низкой энергией, т. е. с большей длиной волны ( длина волны и энергия обратно пропорциональны). [4] Разница в длинах волн возбуждения и излучения называется стоксовым сдвигом , а время, необходимое возбужденному электрону для испускания фотона, называется временем жизни . Квантовый выход является показателем эффективности красителя (это соотношение испускаемых фотонов на один поглощенный фотон), а коэффициент экстинкции — это количество света, которое может быть поглощено флуорофором. Как квантовый выход, так и коэффициент экстинкции специфичны для каждого флуорофора, и их умножение позволяет рассчитать яркость флуоресцентной молекулы. [5]
Маркировка
[ редактировать ]Реактивные красители
[ редактировать ]Флуорофоры могут быть присоединены к белкам через определенные функциональные группы, такие как:
- аминогруппы ( например, через сукцинимид или изотиоцианат );
- карбоксильные группы ( например, посредством активации карбодиимидом и последующего сочетания с амином );
- тиол ( например, через малеимид или йодацетамиды);
- азид ( например , посредством клик-химии с терминальным алкином );
или неспецифически ( глутаральдегид ), или нековалентно ( например, за счет гидрофобности и т.д.).
Эти флуорофоры представляют собой небольшие молекулы, белки или квантовые точки.
Органические флуорофоры флуоресцируют благодаря делокализованным электронам, которые могут перепрыгивать зону и стабилизировать поглощенную энергию, поэтому большинство флуорофоров представляют собой сопряженные системы . Существует несколько семейств, и их возбуждение варьируется от инфракрасного до ультрафиолетового .
Лантаниды (хелатированные) представляют собой уникальные флуоресцентные металлы, которые излучают благодаря переходам с участием 4 f -орбит, которые запрещены, поэтому они имеют очень низкие коэффициенты поглощения и медленное излучение, требующее возбуждения с помощью флуоресцентных органических хелаторов ( например, дипиколината тербия (III) на основе ). хелаторов [6] ).
Третий класс низкомолекулярных флуорофоров - это переходного металла с лигандом комплексы , которые проявляют молекулярную флуоресценцию из состояния переноса заряда от металла к лиганду , которое частично запрещено. Обычно это комплексы рутения , рения или осмия .
Квантовые точки
[ редактировать ]Квантовые точки — это флуоресцентные полупроводниковые наночастицы , которые обычно ярче, чем обычные пятна. Они, как правило, более дороги, токсичны, не проникают через клеточные мембраны и не могут вырабатываться клеткой.
Флуоресцентные белки
[ редактировать ]В природе существует несколько флуоресцентных белков. [ нужна ссылка ] , но наиболее важным в качестве инструмента исследования является зеленый флуоресцентный белок (GFP) медузы Aequorea victoria , [7] который спонтанно флуоресцирует при сворачивании за счет специфических остатков серин-тирозин-глицин. Преимущество GFP и других флуоресцентных белков перед органическими красителями или квантовыми точками заключается в том, что они могут экспрессироваться экзогенно в клетках отдельно или в виде слитого белка , белка, который создается путем лигирования флуоресцентного гена (например, GFP) с другим геном и экспрессия которых управляется промотором гена домашнего хозяйства или другим специфическим промотором. Этот подход позволяет использовать флуоресцентные белки в качестве репортеров любого количества биологических событий, таких как субклеточная локализация и паттерны экспрессии .Вариант GFP естественным образом встречается в кораллах , особенно в Anthozoa , и было создано несколько мутантов, которые охватывают видимый спектр и флуоресцируют дольше и стабильнее.Другие белки флуоресцентны, но требуют кофактора флуорофора и, следовательно, могут использоваться только in vitro ; они часто встречаются в растениях и водорослях (фитофторы, фикобилипротеины, такие как аллофикоцианин ).
Вычислительные методы
[ редактировать ]Вышеупомянутые методы можно комбинировать с вычислительными методами для оценки уровней окрашивания без окрашивания клетки. Эти подходы, как правило, основаны на обучении глубокой сверточной нейронной сети для выполнения переназначения изображений, преобразования светлопольного или фазового изображения в флуоресцентное изображение. [8] [9] Отделяя обучающий корпус от исследуемых клеток, эти подходы предоставляют возможность использовать пятна, которые в противном случае несовместимы с визуализацией живых клеток, например, окрашивание антителами. [10]
Биолюминесценция и флуоресценция
[ редактировать ]Флуоресценция , хемилюминесценция и фосфоресценция — это три разных типа свойств люминесценции , то есть испускания света веществом.Флуоресценция — это свойство, при котором свет поглощается и излучается в течение нескольких наносекунд (около 10 нс) при более низкой энергии (= более высокой длине волны), тогда как биолюминесценция — это биологическая хемилюминесценция , свойство, при котором свет генерируется в результате химической реакции фермента на субстрат. Фосфоресценция — это свойство материалов поглощать свет и излучать энергию через несколько миллисекунд или более (из-за запрещенных переходов в основное состояние , триплетного состояния тогда как флуоресценция происходит в возбужденных синглетных состояниях ). До недавнего времени это было неприменимо к исследованиям в области медико-биологических наук из-за размера неорганических частиц. Однако граница между флуоресценцией и фосфоресценцией не является четкой, поскольку комплексы переходного металла с лигандом, которые объединяют металл и несколько органических фрагментов, имеют длительное время жизни, до нескольких микросекунд (поскольку они проявляют смешанные синглет-триплетные состояния).
Сравнение с радиоактивностью
[ редактировать ]До его широкого использования в последние три десятилетия радиоактивность была наиболее распространенным ярлыком.
Преимущества флуоресценции перед радиоактивными метками заключаются в следующем:
- Флуоресценция безопаснее в использовании и не требует радиологического контроля.
- Одновременно можно использовать несколько флуоресцентных молекул при условии, что они не перекрываются, ср. FRET, тогда как при радиоактивности два изотопа можно использовать ( тритий и изотоп низкой энергии, такой как 33 P из-за различной интенсивности), но требуют специального оборудования (тритиевый экран и обычный фосфорный экран или специальный двухканальный детектор). [11] ).
Примечание. Канал аналогичен «цвету», но отличается от него. Это пара фильтров возбуждения и излучения, специфичных для красителя, например, микрочипы Agilent являются двухканальными, работающими на cy3 и cy5, в просторечии они называются зеленым и красным.
Использование флуоресценции не обязательно более удобно, поскольку для нее требуется собственное специализированное оборудование для обнаружения. Он может быть полезен для неколичественного или относительного количественного определения, но плохо подходит для проведения абсолютных измерений из-за тушения флуоресценции , тогда как измерение радиоактивно меченых молекул всегда является прямым и высокочувствительным.
К недостаткам флуорофоров можно отнести:
- Значительно изменяет свойства флуоресцентно-меченной молекулы.
- Вмешательство в нормальные биологические процессы
- Токсичность
Дополнительные полезные свойства
[ редактировать ]Основное свойство флуоресценции широко используется, например, в качестве маркера меченых компонентов в клетках ( флуоресцентная микроскопия ) или в качестве индикатора в растворе ( флуоресцентная спектроскопия ), но другие дополнительные свойства, не обнаруженные при радиоактивности, делают ее еще более широко используемой.
ЛАДА
[ редактировать ]
FRET (резонансная передача энергии Фёрстера) — это свойство, при котором энергия возбужденного электрона одного флуорфора, называемого донором, передается ближайшему акцепторному красителю, либо темному тушителю , либо другому флуорофору, спектр возбуждения которого перекрывается. спектр излучения донорного красителя приводит к уменьшению флуоресценции.Это можно использовать для:
- обнаружить, вступают ли в контакт два меченых белка или нуклеиновые кислоты или гидролизуется дважды меченная одиночная молекула;
- обнаружить изменения в конформации;
- измерить концентрацию с помощью анализа конкурентного связывания.
Чувствительность к окружающей среде
[ редактировать ]
Красители, чувствительные к окружающей среде, меняют свои свойства (интенсивность, период полураспада, спектры возбуждения и испускания) в зависимости от полярности (гидрофобности и заряда) окружающей среды. Примеры включают: индол , каскадный желтый, продан, дансил, дапоксил, NBD, PyMPO, пирен и диэтиламинокумарин.
Это изменение наиболее выражено, когда электронодонорная и электроноакцепторная группы располагаются на противоположных концах ароматической кольцевой системы. [12] поскольку это приводит к большому изменению дипольного момента при возбуждении.
Когда флуорофор возбужден, он обычно имеет больший дипольный момент (μ E ), чем в основном состоянии (μ G ). Поглощение фотона флуорофором занимает несколько пикосекунд. Прежде чем эта энергия высвободится (эмиссия: 1–10 нс), молекулы растворителя, окружающие флуорофор, переориентируются (10–100 пс) за счет изменения полярности в возбужденном синглетном состоянии; этот процесс называется релаксацией растворителя. В результате этой релаксации энергия возбужденного состояния флуорофора снижается (больше длина волны), следовательно, флуорофоры с большим изменением дипольного момента имеют большие изменения стокс-сдвига в разных растворителях. Разницу между уровнями энергии можно грубо определить с помощью уравнения Липпера-Матаги.
Гидрофобный краситель — это краситель , нерастворимый в воде, причем это свойство не зависит от сольватохромии.
Кроме того, термин «чувствительность к окружающей среде» в химии на самом деле описывает изменения, вызванные одним из множества различных факторов окружающей среды, таких как pH или температура, а не только полярностью; однако в биохимии флуорфор, чувствительный к окружающей среде, и сольватохромный флуорофор используются как взаимозаменяемые: это соглашение настолько широко распространено, что поставщики описывают их как чувствительные к окружающей среде, а не сольватохромные.
Срок службы флуоресценции
[ редактировать ]Флуоресцентные фрагменты испускают фотоны через несколько наносекунд после поглощения по экспоненциальной кривой затухания, которая различается в зависимости от красителя и зависит от окружающего растворителя. Когда краситель присоединяется к макромолекулам, кривая распада становится многоэкспоненциальной. Сопряженные красители обычно имеют время жизни от 1 до 10 нс, существует небольшое количество более долгоживущих исключений, в частности пирен со временем жизни 400 нс в дегазированных растворителях или 100 нс в липидах и коронен с 200 нс. К другой категории флуорфоров относятся флуоресцентные металлоорганические соединения (лантаниды и комплексы переходного металла с лигандом), которые были описаны ранее и имеют гораздо более длительное время жизни из-за ограниченных состояний: лантаноиды имеют время жизни от 0,5 до 3 мс, тогда как переходный металл-лиганд комплексы имеют время жизни от 10 нс до 10 мкс. Обратите внимание, что время жизни флуоресценции не следует путать со временем жизни фотодеструкции или «сроком годности» красителя.
Многофотонное возбуждение
[ редактировать ]Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( декабрь 2009 г. ) |
Многофотонное возбуждение — это способ фокусировки плоскости обзора микроскопа за счет использования преимущества явления, когда два фотона низкой энергии одновременно поглощаются флуоресцентной частью, которая обычно поглощает один фотон с удвоенной их индивидуальной энергией: скажем, два фотона ближнего ИК-диапазона (800 нм). для возбуждения УФ-красителя (400 нм).
Анизотропия флуоресценции
[ редактировать ]Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( декабрь 2009 г. ) |
Совершенно неподвижный флуоресцентный фрагмент при воздействии на него поляризованного света будет излучать свет, который также поляризован. Однако если молекула движется, она будет иметь тенденцию «искажать» поляризацию света, излучая его в направлении, отличном от падающего света.
Флуоресцентная термометрия
[ редактировать ]Некоторые флуоресцентные химические вещества демонстрируют значительное гашение флуоресценции при воздействии повышенных температур. Этот эффект был использован для измерения и изучения термогенных свойств митохондрий. Это предполагает размещение термочувствительных флуорофоров, нацеленных на митохондрии, внутри клеток, которые естественным образом локализуются внутри митохондрий из-за отрицательного заряда лицевой стороны матрицы внутренней митохондриальной мембраны (поскольку флуорофоры являются катионными). [13] Температура этих флуорофоров обратно пропорциональна их флуоресцентному излучению, и, таким образом, измеряя выход флуоресценции, можно определить температуру активно дышащих митохондрий. Используемые флуорофоры обычно представляют собой липофильные катионы, полученные из родамина-B . [13] такие как MitoTracker компании ThermoFisher. зонды [14] Этот метод внес значительный вклад в общее научное мнение о том, что митохондрии физиологически поддерживаются при температуре, близкой к 50 ˚C, что более чем на 10 ˚C выше температуры остальной части клетки. [15]

Обратная зависимость между флуоресценцией и температурой может быть объяснена изменением числа столкновений атомов в окружении флуорофора в зависимости от кинетической энергии. Столкновения способствуют безызлучательному распаду и потере дополнительной энергии в виде тепла, поэтому большее количество столкновений или более сильные столкновения будут способствовать безызлучательному распаду и уменьшению излучения флуоресценции. [16]
Однако этот метод измерения температуры ограничен. На эти катионные флуорофоры сильно влияет заряд внутренней поверхности матрикса митохондриальной мембраны, зависящий от типа клетки. Например, термочувствительный флуорофор MTY (MitoTracker Yellow) демонстрирует внезапное и резкое падение флуоресценции после добавления олигомицина ( ингибитора АТФ-синтазы ) к митохондриям первичных фибробластов человека. Это предполагает резкое повышение температуры митохондрий, но на самом деле это объясняется гиперполяризацией внутренней мембраны митохондрий олигомицином, что приводит к разрушению положительно заряженного флуорофора MTY. [13]
Методы
[ редактировать ]Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( декабрь 2009 г. ) |
- Флуоресцентная микроскопия тканей, клеток или субклеточных структур осуществляется путем мечения антитела флуорофором и предоставления антителу возможности найти целевой антиген в образце. Маркировка нескольких антител разными флуорофорами позволяет визуализировать несколько мишеней на одном изображении.
- Автоматизированное секвенирование ДНК методом терминации цепи ; каждое из четырех различных оснований, обрывающих цепь, имеет свою собственную флуоресцентную метку. Когда меченые молекулы ДНК разделяются, флуоресцентная метка возбуждается источником УФ-излучения, и идентичность основания, замыкающего молекулу, определяется по длине волны излучаемого света.

- Обнаружение ДНК: соединение бромистого этидия , когда оно свободно меняет свою конформацию в растворе, имеет очень слабую флуоресценцию. Флуоресценция бромида этидия значительно усиливается, когда он связывается с ДНК, поэтому это соединение очень полезно для визуализации местоположения фрагментов ДНК при электрофорезе в агарозном геле . Бромид этидия может быть токсичным – предположительно более безопасной альтернативой является краситель SYBR Green .
- ДНК -микрочип .
- Иммунология: к антителу прикреплена флуоресцентная химическая группа, и участки (например, на микроскопическом образце), с которыми антитело связалось, можно увидеть и даже количественно оценить по флуоресценции.
- FACS ( сортировка клеток, активируемая флуоресценцией ).
- Микромасштабный термофорез (MST) использует флуоресценцию для количественной оценки направленного движения биомолекул в микроскопических градиентах температуры.
- Флуоресценция использовалась для изучения структуры и конформации ДНК и белков с помощью таких методов, как резонансный перенос энергии флуоресценции , который измеряет расстояние на уровне ангстрема. Это особенно важно в комплексах из нескольких биомолекул.
- Флуоресценцию можно применять для изучения колокализации различных представляющих интерес белков. [17] Затем его можно проанализировать с помощью специализированного программного обеспечения, например CoLocalizer Pro .
Кроме того, многие биологические молекулы обладают собственной флуоресценцией, которую иногда можно использовать без необходимости прикреплять химическую метку. Иногда эта собственная флуоресценция меняется, когда молекула находится в определенной среде, поэтому можно измерить распределение или связывание молекулы. Билирубин , например, обладает высокой флуоресценцией, когда он связан с определенным участком сывороточного альбумина. Протопорфирин цинка , образующийся в развивающихся эритроцитах вместо гемоглобина, когда железо недоступно или присутствует свинец, имеет яркую флуоресценцию и может использоваться для выявления этих проблем.
Число применений флуоресценции в биомедицинских, биологических и смежных науках постоянно расширяется. Методы анализа в этих областях также растут, часто с номенклатурой в виде сокращений, таких как: FLIM , FLI, FLIP , CALI, FLIE, FRET , FRAP , FCS , PFRAP, smFRET, FIONA, FRIPS, SHREK, SHRIMP или TIRF. . Большинство этих методов основаны на флуоресцентных микроскопах, в которых используются источники света высокой интенсивности, обычно ртутные или ксеноновые лампы, светодиоды или лазеры, для возбуждения флуоресценции в исследуемых образцах. Затем оптические фильтры отделяют возбуждающий свет от испускаемой флуоресценции для обнаружения глазом, ПЗС-камерой или другим детектором света (например, фотоумножителями, спектрографами). Ведутся значительные исследования по улучшению возможностей таких микроскопов, используемых флуоресцентных зондов и областей их применения. Особого внимания заслуживают конфокальные микроскопы, в которых для получения оптических срезов используется точечное отверстие , позволяющее получить количественное трехмерное изображение образца.
См. также
[ редактировать ]- флюорофор
- Флуоресцентная микроскопия
- Флуоресцентная визуализация
- Флуоресцентные биосенсоры глюкозы
- Рентгеноскопия
Ссылки
[ редактировать ]- ^ Джозеф Р. Лакович (2006). Принципы флуоресцентной спектроскопии . Спрингер. стр. 26–. ISBN 978-0-387-31278-1 . Проверено 25 июня 2011 г.
- ^ Основы флуоресценции . Invitrogen.com. Проверено 25 июня 2011 г.
- ^ Хуан Карлос Стокерт, Альфонсо Бласкес-Кастро (2017). Флуоресцентная микроскопия в науках о жизни . Издательство Bentham Science. ISBN 978-1-68108-519-7 . Проверено 17 декабря 2017 г.
- ^ Анимация принципа флуоресценции и поглощения в УФ-видимой области.
- ^ Ау-Юнг, Хо Ю; Тонг, Ка Ян (2021). «Глава 16. Переходные металлы и методы визуализации в нейробиологии и нейродегенеративных заболеваниях». Ионы металлов в методах биовизуализации . Спрингер. стр. 437–456. дои : 10.1515/9783110685701-022 . S2CID 233678495 .
- ^ Ламтюр, Дж. Б.; Вензель, Т.Г. (1995). «Интенсально люминесцентные иммунореактивные конъюгаты белков и полимерные хелаты Tb (III) на основе дипиколината». Биоконъюгатная химия . 6 (1): 88–92. дои : 10.1021/bc00031a010 . ПМИД 7711110 .
- ^ Чалфи, М; Ту, Ю; Ойскирхен, Г; Уорд, WW; Прашер, округ Колумбия (1994). «Зеленый флуоресцентный белок как маркер экспрессии генов». Наука . 263 (5148): 802–5. Бибкод : 1994Sci...263..802C . дои : 10.1126/science.8303295 . ПМИД 8303295 .
- ^ Кристиансен, Эрик М.; Ян, Сэмюэл Дж.; Андо, Д. Майкл; Джавахериан, Ашкан; Скибински, Гайя; Липник, Скотт; Маунт, Эллиот; О'Нил, Элисон; Шах, Киван; Ли, Алисия К.; Гоял, Пиюш; Федус, Уильям; Поплин, Райан; Эстева, Андре; Берндл, Марк; Рубин, Ли Л.; Нельсон, Филип; Финкбайнер, Стивен (апрель 2018 г.). «Маркировка In Silico: прогнозирование флуоресцентных меток на немаркированных изображениях» . Клетка . 173 (3): 792–803.e19. дои : 10.1016/j.cell.2018.03.040 . ПМК 6309178 . ПМИД 29656897 .
- ^ Кандель Михаил Евгеньевич; Он, Ючен Р.; Ли, Ён Джэ; Чен, Тейлор Сюань-Ю; Салливан, Кэтрин Мишель; Айдын, Онур; Саиф, М. Тахер А.; Конг, Хёнджун; Собх, Нахиль; Попеску, Габриэль (7 декабря 2020 г.). «Фазовая визуализация с вычислительной специфичностью (PICS) для измерения изменений сухой массы в субклеточных компартментах» . Природные коммуникации . 11 (1): 6256. arXiv : 2002.08361 . Бибкод : 2020NatCo..11.6256K . дои : 10.1038/s41467-020-20062-x . ПМЦ 7721808 . ПМИД 33288761 .
- ^ Кандель Михаил Евгеньевич; Ким, Ындже; Ли, Ён Джэ; Трейси, Грегори; Чунг, Хи Юнг; Попеску, Габриэль (28 мая 2021 г.). «Многомасштабный анализ динамики немеченых нейритов с использованием фазовой визуализации с вычислительной специфичностью» . Датчики СКУД . 6 (5): 1864–1874. doi : 10.1021/acsensors.1c00100 . ПМЦ 8815662 . ПМИД 33882232 . S2CID 220936922 .
- ^ «Микроизображитель от Biospace Lab» . Biospacelab.com . Архивировано из оригинала 5 января 2009 г. Проверено 25 июня 2011 г.
- ^ Эванко, Даниэль (2005). «Хрупкий, но полезный флуорофор». Природные методы . 2 (3): 160–161. дои : 10.1038/nmeth0305-160b . S2CID 33954899 .
- ^ Jump up to: а б с Кретьен, Доминик; Бенит, Поль; Лерой, Кристина; Эль-Хури, Рияд; Пак, Соню; Ли, Чон Ёль; Чанг, Ён-Тэ; Ленаерс, Гай; Растин, Пьер; Рак, Малгожата (02.12.2020). «Подводные камни мониторинга температуры митохондрий с использованием заряженных термочувствительных флуорофоров» . Хемосенсоры . 8 (4): 124. doi : 10.3390/chemosensors8040124 . ISSN 2227-9040 .
- ^ Арай, Сатоши; Сузуки, Мадока; Пак, Сон-Джин; Ю, Чон Сон; Ван, Лу; Канг, Нам-Янг; Ха, Хён Хо; Чанг, Ён Тэ (2015). «Флуоресцентный термометр, нацеленный на митохондрии, контролирует внутриклеточный градиент температуры» . Химические коммуникации . 51 (38): 8044–8047. дои : 10.1039/c5cc01088h . ISSN 1359-7345 . ПМИД 25865069 .
- ^ Кретьен, Доминик; Бенит, Поль; Ха, Хён Хо; Кейперт, Сюзанна; Эль-Хури, Рияд; Чанг, Ён-Тэ; Ястрох, Мартин; Джейкобс, Ховард Т.; Растин, Пьер; Рак, Малгожата (январь 2018 г.). «Митохондрии физиологически поддерживаются при температуре, близкой к 50 °C» . ПЛОС Биология . 16 (1): e2003992. дои : 10.1371/journal.pbio.2003992 . ISSN 1545-7885 . ПМЦ 5784887 . ПМИД 29370167 .
- ^ «3.6: Переменные, влияющие на измерения флуоресценции» . Химия LibreTexts . 26 октября 2018 г. Проверено 8 июня 2022 г.
- ^ Зинчук, Гроссенбахер-Зинчук (2009). «Последние достижения в количественном анализе колокализации: фокус на нейробиологии». Прога Гистохем Цитохем . 44 (3): 125–172. дои : 10.1016/j.proghi.2009.03.001 . ПМИД 19822255 .