Флуоресцентная визуализация

Флуоресцентная визуализация — это тип неинвазивного метода визуализации, который может помочь визуализировать биологические процессы, происходящие в живом организме. Изображения могут быть получены с помощью различных методов, включая микроскопию , визуализирующие датчики и спектроскопию .
Сама флуоресценция представляет собой форму люминесценции , возникающую в результате того, что вещество излучает свет определенной длины волны после поглощения электромагнитного излучения . Молекулы, которые переизлучают свет при поглощении света, называются флуорофорами . [ 1 ] [ 2 ]
Флуоресцентная визуализация фотографирует флуоресцентные красители и флуоресцентные белки, чтобы обозначить молекулярные механизмы и структуры. Он позволяет экспериментально наблюдать динамику экспрессии генов , экспрессии белков и молекулярных взаимодействий в живой клетке. [ 3 ] По сути, он служит точным количественным инструментом в биохимических приложениях.
Распространенное заблуждение: флуоресценция отличается от биолюминесценции тем, как белки каждого процесса производят свет. Биолюминесценция — это химический процесс, в котором участвуют ферменты, расщепляющие субстрат с образованием света. Флуоресценция — это физическое возбуждение электрона и последующее возвращение к излучению света.
Атрибуты
[ редактировать ]Механизм флуоресценции
[ редактировать ]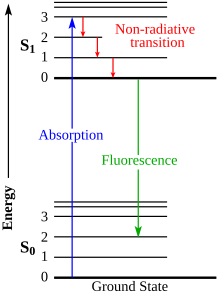
Когда определенная молекула поглощает свет, энергия молекулы на короткое время переходит в более высокое возбужденное состояние. Последующий возврат в основное состояние приводит к излучению флуоресцентного света, который можно обнаружить и измерить. Излучаемый свет, возникающий в результате поглощения фотона энергии hv , имеет определенную длину волны. Важно заранее знать эту длину волны, чтобы во время эксперимента измерительное устройство знало, какую длину волны следует установить для обнаружения излучения света. Эта длина волны определяется уравнением:
Где h = постоянная Планка, а c = скорость света. Обычно здесь используется большое сканирующее устройство или ПЗС-матрица для измерения интенсивности и цифровой фотографии изображения. [ 1 ]
Флуоресцентные красители в сравнении с белками
[ редактировать ]Флуоресцентные красители, не имеющие времени созревания, обеспечивают более высокую фотостабильность и яркость по сравнению с флуоресцентными белками. Что касается яркости, светимость зависит от коэффициента экстинкции или способности флуорофоров поглощать свет, а также от его квантовой эффективности или эффективности преобразования поглощенного света во флуоресцентно излучающую люминесценцию. Сами красители не очень флуоресцентны, но когда они связываются с белками, их становится легче обнаружить. Один из примеров, NanoOrange, связывается с оболочкой и гидрофобными областями белка, оставаясь при этом невосприимчивым к восстанавливающим агентам. Что касается белков, то эти молекулы сами флуоресцируют, когда поглощают определенную длину волны падающего света. Один из примеров этого, зеленый флуоресцентный белок (GFP), флуоресцирует зеленым при воздействии света в диапазоне от синего до УФ. Флуоресцентные белки являются отличными репортерными молекулами, которые могут помочь в локализации белков, наблюдении за связыванием белков и количественной оценке экспрессии генов. [ 1 ]
Диапазон изображения
[ редактировать ]Поскольку некоторые длины волн флуоресценции находятся за пределами диапазона человеческого глаза, для точного обнаружения света и отображения излучения используются устройства с зарядовой связью (ПЗС). Обычно это происходит в диапазоне 300–800 нм. Одним из преимуществ флуоресцентной передачи сигналов является то, что интенсивность излучаемого света ведет себя довольно линейно в зависимости от количества предоставленных флуоресцентных молекул. Очевидно, это обусловлено тем, что интенсивность и длина волны поглощенного света постоянны. Что касается самого изображения, оно обычно имеет 12-битный или 16-битный формат данных. [ 1 ]

Системы визуализации
[ редактировать ]Основными компонентами систем флуоресцентной визуализации являются:
- Источник возбуждения: устройство, которое производит либо источник с широкой длиной волны, например ультрафиолетовый свет, либо источник с узкой длиной волны, например лазер.
- Оптика светового дисплея: механизм освещения образца светом. Обычно это делается путем прямого освещения образца.
- Световая ассорти оптика: метод сбора самого света. Обычно это линзы, зеркала и фильтры.
- Фильтрация излучаемого света: оптические фильтры гарантируют, что отраженный и рассеянный свет не будет включен в флуоресценцию. Три класса эмиссионных фильтров: длиннопроходные, короткопроходные и полосовые.
- Обнаружение, усиление и визуализация: для обнаружения и количественного определения испускаемых фотонов используется либо фотоумножитель (ФЭУ), либо устройство с зарядовой парой (CCD).
Приложения
[ редактировать ]- В ПЦР (электрофорез в агарозном геле): SYBR Green — очень распространенный краситель, который связывается с ДНК и используется для визуализации полос ДНК в агарозном геле. Краситель поглощает синий свет и флуоресцирует зеленым, что позволяет системе визуализации фиксировать его.
- Блоттинг (западный, нозерн и южный): флуорохромы могут связываться с антителами, РНК и ДНК для флуоресценции и количественной оценки данных.
- Секвенирование ДНК: Секвенирование по Сэнгеру — это распространенная форма обнаружения нуклеиновых кислот, в которой могут использоваться флуоресцентно меченные ddNTP для изображения пиков флуоресценции.
- Хирургия под контролем флуоресцентных изображений: это метод медицинской визуализации, при котором масса маркируется флюоресцентно, чтобы облегчить навигацию. Например, индоцианин зеленый можно использовать для обнаружения лимфатических узлов у онкологических больных. [ 4 ]
- Флуоресцентная визуализация с точностью до одного нанометра (FIONA): используется освещение полного внутреннего отражения для уменьшения шума и увеличения яркости флуорофоров. [ 5 ]
- Визуализация кальция: метод, в котором используются флуоресцентные молекулы, называемые индикаторами кальция, флуоресценция которых меняется при связывании с Ca. 2+ ионы. Это ключевой момент в определении активности клеток нервной системы. [ 6 ]
- Пегулицианин (Lumisight) показан для флуоресцентной визуализации у взрослых с раком молочной железы в качестве вспомогательного средства для интраоперационного обнаружения раковой ткани в полости резекции после удаления первичного образца во время лампэктомии. [ 7 ]
- Фотоактивируемая локализационная микроскопия .

Виды микроскопии
[ редактировать ]Для изменения визуализации и контрастности изображения можно использовать различные методы микроскопии. У каждого метода есть свои плюсы и минусы, но все они используют один и тот же механизм флуоресценции для наблюдения за биологическим процессом.
- Флуоресцентная микроскопия полного внутреннего отражения: метод микроскопии, в котором используются затухающие волны для выборочного наблюдения флуоресценции одной молекулы. [ 8 ]
- Световая листовая флуоресцентная микроскопия: метод флуоресцентной микроскопии, при котором тонкий срез образца освещается под перпендикулярным углом исследования. [ 9 ]
- Флуоресцентная микроскопия с отображением времени жизни: метод визуализации, который регистрирует изменения флуоресценции с течением времени.
Преимущества
[ редактировать ]- Неинвазивность: визуализация in vivo может осуществляться без прокола кожи.
- Чувствительность: зонды чрезвычайно чувствительны к обнаружению биологических молекул, таких как ДНК, РНК и белки. [ 1 ]
- Множественная маркировка: в образцах можно обнаружить несколько флуорохромов, что упрощает интеграцию стандартов и контроля.
- Стабильность меченых молекул: молекулы с флуоресцентной меткой, используемые для визуализации, могут храниться месяцами, в то время как другие молекулы, подобные меченым радиоактивным изотопом, распадаются в течение нескольких дней. [ 9 ]
- Относительно безопасен в обращении: с большинством флуорофоров можно безопасно и достаточно обращаться в перчатках, тогда как, например, для радиоизотопов могут потребоваться свинцовые экраны или другая радиационная защита. [ 9 ]
- Простая утилизация: многие флуорофоры требуют минимальных методов утилизации, тогда как радиоактивные отходы требуют регулируемой утилизации и длительного обращения. Это также помогает снизить затраты, необходимые для использования этих продуктов.
Недостатки
[ редактировать ]
- Фотообесцвечивание: распространенная проблема с флуорофорами, когда постоянное циклическое движение между основным и возбужденным состояниями повреждает молекулу и снижает ее интенсивность. [ 9 ]
- Восприимчивость к окружающей среде: факторы окружающей среды, такие как температура, концентрация ионов и pH, могут влиять на эффективность и эмиссию флуорохромов.
- Токсичность: флуорохромы Аоме могут быть токсичными для клеток, тканей, in vivo или вызывая мутации. [ 10 ]
- Ограниченная разрешающая способность. Флуоресцентные микроскопы ограничены в своей способности различать близкие объекты на макроскопическом уровне. Для сравнения, электронные микроскопы, например, способны разрешать в гораздо меньшем диапазоне.
- Ограниченный начальный диапазон светимости: интенсивность источника падающего света имеет предел, выход за который может привести к фотодеструкции молекул. [ 1 ]
В целом, эта форма визуализации чрезвычайно полезна в передовых исследованиях, поскольку позволяет отслеживать биологические процессы. Переход от 2D-флуоресцентных изображений к 3D-изображениям позволил ученым лучше изучить пространственную точность и разрешение. Кроме того, сосредоточив усилия на 4D-анализе, ученые теперь могут контролировать клетку в режиме реального времени, что позволяет им отслеживать быстродействующие процессы.
Будущие направления
[ редактировать ]
Разработка более эффективных флуоресцентных белков — задача, которую взяли на себя многие ученые, чтобы улучшить возможности зондов визуализации. Часто мутации в определенных остатках могут существенно изменить флуоресцентные свойства белка. Например, путем мутации гена F64L в GFP медузы белок способен более эффективно флуоресцировать при 37 °C, что является важным свойством при выращивании культур в лаборатории. [ 11 ] В дополнение к этому, генная инженерия может создать белок, излучающий свет с лучшей длиной волны или частотой. [ 11 ] Кроме того, решающую роль может сыграть сама окружающая среда. Время жизни флуоресценции можно стабилизировать в полярной среде.
Механизмы, которые хорошо описаны, но не обязательно включены в практическое применение, обладают многообещающим потенциалом для флуоресцентной визуализации. Резонансный перенос энергии флуоресценции (FRET) — чрезвычайно чувствительный механизм, который производит сигнальные молекулы в диапазоне 1–10 нм. [ 8 ]
Совершенствование методов, составляющих процессы флуоресценции, также имеет решающее значение для более эффективных разработок. Корреляционная спектроскопия флуоресценции (FCS) — это метод анализа, позволяющий наблюдать колебания интенсивности флуоресценции. Этот анализ является компонентом многих машин флуоресцентной визуализации, и улучшение пространственного разрешения может улучшить чувствительность и дальность действия. [ 8 ]
Разработка более чувствительных зондов и аналитических методов лазерно-индуцированной флуоресценции может позволить получить более точные и актуальные экспериментальные данные.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж «Принципы и методы флуоресцентной визуализации» (PDF) . Бостонский университет . Декабрь 2012.
- ^ Сырбу, Дмитрий; Лули, Саймир; Лесли, Джек; Окли, Фиона; Беннистон, Эндрю К. (17 мая 2019 г.). «Улучшенная оптическая визуализация in vivo воспалительной реакции на острое повреждение печени у мышей C57BL/6 с использованием очень яркого красителя BODIPY, работающего в ближнем инфракрасном диапазоне» . ХимМедХим . 14 (10): 995–999. дои : 10.1002/cmdc.201900181 . ISSN 1860-7179 . ПМИД 30920173 . S2CID 85544665 .
- ^ «Флуоресцентная визуализация — последние исследования и новости» . Природа . Проверено 18 апреля 2019 г.
- ^ Нагая, Таданобу; Накамура Ю А.; Чойк, Питер Л.; Кобаяши, Хисатака (22 декабря 2017 г.). «Хирургия под флуоресцентным контролем» . Границы онкологии . 7 : 314. doi : 10.3389/fonc.2017.00314 . ISSN 2234-943X . ПМЦ 5743791 . ПМИД 29312886 .
- ^ Йылдыз, Ахмет; Селвин, Пол Р. (1 июля 2005 г.). «Флуоресцентная визуализация с точностью до одного нанометра: применение к молекулярным двигателям» . Отчеты о химических исследованиях . 38 (7): 574–582. дои : 10.1021/ar040136s . ISSN 0001-4842 . ПМИД 16028892 .
- ^ «Флуоресцентная микроскопия – плюсы и минусы» . Учебный центр ДНК . Проверено 18 апреля 2019 г.
- ^ https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2024/214511Orig1s000ltr.pdf .
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Перейти обратно: а б с Хауштайн, Эльке; Швилле, Петра (сентябрь 2007 г.). «Тенденции в области флуоресцентной визуализации и связанных с ними методов для раскрытия биологической информации» . Журнал HFSP . 1 (3): 169–180. дои : 10.2976/1.2778852 . ISSN 1955-2068 . ПМК 2640989 . ПМИД 19404444 .
- ^ Перейти обратно: а б с д Фореро-Шелтон, Ману (апрель 2019 г.). «Всматриваться в клетки в высоком разрешении стало проще». Природные методы . 16 (4): 293–294. дои : 10.1038/s41592-019-0373-3 . ISSN 1548-7105 . ПМИД 30886415 . S2CID 81982416 .
- ^ Алфорд, Рафаэль; Симпсон, Хейли М.; Дуберман, Джош; Хилл, Дж. Крейг; Огава, Микако; Реджино, Селеста; Кобаяши, Хисатака; Чойк, Питер Л. (1 ноября 2009 г.). «Токсичность органических флуорофоров, используемых в молекулярной визуализации: обзор литературы» . Молекулярная визуализация . 8 (6): 341–354. дои : 10.2310/7290.2009.00031 . ISSN 1536-0121 . ПМИД 20003892 .
- ^ Перейти обратно: а б Поршень, Дэвид В.; Дэвидсон, Майкл В.; Крэнфилл, Паула Дж.; Гилберт, Сара Г.; Кремерс, Герт-Ян (15 января 2011 г.). «Флуоресцентные белки с первого взгляда» . J Cell Sci . 124 (2): 157–160. дои : 10.1242/jcs.072744 . ISSN 0021-9533 . ПМК 3037093 . ПМИД 21187342 .
Дальнейшее чтение
[ редактировать ]- Ю, Цзяо; Харанхедкар, Шефали; Набатилан, Ариэль; Фарни, Кристофер (2021). «Глава 4: Визуализация следов металлов в биологических системах». В Кронеке, Питер М.Х.; Соса Торрес, Марта (ред.). Металлы, микробы и минералы: биогеохимическая сторона жизни . Том 21 из серии «Ионы металлов в науках о жизни». Берлин: Вальтер де Грюйтер. стр. 81–134. дои : 10.1515/9783110589771-010 . ISBN 9783110589771 . S2CID 240664558 (требуется подписка) .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) CS1 maint: постскриптум ( ссылка )
