MAGICчип
MAGIChips , также известные как « микроматрицы иммобилизованных в геле соединений на чипе » или « трехмерные ДНК-микроматрицы », представляют собой устройства для молекулярной гибридизации, получаемые путем иммобилизации олигонуклеотидов , ДНК , ферментов , антител и других соединений на фотополимеризованной микроматрице полиакриламида. гелевые подушечки размером 100х100х20 мкм или меньше. Эта технология используется для анализа гибридизации нуклеиновых кислот , специфического связывания ДНК и низкомолекулярных соединений с белками, а также белок-белковых взаимодействий.
Гелевые подушечки увеличивают поверхность для гибридизации в 50 раз по сравнению с типичными микрочипами, которые печатаются на плоской поверхности предметного стекла, обычно обрабатываемой химическими соединениями, к которым прикрепляются зонды. Плотность зонда более 1012 молекул на гелевую подушечку может быть достигнута благодаря трехмерной природе гелевых подушечек. В основе массива лежит стеклянная поверхность, к которой прикреплены небольшие блоки полиакриламидного геля. Каждый блок геля функционирует как отдельная реакционная ячейка, поскольку он окружен гидрофобной стеклянной поверхностью, которая предотвращает смешивание раствора в блоках геля. Это закладывает основу для проведения лигирования , удлинения одного основания, ПЦР-амплификации ДНК, MALDI-TOF масс-спектрометрии на чипе и других реакций.

Историческая справка
[ редактировать ]Технология MAGIChip была разработана в результате сотрудничества доктора Дэвида Сталя из Вашингтонского университета и доктора Андрея Мирзабекова, ранее работавшего в Аргоннской национальной лаборатории. В 1988 году Андрей Мирзабеков инициировал разработку нового метода секвенирования ДНК методом гибридизации с олигонуклеотидами. Этот метод лег в основу биотехнологии, использующей биологические микрочипы для быстрой идентификации структур ДНК, что имеет большое значение в борьбе с множеством заболевания.
В 1998 году было объявлено о совместном исследовательском проекте компаний Motorola Inc, Packard Instrument Company и Аргоннской национальной лаборатории Министерства энергетики США. В 1999 году исследователи из Аргоннской национальной лаборатории продвинули разработку технологии биочипов на основе микрочипов, которую они разработали совместно с Институтом Энгельхардта, чтобы предотвратить вспышку туберкулеза во всем мире.
Motorola разработала производственные процессы для массового производства биочипов, а Packard разработала и произвела аналитические инструменты для обработки и анализа биочипов. Вкладом Аргонна совместно с Институтом молекулярной биологии Энгельхардта (EIMB) стала интеллектуальная собственность в виде 19 изобретений, связанных с биологическими микрочипами.
Но это сотрудничество между EIMB в Москве, Аргоннской национальной лабораторией в Иллинойсе и двумя другими коммерческими партнерами в США рухнуло в результате спора о договорных отношениях между сторонами в 2001 году. В результате этого спора д-р Андрей Мирзабеков ушел с поста директора Технологический центр биочипов в Аргонне. [ нужна ссылка ]
Метод
[ редактировать ]На поверхности стекла (микроматрицы) создаются массивы гелевых элементов (подушечек) с последующим нанесением и химической иммобилизацией различных соединений (зондов) на эти гелевые подушечки. Затем к этой микроматрице, содержащей иммобилизованные зонды в гелевых подушечках, добавляется тестируемый образец, и при определенных условиях происходят реакции молекулярного распознавания. Тестируемый образец помечен флуоресцентной меткой для мониторинга молекулярных взаимодействий. Анализ закономерностей молекулярного взаимодействия проводится с помощью специализированного программного обеспечения.
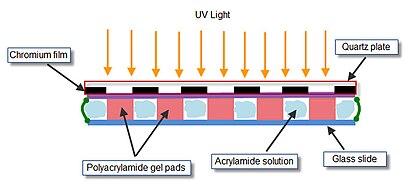

Массив гелевых элементов на предметном стекле получают методом «фотополимеризации». Раствор акриламида, подлежащий полимеризации, подается в камеру полимеризации . Камера полимеризации состоит из кварцевой маски, двух тефлоновых прокладок и предметного стекла, скрепленных двумя металлическими зажимами. Внутренняя сторона кварцевой маски имеет прозрачные для ультрафиолета (УФ) окна, расположенные заданным пространственным образом в непрозрачной хромовой пленке. Собранную камеру, содержащую акриламидный гель, подвергают воздействию УФ-излучения, чтобы обеспечить полимеризацию только в тех положениях камеры, которые расположены непосредственно под прозрачными окнами.
Олигонуклеотиды или фрагменты ДНК необходимо активировать, чтобы они содержали химически активные группы для облегчения связывания с активированными элементами геля. Активация зонда зависит от химического состава активации полиакриламидных гелей. Таким образом, для иммобилизации в альдегидсодержащем геле зонд должен иметь реакционноспособную аминогруппу, а если гели активируются введением аминогрупп, то зонды должны содержать свободную альдегидную группу. Зонды обычно готовят путем введения химически активных групп в концевые положения олигонуклеотидов при их синтезе.
Зонды для иммобилизации переносят в гелевые элементы микроматрицы с помощью роботов-дозаторов. Волоконно-оптический штифт роботов имеет гидрофобную боковую поверхность и гидрофильный наконечник и работает при температуре росы, чтобы предотвратить испарение образца во время транспортировки. Активированные зонды химически иммобилизуют путем сочетания олигонуклеотидов, несущих амино- или альдегидные группы, с гелевыми носителями, содержащими альдегидные или аминогруппы соответственно.
Молекулы-мишени метят флуоресцентными красителями . Флуоресцентное детектирование позволяет отслеживать процесс в режиме реального времени с высоким пространственным разрешением. Критерии процедуры маркировки включают:
- Это должно быть просто, быстро и недорого
- Он должен быть применим как к РНК, так и к ДНК-мишеням.
- Он должен быть совместим с фрагментацией, необходимой для уменьшения образования вторичной структуры.
- Это должно позволять включение одной метки в один фрагмент, чтобы обеспечить правильную количественную оценку интенсивности гибридизации.
- Это должно позволять сочетание нескольких красителей.
Реакции амплификации на кристалле
[ редактировать ]Амплификация реакции гибридизации на чипе служит очень полезным инструментом, когда исследуемая ДНК или белок присутствуют в относительно небольшой пропорции в молекулярной популяции, нанесенной на чип, например, когда мы имеем дело с единственной копией гена или мРНК низкая численность.
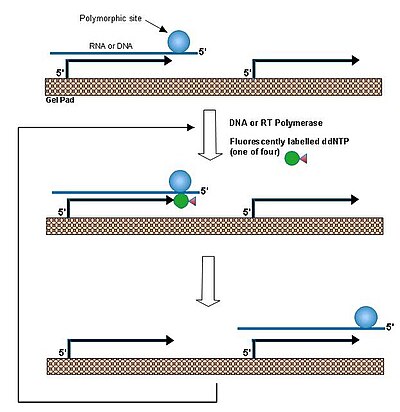
В одном базовом методе расширения [1] праймер гибридизуется с ДНК и удлиняется дидезоксирибонуклеозидтрифосфатом, который соответствует нуклеотиду в полиморфном сайте. Выполнение этой реакции при температуре выше температуры плавления дуплекса между ДНК и иммобилизованным зондом обеспечивает быструю ассоциацию/диссоциацию целевой ДНК. Таким образом, одна и та же молекула ДНК реагирует со многими отдельными праймерами, что приводит к амплификации праймеров в каждой отдельной гелевой подушечке. Данная процедура была применена для выявления мутации гена бета-глобина у больных бета-талассемией и для выявления гена сибиреязвенного токсина.
Чипы также обеспечивают хорошую платформу для проведения ПЦР непосредственно на чипе (в отдельных гелевых подушечках), поскольку каждую гелевую подушечку легко изолировать от соседней, в отличие от типичных микрочипов, которые сталкиваются с серьезными проблемами при выполнении одной и той же задачи.
Для анализа результатов гибридизации, полученных с флуоресцентно мечеными целевыми молекулами, флуоресцентные микроскопы используют . Прибор оснащен столом для образцов с контролируемой температурой, позволяющим изменять температуру в реакционной камере, содержащей чип, в ходе эксперимента. Охлаждаемая камера устройства с зарядовой связью (CCD) используется для записи световых сигналов от чипа, которые затем отправляются в компьютерную программу для количественной оценки сигналов гибридизации по всему чипу. Данные, полученные в результате этих экспериментов, хранятся в базе данных и анализируются программным обеспечением, которое помогает проводить оценку, экспериментировать in silico , а также контролировать качество аппаратного и программного обеспечения.
Типы
[ редактировать ]олигонуклеотидные чипы
[ редактировать ]Индивидуальные олигонуклеотидные биочипы предназначены для исследования тестовых образцов известных нуклеотидных последовательностей. Например, известные гены в тех случаях, когда интересуют уровни их экспрессии в определенных условиях, гены, о которых известно, что они содержат точковые мутации или являются полиморфными в данной популяции. Успех микрочипа зависит от правильного выбора зондов в этих случаях.
набор потенциальных зондов гибридизации Для каждой последовательности ДНК создается , которые образуют с этой последовательностью идеальные дуплексы. Потенциальные зонды, которые могут создать неоднозначность в интерпретации картины гибридизации, исключаются на основании содержания AT и GC, а также склонности к образованию шпилек и других типов стабильных вторичных структур, которые могут существенно повлиять на интенсивность гибридизации.
Одним из случаев успешного применения индивидуальных олигонуклеотидных чипов является обнаружение у пациентов мутации бета-талассемии . Для диагностики мутаций бета-талассемии был разработан простой чип, содержащий шесть зондов, соответствующих различным генотипам бета-талассемии и гибридизованных с ПЦР-амплифицированной ДНК здоровых людей и пациентов. [2] Результаты гибридизации показали ожидаемые существенные различия в интенсивности сигнала между совпадающими и несовпадающими дуплексами, что позволяет надежно идентифицировать как гомозиготные, так и гетерозиготные мутации.
чипы рРНК
[ редактировать ]Эти чипы были разработаны для целей рибосомальной РНК (рРНК), обычно используемых для обнаружения бактерий. рРНК очень распространены в клетке и составляют около 80% содержания РНК типичной эукариотической клетки. [3] РРНК предварительно амплифицируется бактериями и присутствует в нескольких тысячах копий на клетку, что делает ее хорошей мишенью для микроанализов. Однонуклеотидные полиморфизмы, присутствующие в последовательности бактериальной рРНК, используются для дифференциации бактерий на уровне рода, вида и штамма. Это уникальная особенность этого микрочипа, не требующая ПЦР-амплификации. Процесс обнаружения бактерий относительно прост. Бактерии культивируют, промывают и осаждают. Лизосома используется для лизиса гранул – для разрушения клеточных стенок и высвобождения нуклеиновой кислоты. Лизированные бактерии пропускают через краситель. [ проверьте орфографию ] препарат, при котором нуклеиновая кислота из клетки иммобилизуется, а остальной мусор вымывается. Все процессы после лизиса – выделение, очистка, фрагментация и мечение целевых рРНК – представляют собой стабильные химические реакции. Фрагменты <500 п.о. легко гибридизуются с матрицей геля. Общее количество элюированных с чипа определяется УФ-спектрофотометром. Процесс от подготовки проб до идентификации организмов на основе автоматизированных алгоритмов занимает 2 часа.
кДНК
[ редактировать ]В качестве иммобилизованных зондов используют кДНК, полученные в результате обратной транскрипции популяции мРНК, выделенной из клеток в различных физиологических и экспериментальных условиях. Эти массивы широко используются для изучения экспрессии генов. Потенциальное препятствие в использовании кДНК связано с трудностью инъекции и равномерного распределения длинных молекул в гелевых подушечках. Эта проблема решена путем разработки полиакриламидных гелей, имеющих больший средний размер пор. Другой способ решить эту проблему — случайным образом фрагментировать кДНК на относительно небольшие кусочки перед иммобилизацией.
Белки
[ редактировать ]Можно приготовить белковые чипы, содержащие различные белки, иммобилизованные в виде зондов таким образом, чтобы сохранить их биологическую активность. [4] Гель с большими порами используется для предотвращения диффузии белка в гель. Существует два способа иммобилизации белков на гелевых подушечках. Первый основан на активации геля глютиральдегидом . Во второй процедуре гель активируют путем частичного замещения аминогрупп гидразидными группами. Реакция между гидразидными и альдегидными группами эффективно связывает белок с клеткой. Белковые микрочипы демонстрируют высокую специфичность реакций молекулярного распознавания, наблюдаемых в растворе. Взаимодействие между антигеном и его специфическими антителами можно изучать на чипе в различных экспериментальных условиях. Либо антиген , либо антитело можно иммобилизовать и контролировать как прямыми, так и непрямыми методами. В прямом методе используются целевые молекулы, меченные флуоресцентным красителем, а в непрямом методе реакция обнаруживается с использованием меченой молекулы, которая специфически распознает мишень.Эти чипы можно использовать для изучения ферментативной активности иммобилизованных ферментов. путем покрытия чипа раствором, содержащим определенные подложки. Реакцию контролируют путем выявления образования цветных или флуоресцентных осадков.
Другие приложения
[ редактировать ]- Их можно использовать для изучения однонуклеотидных полиморфизмов (SNP) в этом методе. Поскольку бактериальная ДНК высококонсервативна с течением времени, SNP полезны для идентификации бактерий на чипе, а поскольку SNP являются наиболее распространенными вариациями в геноме человека, они стали основными маркерами в генетических исследованиях для картирования и идентификации генов, чувствительных к сложным заболеваниям. . [5]
- Их можно использовать для обнаружения факторов вирулентности, то есть токсинов и белков, проникающих в организм. Эти токсины, как правило, имеют небольшое количество копий-транскриптов и производятся в очень специфических условиях хозяина. Здесь стратегия идентификации сосредоточена на единственной копии последовательности ДНК, где MAGIChips очень эффективны.
- Белковые биочипы делают эту задачу очень интересной, поскольку белки содержатся в одной клетке, и все они могут быть проанализированы на одной платформе. Белковые биочипы можно использовать для выявления белковых биомаркеров для диагностики заболеваний или определенной стадии заболевания. Они также могут помочь определить взаимосвязь между структурой белка и функцией белка и определить функцию белка или различных белков в одном и том же или разных типах клеток. Хотя чипы MAGIChips нуждаются в некоторых модификациях, приложения и методы вполне стандартны. [6]
- Чипы могут использоваться в качестве диагностического инструмента в клиниках благодаря быстрому времени обнаружения, высокой пропускной способности, достоверности результатов, иерархической идентификации и количественному определению. С их помощью можно добиться времени, необходимого для сбора проб и представления результатов в клинических условиях в течение 2 часов. Быстрое время выполнения является привлекательным атрибутом тестирования на месте оказания медицинской помощи, пока пациент ожидает результатов.
- Высокая пропускная способность этих устройств позволяет одновременно использовать тысячи микробных зондов для видовой и даже штаммоспецифичной идентификации на одном чипе, сокращая количество образцов, необходимых для проведения нескольких тестов. Потенциальные угрозы, создаваемые использованием бактерий, вирусов и грибов в качестве биологического оружия против людей, сельского хозяйства и окружающей среды, требуют разработки технологий для точного и чувствительного обнаружения в течение очень короткого времени. Перспективная технология MAGIChip, которая использовалась для распознавания важных вирусов. Грибковые зонды были введены в чипы рРНК для сельскохозяйственных исследований в области генетики, репродукции, болезней и даже защиты сельскохозяйственных культур. Тысячи генов могут быть одновременно нацелены на поиск генетического разнообразия или микробной зараженности по своей природе или путем преднамеренного высвобождения.
См. также
[ редактировать ]- Биочип
- Белковые микрочипы
- Микрочип антител
- Клеточная микроматрица
- Химическое соединение
- ДНК-микрочип
- MicroArray и экспрессия генов
- Лаборатория на чипе
Ссылки
[ редактировать ]- ^ (1998) Второе место. Наука 282, 2156–2157.
- ^ Yershov, G., Barsky, V., Belgovskiy, A., Kirillov, E., Kreindlin, E., Ivanov, I., Parinov, S., Guschin, D., Drobyshev, A., Dubiley, S., and Mirzabekov, A. (1996) DNA analysis and diagnostics on oligonucleotide microchips. Proc. Natl. Acad. Sci. USA 93, 4913–4918.
- ^ Златанова Дж., Мирзабеков А., «Иммобилизованные в геле микрочипы нуклеиновых кислот и белков. Производство и применение для макромолекулярных исследований», Methods Mol. Биол. 170, 17−38 (2001).
- ^ Гущин Д., Ершов Г., Заславский А., Геммелл А., Шик В., Прудников Д., Аренков П. и Мирзабеков А. (1997) Ручное производство олигонуклеотидов ДНК и белковые микрочипы. Анальный. Биохим. 250, 203–211.
- ^ Вайнер, член парламента, и Хадсон, Т.Дж., «Введение в SNP: открытие маркеров заболеваний», Biotechniques 32 (S), 4–13 (2002).
- ^ Организация биотехнологической промышленности (Bio), Технологии и их применения, доступно по адресу http://www.bio.org/er/applications.asp .