Гексаметафосфат натрия
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК натрия циклогексафосфат | |
| Другие имена Калгон С Стекловидный натрий | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.030.299 |
| Номер ЕС |
|
| МеШ | натрий+полиметафосфат |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
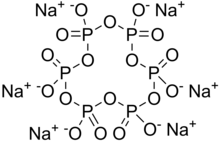
| Na 6 [(PO 3 ) 6 ] | |
| Молярная масса | 611.7704 g mol −1 |
| Появление | Белые кристаллы |
| Запах | без запаха |
| Плотность | 2,484 г/см 3 |
| Температура плавления | 628 ° C (1162 ° F; 901 К) |
| Точка кипения | 1500 ° C (2730 ° F; 1770 К) |
| растворимый | |
| Растворимость | нерастворим в органических растворителях |
Показатель преломления ( n D ) | 1.482 |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Раздражающий |
| СГС Маркировка : [2] | |
 | |
| Предупреждение | |
| H319 | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 3,053 г кг −1 |
| Паспорт безопасности (SDS) | hazard.com |
| Родственные соединения | |
Другие анионы | Тринатрийфосфат Тетранатрия пирофосфат Пентатрийтрифосфат |
Родственные соединения | Триметафосфат натрия |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Гексаметафосфат натрия ( ГГМП ) представляет собой соль состава Na 6 [(PO 3 ) 6 ] . [3] Коммерческий гексаметафосфат натрия обычно представляет собой смесь метафосфатов (эмпирическая формула: NaPO 3 ), одним из которых является гексамер, и обычно это соединение, называемое этим названием. Такую смесь правильнее называть полиметафосфатом натрия. Это белые твердые вещества, растворяющиеся в воде.
Использование
[ редактировать ]SHMP используется в качестве секвестранта и применяется в самых разных отраслях промышленности, в том числе в качестве пищевой добавки , в которой он используется под номером E E452i. Карбонат натрия иногда добавляют в SHMP для повышения pH до 8,0–8,6, что позволяет получить ряд продуктов SHMP, используемых для умягчения воды и моющих средств .
Гексаметафосфат натрия широко используется в качестве дефлокулянта при производстве керамических частиц на основе глины. [4] [5] [6] [7] Он также используется в качестве диспергатора для разрушения глины и других типов почвы для оценки текстуры почвы . [8]
Он используется в качестве активного ингредиента в зубных пастах в качестве ингредиента, препятствующего образованию пятен и зубного камня. [9]
Пищевая добавка
[ редактировать ]В качестве пищевой добавки SHMP используется в качестве эмульгатора . Искусственный кленовый сироп, консервированное молоко, сырные порошки и соусы, искусственный сыр, взбитые начинки, упакованные яичные белки, ростбиф, рыбное филе, фруктовое желе, замороженные десерты, заправки для салатов, сельдь, хлопья для завтрака, мороженое, пиво и напитки в бутылках. , среди других продуктов, может содержать SHMP. [10] [11] [12]
Соль для смягчения воды
[ редактировать ]SHMP используется в соляных гранулах Bright & Soft Salt Pellets Diamond Crystal для умягчителей воды в концентрации 0,03%. Это единственная добавка, кроме хлорида натрия .
Подготовка
[ редактировать ]SHMP получают путем нагревания ортофосфата натрия с образованием кислого пирофосфата натрия :
- 2 NaH 2 PO 4 → Na 2 H 2 P 2 O 7 + H 2 O
Затем пирофосфат нагревают с получением соответствующего гексаметафосфата натрия:
- 3 Na 2 H 2 P 2 O 7 → (NaPO 3 ) 6 + 3 H 2 O
с последующим быстрым охлаждением.
Реакции
[ редактировать ]SHMP гидролизуется в водном растворе, особенно в кислых условиях и/или при нагревании, до триметафосфата натрия и ортофосфата натрия . [13]
История
[ редактировать ]Гексаметафосфат натрия — щелочная соль одного из рядов полиметафосфорных кислот (кислот, образующихся при полимеризации фосфатных групп). [14] Гексаметафосфорная кислота была впервые получена в 1825 году немецким химиком Иоганном Фридрихом Филиппом Энгельхартом (1797-1853). [15] В своей докторской диссертации Энгельхарт намеревался определить, ответственно ли железо за красный цвет крови. Чтобы очистить образцы крови, Энгельхарт обнаружил, что он может коагулировать альбумин сыворотки крови (растворенные белки), обрабатывая кровь фосфорной кислотой. Это противоречило выводам известного шведского химика Йонса Якоба Берцелиуса , который заявил, что фосфорная кислота не коагулирует водорастворимые белки, такие как яичный белок. [16] Берцелиус и Энгельгарт сотрудничали с намерением разрешить противоречие; они пришли к выводу, что Энгельхарт получил новую форму фосфорной кислоты, просто сжигая фосфор на воздухе и затем растворяя полученное вещество в воде. [17] Однако они не определили состав новой кислоты. Этот анализ был выполнен в 1833 году шотландским химиком Томасом Грэмом , который назвал натриевую соль новой кислоты «метафосфатом соды». [18] Выводы Грэма подтвердили немецкие химики Юстус фон Либих и Теодор Флейтманн . [19] В 1849 году Флейтманн придумал название «гексаметафосфорная кислота». [20] [21]
К 1956 г. хроматографический анализ гидролизатов соли Грэма ( полифосфата натрия) показал наличие циклических анионов, содержащих более четырех фосфатных групп; [22] эти результаты были подтверждены в 1961 году. [23] В 1963 году немецким химикам Эриху Тило и Ульриху Шюльке удалось получить гексаметафосфат натрия путем нагревания безводного триметафосфата натрия. [24]
Безопасность
[ редактировать ]Установлено, что фосфаты натрия обладают низкой острой пероральной токсичностью . Концентрации SHMP, не превышающие 10 000 мг/л или мг/кг, считаются защитными уровнями EFSA и USFDA. Экстремальные концентрации этой соли могут вызвать острые побочные эффекты из-за чрезмерной концентрации натрия в сыворотке крови, такие как: «нерегулярный пульс , брадикардия и гипокальциемия ». [25]
Ссылки
[ редактировать ]- ^ Индекс Merck , 12-е издание, Полиметафосфат натрия, 8814.
- ^ «Инвентаризация C&L» . echa.europa.eu .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 530. ИСБН 978-0-08-037941-8 .
- ^ Роль гексаметафосфата натрия в процессе растворения каолинита и каолина Ф. Андреола; Э.Кастеллини; Т.Манфредини; М.Романьоли. Журнал Европейского керамического общества, том 24, номер 7, июнь 2004 г.
- ^ Влияние диспергаторов на развитие механической прочности самотекущих огнеупорных литых изделий из глинозема и шпинели. Сасан Отродж, Мохаммад Реза Нилфорушан, Араш Дагиги, Реза Марзбан. Керамика – Силикаты 54 (3) 284–289 (2010)
- ^ Влияние добавления разжижителя гексаметафосфата натрия на основные свойства цементов на основе фосфата кальция . С. Хесараки; А. Заманян; Ф. Мозтарзаде. Журнал исследований биомедицинских материалов. Часть A. Том. 88А, № 2, 2009 г.
- ^ Исследование влияния минералогии глины на реологическое поведение керамических суспензий с использованием экспериментальной схемы. Афеф Джмал Айади; Жюльен Соро; Амель Камун; Самир Баклоути. Международный журнал последних исследований и прикладных исследований 14 (2). Февраль 2013.
- ^ ASTM D422 – 63 (2007) Стандартный метод испытаний для анализа размеров частиц почв.
- ^ «Часто задаваемые вопросы Crest Pro-Health» . Архивировано из оригинала 19 ноября 2012 г. Проверено 20 ноября 2012 г.
- ^ «Результаты по ингредиентам — гексаметафосфат натрия» .
- ^ «Пищевые добавки и ингредиенты — Список статуса пищевых добавок» . Управление по контролю за продуктами и лекарствами . 26 августа 2021 г.
- ^ «CFR — Свод федеральных правил, раздел 21» .
- ^ Ван Вазер, Джон (1958). Фосфор и его соединения . Нью-Йорк: Издательство Interscience . Проверено 7 апреля 2015 г.
- ^ Мехротра, Р.К. (1975). «Синтез и свойства простых и сложных полиметафосфатных стекол щелочных металлов» . Чистая и прикладная химия . 44 (2): 201–220. дои : 10.1351/pac197544020201 .
- ^ Стэнли, Майкл (ноябрь 1979 г.) «Химическая работа Томаса Грэма», доктор философии. диссертация (Открытый университет, Милтон Кейнс, Англия, Великобритания), с. 151.
- ^ Энгельхарт, Иоганн Фридрих (1825) «Commentatio de vera materiae sanguini purpureum colorem impertientis natura» [Комментарий к истинной природе вещества крови, которое придает ей пурпурный цвет] Доктор философии. диссертация (Геттингенский университет, Геттинген, Германия), (на латыни), стр. 40-42.
- Рецензия на английском языке на докторскую диссертацию Энгельхарта. диссертация: Энгельхарт, Джон Фредерик (1827). «Комментарий к природе истинного вещества крови, придающего ей малиновый цвет [...]» . Эдинбургский медицинский и хирургический журнал . 27 : 95–102. См. стр. 98.
- ^ Берцелиус (1827 г.). «Странное поведение фосфорной кислоты по отношению к яичному белку». Анналы физики и химии . 2-я серия (на немецком языке). 9 :631-632.
- Перепечатано на французском языке: Берцелиус (1827 г.). «Особое поведение фосфорной кислоты с альбумином». Анналы химии и физики (на французском языке). 36 : 110–111.
- ^ Грэм, Томас (1833). «Исследования арсениатов, фосфатов и модификаций фосфорной кислоты» . Философские труды Лондонского королевского общества : 253–284. См. стр. 277.
- Перепечатано на немецком языке: Грэм, Томас (1834). «Исследование солей мышьяка и фосфорной кислоты, а также модификаций фосфорной кислоты » . Анналы физики и химии . 2-я серия (на немецком языке). 32 (3): 33–76.
- ^ Либих, Юстус (апрель 1838 г.). «О составе органических кислот». Анналы аптеки (на немецком языке). 26 : 113–189. Озеро п. 142.
- Перепечатано на французском языке: Либих, Дж. (1838). «Sur la конституция органических кислот» [О составе органических кислот]. Анналы де Шими . 2-я серия (на французском языке). 68 : 5–93. См. стр. 39.
- См. также: Стэнли (1979), с. 186ff, сноска 162.
- ^ Флейтманн, Т. (1849). «О различных метафосфорных кислотах и двух новых кислотах того же соединения» . Анналы физики и химии . 2-я серия (на немецком языке). 78 : 233–260, 338–366. На стр. 239, Флейтман ввёл название Гексаметафосфорная кислота (гексаметафосфорная кислота).
- ^ Гриффит, Э.Дж.; Бакстон, РЛ (1965). «Получение и свойства двенадцатичленного кольцевого гексаметафосфат-аниона». Неорганическая химия . 4 (4): 549–551. дои : 10.1021/ic50026a023 . ; см. стр. 549.
- ^ Ван Вазер-младший; Крупа, Э. Карл (1956). «Существование кольцевых фосфатов выше, чем тетраметафосфат». Журнал Американского химического общества . 78 (8): 1772. doi : 10.1021/ja01589a086 .
- ^ (Тило и Шюльке, 1963a), с. 1175.
- ^ См.:
- Тило, Э.; Шюльке, У. (1963a). «Получение истинного 6 P 6 O 18 » гексаметафосфата [ Na . натрия ] Прикладная химия (на немецком языке). 75 (23): 1175–1176. Бибкод : 1963АнгЧ..75.1175Т . дои : 10.1002/anie.19630752305 .
- Тило, Э.; Шюльке, У. (1963b). «Получение истинного гексаметафосфата натрия Na 6 [P 6 O 18 ]». Международное издание «Прикладная химия» . 2 (12): 742. doi : 10.1002/anie.196307421 .
- ^ Шрёдтер, Клаус; Беттерманн, Герхард; Стаффель, Томас; Валь, Фридрих; Кляйн, Томас; Хофманн, Томас (2008). «Фосфорная кислота и фосфаты». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a19_465.pub3 . ISBN 978-3527306732 .