Импортин
| Субъединица импортина альфа-5 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | КПНА1 | ||
| ген NCBI | 3836 | ||
| HGNC | 6394 | ||
| МОЙ БОГ | 600686 | ||
| RefSeq | НП_002255 | ||
| ЮниПрот | P52294 | ||
| Другие данные | |||
| Локус | Хр. 3 q21.1 | ||
| |||
| Импортиновая субъединица бета-1 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | КПНБ1 | ||
| ген NCBI | 3837 | ||
| HGNC | 6400 | ||
| МОЙ БОГ | 602738 | ||
| RefSeq | НП_002256 | ||
| ЮниПрот | Q14974 | ||
| Другие данные | |||
| Локус | Хр. 17 д21.32 | ||
| |||
Импортин – разновидность кариоферина. [1] который транспортирует белковые молекулы клетки цитоплазмы из в ядро . Это происходит путем связывания со специфическими последовательностями распознавания , называемыми последовательностями ядерной локализации (NLS).
Импортин состоит из двух субъединиц: импортин α и импортин β. Члены семейства импортина-β могут связывать и транспортировать грузы сами по себе или образовывать гетеродимеры с импортином-α. Как часть гетеродимера , импортин-β опосредует взаимодействие с поровым комплексом , в то время как импортин-α действует как адаптерный белок, связывающий сигнал ядерной локализации (NLS) с грузом. NLS-импортина α-импортина β Тример диссоциирует после связывания с Ran GTP внутри ядра . [2] при этом два белка импортина возвращаются в цитоплазму для дальнейшего использования.
Открытие
[ редактировать ]Импортин может существовать либо в виде гетеродимера импортина-α/β, либо в виде мономера импортина-β. Импортин-α был впервые выделен в 1994 году группой, в которую входила Энно Хартманн , из Центра молекулярной медицины Макса Дельбрюка . [1] Процесс импорта ядерного белка уже был охарактеризован в предыдущих обзорах. [3] но ключевые задействованные белки до этого момента не были выяснены. белок массой 60 кДа Цитозольный , необходимый для импорта белка в ядро, и имеющий 44% идентичность последовательности с SRP1p , был очищен из Xenopus яиц . Он был клонирован, секвенирован и экспрессирован в E.coli , и для того, чтобы полностью восстановить сигнально-зависимый транспорт, его пришлось объединить с Ran (TC4). В исследовании также были обнаружены другие ключевые стимулирующие факторы. [1]
Импортин-β, в отличие от импортина-α, не имеет прямых гомологов обнаружил, что образует гетеродимер у дрожжей, но был очищен до белка массой 90–95 кДа и в ряде различных случаев с импортином-α. В их число входило исследование под руководством Майкла Рексака. [4] и дальнейшие исследования Дирка Герлиха . [5] Эти группы обнаружили, что для функционирования импортина-α требуется другой белок, импортин-β, и что вместе они образуют рецептор сигналов ядерной локализации (NLS) , что обеспечивает транспортировку в ядро . множество генов импортина, таких как IPO4 и IPO7 Со времени этих первоначальных открытий в 1994 и 1995 годах было обнаружено , которые облегчают импорт несколько разных грузовых белков из-за их различной структуры и локализации.
Структура
[ редактировать ]Импортин-а
[ редактировать ]Большая часть адаптерного белка импортина-α состоит из нескольких повторов броненосца (ARM), расположенных тандемно . Эти повторы могут складываться вместе, образуя структуру изогнутой формы, которая облегчает связывание с NLS конкретных грузовых белков. Основной сайт связывания NLS расположен на N-конце , а второстепенный сайт — на С-конце . Помимо структур ARM , импортин-α также содержит область из 90 аминокислот N-концевую , отвечающую за связывание с импортином-β, известную как домен связывания импортина-β (IBB). [6] Это также место самоторможения, [7] и участвует в высвобождении груза, когда импортин-α достигает ядра . [8]
Импортин-b
[ редактировать ]β представляет собой типичную структуру более крупного суперсемейства кариоферинов Импортин - . Основу их структуры составляют 18-20 тандемных повторов мотива HEAT . Каждый из этих повторов содержит две антипараллельные альфа-спирали, соединенные витком , которые складываются вместе, образуя общую структуру белка . [9]
Чтобы транспортировать груз в ядро , импортин-β должен связываться с комплексами ядерных пор . Он делает это путем образования слабых временных связей с нуклеопоринами различных мотивах FG в их (Phe-Gly). Кристаллографический анализ показал, что эти мотивы связываются с импортином-β в неглубоких гидрофобных карманах, обнаруженных на его поверхности. [10]
Цикл импорта ядерного белка
[ редактировать ]Основная функция импортина — опосредовать транслокацию белков с сигналами ядерной локализации в ядро через комплексы ядерных пор (NPC) в процессе, известном как цикл импорта ядерного белка.
Обвязка груза
[ редактировать ]Первым этапом этого цикла является связывание груза. Импортин может выполнять эту функцию как мономерный импортин-β белок , но обычно требует присутствия импортина-α, который действует как адаптер для грузовых белков (посредством взаимодействия с NLS ). NLS как груз , представляет собой последовательность основных аминокислот , которая помечает белок предназначенный для ядра . Грузовой белок может содержать один или два из этих мотивов , которые будут связываться с основным и/или минорным сайтами связывания импортина-α. [11]
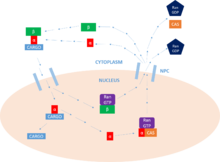
Грузовой транспорт
[ редактировать ]Как только белок-груз связывается, импортин-β взаимодействует с NPC , и комплекс диффундирует в ядро из цитоплазмы . Скорость диффузии зависит как от концентрации импортина-α, присутствующего в цитоплазме, так и от сродства связывания импортина-α с грузом. Попав внутрь ядра , комплекс взаимодействует с ГТФазой Ras-семейства , Ran-GTP . Это приводит к диссоциации комплекса за счет изменения конформации импортина-β. Импортин-β остается связанным с Ran - GTP и готов к переработке. [11]
Выпуск груза
[ редактировать ]Теперь, когда комплекс импортин-α/карго свободен от импортина-β, белок-груз может быть высвобожден в ядро . N -концевой импортин-β-связывающий (IBB) домен импортина-α содержит ауторегуляторную область, которая имитирует мотив NLS . [7] Высвобождение импортина-β освобождает эту область и позволяет ей вернуться назад и конкурировать за связывание с белком-грузом в основном сайте связывания NLS . Эта конкуренция приводит к высвобождению белка . специальные факторы высвобождения, такие как Nup2 и Nup50 . В некоторых случаях для облегчения высвобождения груза также можно использовать [11]
Переработка
[ редактировать ]Наконец, чтобы вернуться в цитоплазму , импортин-α должен соединиться с комплексом Ran-GTP / CAS (фактор ядерного экспорта), который облегчает его выход из ядра . CAS (белок восприимчивости к клеточному апоптозу) является частью суперсемейства кариоферинов импортина-β и определяется как фактор ядерного экспорта. Импортин-β возвращается в цитоплазму , все еще связанный с Ran - GTP . Попав в цитоплазму , Ran - GTP гидролизуется . GAP Ran и , образуя GDP Ran- высвобождая два импортина для дальнейшей активности Именно этот гидролиз ГТФ обеспечивает энергию для цикла в целом. В ядре GEF цитоплазме заряжает Ran молекулой GTP затем гидролизуется GAP в , которая , как указано выше. Именно эта активность Ran обеспечивает однонаправленный транспорт белков . [11]
Болезнь
[ редактировать ]Существует несколько болезненных состояний и патологий, которые связаны с мутациями или изменениями экспрессии импортина-α и импортина-β.
Импортины являются жизненно важными регуляторными белками в процессах гаметогенеза и эмбриогенеза . В результате было показано, что нарушение паттернов экспрессии импортина-α вызывает дефекты фертильности у Drosophila melanogaster . [12]
Также были проведены исследования, которые связывают измененный импортин-α с некоторыми случаями рака . Исследования рака молочной железы выявили усеченную форму импортина-α, в которой NLS . отсутствует связывающий домен [13] Кроме того, было показано, что импортин-α транспортирует ген-супрессор опухоли , BRCA1 (белок восприимчивости к раку молочной железы типа 1) , в ядро . Сверхэкспрессия импортина-α также связана с плохой выживаемостью, наблюдаемой у некоторых пациентов с меланомой . [14]
Активность импортина также связана с некоторыми вирусными патологиями . Например, на пути заражения вирусом Эбола ключевым этапом является ингибирование ядерного импорта PY-STAT1 . Это достигается за счет того, что вирус связывает импортин-α в цитоплазме , что означает, что он больше не может связывать свой груз в NLS . [15] В результате импортин не может функционировать, и белок-груз остается в цитоплазме.
Виды грузов
[ редактировать ]Многие различные грузовые белки могут транспортироваться в ядро с помощью импортина. Часто для перемещения различным белкам требуются разные комбинации α и β. Некоторые примеры различных грузов перечислены ниже.
| Груз | Импортировать рецептор |
|---|---|
| СВ40 | Импортин-β и импортин-α |
| Нуклеоплазмин | Импортин-β и импортин-α |
| СТАТ1 | Импортин-β и NPI-1 (тип импортина-α) |
| ТФИИА | Импортин-α не требуется |
| U1A | Импортин-α не требуется |
Гены импортина человека
[ редактировать ]Хотя импортин-α и импортин-β используются для описания импортина в целом, на самом деле они представляют собой более крупные семейства белков , имеющих схожую структуру и функцию. Для α и β были идентифицированы различные гены, некоторые из них перечислены ниже. Обратите внимание, что часто кариоферин и импортин используются как взаимозаменяемые.
- Импорт : ИПО4 , ИПО5 , ИПО7 , ИПО8 , ИПО9 , ИПО11 , ИПО13.
- Кариоферин-α : КПНА1 , КПНА2 , КПНА3 , КПНА4 , КПНА5 , КПНА6.
- Кариоферин-β : KPNB1
См. также
[ редактировать ]- Кариоферин
- Последовательность ядерной локализации
- Ядерный поровый комплекс
- Ядерный транспорт
- Ран (ген)
Ссылки
[ редактировать ]- ^ Jump up to: а б с Герлих Д., Прен С., Ласки Р.А., Хартманн Э. (декабрь 1994 г.). «Выделение белка, необходимого для первого этапа импорта ядерного белка». Клетка . 79 (5): 767–78. дои : 10.1016/0092-8674(94)90067-1 . ПМИД 8001116 . S2CID 7539929 .
- ^ Маттай И.В., Энглмайер Л. (1998). «Нуклеоцитоплазматический транспорт: растворимая фаза» . Ежегодный обзор биохимии . 67 : 265–306. doi : 10.1146/annurev.biochem.67.1.265 . ПМИД 9759490 .
- ^ Гарсиа-Бустос Дж., Хейтман Дж., Холл Миннесота (март 1991 г.). «Локализация ядерных белков». Биохим. Биофиз. Акта . 1071 (1): 83–101. дои : 10.1016/0304-4157(91)90013-м . ПМИД 2004116 .
- ^ Эненкель С., Блобель Г., Рексач М. (июль 1995 г.). «Идентификация дрожжевого гетеродимера кариоферина, который нацелен на импорт субстрата в комплексы ядерных пор млекопитающих» . Ж. Биол. Хим . 270 (28): 16499–502. дои : 10.1074/jbc.270.28.16499 . ПМИД 7622450 .
- ^ Герлих Д., Костка С., Крафт Р., Дингуолл С., Ласки Р.А., Хартманн Е., Прен С. (апрель 1995 г.). «Две разные субъединицы импортина взаимодействуют, чтобы распознавать сигналы ядерной локализации и связывать их с ядерной оболочкой». Современная биология . 5 (4): 383–92. Бибкод : 1995CBio....5..383G . дои : 10.1016/s0960-9822(95)00079-0 . hdl : 11858/00-001M-0000-002D-1CBD-2 . ПМИД 7627554 . S2CID 6055941 .
- ^ Лотт К., Чинголани Дж. (сентябрь 2011 г.). «Домен связывания импортина β как главный регулятор нуклеоцитоплазматического транспорта» . Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1813 (9): 1578–92. дои : 10.1016/j.bbamcr.2010.10.012 . ПМК 3037977 . ПМИД 21029753 .
- ^ Jump up to: а б Пуфалл М.А., Грейвс Б.Дж. (2002). «Аутоингибирующие домены: модульные эффекторы клеточной регуляции». Ежегодный обзор клеточной биологии и биологии развития . 18 : 421–62. doi : 10.1146/annurev.cellbio.18.031502.133614 . ПМИД 12142282 .
- ^ Конти Э., Уй М., Лейтон Л., Блобель Г., Куриян Дж. (июль 1998 г.). «Кристаллографический анализ распознавания сигнала ядерной локализации фактором ядерного импорта кариоферином альфа» . Клетка . 94 (2): 193–204. дои : 10.1016/s0092-8674(00)81419-1 . ПМИД 9695948 . S2CID 16230174 .
- ^ Ли С.Дж., Мацуура Ю., Лю С.М., Стюарт М. (июнь 2005 г.). «Структурная основа диссоциации ядерного импортного комплекса с помощью RanGTP». Природа . 435 (7042): 693–6. Бибкод : 2005Natur.435..693L . дои : 10.1038/nature03578 . ПМИД 15864302 . S2CID 4304731 .
- ^ Бэйлисс Р., Литтлвуд Т., Стюарт М. (июль 2000 г.). «Структурная основа взаимодействия между повторами нуклеопорина FxFG и импортином-бета при ядерной торговле» . Клетка . 102 (1): 99–108. дои : 10.1016/s0092-8674(00)00014-3 . ПМИД 10929717 . S2CID 17495979 .
- ^ Jump up to: а б с д Вейс К. (февраль 2003 г.). «Регулирование доступа к геному: нуклеоцитоплазматический транспорт на протяжении клеточного цикла» . Клетка . 112 (4): 441–51. дои : 10.1016/s0092-8674(03)00082-5 . ПМИД 12600309 . S2CID 17664108 .
- ^ Терри LJ, Shows EB, Wente SR (ноябрь 2007 г.). «Пересечение ядерной оболочки: иерархическая регуляция нуклеоцитоплазматического транспорта». Наука . 318 (5855): 1412–6. Бибкод : 2007Sci...318.1412T . дои : 10.1126/science.1142204 . ПМИД 18048681 . S2CID 163986 .
- ^ Ким И.С., Ким Д.Х., Хан С.М., Чин М.У., Нам Х.Дж., Чо Х.П., Чхве С.И., Сонг Би.Дж., Ким Э.Р., Пэ Ю.С., Мун Ю.Х. (июль 2000 г.). «Усеченная форма импортина альфа, обнаруженная в клетках рака молочной железы, ингибирует ядерный импорт р53» . Журнал биологической химии . 275 (30): 23139–45. дои : 10.1074/jbc.M909256199 . ПМИД 10930427 .
- ^ Виннепеннинкс В, Лазар В, Михильс С, Дессен П, Стас М, Алонсо С.Р., Аврил МФ, Ортис Ромеро П.Л., Роберт Т., Балаческу О., Эггермонт А.М., Ленуар Г., Сарасин А., Турс Т., ван ден Оорд Дж.Дж., Спатц А. (апрель 2006 г.). «Профилирование экспрессии генов первичной меланомы кожи и клинический исход» . Журнал Национального института рака . 98 (7): 472–82. дои : 10.1093/jnci/djj103 . ПМИД 16595783 .
- ^ Сэкимото Т., Имамото Н., Накадзима К., Хирано Т., Йонеда Ю. (декабрь 1997 г.). «Внеклеточный сигнал-зависимый ядерный импорт Stat1 опосредован образованием комплекса, нацеленного на ядерные поры, с NPI-1, но не с Rch1» . Журнал ЭМБО . 16 (23): 7067–77. дои : 10.1093/emboj/16.23.7067 . ПМК 1170309 . ПМИД 9384585 .
Внешние ссылки
[ редактировать ]- Импортины Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)
- PDB Молекула месяца Импортины