Эпотилон
| Эпотилоны | |
|---|---|

Эпотилоны A (R = H) и B (R = CH 3 ) | |
| Химические формулы |
А: С 26 Ч 39 НЕТ 6 С |
| Молекулярные массы |
А: 493,66 г/моль |
| номера CAS |
А: 152044-53-6 |
| ПабХим |
А: 448799 |

Эпотилоны C (R = H) и D (R = CH 3 ) | |
| Химические формулы |
С: С 26 Ч 39 НЕТ 5 С |
| Молекулярные массы |
С: 477,66 г/моль |
| номера CAS |
С: 186692-73-9 |
| ПабХим |
С: 9891226 |

Эпотилоны E (R = H) и F (R = CH 3 ) | |
| Химические формулы |
Э: С 26 Ч 39 НЕТ 7 С |
| Молекулярные массы |
Е: 509,66 г/моль |
| номера CAS |
Э: 201049-37-8 |
| ПабХим |
Е: 9806341 |
| Отказ от ответственности и ссылки | |
Эпотилоны представляют собой класс потенциальных лекарств от рака. Как и таксаны , они предотвращают деление раковых клеток, вмешиваясь в работу тубулина , но в ранних исследованиях эпотилоны имели лучшую эффективность и более мягкие побочные эффекты, чем таксаны. [ 1 ] [ 2 ]
Эпотилоны первоначально были идентифицированы как метаболиты , продуцируемые почвенной миксобактерией Sorangium cellulosum . [ 3 ] По состоянию на сентябрь 2008 г. [update]эпотилоны A - F были идентифицированы и охарактеризованы. [ 4 ]
Ранние исследования на линиях раковых клеток и больных раком людей указывают на превосходную эффективность таксанов . Их механизм действия аналогичен, но химическая структура проще. , которые могут влиять на функцию сердца и вызывать тяжелую гиперчувствительность) из-за их лучшей растворимости в воде Кремофоры (солюбилизирующие агенты, используемые для паклитаксела не требуются. [ 5 ] Эндотоксиноподобные свойства, известные у паклитаксела, такие как активация макрофагов, синтезирующих воспалительные цитокины и оксид азота, не наблюдаются у эпотилона В. [ 6 ]
История
[ редактировать ]Структура эпотилона А была определена в 1996 году с помощью рентгеновской кристаллографии . [ 7 ]
Механизм действия
[ редактировать ]Основным механизмом действия класса эпотилонов является ингибирование функции микротрубочек . [ 8 ] Микротрубочки необходимы для деления клеток, и поэтому эпотилоны препятствуют правильному делению клеток. Эпотилон В обладает теми же биологическими эффектами, что и паклитаксел, как in vitro , так и в культивируемых клетках. Это связано с тем, что они имеют один и тот же сайт связывания, а также аффинность связывания с микротрубочками. Как и паклитаксел, эпотилон B связывается с субъединицей гетеродимера αβ-тубулина. После связывания скорость диссоциации αβ-тубулина снижается, тем самым стабилизируя микротрубочки. Кроме того, было показано, что эпотилон B индуцирует полимеризацию тубулина в микротрубочки без присутствия GTP. Это вызвано образованием пучков микротрубочек по всей цитоплазме. Наконец, эпотилон B также вызывает остановку клеточного цикла в фазе перехода G2-M, что приводит к цитотоксичности и, в конечном итоге, к апоптозу клеток. [ 9 ] Способность эпотилона ингибировать функцию веретена обычно объясняется его подавлением динамики микротрубочек; [ 10 ] но недавние исследования показали, что подавление динамики происходит при концентрациях ниже тех, которые необходимы для блокирования митоза. При более высоких антимитотических концентрациях паклитаксел, по-видимому, действует путем подавления отслоения микротрубочек от центросом - процесса, который обычно активируется во время митоза. Вполне возможно, что эпотилон также может действовать по аналогичному механизму. [ 11 ]
Медицинское использование и исследования
[ редактировать ]Эпотилон D под общим названием утиделон был одобрен в Китае в 2021 году для лечения метастатического рака молочной железы . [ 12 ] [ 13 ] Утиделон продемонстрировал преимущества в III фазе исследования рака молочной железы при добавлении к капецитабину . [ 14 ]
Один синтетический аналог, иксабепилон США , был одобрен в октябре 2007 года Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов для использования в лечении агрессивного метастатического или местно-распространенного рака молочной железы , который больше не реагирует на доступные в настоящее время химиотерапии. [ 15 ] В ноябре 2008 года EMEA отказало в выдаче регистрационного удостоверения на иксабепилон. [ 16 ]
На нескольких моделях ксенотрансплантатов человека было доказано , что эпотилон B с общим лекарственным названием патупилон обладает мощной in vivo при переносимых уровнях доз. противораковой активностью [ 17 ] В результате патупилон и различные аналоги прошли различные клинические фазы.
Патупилон и полностью синтетический сагопилон были протестированы в исследованиях фазы II, а BMS-310705 - в исследованиях фазы I). Патупилон провалил исследование III фазы по лечению рака яичников в 2010 году. [ 18 ]
результаты исследования III фазы иксабепилона (BMS-247550) в сочетании с капецитабином при метастатическом раке молочной железы (2007 г., что привело к одобрению FDA). Были объявлены [ 19 ]
Полный синтез
[ редактировать ]Из-за высокой эффективности и клинической необходимости в лечении рака эпотилоны стали целью многих тотальных синтезов . [ 20 ] Первой группой, опубликовавшей полный синтез эпотилонов, была SJ Danishefsky et al. в 1996 году. [ 9 ] [ 21 ] Этот полный синтез эпотилона А был достигнут посредством внутримолекулярной конденсации енолята-альдегида сложного эфира. Другие синтезы эпотилонов были опубликованы Николау , [ 22 ] Шинцер, [ 23 ] Мюльцер , [ 24 ] и Карьера . [ 25 ] В этом подходе ключевые строительные блоки альдегид , глицидол и кетокислота были построены и соединены с предшественником метатезиса олефина посредством альдольной реакции , а затем этерификационного сочетания. Катализатор Граббса использовали для замыкания бис-концевого олефина соединения-предшественника. Полученные соединения представляли собой цис- и транс-макроциклические изомеры с различными стереоцентрами . Эпоксидирование цис- и транс-олефинов дает эпотилон А и его аналоги.
Один из полных синтезов эпотилона В описан ниже и описан лабораторией К.С. Николау . [ 26 ] Ретросинтетический анализ выявил 1 , 2 и 3 как строительные блоки (рис. 1).
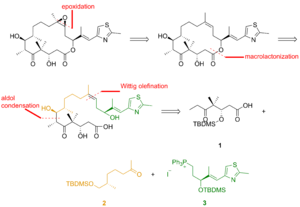
Как видно на рисунке 2, кетокислота 1 образовалась из кетоальдегида, который был преобразован в силиловый эфир посредством асимметричного аллилборирования и силилирования полученного спирта. Озонолиз силилового эфира и окисление альдегида по Линдгрену - Пиннику дали кетокислоту. Кетон 2 был создан путем алкилирования по Эндерсу, исходя из гидразона. Озонолиз, последняя стадия алкилирования по Эндерсу, сопровождался восстановлением альдегида и силилированием полученного спирта. Гидрогенолиз бензилового эфира дал спирт, который окислили в условиях Сверна и алкилировали реактивом Гриньяра с получением вторичного спирта. Окисление этого спирта реагентом Лея-Гриффита дало искомый кетон. Тиазол 3 синтезировали из сложного эфира, который восстанавливали диизобутилалюминийгидридом , а альдегид вводили в реакцию со стабилизированным илидом по реакции Виттига . Асимметричное аллилборирование α,β-ненасыщенного альдегида и защита гидроксигруппы дали силиловый эфир, концевой олефин которого вступал в реакцию с тетраоксид осмия в диол, который расщепляли тетраацетатом свинца с образованием альдегида. Восстановление, йодирование и обработка трифенилфосфином привели к образованию фосфониевой соли.
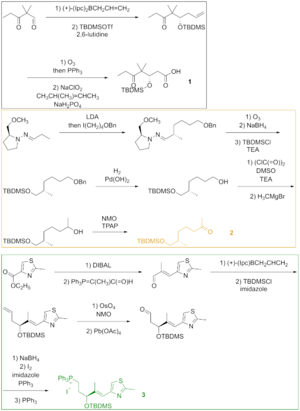
Фрагменты 1 , 2 и 3 подвергали взаимодействию друг с другом для доставки эпотилона B, используя подход, включающий реакцию Виттига , альдольную реакцию и этерификацию Ямагути (рис. 3). препаративную тонкослойную хроматографию Для разделения диастереомеров использовали .

Биосинтез
[ редактировать ]Эпотилон Б представляет собой 16-членный поликетид макролактон с метилтиазольной группой , связанной с макроциклом олефиновой связью. Поликетидный остов был синтезирован поликетидсинтазой I типа (PKS), а тиазольное кольцо было получено из цистеина , включенного нерибосомальной пептидсинтетазой (NRPS). В этом биосинтезе и PKS, и NRPS используют белки-носители , которые были посттрансляционно модифицированы фосфопантетеиновыми группами, чтобы присоединиться к растущей цепи. PKS использует тиоэфир коэнзима-A для катализа реакции и модификации субстратов путем избирательного восстановления β-карбонила до гидроксила (кеторедуктаза, KR), алкена (дегидратаза, DH) и алкана (еноилредуктаза, ER). ПКС-I также может метилировать α-углерод субстрата. С другой стороны, NRPS использует аминокислоты, активированные ферментом, в виде аминоациладенилатов. В отличие от PKS, в ферменте NRPS происходит эпимеризация , N-метилирование и образование гетероцикла. [ 27 ]

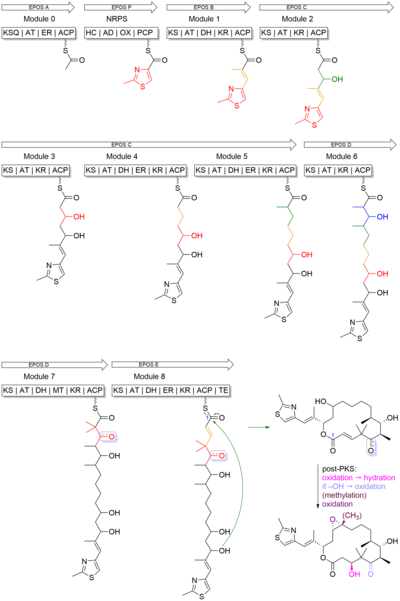
Эпотилон B начинается со стартовой единицы 2-метил-4-карбокситиазола, которая образуется в результате трансляционного взаимодействия между PKS, модулем EPOS A (epoA) и NRPS, модулем EPOS P(epoP). EPOS A содержит модифицированную β-кетоацилсинтазу (малонил-ACP-декарбоксилазу, KSQ), ацилтрансферазу (AT), еноилредуктазу (ER) и домен белка-переносчика ацила (ACP). Однако EPOS P содержит домен гетероцилизации, аденилирования, оксидазы и тиолирования. Эти домены важны, поскольку они участвуют в образовании пятичленного гетероциклического кольца тиазола. Как видно на фигуре 4 , EPOS P активирует цистеин и связывает активированный цистеин в виде аминоацил-S-PCP. После связывания цистеина EPOS A загружает ацетатную единицу в комплекс EPOS P, тем самым инициируя образование тиазолинового кольца путем внутримолекулярной циклодегидратации. [ 27 ]
После образования 2-метилтиазольного кольца его переносят в ПКС EPOS B (epoB), EPOS C (epoC), EPOS D (epoD), EPOS E (epoE) и EPOS F (epoF) для последующей элонгации. и модификацию для образования олефиновой связи, 16-членного кольца и эпоксида, как показано на Фигуре 5 . Следует отметить одну важную вещь: синтез гем-диметильного звена в модуле 7. Эти два диметила не были синтезированы путем двух последовательных C-метилирований. Вместо этого одна из метильных групп была получена из единицы пропионатного удлинителя, а вторая метильная группа была интегрирована с помощью домена C-метилтрансферазы. [ 27 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Розенберг, Стивен; ДеВита, Винсент Т.; Хеллман, Сэмюэл (2005). Рак: принципы и практика онкологии (7-е изд.). Хагерствон, доктор медицины: Липпинкотт Уильямс и Уилкинс. ISBN 0-7817-4450-4 .
- ^ Форли, Стефано (2014). «Эпотилоны: от открытия к клиническим испытаниям» . Актуальные темы медицинской химии . 14 (20): 2312–2321. дои : 10.2174/1568026614666141130095855 . ПМЦ 4629788 . ПМИД 25434353 .
- ^ «Эпотилон - обзор | Темы ScienceDirect» . www.sciencedirect.com . Проверено 18 июня 2022 г.
- ^ Х. Шпрейцер (15 сентября 2008 г.). «Новые активные ингредиенты - сагобепилон - синтетическая вариация эпотилона Б как надежда на борьбу с раком». Австрийская фармацевтическая газета (на немецком языке) (19/2008): 978.
- ^ Жюльен, Б.; Шах, С. (2002). «Гетерологичная экспрессия генов биосинтеза эпотилона в Myxococcus xanthus» . Антимикроб. Агенты Чематер . 46 (9): 2772–8. doi : 10.1128/AAC.46.9.2772-2778.2002 . ПМК 127399 . ПМИД 12183227 .
- ^ Мюльрадт, П.Ф.; Сасс, Ф. (1997). «Эпотилон B стабилизирует микротрубочки макрофагов, как таксол, не проявляя при этом таксолоподобной активности эндотоксина». Исследования рака . 57 (16): 3344–6. ПМИД 9269992 .
- ^ Хёфле, Г.; Бедорф, Н.; Штайнмерц, Х.; Шомбург, Д.; Герт, К.; Райхенбах, Х. (1996). «Эпотилон А и В — новые 16-членные макролиды с цитотоксической активностью: выделение, кристаллическая структура и конформация в растворе». Энджью. Хим . 35 (1314): 1567. doi : 10.1002/anie.199615671 .
- ^ Гудин С., Кейн, член парламента, Рубин Э.Х. (май 2004 г.). «Эпотилоны: механизм действия и биологическая активность» . Дж. Клин. Онкол . 22 (10): 2015–25. дои : 10.1200/JCO.2004.12.001 . ПМИД 15143095 . Архивировано из оригинала 13 февраля 2006 г. Проверено 14 мая 2006 г.
- ^ Jump up to: а б Балог, Д.М.; Мэн, Д.; Каманецка, Т.; Бертинато, П.; Су, Д.-С.; Соренсен, Э.Дж.; Данишевский, С.Дж. (1996). «Полный синтез (—)-эпотилона А». Энджью. Хим . 108 (23–24): 2976. Бибкод : 1996AngCh.108.2976B . дои : 10.1002/ange.19961082318 .
- ^ Джордан, Массачусетс, Уилсон Л. (апрель 2004 г.). «Микротрубочки как мишень для противораковых препаратов». Обзоры природы Рак . 4 (4): 253–65. дои : 10.1038/nrc1317 . ПМИД 15057285 . S2CID 10228718 .
- ^ Гангули А., Ян Х., Кабрал Ф. (ноябрь 2010 г.). «Паклитаксел-зависимые клеточные линии обнаруживают новую лекарственную активность» . Мол. Рак Там . 9 (11): 2914–23. дои : 10.1158/1535-7163.MCT-10-0552 . ПМЦ 2978777 . ПМИД 20978163 .
- ^ «Новые разрешения на лекарства в Китае в 2021 году» . Diaglobal.org . 2 мая 2022 г.
- ^ Вильегас, Сесилия; Гонсалес-Чаваррия, Иван; Бургос, Вивиана; Итурра-Бейза, Гектор; Ульрих, Хеннинг; Мир, Кристиан (январь 2023 г.). «Эпотилоны как природные соединения для разработки новых противораковых препаратов» . Международный журнал молекулярных наук . 24 (7):6063.doi : 10.3390 /ijms24076063 . ISSN 1422-0067 . ПМЦ 10093981 . ПМИД 37047035 .
- ^ Утиделон активен при предварительно обработанном метастатическом раке молочной железы. июнь 2016 г.
- ^ «Медицинские новости сегодня: FDA одобрило IXEMPRA™ (ixabepilone), полусинтетический аналог эпотилона B для лечения распространенного рака молочной железы» . Архивировано из оригинала 16 мая 2011 г. Проверено 17 февраля 2009 г.
- ↑ Лондон, 20 ноября 2008 г. Док. Ссылка. Европа, Ближний Восток и Африка/602569/2008
- ^ Одзима, И.; Вите, Г.Д.; Альтманн, КХ; 2001 Противораковые агенты: границы химиотерапии рака. Американское химическое общество, Вашингтон, округ Колумбия.
- ^ «ESMO: неудачные испытания доминируют на сеансе гинекологического рака» . 14 октября 2010 г. Архивировано из оригинала 18 июня 2010 г. Проверено 26 октября 2010 г.
- ^ «Исследование иксабепилона фазы III продемонстрировало значительное улучшение выживаемости без прогрессирования у пациентов с распространенным метастатическим раком молочной железы» . Медицинские новости сегодня. 4 июня 2007 г.
- ^ Людувико, И.; Хиарик, ML; Алмейда, МВ; Да Силва, AD (2006). «Синтетические методики получения эпотилонов и аналогов». Мини-обзоры по органической химии (обзор). 3 : 49–75. дои : 10.2174/157019306775474194 .
- ^ Су, Д.-С.; Мэн, Д.; Бертинато, П.; Балог, Д.М.; Соренсен, Э.Дж.; Данишевский, С.Дж.; Чжэн, Ю.-Х.; Чжоу, Т.-Ц.; Он, Л.; Хорвиц, С.Б. (1997). «Полный синтез (–)-эпотилона B: расширение метода соединения Сузуки и понимание взаимосвязей структура-активность эпотилонов». Энджью. хим. Межд. Эд. англ . 36 (7): 757. doi : 10.1002/anie.199707571 .
- ^ Ян, З.; Привет.; Вурлумис, Д.; Вальберг, Х .; Николау, КЦ (1997). «Полный синтез эпотилона А: подход к метатезису олефинов». Энджью. хим. Межд. Эд. англ . 36 (12): 166. doi : 10.1002/anie.199701661 .
- ^ Шинцер, Д.; Лимберг, А.; Бауэр, А.; Бём, О.М.; Кордес, М. (1997). «Тотальный синтез (-)-эпотилона А». Энджью. хим. Межд. Эд. англ . 36 (5): 523. doi : 10.1002/anie.199705231 .
- ^ Мюльцер, Дж.; Мантулидис, А.; Олер, Э. (2000). «Полный синтез эпотилонов B и D». Дж. Орг. Хим . 65 (22): 7456–67. дои : 10.1021/jo0007480 . ПМИД 11076603 .
- ^ Боде, Дж.В.; Каррейра, ЕМ (2001). «Стереоселективный синтез эпотилонов A и B посредством направленного циклоприсоединения оксида нитрила». Дж. Ам. хим. Соц . 123 (15): 3611–2. дои : 10.1021/ja0155635 . ПМИД 11472140 .
- ^ Николау, КЦ; Нинкович, С.; Сарабия, Ф.; Вурлумис, Д.; Привет.; Вальберг, Х.; Финли, MRV; Ян, З. (1997). «Полный синтез эпотилонов A и B с помощью стратегии, основанной на макролактонизации». Дж. Ам. хим. Соц . 119 (34): 7974. дои : 10.1021/ja971110h .
- ^ Jump up to: а б с Мольнар, И.; Шупп, Т.; Оно, М.; Зиркль, Р.Э.; Милнамоу, М.; Новак-Томпсон, Б.; Энгель, Н.; Тупе, К.; Стратманн, А.; Сир, Д.Д.; Горлач, Дж.; Мэйо, Дж. М.; Ху, А.; Гофф, С.; Шмид, Дж.; Лигон, Дж.М. (2000). «Кластер биосинтетических генов агентов, стабилизирующих микротрубочки, эпотилонов A и B из Sorangium cellulosum So ce90» . Химия и биология . 7 (2): 97–109. дои : 10.1016/S1074-5521(00)00075-2 . ПМИД 10662695 .