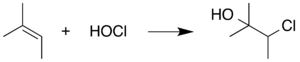Окисление Пинника
| Окисление Пинника | |
|---|---|
| Назван в честь | Гарольд В. Пинник |
| Тип реакции | Органическая окислительно-восстановительная реакция |
Окисление Пинника — это органическая реакция , посредством которой альдегиды могут быть окислены до соответствующих им карбоновых кислот с использованием хлорита натрия (NaClO 2 ) в умеренно кислых условиях. Первоначально он был разработан Линдгреном и Нильссоном. [1] Типичные условия реакции, используемые в настоящее время, были разработаны Г. А. Краусом. [2] [3] Позже Х.В. Пинник продемонстрировал, что эти условия можно применять для окисления α,β-ненасыщенных альдегидов. [4] Существует множество различных реакций окисления альдегидов, но лишь немногие из них поддаются широкому набору функциональных групп . Окисление по Пиннику оказалось как устойчивым к чувствительным функциональным группам, так и способным реагировать со стерически затрудненными группами. Эта реакция особенно полезна для окисления α,β-ненасыщенных альдегидов, а еще одним ее преимуществом является относительно низкая стоимость. [4] [5]
Механизм
[ редактировать ]В предлагаемом механизме реакции в качестве активного окислителя используется хлористая кислота , которая образуется в кислых условиях из хлорита.
- ClO 2 − + Н 2 ПО 4 − ⇌ HClO 2 + HPO 4 2−
Сначала хлористая кислота присоединяется к альдегиду. Затем полученная структура подвергается перициклической фрагментации , при которой альдегидный водород переходит в кислород на хлоре, при этом группа хлора высвобождается в виде хлорноватистой кислоты (HOCl). [6]
Побочные реакции и поглотители
[ редактировать ]Побочный продукт HOCl, который сам по себе является активным окислителем, может быть проблемой по нескольким причинам. [6] Он может разрушить реагент NaClO 2 :
- HOCl + 2ClO 2 − → 2ClO 2 + Cl − + ОН −
делая его недоступным для желаемой реакции. Это также может вызвать другие нежелательные побочные реакции с органическими материалами. Например, HOCl может реагировать с двойными связями в органическом реагенте или продукте посредством реакции образования галогенгидрина .
Чтобы предотвратить вмешательство HOCl, поглотитель в реакцию обычно добавляют , который потребляет HOCl по мере его образования. Например, можно воспользоваться склонностью HOCl к реакции присоединения, добавив в реакционную смесь жертвенный алкенсодержащий химикат. Этот альтернативный субстрат реагирует с HOCl, предотвращая реакции HOCl, которые мешают самой реакции Пинника. 2-метил-2-бутен В этом контексте часто используется :
Резорцин и сульфаминовая кислота также являются распространенными реагентами-поглотителями. [6] [7]
Перекись водорода (H 2 O 2 ) может использоваться в качестве поглотителя HOCl, побочные продукты которой не мешают реакции окисления Пинника:
- HOCl + H 2 O 2 → HCl + O 2 + H 2 O
В слабокислой среде достаточно концентрированный (35%) раствор H 2 O 2 подвергается быстрой окислительной реакции без конкурентной реакции восстановления HClO 2 с образованием HOCl.
- HClO 2 + H 2 O 2 → HOCl + O 2 + H 2 O
Диоксид хлора быстро реагирует с H 2 O 2 с образованием хлористой кислоты .
- 2ClO 2 + H 2 O 2 → 2HClO 2 + O 2
Также образование кислорода дает хороший индикатор хода реакции. ДМСО использовался вместо H 2 O 2 для реакций окисления, которые не дают больших выходов с использованием только H 2 O 2 . В эту категорию попадают в основном богатые электронами альдегиды. [7] (См. Ограничение ниже)
Кроме того, были приготовлены и использованы реагенты на твердом носителе, такие как силикагель с фосфатным буфером на перманганате калия и хлорит на полимерном носителе, для превращения альдегидов в карбоновую кислоту без необходимости выполнения традиционных процедур обработки. В реакции продукты улавливаются силикагелем в виде их калиевых солей. Таким образом, эта процедура облегчает удаление нейтральных примесей путем промывки органическими растворителями . [8]
Область применения и ограничения
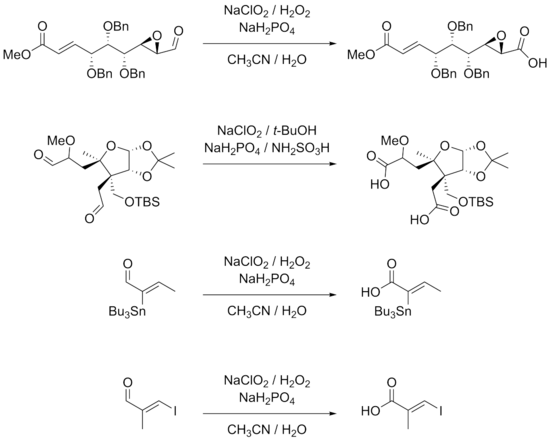
[ редактировать ]Реакция хорошо подходит для субстратов с множеством функциональных групп. β-арилзамещенные α,β- ненасыщенные альдегиды хорошо сочетаются с условиями реакции. тройные связи, непосредственно связанные с альдегидными группами или сопряженные с другими двойными связями. Реакции также могут подвергаться [7] [9] гидроксиды , эпоксиды , бензиловые эфиры , галогениды , включая йодиды , и даже станнаны. Достаточно устойчивы в реакции [7] [9] [10] [11] Приведенные ниже примеры реакций также показывают, что стереоцентры α-углеродов остаются неповрежденными, а двойные связи, особенно тризамещенные, не претерпевают E / Z в реакции -изомеризации.
Меньшие выходы получаются для реакций с участием алифатических α,β-ненасыщенных и более гидрофильных альдегидов. Двойные связи и богатые электронами альдегидные субстраты могут привести к хлорированию как альтернативной реакции. Использование ДМСО в этих случаях дает лучший выход. Незащищенные ароматические амины и пирролы также плохо подходят для реакций. В частности, хиральные α-аминоальдегиды плохо реагируют из-за эпимеризации и потому, что аминогруппы легко трансформируются в соответствующие им N -оксиды. Стандартные подходы защитных групп , такие как использование t -BOC , являются жизнеспособным решением этих проблем. [12]
Тиоэфиры также очень чувствительны к окислению. Например, окисление тиоанисового альдегида по Пиннику дает высокий выход продуктов карбоновой кислоты, но с сопутствующим превращением тиоэфира в сульфоксид или сульфон . [7]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Линдгрен, Бенгт О.; Нильссон, Торстен; Хасебай, Стейнар; Микалсен, Ойвинд; Леандер, Курт; Сван, Карл-Гуннар (1973). «Получение карбоновых кислот из альдегидов (в том числе гидроксилированных бензальдегидов) окислением хлоритом» . Акта Хим. Скан. 27 : 888–890. doi : 10.3891/acta.chem.scand.27-0888 .
- ^ Джордж А. Краус; Брюс Рот (1980). «Синтетические исследования веррукарола. 2. Синтез кольцевой системы AB» . Дж. Орг. хим. 45 (24): 4825–4830. дои : 10.1021/jo01312a004 .
- ^ Джордж А. Краус; Майкл Дж. Ташнер (1980). «Модельные исследования по синтезу квассиноидов. 1. Построение кольцевой системы BCE» . Дж. Орг. хим. 45 (6): 1175–1176. дои : 10.1021/jo01294a058 .
- ^ Перейти обратно: а б Бал, Б.С.; Чайлдерс, МЫ; Пинник, HW (1981). «Окисление α,β-ненасыщенных альдегидов». Тетраэдр . 37 (11): 2091–2096. дои : 10.1016/S0040-4020(01)97963-3 .
- ^ Манди, Би Джей; Эллерд, Майкл Г.; Фавалоро, Фрэнк Г. (2005). «Окисление Пинника». Назовите реакции и реагенты в органическом синтезе . Джон Уайли и сыновья . п. 518. ИСБН 978-0-471-22854-7 .
- ^ Перейти обратно: а б с Курти, Ласло; Чако, Барбара (2005). «Окисление Пинника». Стратегическое применение названных реакций в органическом синтезе: предпосылки и подробные механизмы . Эльзевир . стр. 354–356. ISBN 9780124297852 .
- ^ Перейти обратно: а б с д и Далканале, Э; Монтанари, Ф (1986). «Селективное окисление альдегидов до карбоновых кислот хлоритом натрия-перекисью водорода». Дж. Орг. хим. 51 (4): 567–569. дои : 10.1021/jo00354a037 .
- ^ Такемото, Т.; Ясуда, К.; Лей, С.В. (2001). «Реагенты на твердом носителе для окисления альдегидов до карбоновых кислот». Синлетт . 2001 (10): 1555–1556. дои : 10.1055/s-2001-17448 .
- ^ Перейти обратно: а б Раах, А.; Райзер, О. (2000). «Хлорит натрия-перекись водорода, мягкий и селективный реагент для окисления альдегидов до карбоновых кислот». Ж. Практ. хим. 342 (6): 605–608. doi : 10.1002/1521-3897(200006)342:6<605::aid-prac605>3.0.co;2-i .
- ^ Исихара, Дж.; Хагихара, К.; Чиба, Х.; Ито, К.; Янагисава, Ю.; Тотани, К; Тадано, К. (2000). «Синтетические исследования вириденомицина. Построение части циклопентенкарбоновой кислоты». Тетраэдр Летт. 41 (11): 1771–1774. дои : 10.1016/S0040-4039(00)00013-7 .
- ^ Курамочи, К.; Нагата, С.; Итайя, Х.; Такао, Х.; Кобаяши, С. (1999). «Конвергентный полный синтез эполактаена: применение стратегии мостового оксиранилового аниона». Тетраэдр Летт. 40 (41): 7371–7374. дои : 10.1016/S0040-4039(99)01512-9 .
- ^ Деу, К.; Фонтейн, Э.; Эскюдье, Дж.; Балтас, М.; Горричон, Л. (1998). «Полный синтез аналога тимидина 2-дезоксиполиоксина C». Дж. Орг. хим. 63 (8): 2601–2608. дои : 10.1021/jo972116s . ПМИД 11672125 .