Кониин
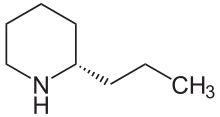 ( S )-Кониин | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК ( 2S )-2-пропилпиперидин | |
| Идентификаторы | |
3D model ( JSmol ) |
|
| ЧЭБИ |
|
| ЧЕМБЛ |
|
| ХимическийПаук |
|
| Информационная карта ECHA | 100.006.621 |
| Номер ЕС |
|
| КЕГГ |
|
ПабХим CID | |
| НЕКОТОРЫЙ |
|
Панель управления CompTox ( EPA ) |
|
| Характеристики | |
| С 8 Ч 17 Н | |
| Молярная масса | 127.231 g·mol −1 |
| Появление | Бесцветная маслянистая жидкость |
| Температура плавления | −2 ° C (28 ° F; 271 К) |
| Точка кипения | От 166 до 167 ° C (от 331 до 333 ° F; от 439 до 440 К) |
Показатель преломления ( n D ) | 1.4505 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Кониин — ядовитое химическое соединение , алкалоид , присутствующий и выделяемый из болиголова ядовитого ( Conium maculatum ), где его присутствие было источником значительного экономического, медицинского и историко-культурного интереса; Кониин также вырабатывается желтым кувшинником ( Sarracenia flava ) и дурацкой петрушкой ( Aethusa cynapium ). Его проглатывание и длительное воздействие токсичны для человека и всех классов домашнего скота; Механизм отравления включает нарушение работы центральной нервной системы со смертью, вызванной параличом дыхания . Биосинтез отличающееся от кониина кониина представляет собой предпоследнюю стадию неферментативной циклизации 5 -оксооктиламина в γ-коницеин, основание Шиффа, только двойной связью углерод-азот в кольце . Этот путь приводит к образованию природного кониина, который представляет собой смесь — рацемат — состоящую из двух энантиомеров, стереоизомеров ( S )-(+)-кониина и ( R )-(-)-кониина, в зависимости от направления цепи, которая ответвления от кольца. Оба энантиомера токсичны: ( R )-энантиомер в целом является более биологически активным и токсичным из двух. Кониин занимает место в истории органической химии как первый представитель важного класса алкалоидов , который был синтезирован Альбертом Ладенбургом в 1886 году, и вплоть до наших дней он синтезировался в лаборатории множеством уникальных способов.
Отравление болиголовом было периодической проблемой человечества, регулярной проблемой ветеринаров и имело значительные случаи в истории человечества и культуры. Примечательно, что в 399 году до нашей эры Сократ был приговорен к смертной казни за то, что выпил кониинсодержащую смесь яда болиголова .
Естественное происхождение
[ редактировать ]
Болиголов ядовитый ( Conium maculatum ) содержит высокотоксичное количество кониина. Его присутствие на сельскохозяйственных угодьях является проблемой для животноводов, поскольку животные будут его есть, если их плохо кормить или если болиголов смешан с пастбищной травой. [1] Кониин присутствует в Conium maculatum в виде смеси R-(-)- и S-(+)- энантиомеров . [2]

Кониин также содержится в Sarracenia flava , растении желтого кувшина. [3] [4] Желтый кувшин — хищное растение , эндемичное для юго-востока США. Растение использует смесь сахара и кониина для одновременного привлечения и отравления насекомых, которые затем попадают в пищеварительную трубку. [5] Кониин также содержится в Aethusa cynapium , широко известном как дурацкая петрушка. [6]
История природных изолятов
[ редактировать ]История кониина, по понятным причинам, связана с ядовитым растением болиголов, поскольку этот натуральный продукт невозможно было синтезировать до 1880-х годов. [7] Евреи на Ближнем Востоке были отравлены кониином после употребления в пищу перепелов в районе, где обычно ели семена болиголова, а греки на острове Лесбос , которые также употребляли в пищу перепелов, пострадали от того же отравления, вызвав миоглобинурию и острое повреждение почек . [8] Самое известное отравление болиголовом произошло в 399 году до нашей эры, когда философ Сократ, как полагают, употребил жидкость, настоянную на болиголове, чтобы привести в исполнение свой смертный приговор, поскольку он был признан виновным в нечестии по отношению к богам и развращении молодежи. [9] [10] [11] Сок болиголова часто использовался для казни преступников в Древней Греции . [12]
На протяжении всей истории болиголов имел ограниченное медицинское применение. Греки использовали его не только как смертную казнь, но и как спазмолитическое средство и средство для лечения артрита . Книги X века свидетельствуют о медицинском использовании англосаксами. [13] В средние века считалось, что болиголов можно использовать для лечения бешенства; в более поздние европейские времена это стало ассоциироваться с летучими мазями в колдовстве. Коренные американцы использовали экстракт болиголова в качестве яда для стрел . [14]
Хотя растение желтого кувшина и петрушка дурака также содержат кониин, сообщений о традиционном использовании этих растений нет.
Фармакология и токсикология
[ редактировать ]( R )-(-)-энантиомер кониина является более биологически активным, по крайней мере, в одной системе (клетки TE-671, экспрессирующие никотиновые нервно-мышечные рецепторы плода человека), а в биоанализе на мышах тот же энантиомер и рацемическая смесь примерно в двух -раз более токсичен, чем ( S )-(+)-энантиомер (см. ниже). [2]
Кониин в виде рацемата или чистого энантиомера начинается со связывания и стимуляции никотинового рецептора на постсинаптической мембране нервно-мышечного соединения . Последующая деполяризация приводит к никотиновой токсичности; поскольку кониин остается связанным с рецептором, нерв остается деполяризованным, инактивируя его. [15] Системно это приводит к вялому параличу , действие которого аналогично действию сукцинилхолина , поскольку оба они являются деполяризующими нервно-мышечными блокаторами. Симптомы паралича обычно возникают в течение получаса, хотя смерть может занять несколько часов. Центральная нервная система не поражается: человек остается в сознании до тех пор, пока паралич дыхания не приводит к остановке дыхания. Вялый мышечный паралич представляет собой восходящий паралич, при котором сначала поражаются нижние конечности. Непосредственно перед смертью у человека могут возникнуть гипоксические судороги, замаскированные мышечным параличом, так что человек может просто слегка вздрагивать. Причиной смерти является недостаток кислорода в мозге и сердце вследствие паралича дыхания, поэтому отравленный человек может выздороветь, если поддерживать искусственную вентиляцию до тех пор, пока токсин не будет удален из организма жертвы.
Значения LD -(+) - 50 (у мышей, при внутривенном введении) для R -(-) и S энантиомеров и рацемата составляют приблизительно 7, 12 и 8 миллиграммов на килограмм соответственно. [2]
Химические свойства
[ редактировать ](+/–)-Кониин был впервые выделен Гизеке. [16] но формулу предложил Блит [17] и определенно установлено Хофманном . [18] [19]
С тех пор было установлено, что D- ( S )-кониин представляет собой бесцветную щелочную жидкость с резким запахом и жгучим вкусом; имеет D 0° 0,8626 и Д 19° 0,8438, показатель преломления n 23° D 1,4505, правовращающий, [α] 19° D +15,7° (см. соответствующие комментарии в «Особое вращение» разделе ниже ). L- ( R )-Кониин имеет [α] 21° D 15° и в других отношениях напоминает свой D -изомер, но соли имеют несколько разные температуры плавления; платинихлорид имеет т.пл. 160 °C (Леффлер и Фридрих сообщают о 175 °C), аурихлорид т.пл. 59 °С. [20] [21]
Растворимость
[ редактировать ]Кониин мало растворим (1 из 90) в холодной воде, в меньшей степени в горячей, поэтому прозрачный холодный раствор мутнеет при нагревании . С другой стороны, основа растворяет около 25% воды при комнатной температуре. Смешивается со спиртом во всех соотношениях, хорошо растворяется в эфире и большинстве органических растворителей. Кониин растворяется в сероуглероде , образуя сложный тиокарбамат. [22] [23]
Кристаллизация
[ редактировать ]Этот раздел в значительной степени или полностью опирается на один источник . ( январь 2017 г. ) |
Кониин затвердевает в мягкую кристаллическую массу при -2 ° C. Медленно окисляется на воздухе. Соли хорошо кристаллизуются и растворимы в воде или спирте. Гидрохлорид B·HCl кристаллизуется из воды в виде ромбов, т. пл. 220 °С, [α] 20° Д +10,1°; гидробромид, в иглах, т. пл. 211°С, а тартрат D -кислоты B•C 4 H 6 O 6 •2 H 2 O в ромбических кристаллах, т. пл. 54 °С. Платинихлорид (B•HCl) 2 ·PtCl 4 ·H 2 O выделяется из концентрированного раствора в виде масла, которое затвердевает с образованием массы оранжево-желтых кристаллов, т. пл. 175 °С (сухой). Аурихлорид B•HAuCl 4 кристаллизуется при стоянии, т. пл. 77 °С. Пикрат . образует мелкие желтые иголки, т. пл 75°С, от горячей воды. Производные 2,4-динитробензоила и 3,5-динитробензоила имеют Т.пл. 139,0–139,5 °С и 108–9 °С соответственно. [24] Осадок, образующийся при растворе иодида калия-кадмия, кристаллический, т. пл. 118 °С, тогда как никотин с этим реагентом аморфен.
Изменения цвета
[ редактировать ]Кониин не окрашивается ни серной , ни азотной кислотой . Нитропруссид натрия меняется на синий или фиолетовый дает темно-красный цвет, который исчезает при нагревании, но вновь появляется при охлаждении и под действием альдегидов . [25]
Удельное вращение
[ редактировать ]Стереохимический . состав «кониина» имеет определенное значение, поскольку два его энантиомера не обладают идентичными биологическими свойствами [2] и многие из более старых фармакологических исследований этого соединения проводились с использованием встречающейся в природе изомерной смеси. [ нужна ссылка ] S -(+)-Кониин имеет удельное вращение [α] D +8,4° (c = 4,0 в CHCl 3 ). [26] Эти авторы отмечают, что значение Ладенбурга, [27] +15° — для «чистой», т. е. неразбавленной, пробы. Столь же высокое значение +16° для [α] D «кониина» приведено без явной ссылки на источник в The Merck Index . [28] Значение +7,7° (с = 4,0, CHCl 3 ) для синтетического S-(+)-кониина и -7,9° (с = 0,5, CHCl 3 ) для синтетического R-(-)-кониина дано другими химиками. [29] Гидрохлоридные соли ( S )-(+) и ( R )-(-)-энантиомеров кониина имеют значения [α] D +4,6° и -5,2° соответственно (с = 0,5, в метаноле). [2]
Синтез
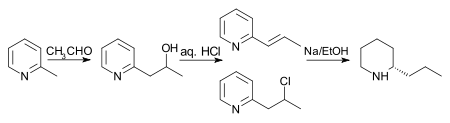
[ редактировать ]Первоначальный синтез (показанный ниже) кониина был выполнен Ладенбургом в 1886 году. [30] Ладенбург нагрел иодид N-метилпиридина до 250 ° C, чтобы получить 2-метилпиридин . Затем он провел конденсацию Кнёвенагеля с ацетальдегидом в безводном хлориде цинка с получением 2-пропенилпиридина. Фактически, Ладенбург использовал паральдегид , циклический тример ацетальдегида, который легко образует ацетальдегид при нагревании. Наконец, 2-пропенилпиридин восстанавливали металлическим натрием в этаноле с получением рацемического (±) кониина. Фракционная кристаллизация рацемического кониина с (+)- винной кислотой привела к получению энантиочистого кониина.

Схема, предложенная Ладенбургом, дала низкую урожайность, поэтому был открыт поиск альтернативных маршрутов. Несколько лучший выход наблюдается, если 2-метилпиридин и ацетальдегид нагревать в запаянной пробирке с соляной кислотой в течение 10 часов. Образуется смесь 2-пропенилпиридина и 2-хлорпропилпиридина, которую затем восстанавливают натрием в этаноле с получением рац -кониина. Примечание: хотя на схеме ниже показан один энантиомер кониина, в результате окончательной реакции образуется рацемическая смесь, которую затем разделяют.
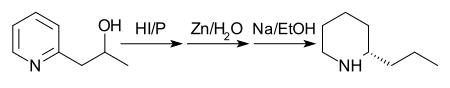
В 1907 году был предложен другой маршрут с большей урожайностью. Сначала 2-(2'-гидроксипропил)пиридин восстанавливают фосфором и дымящей иодистоводородной кислотой при 125 °C. Во-вторых, изделие обрабатывается цинковой пылью и водой. Наконец, продукт второго этапа обрабатывают натрием в этаноле. [31] Примечание: хотя на рисунке ниже показан один энантиомер кониина, в результате этой реакции образуется рацемическая смесь, которую затем очищают и разделяют.
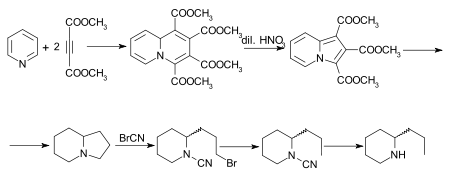
Осуществлен ряд других синтезов кониина. [32] из которых особый интерес представляет работа Дильса и Альдера. [33] Исходным аддуктом пиридина и диметилацетилендикарбоксилата является тетраметилхинолизин-1,2,3,4-тетракарбоксилат, который при окислении разбавленной азотной кислотой превращается в триметилиндолизин-трикарбоксилат. В результате гидролиза и декарбоксилирования образуется индолизин , октагидропроизводное которого, также известное как октагидропирроколин. [34] методом преобразуется бромцианидным последовательно в бромцианамид, цианамид и рац. -кониин. Синтез алкалоида, начиная с индолизина (пирроколина), описан Очиаи и Цуда. [35]
Получение L- ( R )-кониина восстановлением β-коницеина ( L -пропенилпиперидина) по Лёффлеру и Фридриху. [21] обеспечивает средства для превращения конгидрина в L- ( R )-кониин. [36] Гесс и Эйхель сообщили: [37] неправильно, [38] что пеллетерин представляет собой альдегид (β-2-пиперидилпропалдегид), соответствующий кониину, и дает раккониин при его гидразона нагревании с этоксидом натрия в этаноле при 156–170 °C. По мнению этих авторов, D- ( S )-кониин становится практически оптически неактивным при нагревании с гидроксидом бария и спиртом при 180–230 °С. Лейте [39] показал , путем наблюдения за оптическим вращением (+)- пипеколевой кислоты (пиперидин-2-карбоновой кислоты) и некоторых ее производных в различных условиях [40] что он должен принадлежать к D -серии аминокислот .
В настоящее время кониин, как и многие другие алкалоиды, можно синтезировать стереоселективно . [29] Например, катализируемая Pd реакция переноса 1,3-хиральности может стереоспецифически преобразовать одиночный энантиомер аллилового спирта в циклическую структуру (в данном случае пиперидин). [41] Таким образом, исходя из (S)-спирта, получают (S)-энантиомер кониина и наоборот. Примечательно, что разделение рацемического спирта на различные энантиомеры осуществляется с помощью Candida antarctica липазы .
Биосинтез
[ редактировать ]Биосинтез кониина все еще исследуется, но большая часть пути выяснена. Первоначально считалось, что 4 ацетильные группы используются в качестве питательных веществ для поликетидсинтазы, образующей кониин. [42] на самом деле он является производным двух малонилов и бутирила-КоА, которые получаются обычным путем из ацетил-КоА. [43]
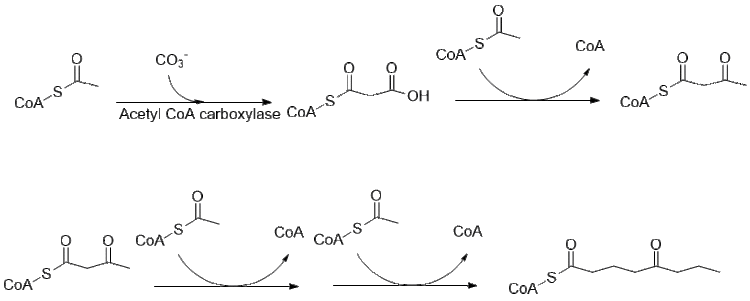
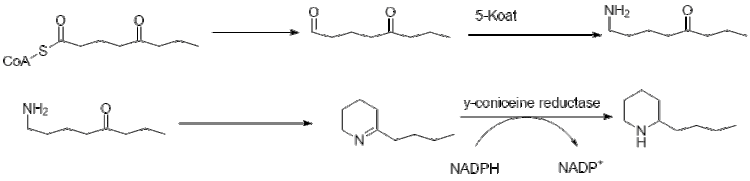
Дальнейшее удлинение бутирил-КоА с помощью 2-малонил-КоА приводит к образованию 5-кетооктаналя. Затем кетооктаналь подвергается трансаминированию с помощью аланин:5-кетооктаналаминотрансферазы. [44] Затем амин самопроизвольно циклизуется и дегидратируется с образованием предшественника кониина γ-коницеина. Затем его восстанавливают с помощью НАДФН-зависимой у-коницеинредуктазы с образованием кониина.
В популярной культуре
[ редактировать ]Кониин — орудие убийства в Агаты Кристи детективном романе «Пять поросят» .
Стереоизомеры R и S 2-пропилпиперидина представляют собой нейротоксин, присутствующий в слизнеподобной форме жизни в The Expanse . В сериале показано, что токсин вызывает почти мгновенную смерть при контакте с кожей.
Ссылки
[ редактировать ]- ^ Питерс, Эми; Бушка, Кэсси. «Ядовитый болиголов» . Служба расширения Osu . Проверено 3 мая 2015 г.
- ^ Jump up to: а б с д и Стивен Т. Ли; Бенедикт Т. Грин; Кевин Д. Уэлч; Джеймс А. Пфистер; Кип Э. Пантер (2008). «Стереоселективная активность и относительная токсичность энантиомеров кониина». Химические исследования в токсикологии . 21 (10): 2061–2064. дои : 10.1021/tx800229w . ПМИД 18763813 .
- ^ Н.В. Моди; Р. Хенсон; П.А. Хедин; У. Кокпол; Д. Х. Майлз (1976). «Выделение из Sarracenia flava возбудителя кониина, парализующего насекомых ». Эксперименты . 32 (7): 829–830. дои : 10.1007/BF02003710 . S2CID 38319708 .
- ^ Хотти, Ханну; Ришер, Хейко (2017). «Убийца Сократа: кониин и родственные алкалоиды в царстве растений» . Молекулы . 22 (11): 1962. doi : 10,3390/molecules22111962 . ПМК 6150177 . ПМИД 29135964 .
- ^ Маки, Робин. «Желтый кувшин или трубы» . Министерство сельского хозяйства США . Лесная служба Министерства сельского хозяйства США . Проверено 3 мая 2015 г.
- ^ Клэпхэм, Тутин и Варбург. Флора Британских островов (2-е изд.). п. 524.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Чисхолм, Хью , изд. (1911). . Британская энциклопедия . Том. 6 (11-е изд.). Издательство Кембриджского университета. п. 942.
- ^ «Массачусетское медицинское общество: не ешьте перепелов» . www.massmed.org . Проверено 30 июля 2021 г.
- ^ Джеймс Уоррен (2001). «Сократическое самоубийство». Журнал эллинистических исследований . 121 : 91–106. дои : 10.2307/631830 . JSTOR 631830 . ПМИД 19681231 . S2CID 24221544 .
- ^ Р.Г. Фрей (1978). «Сократ покончил жизнь самоубийством?». Философия . 53 (203): 106–108. дои : 10.1017/S0031819100016375 . S2CID 170399183 .
- ^ Джексон, Генри (1911). . В Чисхолме, Хью (ред.). Британская энциклопедия . Том. 25 (11-е изд.). Издательство Кембриджского университета. стр. 331–338.
СОКРАТ, сын скульптора Софрониска и повивальной бабки Фенареты, родился в Афинах не ранее 471 года и не позднее мая или июня 469 года до нашей эры... В 399 году, через четыре года после реставрации и амнистии, он был обвинен как нарушитель общественной морали. ... Обвинение звучало так: «Сократ виновен, во-первых, в отрицании признанных государством богов и введении новых божеств, а, во-вторых, в развращении молодых». ... При обычных обстоятельствах осужденный преступник выпил чашу болиголова на следующий день после суда; но в случае Сократа правило, согласно которому в отсутствие священного корабля, ежегодно отправляемого на Делос, никто не должен быть казнен, вызвало исключительный
- ^ «Самоубийство Сократа» . Очевидец истории . Проверено 3 мая 2015 г.
- ^ Грив, М. (1971). Современные травы (2-е изд.). Минеола, Нью-Йорк: Dover Publications. п. 392. ИСБН 978-0-486-22798-6 . Проверено 3 мая 2015 г.
- ^ Мозер, Л; Крисп, Д. «Ядовитый болиголов» (PDF) . Борьба с сорняками в Сан-Франциско-Пикс . Проверено 3 мая 2015 г.
- ^ Голдранк, Льюис; Нельсон, Льюис. Токсикологические чрезвычайные ситуации (11-е изд.). Нью-Йорк: МакГроу-Хилл. стр. Глава 118: Растения.
- ^ Гизеке, Август Луд. (1827) активном компоненте болиголова maculatum » « Об Conium , Archiv der Pharmazie , 20 (2): 97–111. На стр. 99, Гизеке приписывает швейцарскому аптекарю Пешье создание названия coniin (coniine). См . сноску на стр. 87 из: Пешье (1821 г.) «Новые аналитические исследования мака, выращиваемого в различных климатических условиях; кроме того, о некоторых отечественных наркотиках и открытии в них новых растительных кислот и щелочей», « Новый фармацевтический журнал для врачей, фармацевтов и химиков» , 5 (1): 76–101. Из стр. 87: «Иллюстрацию кристаллизованной кислоты см. на рис. 1, кониевую кислоту натра — на рис. 2». (Иллюстрацию кристаллической кислоты см. на рис. 1; натриевая соль кониевой кислоты изображена на рис. 2.)
- ^ Блит, Дж. (1849) «О составе кониина и продуктов его разложения», Ежеквартальный журнал Лондонского химического общества , 1 : 345–363. Блит нашел эмпирическую формулу кониина (стр. 351): C 17 H 17 N. Ошибка в количестве углерода обусловлена отчасти тем, что он предположил, что атомная масса углерода равна 6, а не 12 — распространенная ошибка того времени.
- ^ Хофманн, AW (1881) «Влияние тепла на аммониевые основания: 2. Кониин», Отчеты Немецкого химического общества , 14 : 705–713.
- ^ Пантер, К.Е. и Киллер, РФ, гл. 5: Пиперидиновые алкалоиды болиголова ядовитого ( Conium maculatum ) в: Cheeke, Peter R., ed., Toxicants of Plant Origin: Alkaloids , vol. 1 (Бока-Ратон, Флорида: CRC Press, Inc., 1989), стр. 1. 116.
- ^ Аренс, Бер. , 1902, 35 , 1330
- ^ Jump up to: а б Лёффлер и Фридрих, Бер. , 1909, 42 , 107.
- ^ Мельцер, Фарм. , 1898, 236 , 701.
- ^ см . Диллинг, фарм. Дж. , 1909, [iv], 29 , 34, 70, 102.
- ^ Шпет, Куффнер и Энсфелльнер, Бер. , 1933, 66 , 596.
- ^ Gabutti, Chem. Soc. Abstr. , 1906, [ii], 711.
- ^ Крейг Дж. Саймерман; А. Р. Пиндер (1971). «Улучшенное разрешение метода кониина». Журнал органической химии . 36 (23): 3648–3649. дои : 10.1021/jo00822a051 .
- ^ А. Ладенбург (1888) Энн Юстуса Либиха. хим. 247 1-98.
- ^ Индекс Merck , 15-е изд. (2013), с. 446, Монография 2489 , О'Нил: Королевское химическое общество. http://www.rsc.org/Merck-Index/monograph/mono1500002489
- ^ Jump up to: а б Д. Эндерс и Дж. Тибес (1993) Анна Либиха. хим. 173-177.
- ^ Ладенбург, А. (1 января 1886 г.). «Попытки синтезировать кониин». Отчеты Немецкого химического общества . 19 (1): 439–441. дои : 10.1002/cber.188601901108 . ISSN 0365-9496 .
- ^ Ладенбург, А. (1 июня 1907 г.). «Еще слово об изоконлине. 14. Сообщение об асимметричном азоте» . Отчеты Немецкого химического общества . 40 (3): 3734–3736. дои : 10.1002/cber.190704003170 . ISSN 0365-9496 .
- ^ Денич, Мария; Благоевич, Полина; Радулович, Нико (2013). «Синтетические подходы к кониину и другим 2-алкилпиперидинам» . Facta universitatis — серия: Физика, химия и технология . 11 (1): 1–26. дои : 10.2298/FUPCT1301001D .
- ^ Дильс и Алдер, Аннален , 1932, 498 , 16.
- ^ Г. Р. Клемо; Г. Р. Рэймидж (1932). «Октагидропирроколин». Журнал Химического общества : 2969–2973. дои : 10.1039/JR9320002969 .
- ^ Бер. , 1934, 67 , 1011.
- ^ Талапатра, Сунил Кумар; Талапатра, Бани (2015), Талапатра, Сунил Кумар; Талапатра, Бани (ред.), «Кониин, конгидрин и псевдоконгидрин (C-скелет, полученный из C8-жирной кислоты и N в результате трансаминирования)», Химия растительных натуральных продуктов: стереохимия, конформация, синтез, биология и медицина. , Спрингер, стр. 733–748, номер документа : 10.1007/978-3-642-45410-3_17 , ISBN. 978-3-642-45410-3
- ^ Бер. , 1917, 50 , 1192, 1386.
- ^ Теперь известно, что пеллетирин представляет собой 1-(2-пиперидинил)-2-пропанон; [ по мнению кого? ] см.: Индекс Merck , 15-е изд. (2013), с. 1314, [ оригинальное исследование? ] Монография 7181 , О'Нил: Королевское химическое общество. Доступно онлайн по адресу: http://www.rsc.org/Merck-Index/monograph/mono1500007181.
- ^ Бер. , 1932, 65 , 927.
- ^ Джордж Уильям Клаф (1918). «Взаимосвязь между оптическими вращательными способностями и относительными конфигурациями оптически активных соединений. Влияние некоторых неорганических галоидов на оптические вращательные способности α-гидроксикислот, α-аминокислот и их производных» . Журнал Химического общества, Сделки . 113 : 526–554. дои : 10.1039/CT9181300526 .
- ^ Ханде, Судхир М.; Каваи, Нобуюки; Уэниши, Дзюнъити (2 января 2009 г.). «Эффективный синтез 2- и 2,6-замещенных пиперидинов с использованием реакции переноса 1,3-хиральности, катализируемой PdII». Журнал органической химии . 74 (1): 244–253. дои : 10.1021/jo801926g . ISSN 0022-3263 . ПМИД 19012434 .
- ^ Лит, Эдвард. (1964). «Биосинтез алкалоидов болиголова. Включение ацетата-1-C». 14 на кониин и конгидрин» . Журнал Американского химического общества . 86 (12): 2509–2513. doi : 10.1021/ja01066a039 .
- ^ Хотти, Ханну; Сеппянен-Лааксо, Тууликки; Арвас, Микко; Теери, Теему Х.; Ришер, Хейко (2015). «Поликетидсинтазы болиголова ядовитого ( Conium maculatum L.)» . Журнал ФЭБС . 282 (21): 4141–4156. дои : 10.1111/февраль 13410 . ПМИД 26260860 .
- ^ Робертс, Маргарет Ф. (1978). «Отделение образования γ-коницеина и алифатических аминов от полученной активности в Conium maculatum» . Фитохимия . 17 (1): 107. Бибкод : 1978PChem..17..107R . дои : 10.1016/S0031-9422(00)89689-2 .
Дальнейшее чтение
[ редактировать ]- Грин, Бенедикт Т.; Ли, Стивен Т.; Пантер, Кип Э.; Браун, Дэвид Р. (2012). «Пиперидиновые алкалоиды: тератогены для человека и животных» (PDF) . Пищевая и химическая токсикология . 50 (6): 2049–2055. дои : 10.1016/j.fct.2012.03.049 . ПМИД 22449544 . Проверено 23 января 2017 г.