ингибитор c-Met
Ингибиторы c-Met представляют собой класс небольших молекул , которые ингибируют ферментативную активность тирозинкиназы -Met c , рецептора фактора роста гепатоцитов/фактора рассеяния (HGF/SF). Эти ингибиторы могут иметь терапевтическое применение при лечении различных типов рака. [ 1 ]
Многие ингибиторы c-Met в настоящее время [ когда? ] в клинических испытаниях . Кризотиниб [ 2 ] и кабозантиниб были первыми препаратами, одобренными FDA США . Кризотиниб получил ускоренное одобрение в 2011 году для лечения пациентов с местно-распространенным или метастатическим немелкоклеточным раком легкого , а кабозантиниб был одобрен в 2012 году для лечения медуллярного рака щитовидной железы. [ 3 ] а также начались клинические испытания по лечению нескольких других типов рака.
c-Met стимулирует рассеяние клеток, инвазию, защиту от апоптоза и ангиогенеза . [ 4 ] c-Met представляет собой рецепторную тирозинкиназу , [ 5 ] которые могут вызывать широкий спектр различных видов рака, таких как рак почек , желудка и мелкоклеточный рак легких , опухоли центральной нервной системы , а также некоторые саркомы. [ 6 ] когда его деятельность нарушена. Нацеливание на сайт связывания АТФ c-Met с помощью ингибиторов малых молекул является одной из стратегий ингибирования тирозинкиназы. [ 7 ]
История
[ редактировать ]
В начале 1980-х годов МЕТ был описан как белковый продукт трансформирующего онкогена . [ 9 ] [ 10 ]


Первоначальные попытки идентифицировать АТФ- конкурентные ингибиторы c-Met в 2002 году привели к открытию K252a , стауроспориноподобного ингибитора, который блокирует c-Met. [ 10 ] [ 11 ] K252a была первой структурой, которую удалось решить в комплексе с нефосфорилированным киназным доменом MET. Он образует две водородные связи между шарниром и пирралокарбазольной субъединицей. [ 8 ]
Позже была разработана серия более селективных ингибиторов c-Met, в которых ядро индолин-2-он (обведено на рисунке 1) присутствовало в нескольких ингибиторах киназ. SU-11274 был получен путем замены индолинона в 5-м положении. [ 9 ] а за счет добавления 3,5-диметилпиррольной группы образовался PHA-665752. [ 11 ] – ингибитор второго поколения с большей эффективностью и активностью. [ 10 ]
Интерес к этой области быстро возрос с 2007 года, и в середине 2009 года было опубликовано более 70 патентных заявок. [ 10 ]
Интенсивные усилия были предприняты в фармацевтической промышленности после того, как c-Met был признан подходящей мишенью для терапии рака. и без них , а в 2010 году было клинически протестировано около дюжины низкомолекулярных ингибиторов c-Met. 20 кристаллических структур с лигандами Опубликовано [ 12 ]
Введение
[ редактировать ]Рецепторные тирозинкиназы (RTK) являются жизненно важным элементом регуляции многих путей внутриклеточной передачи сигналов. [ 13 ] Мет-тирозинкиназа является рецептором фактора роста гепатоцитов (HGF), также известного как фактор рассеяния (SF). HGF в основном экспрессируется на эпителиальных клетках и мезенхимальных клетках , например гладкомышечных клетках и фибробластах . [ 10 ] [ 11 ] HGF обычно активен при заживлении ран, регенерации печени , эмбрионе и нормальном млекопитающих . развитии [ 10 ] органов Морфогенез . [ 11 ]
Нарушение регуляции c-Met может быть связано с гиперэкспрессией, амплификацией гена, мутацией , лиганд-зависимой ауто- или паракринной петлей или несвоевременной активацией RTK. [ 10 ] [ 13 ] Все эти факторы влияют на выживаемость клеток, их пролиферацию и подвижность. Они также приводят к раку и резистентности к терапии, направленной на их лечение. [ 13 ] Пациенты с аберрантной активностью c-Met обычно имеют плохой прогноз , агрессивное заболевание, повышенное метастазирование и сокращение выживаемости. [ 10 ] Вот почему воздействие на сигнальный путь HGF/c-MET не рассматривалось в качестве лечения рака. [ 10 ] [ 13 ] и несколько различных терапевтических подходов проходят клинические испытания. Для нацеливания на c-Met использовались различные подходы, каждый из которых фокусировался на одном из последовательных этапов, которые регулируют активацию c-Met антителами , пептидными агонистами , [ 4 ] [ 10 ] рецепторы-ловушки и другие биологические ингибиторы [ 14 ] или ингибиторы малых молекул. [ 10 ]
Структура и функции
[ редактировать ]

Подсемейство c-Met RTK отличается по структуре от многих других семейств RTK: зрелая форма имеет внеклеточную α-цепь (50 кДа) и трансмембранную β-цепь (140 кДа), которые связаны между собой дисульфидной связью. Бета-цепь содержит внутриклеточный тирозинкиназный домен и хвост на С-конце, который жизненно важен для стыковки субстратов и последующей передачи сигналов. [ 10 ] [ 17 ]
HGF является естественным лигандом с высоким сродством к Met. [ 10 ] [ 11 ] [ 17 ] происходит димеризация рецептора, а также аутофосфорилирование двух тирозинов . Его N-концевая область связывается с Met, и в петле активации (A-петли) киназного домена Met [ 10 ]
Фосфорилирование происходит в тирозинах вблизи С-конца, создавая многофункциональный сайт стыковки. [ 10 ] [ 18 ] который рекрутирует адаптерные белки и приводит к последующей передаче сигналов. Передача сигналов опосредована Ras/Mapk, PI3K/Akt, c-Src и STAT3/5 и включает пролиферацию клеток, снижение апоптоза, изменение функции цитоскелета и многое другое.
Киназный домен обычно состоит из двухдольной структуры, где доли соединены шарнирной областью, примыкающей к очень консервативному сайту связывания АТФ. [ 10 ]
Разработка
[ редактировать ]Используя информацию о сокристаллической структуре PHA-66752 и c-Met, был разработан селективный ингибитор PF-2341066. Замена ряда соединений 4-феноксихинолина на ацилтиомочевинную В 2010 году он проходил клинические испытания фазы I/II . группу привела к созданию соединений с активностью c-Met, например хинолина . [ 10 ] Это был ключевой шаг в разработке ингибитора c-Met, поскольку ацильное связывание дает концевой арильной группе способность проникать в глубокий гидрофобный карман и, таким образом, повышает эффективность соединений. Были найдены альтернативы ацилтиомочевинной связи, которые имеют пиримидоновую группу, как в AM7. [ 19 ]
AM7 и SU11274 предоставили первое доказательство того, что можно идентифицировать относительно селективные ингибиторы c-Met и что ингибирование приводит к противоопухолевому эффекту in vivo . При сравнении сокристаллических структур AM7 и SU11274 с c-Met оказалось, что они различны: SU-11274 связывается рядом с шарнирной областью с U-образной конформацией; но AM7 связывается с c-Met в расширенной конформации, которая охватывает область от шарнирной области до C-спирали. Затем он связывается в гидрофобном кармане. c-Met принимает неактивную, нефосфорилированную конформацию AM7, которая может связываться как с фосфорилированной, так и с нефосфорилированной конформацией киназы. [ 20 ]
Из-за этих двух разных типов связывания низкомолекулярные ингибиторы Met были разделены на два класса; класс I (подобный SU-11274) и класс II (подобный AM7). [ 20 ] Однако существует другой тип низкомолекулярных ингибиторов, который не вписывается ни в один из двух классов; ингибитор неконкурентный АТФ, который связывается иначе, чем два других. [ 21 ]
Низкомолекулярные ингибиторы различаются по селективности: они либо очень специфичны, либо обладают широкой селективностью. Они либо конкурентоспособны, либо неконкурентоспособны по версии ATP. [ 12 ]
АТФ-конкурентные низкомолекулярные ингибиторы c-Met
[ редактировать ]Несмотря на то, что эти два класса структурно различны, у них есть некоторые общие свойства: они оба связываются в шарнирной области киназы (хотя они занимают разные части активного сайта c-Met). [ 20 ] ), и все они стремятся имитировать пуриновую АТФ. BMS-777607 и PF-02341066 имеют 2-аминопиридиновую группу, AMG-458 имеет хинолиновую группу, а МК-2461 имеет трициклическую ароматическую группу. [ 22 ]
Класс I
[ редактировать ]Ингибиторы класса I имеют много разных структур. [ 12 ] относительно селективны и имеют U-образную конформацию [ 10 ] и связывается с петлей активации c-Met. [ 12 ]
Взаимосвязь структура-активность ингибиторов класса I
[ редактировать ]
Был открыт ряд триазолотриазинов, показавших большие перспективы в качестве ингибиторов c-MET. Взаимосвязь «структура-активность» (SAR) подразумевает необходимость наличия арильной группы, связанной с триазиновым кольцом, и соответствующего акцептора водородной связи (например, гидроксильной группы), прикрепленного к подвесному бензильному кольцу, но похоже, что фенол действует как шарнирное связующее (с Met1160). и что триазин взаимодействует с Tyr1230. [ 12 ] Был найден и исследован ряд подобных аналогов. Структурно сходная серия ингибиторов c-Met, в которых фенольный шарнирный элемент связан с ариламино-триазолопиридазином или арил-триазолотиапиридазином. Одноатомный линкер был более эффективным, чем двухатомный линкер, и такое замещение в бензильном положении, по-видимому, допускалось. соединения с гетероциклическими шарнирно-связывающими элементами (хинолин, пиридин , азаиндол), связанными с конденсированными азотплотными гетероароматическим соединениями (триазолопиридазинами, триазолопиразинами и триазолотриазинами). Описаны [ 12 ] Подробности см. на рисунке 4. [ 12 ]
Примеры ингибиторов класса I
[ редактировать ]JNJ-38877605 , который содержит дифторметиловый линкер и биодоступную хинолиновую группу, в 2010 году проходил клинические испытания фазы I для лечения распространенных и рефрактерных солидных опухолей. [ 12 ] Исследование было прекращено досрочно из-за почечной токсичности, вызванной метаболитами препарата. [ 23 ] [ 24 ]
PF-04217903 , АТФ-конкурентное и исключительно селективное соединение, имеет N-гидроксиэтилпиразольную группу, связанную с C-7 триазолопиразина . В 2010 году он проходил I фазу клинических испытаний. [ 12 ] [ нужно обновить ]
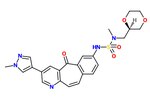
Был исследован SAR уникального каркаса ингибитора киназы с мощной ингибирующей активностью c-Met, МК-2461 . [ 25 ] Азот пиридина необходим для ингибирующей активности и снижения эффективности насыщения центрального кольца. [ 12 ] Планарность молекулы оказалась необходимой для максимальной эффективности. [ 25 ] Циклические эфиры уравновешивают приемлемую клеточную активность и фармакокинетические характеристики. Следующие элементы считаются ключевыми в процессе оптимизации:
1) Арильные группы в положении 7, как бы для максимизации гидрофобной упаковки и планарности,
2) Жесткий SAR при добавлении сульфонамидной группы и
3) Относительно плоский SAR групп, подвергающихся воздействию растворителей.
Часто онкогенные мутации c-Met вызывают устойчивость к низкомолекулярным ингибиторам. Поэтому аналог MK-2461 был протестирован против различных мутантов c-Met, но оказался не менее эффективным против них. Это дает молекуле большое преимущество при лечении опухолей, вызванных нарушением регуляции c-Met. [ 25 ] В 2010 году МК-2461 проходил I фазу испытаний с увеличением дозы. [ 12 ] [ нужно обновить ]
Класс II
[ редактировать ]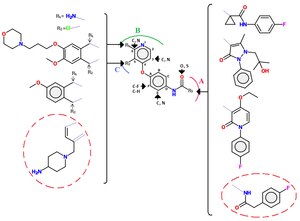
Ингибиторы класса II обычно не столь селективны, как ингибиторы класса I. [ 10 ] Группы мочевины также являются общей чертой ингибиторов класса II как в циклической, так и в ациклической форме. Ингибиторы класса II содержат ряд различных молекул, общий каркас которых можно увидеть на рисунке 4. [ 12 ]
Взаимосвязь структура-активность ингибиторов класса II
[ редактировать ]Были исследованы серии хинолиновых ингибиторов c-Met с ацилтиомочевинной связью. Было обнаружено множество серий аналогов с альтернативными шарнирными связывающими группами (например, заменой хинолиновой группы), заменой тиомочевинной связи (например, малонамид, оксаламид, пиразолоны) и ограничением структурного фрагмента ациклической ацилтиомочевины различными ароматическими гетероциклами. Дальнейшее уточнение включало блокировку p-положения подвесного фенильного кольца атомом фтора . [ 12 ] Пример взаимодействия между c-Met и небольшими молекулами (отмечены красным кружком) класса II: Каркас c-Met прикрепляется к АТФ-карману с помощью трех ключевых водородных связей, концевой амин взаимодействует с рибозным карманом. (АТФ) концевая 4-фторфенильная группа ориентирована в гидрофобном кармане, а роль шарнир-связывающей группы играет пирролотриазин. [ 12 ]
Примеры ингибиторов класса II
[ редактировать ]В клинических исследованиях фазы II GSK 1363089 (XL880, фортиниб) хорошо переносился. Это приводило к незначительному регрессу или стабилизации заболевания у больных папиллярным раком почки и низкодифференцированным раком желудка. [ 12 ]
AMG 458 представляет собой мощный низкомолекулярный ингибитор c-MET, который, как было доказано, обладает более чем 100-кратной селективностью в отношении c-MET по группе из 55 киназ. Кроме того, AMG 458 был на 100% биодоступен у разных видов, а собственный период полураспада увеличивался у высших млекопитающих. [ 12 ]
Неконкурентные АТФ низкомолекулярные ингибиторы c-Met
[ редактировать ]Тивантиниб
[ редактировать ]
Эта статья , по-видимому, противоречит статье Тивантиниб . ( ноябрь 2015 г. ) |
Тивантиниб (ARQ197) представляет собой селективный биодоступный пероральный препарат. [ 17 ] [ 21 ] клинически усовершенствованный низкомолекулярный и хорошо переносимый ингибитор c-MET, который в настоящее время [ когда? ] в клинических исследованиях фазы III у пациентов с немелкоклеточным раком легких . [ 21 ] ARQ197 представляет собой не-АТФ-конкурентный ингибитор аутофосфорилирования c-MET с высокой селективностью в отношении нефосфорилированной конформации киназы. [ 17 ] [ 21 ] Тивантиниб отсекает взаимодействия между ключевыми каталитическими остатками. [ 21 ] Структура тивантиниба в комплексе с киназным доменом c-Met показывает, что ингибитор связывает конформацию, отличную от опубликованных киназных структур. Тивантиниб сильно ингибирует аутоактивацию c-Met, избирательно нацеливаясь на неактивную форму киназы между N- и C-долями и занимая сайт связывания АТФ. [ 21 ]
Клинические испытания и одобрения регулирующих органов
[ редактировать ]Статус по состоянию на 2010 г.
[ редактировать ]С момента открытия Met и HGF большой исследовательский интерес сосредоточился на их роли в развитии рака. Путь Met является одним из наиболее часто нарушаемых путей при раке человека. [ 17 ] Более глубокое понимание способов связывания и структурного дизайна приближает нас к использованию других белковых взаимодействий и карманов связывания, создавая ингибиторы с альтернативными структурами и оптимизированными профилями. [ 10 ]
По состоянию на 2010 год [update] более дюжины ингибиторов Met-пути с различными профилями селективности киназ, от высокоселективных до многоцелевых, [ 12 ] были изучены в клинике и достигнут хороший прогресс [ 17 ] (См. таблицу 1). (например, XL184 (Кабозантиниб), XL880 , ARQ197 ) [ нужно обновить ]
Использование ингибиторов c-Met с другими терапевтическими агентами может иметь решающее значение для преодоления потенциальной резистентности, а также для улучшения общей клинической пользы. Ингибиторы Met-пути можно использовать в сочетании с другими методами лечения, включая химио- , радио- или иммунотерапию, а также с другими ингибиторами Met-пути, например. в сочетании с биологическими антагонистами HGF и Met или антителами против HGF и MET. [ 17 ] Тем не менее, риск накопленной токсичности и взаимодействия с другими лекарственными средствами остается. [ 10 ]
С 2010 года
[ редактировать ]одобрило препарат PF-02341066 (теперь называемый кризотиниб) В 2011 году FDA США для лечения некоторых видов немелкоклеточного рака легких .
В 2012 году XL184/кабозантиниб получил одобрение FDA для лечения медуллярного рака щитовидной железы , а в 2016 году он получил одобрение FDA и ЕС для лечения рака почки.
Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( июнь 2018 г. ) |
Исследования других ингибиторов
[ редактировать ]Тепотиниб (MSC 2156119J), [ 26 ]
сообщила о результатах II фазы клинических испытаний рака легких. [ 27 ] присвоило тепотинибу статус революционной терапии . США В сентябре 2019 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) [ 28 ] Ему был присвоен статус орфанного препарата в Японии в ноябре 2019 года и в Австралии в сентябре 2020 года. [ 29 ]
См. также
[ редактировать ]- Мезенхимально-эпителиальный переход
- Фактор роста гепатоцитов
- К252а
- Эпителиально-мезенхимальный переход
- c-Met
Внешние ссылки
[ редактировать ]Ссылки
[ редактировать ]- ^ Лю X, Ньютон Р.К., Шерле П.А. (сентябрь 2011 г.). «Разработка ингибиторов пути c-MET». Экспертное заключение по исследованию наркотиков . 20 (9): 1225–41. дои : 10.1517/13543784.2011.600687 . ПМИД 21740293 . S2CID 24415851 .
- ^ Казанджян, Д; и др. (октябрь 2014 г.). «Краткий обзор одобрения FDA: кризотиниб для лечения метастатического немелкоклеточного рака легких с перестройками киназы анапластической лимфомы» . Онколог . 19 (10): e5-11. doi : 10.1634/теонколог.2014-0241 . ПМК 4201002 . ПМИД 25170012 .
- ^ «FDA одобрило препарат Cometriq для лечения редкого типа рака щитовидной железы» . Управление по контролю за продуктами и лекарствами . 29 ноября 2012 г.
- ^ Перейти обратно: а б Комольо П.М., Джордано С., Трусолино Л. (июнь 2008 г.). «Разработка лекарственных средств ингибиторов МЕТ: борьба с онкогенной зависимостью и целесообразность». Nature Reviews Открытие лекарств . 7 (6): 504–16. дои : 10.1038/nrd2530 . ПМИД 18511928 . S2CID 24601127 .
- ^ Маулик Г., Шриханде А., Кидзима Т., Ма ПК, Моррисон П.Т., Салгия Р. (февраль 2002 г.). «Роль рецептора фактора роста гепатоцитов c-Met в онкогенезе и потенциал терапевтического ингибирования». Цитокиновый фактор роста Rev. 13 (1): 41–59. дои : 10.1016/S1359-6101(01)00029-6 . ПМИД 11750879 .
- ^ Дэвис И.Дж., Макфадден А.В., Чжан Ю., Коксон А., Берджесс Т.Л., Вагнер А.Дж., Фишер Д.Е. (январь 2010 г.). «Идентификация рецептора тирозинкиназы c-Met и его лиганда, фактора роста гепатоцитов, как терапевтических мишеней при светлоклеточной саркоме» . Рак Рез . 70 (2): 639–45. дои : 10.1158/0008-5472.CAN-09-1121 . ПМЦ 2807989 . ПМИД 20068147 .
- ^ Портер Дж., Ламб С., Франклин Р.Дж., Гаскон-Симорте Дж.М., Кальмиано М., Риш К.Л., Лаллеманд Б., Кейертс Дж., Эдвардс Х., Мэлони А., Дельгадо Дж., Кинг Л., Фоли А., Леконт Ф., Реуберсон Дж., Мейер С., Бэтчелор М. (май 2009 г.). «Открытие 4-азаиндолов как новых ингибиторов киназы c-Met». Биоорг. Мед. хим. Летт . 19 (10): 2780–4. дои : 10.1016/j.bmcl.2009.03.110 . ПМИД 19369077 .
- ^ Перейти обратно: а б Ширинг Н., Кнапп С., Маркони М., Флокко М.М., Куи Дж., Перего Р., Рускони Л., Кристиани С. (октябрь 2003 г.), «Кристаллическая структура тирозинкиназного домена рецептора фактора роста гепатоцитов c-Met и его комплекса с микробный алкалоид К-252а", Учеб. Натл. акад. наук. США , 100 (22): 12654–12659, Bibcode : 2003PNAS..10012654S , doi : 10.1073/pnas.1734128100 , PMC 240673 , PMID 14559966
- ^ Перейти обратно: а б Саттлер М., Прайд Ю.Б., Ма П., Грамлих Дж.Л., Чу С.К., Куиннан Л.А., Ширазиан С., Лян С.Х., Подар К., Кристенсен Дж.Г., Салгия Р. (сентябрь 2003 г.), «Новая малая молекула-ингибитор Met индуцирует апоптоз в клетках, трансформированных онкогенная тирозинкиназа TPR-MET», Cancer Research , 63 (17): 5462–5469, PMID 14500382
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в Porter, J (February 2010), "Small molecule c-Met kinase inhibitors: a review of recent patents", Expert Opinion on Therapeutic Patents , 20 (2): 159–177, doi : 10.1517/13543770903514137 , PMID 20100000 , S2CID 22743228
- ^ Перейти обратно: а б с д и Кристенсен Дж.Г., Шрек Р., Берроуз Дж., Куруганти П., Чан Э., Ле П., Чен Дж., Ван XY, Руслим Л., Блейк Р., Липсон К.Э., Рамфал Дж., До С., Куи Дж.Р., Черрингтон Дж.М., Мендель Д.Б. (ноябрь 2003 г.) ), «Селективный низкомолекулярный ингибитор киназы c-Met ингибирует c-Met-зависимые фенотипы in vitro и проявляет циторедуктивную противоопухолевую активность in vivo», Cancer Research , 63 (21): 7345–55, PMID 14612533
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в Ундеринер Т.Л., Гербертц Т., Микнёчки С.Дж. (январь 2010 г.), «Открытие малых молекул ингибиторов c-Met: эволюция и профили клинических кандидатов», Противораковые агенты в медицинской химии , 10 (1): 7–27, doi : 10.2174/1871520611009010007 , PMID 20015007
- ^ Перейти обратно: а б с д Саттлер М., Салгия Р. (апрель 2009 г.), «Ось Met как терапевтическая мишень», Обновленная информация о терапии рака , 3 (3): 109–118, doi : 10.1016/j.uct.2009.01.001 , PMC 2847295 , PMID 20368753
- ^ Кристенсен Дж.Г.; Берроуз Дж; Салгия Р. (июль 2005 г.), «c-Met как мишень для рака человека и характеристика ингибиторов для терапевтического вмешательства», Cancer Letters , 225 (1): 1–26, doi : 10.1016/j.canlet.2004.09.044 , PMID 15922853
- ^ Кнудсен Б.С., Вауде Г.В. (февраль 2008 г.), «Лекарственные средства против c-MET-зависимого рака», Current Opinion in Genetics & Development , 18 (1): 87–96, doi : 10.1016/j.gde.2008.02.001 , ПМИД 18406132
- ^ Дональд П. Боттаро; Меган Пич; Марец Никлаус; Терренс Берк-младший; Гагани Атауда; Сара Чойк; Алессио Гибеллино; Нелли Тан; Чжэнь-Дан Ши (август 2011 г.), «Композиции и способы ингибирования передачи сигналов c-Met рецептора фактора роста гепатоцитов», публикация заявки на патент США.
- ^ Перейти обратно: а б с д и ж г Лю XD, Newton RC, Scherle PA (январь 2010 г.), «Разработка ингибиторов пути c-MET для терапии рака: прогресс и проблемы», Trends in Molecular Medicine , 16 (1): 37–45, doi : 10.1016/j.molmed .2009.11.005 , PMID 20031486
- ^ Кунг П.П., Фанк Л., Мэн Дж., Алтон Дж., Падрик Э., Мрочковски Б. (июнь 2008 г.), «Взаимосвязь между структурой и активностью хинолинсодержащих ингибиторов c-Met», Европейский журнал медицинской химии , 43 (8): 1321–1329 , doi : 10.1016/j.ejmech.2007.08.011 , PMID 17964000
- ^ Беллон СФ; Каплан-Лефко П; Ян Ю.Дж.; Чжан Ю.Х.; Моригучи Дж; Рекс К; Джонсон CW; Роза ПЭ; Длинный AM; О'Коннор AB; Парень; Коксон А; Ким Т.С.; Таскер А; Берджесс Т.Л.; Дюссо I (февраль 2008 г.), «Ингибиторы c-Met с новым способом связывания проявляют активность против нескольких наследственных мутаций, связанных с папиллярной почечно-клеточной карциномой», Journal of Biological Chemistry , 283 (5): 2675–2683, doi : 10.1074/jbc. М705774200 , ПМИД 18055465
- ^ Перейти обратно: а б с Дюссо I, Беллон С.Ф. (февраль 2009 г.), «От концепции к реальности: долгий путь к ингибиторам тирозинкиназы рецепторов c-Met и RON для лечения рака», Противораковые агенты в медицинской химии , 9 (2): 221 –229, doi : 10.2174/187152009787313792 , PMID 19199866
- ^ Перейти обратно: а б с д и ж Этирадж С., Пальма Р., Волкова Э., Хирши М., Франс Д.С., Эшвелл М.А., Чан Т.С. (июнь 2011 г.), «Открытие нового режима ингибирования протеинкиназы, характеризующегося механизмом ингибирования фактора мезенхимально-эпителиального перехода человека (c -Met) Аутофосфорилирование белка с помощью ARQ 197», Journal of Biological Chemistry , 286 (23): 20666–20676, doi : 10.1074/jbc.M110.213801 , PMC 3121448 , PMID 21454604
- ^ Аллен Дж.В., Барделл С., Блейдс К., Баттар Д., Чепмен Л., Колклаф Н., Доссеттер А.Г., Гарнер А.П., Гирдвуд А., Ламберт С., Лиш А.Г., Лоу Б, Майор Дж., Плант Х., Слейтер А.М. (сентябрь 2011 г.), " Открытие бензанилидов в качестве ингибиторов тирозинкиназы рецептора c-Met с помощью подхода направленного скрининга», Bioorganic & Medicinal Chemistry Letters , 21 (18): 5224–5229, doi : 10.1016/j.bmcl.2011.07.047 , PMID 21835616
- ^ Лолкема, Мартин П.; Богетс, Хильда Х.; Аркенау, Хендрик-Тобиас; Лампо, Энн; Барале, Эрио; де Йонге, Майя Х.А.; ван Доорн, Лени; Хеллеманс, Питер; де Боно, Иоганн С.; Эскенс, Ферри АЛМ (15 мая 2015 г.). «Ингибитор тирозинкиназы c-Met JNJ-38877605 вызывает почечную токсичность за счет образования видоспецифичных нерастворимых метаболитов» . Клинические исследования рака . 21 (10): 2297–2304. дои : 10.1158/1078-0432.CCR-14-3258 . ISSN 1557-3265 . ПМЦ 4433755 . ПМИД 25745036 .
- ^ Johnson & Johnson Pharmaceutical Research & Development, LLC (07 марта 2013 г.). «Исследование фазы I для определения безопасности, фармакокинетики и фармакодинамики селективного ингибитора Met JNJ-38877605 у субъектов с распространенными или рефрактерными солидными опухолями» . Орто Биотех, Инк.
- ^ Перейти обратно: а б с Кац Дж.Д., Джуэлл Дж.П., Герин Д.Д., Лим Дж., Динсмор С.Дж., Дешмук С.В., Пан Б.С., Маршалл К.Г., Лу В., Альтман М.Д., Дальберг В.К., Дэвис Л., Фальконе Д., Габарда А.Е., Ханг Г.З., Хэтч Х., Холмс Р. , Куни К., Ламб К.Дж., Луттербах Б., Матвинк Р., Назеф Н., Патель С.Б., Цюй XL, Рейли Дж.Ф., Рикерт К.В., Розенштейн С., Суассон С.М., Спенсер К.Б., Шевчак А.А., Уокер Д., Ван В.С., Янг Дж., Зенг QW (июнь 2011 г.), «Открытие 5H-бензо[4,5]циклогепта[1,2-b]пиридин-5-она (MK-2461) ингибитора c-Met киназы для лечения рака», журнал медицинской химии , 54 (12): 4092–4108, doi : 10.1021/jm200112k , PMID 21608528 , S2CID 5293187
- ^ Тепотиниб с гефитинибом у пациентов с местно-распространенным или метастатическим немелкоклеточным раком легких (НМРЛ) (INSIGHT)
- ^ Испытание фазы II ингибитора c-Met тепотиниба при распространенной аденокарциноме легких с мутациями пропуска экзона 14 MET. 2017 год
- ^ «Прорывная терапия тепотинибом» . Merck KGaA, Дармштадт, Германия (Пресс-релиз). 11 сентября 2019 года . Проверено 8 ноября 2020 г.
- ^ «Орфанное лекарственное средство» . Merck KGaA, Дармштадт, Германия (Пресс-релиз). 20 ноября 2019 г. Проверено 8 ноября 2020 г.
