5- HT3 антагонист
| 5-НТ 3 Антагонист рецептора | |
|---|---|
| Класс препарата | |
 | |
| Идентификаторы классов | |
| Использовать | Тошнота и рвота |
| код АТС | А04АА |
| Биологическая цель | 5-HT3 - рецептор |
| Клинические данные | |
| Drugs.com | Классы наркотиков |
| Отчеты потребителей | Лучшая покупка лекарств |
| Внешние ссылки | |
| МеШ | D058831 |
| Юридический статус | |
| В Викиданных | |
Антагонисты 5-HT3 , класс известные как « сетроны », представляют собой препаратов , которые действуют как антагонисты рецептора 5- HT3 неофициально , подтипа серотонина рецептора , обнаруженного в окончаниях блуждающего нерва и в определенных областях мозг. За заметным исключением алосетрона и цилансетрона , которые используются при лечении синдрома раздраженного кишечника , все 5-НТ 3 антагонисты являются противорвотными средствами , используемыми для профилактики и лечения тошноты и рвоты. Они особенно эффективны в борьбе с тошнотой и рвотой, вызванными химиотерапией рака , и считаются золотым стандартом для этой цели. [1]
Антагонисты 5-НТ3 можно идентифицировать по суффиксу -сетрон , [2] и классифицируются под кодом A04AA ВОЗ - Анатомо терапевтической химической системы классификации .
Медицинское использование
[ редактировать ]Антагонисты 5-HT3 наиболее эффективны в профилактике и лечении тошноты и рвоты, вызванных химиотерапией (CINV), особенно вызванных высокоэметогенными препаратами, такими как цисплатин ; при использовании с этой целью их можно назначать отдельно или, что чаще, вместе с глюкокортикоидами , обычно дексаметазоном . Обычно их вводят внутривенно , незадолго до введения химиотерапевтического препарата. [3] хотя некоторые авторы утверждают, что пероральное введение может быть предпочтительным. [4] Одновременное применение NK 1 антагонистов рецепторов , таких как апрепитант , значительно повышает эффективность антагонистов 5-HT 3 в предотвращении как острой, так и отсроченной CINV. [5]
Антагонисты 5-HT 3 также показаны для профилактики и лечения радиационной тошноты и рвоты (RINV), когда это необходимо, и послеоперационной тошноты и рвоты (PONV). Хотя они более эффективны при контроле CINV (полностью купируют симптомы у 70% людей и уменьшают их у оставшихся 30%), они так же эффективны, как и другие средства для лечения PONV.
Имеющиеся данные свидетельствуют о том, что антагонисты 5-HT3 неэффективны в борьбе с морской болезнью . [6] [7] [8] Рандомизированное плацебо-контролируемое исследование ондансетрона для лечения морской болезни у персонала санитарной авиации показало субъективное улучшение, но оно не было статистически значимым . [9]
Доступные агенты
[ редактировать ]- Ондансетрон был первым антагонистом 5-HT3 , разработанным компанией Glaxo примерно в 1984 году. Его эффективность была впервые установлена в 1987 году на животных моделях. [10] [11] и в последующие годы он был тщательно изучен. [12] Ондансетрон был одобрен Управлением по контролю за продуктами и лекарствами США в 1991 году и с тех пор стал доступен в ряде других стран, включая Великобританию, Ирландию, Австралию, Канаду, Францию и Бразилию. По состоянию на 2008 год ондансетрон и гранисетрон являются единственными антагонистами 5-НТ3, доступными в качестве непатентованных препаратов в США. Ондансетрон можно назначать несколько раз в день, в зависимости от тяжести симптомов.
- Трописетрон также был впервые описан в 1984 году. [13] Он доступен в нескольких странах, таких как Великобритания, Австралия и Франция, но не в США. Эффект трописетрона длится до 24 часов, поэтому его необходимо принимать только один раз в день.
- Гранисетрон был разработан примерно в 1988 году. [14] Он доступен в США, Великобритании, Австралии и других странах. Клинические испытания показывают, что он более эффективен, чем другие антагонисты 5-HT3 , в предотвращении отсроченной CINV (тошнота и рвота, возникающие более чем через 24 часа после первой дозы химиотерапии). [15] Его принимают один раз в день.
- Доласетрон впервые был упомянут в литературе в 1989 году. [16] Это пролекарство , и большая часть его эффектов обусловлена его активным метаболитом гидродоласетроном , который образуется в печени под действием фермента карбонилредуктазы . Доласетрон был одобрен FDA в 1997 году и также назначается один раз в день.
- Палоносетрон — новейший антагонист 5-HT3, появившийся на рынке США. Это производное изохинолина , эффективно предотвращающее отсроченную CINV. [17] Палоносетрон был одобрен FDA в 2003 году. [18] первоначально для внутривенного применения . Пероральная форма была одобрена 22 августа 2008 г. только для профилактики острой CINV, поскольку крупное клиническое исследование не показало, что пероральное введение так же эффективно, как внутривенное применение, против отсроченной CINV. [19]
- По состоянию на 2008 год Рамосетрон доступен только в Японии и некоторых странах Юго-Восточной Азии . [20] Он имеет более высокое сродство к рецептору 5-HT3, чем более старые антагонисты 5-HT3 , и сохраняет свое действие в течение двух дней; поэтому он значительно более эффективен при отсроченной CINV. [21] В исследованиях на животных рамосетрон также оказался эффективен против синдрому раздраженного кишечника . симптомов, подобных [22]
Алосетрон и цилансетрон (последний был разработан Solvay , но никогда не одобрен FDA) не являются противорвотными средствами; вместо этого они показаны для лечения синдрома раздраженного кишечника, при котором диарея является доминирующим симптомом. Алосетрон был снят с рынка США в 2000 году из-за неприемлемо частых тяжелых побочных эффектов, включая ишемический колит , и доступен только в рамках ограничительной программы для пациентов, отвечающих определенным требованиям. [23]
Некоторые прокинетические препараты, такие как цизаприд , рензаприд и метоклопрамид , хотя и не являются собственно антагонистами 5-HT3 , обладают некоторым слабым антагонистическим действием на 5-HT3 - рецептор. Галанолактон , дитерпеноид, обнаруженный в имбире , является антагонистом 5-HT3 и , как полагают, по крайней мере частично опосредует противорвотную активность этого растения. [24] [25] Миртазапин представляет собой тетрациклический антидепрессант с антагонистическим действием 5-HT 2 и 5-HT 3 , который также обладает сильными противорвотными свойствами, однако он также обладает сильным седативным действием. Исследования показывают, что миртазапин столь же эффективен при лечении тошноты и рвоты, связанных с химиотерапией, как и стандартные методы лечения; он также дешевле и имеет меньше побочных эффектов, чем типичные противорвотные средства, а его антидепрессивные свойства могут быть дополнительным преимуществом для больных раком. [26] Миртазапин также использовался при лечении гастропареза, нарушения моторики , из-за его противорвотного действия. [27] Оланзапин , атипичный антипсихотик с противорвотными свойствами, аналогичными свойствам миртазапина, также перспективен в лечении тошноты и рвоты, вызванных химиотерапией. [26]
Побочные эффекты
[ редактировать ]небольшое количество побочных эффектов При использовании антагонистов 5-НТ3 наблюдается ; наиболее распространенными являются запор или диарея , головная боль и головокружение . [28] В отличие от антигистаминных препаратов с противорвотными свойствами, таких как циклизин , антагонисты 5-HT3 не вызывают седативного эффекта и не вызывают экстрапирамидных эффектов , как иногда это делают фенотиазины (такие как прохлорперазин ).
Все антагонисты 5-HT3 были связаны с бессимптомными изменениями электрокардиограммы , такими как удлинение интервалов PT и QTc и некоторые аритмии . [28] Клиническое значение этих побочных эффектов неизвестно.
Фармакология
[ редактировать ]Механизм действия
[ редактировать ]Рецепторы 5-HT3 присутствуют в нескольких критических участках, участвующих в рвоте, включая блуждающего нерва афференты , ядро одиночного тракта (STN) и саму постремную область. Серотонин высвобождается энтерохромаффинными клетками тонкой кишки в ответ на химиотерапевтические агенты и может стимулировать афференты блуждающего нерва (через 5-НТ3 - рецепторы), вызывая рвотный рефлекс. Антагонисты рецепторов 5-HT3 подавляют рвоту и тошноту, ингибируя связывание серотонина с рецепторами 5- HT3 . Самая высокая концентрация 5-HT3 - рецепторов в центральной нервной системе ( ЦНС ) обнаруживается в STN и триггерной зоне хеморецепторов (CTZ), а антагонисты 5-HT3 могут также подавлять рвоту и тошноту, действуя в этих местах. [29] Антагонисты 5-HT3 очень селективны и имеют малое сродство к другим рецепторам, таким как дофаминовые , гистаминовые и мускариновые рецепторы ацетилхолина . [28]
Фармакокинетика
[ редактировать ]Все антагонисты 5-HT3 хорошо всасываются и эффективны после перорального применения. [4] [28] и все они метаболизируются в печени различными изоферментами системы цитохрома P450 . Однако они не ингибируют и не индуцируют эти ферменты. [28]
Сравнительная фармакология
[ редактировать ]Несмотря на то, что антагонисты рецептора 5-HT 3 имеют общий механизм действия , они имеют различную химическую структуру и демонстрируют различия в сродстве к рецептору , реакции на дозу и продолжительности эффекта. они также Метаболизируются по-разному, то есть цитохрома Р450 ( CYP ). преобладают разные компоненты системы в метаболизме антагонистов [30]
По этой причине пациенты, резистентные к одному антагонисту, могут получить пользу от другого. Существует корреляция между количеством активных аллелей CYP 2D6 и количеством эпизодов рвоты у пациентов, получающих лечение цисплатином и ондансетроном или трописетроном . Пациенты с множественными аллелями, как правило, не реагируют на противорвотные препараты, и наоборот. [31]
| Лекарство | Химическая природа |
Антагонисты рецепторов | Т 1/2 (ч) | Метаболизм | Доза |
|---|---|---|---|---|---|
| Ондансетрон | карбазола Производное | Антагонист рецептора 5-HT 3 и слабый 5-HT 4 антагонист | 3,9 часа | CYP1A1 / 2 , CYP2D6 , CYP 3A3/ 4 / 5 | 150 мкг/кг |
| Гранисетрон | Индазол | 5-НТ 3 Антагонист рецептора | 9–11,6 часов | CYP3A3/ 4 / 5 | 10 мкг/кг |
| Доласетрон | Индол | 5-НТ 3 Антагонист рецептора | 7–9 часов | CYP 3A3/ 4 / 5 , CYP2D6 | 600 – 3000 мкг/кг |
| Палоносетрон | изохинолин | 5-HT3 ; антагонист рецептора самое высокое сродство к рецептору 5-НТ 3 в этом классе | 40 часов | CYP1A2 , CYP2D6 , CYP3A3/ 4 / 5 [32] | доза 0,25 мг |
| Рамосетрон | бензимидазола Производное | 5-НТ 3 Антагонист рецептора | 5,8 часов | 300 мкг/кг | |
| Трописетрон [30] | Индол | 5-НТ 3 Антагонист рецептора | 5,6 часов | CYP 3A3/ 4 / 5 , CYP2D6 | 200 мкг/кг |
| Вортиоксетин (Тринтелликс) | Индол | 5-HT3 - Антагонист рецепторов Антидепрессант | 66 часов | CYP 2D6/ 2A6 / CYP2B6 / CYP2C8/9 , CYP2C19 | Дозы 5 мг, 10 мг, 20 мг |
История
[ редактировать ]История антагонистов рецепторов 5-HT3 началась в 1957 году, когда Джон Гаддум и Зулейка П. Пикарелли из Эдинбургского университета предположили существование двух подтипов рецепторов серотонина, рецепторов M и D (названных так потому, что их функцию можно блокировать). морфином . и дибензилином соответственно) [33] Позже было обнаружено, что рецептор 5-НТ 3 соответствует рецептору М. [34] В 1970-х годах Джон Фозард обнаружил, что метоклопрамид и кокаин являются слабыми антагонистами рецептора 5-НТ 3 (5-НТ-М). Позже Фозар и Морис Гиттос синтезировали MDL 72222, первый мощный и по-настоящему селективный антагонист 5-HT3 - рецепторов. [35] [36] Было обнаружено, что противорвотное действие метоклопрамида частично обусловлено его антагонизмом к серотонину. [30]
Пока Фозар исследовал аналоги кокаина, исследователи из компании Sandoz выявили мощный селективный антагонист 5-HT 3 первые поступившие на рынок селективные 5-HT 3 антагонисты рецепторов ондансетрон и гранисетрон рецепторов ICS 205-930, на основе которого были разработаны и одобрены в 1991 и 1993 годах . . [35] [37] Было синтезировано несколько соединений, родственных MDL 72222, что в конечном итоге привело к одобрению трописетрона в 1994 году и доласетрона в 1997 году. [37] В 2003 году был одобрен новый улучшенный антагонист 5-НТ3 - рецепторов, названный палоносетрон. [37] Разработка селективных антагонистов 5-HT3 - рецепторов привела к значительному улучшению лечения тошноты и рвоты. [30] Ондансетрон, гранисетрон, доласетрон и палоносетрон в настоящее время одобрены в США и составляют краеугольный камень терапии для контроля острой рвоты химиотерапевтическими агентами с умеренным и высоким эметогенным потенциалом. [38]
Разработка
[ редактировать ]Антагонисты рецепторов 5-HT 3 серотонина или антагонисты были впервые представлены в начале 1990-х годов и стали наиболее широко используемыми противорвотными препаратами в химиотерапии . [29] Они также доказали свою безопасность и эффективность при лечении послеоперационной тошноты и рвоты . [30] Серотонин (5-НТ) широко распространен в кишечнике и центральной нервной системе . В кишечнике 5-НТ обнаруживается главным образом в слизистой оболочки энтерохромаффинных клетках . Энтерохромаффинные клетки являются сенсорными преобразователями, которые высвобождают 5-HT для активации внутренних (через 5-HT1P и 5-HT 4 рецепторы) и внешних (через 5-HT 3 рецепторы) первичных афферентных нервов . [39] Было обнаружено, что химиотерапевтические препараты для лечения злокачественных заболеваний, вызывающих рвоту, вызывают высвобождение большого количества серотонина из энтерохромаффинных клеток кишечника, серотонин действует на 5-HT3 - рецепторы в кишечнике и стволе мозга. [39]
Дизайн лекарств
[ редактировать ]Эксперименты показали, что сайт связывания лиганда расположен на границе раздела двух соседних субъединиц. [40] Сайт связывания лиганда образован тремя петлями (AC) из основной лигандсвязывающей субъединицы (основная грань) и тремя β-нитями (DF) из соседней субъединицы (комплементарная грань). [34] [41] Аминокислотный остаток E129 в петле A обращен в карман связывания и образует критическую водородную связь с гидроксильной группой 5-HT. Петля B содержит W183, критический остаток, связывающий лиганд триптофана , который способствует катион-π-взаимодействию между пи- электронной плотностью триптофана и первичным амином 5-HT. Остатки петли C рассматривались как кандидаты на различную фармакологию рецепторов грызунов из и человека 5-HT3 - -за их расхождения между видами. Наиболее важным ароматическим остатком в петле C, вероятно, является Y234, который расположен напротив триптофана петли B в лигандсвязывающем кармане и участвует в связывании лиганда. Петли D и F на самом деле являются β-нитями, а не петлями. W90 в петле D имеет решающее значение для связывания лиганда, и антагонисты могут напрямую связываться с R92. Азабициклическое кольцо конкурентного антагониста гранисетрона расположено вблизи W183, образуя катион-пи-взаимодействие. [42] Остатки петли E Y143, G148, E149, V150, Q151, N152, Y153 и K154 могут быть важны для связывания гранисетрона. Структура петли F еще не выяснена, но W195 и D204, по-видимому, имеют решающее значение для связывания лиганда. [34]
| 5- HT3 Антагонисты рецепторов | Сродство связывания (K d , Ki , K 50 ) | Разновидность |
|---|---|---|
| Трописетрон | 11 нМ | Человек |
| Гранисетрон | 1,44 нМ | Человек |
| Ондансетрон | 4,9 нМ | Человек |
| Палоносетрон | 31,6 нМ | Кора головного мозга крысы, подвздошно-миентеральное сплетение кролика, подвздошное сплетение морской свинки |
| Доласетрон | 20,03 нМ | ОФ 108-15 |
| Метоклопрамид (неселективный) | 355 нМ | Человек |
| Кокаин | 2,45-83 нМ | Крыса-кролик |
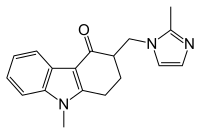

первого поколения Химические структуры антагонистов рецепторов 5-HT 3 можно разделить на три основных класса. [30]
- Производные карбазола (ондансетрон)
- Индазолы (гранисетрон)
- Индолы ( Трописетрон и Доласетрон )
-рецепторов первого поколения Антагонисты 5- HT3 (ондансетрон, доласетрон , гранисетрон и трописетрон ) являются наиболее важными препаратами в противорвотной терапии при эметогенной химиотерапии . Они особенно эффективны при лечении острой рвоты , возникающей в первые 24 часа после химиотерапии . [38] Новый препарат палоносетрон представляет собой фармакологически отличный и высокоселективный антагонист 5-НТ3-рецепторов второго поколения . [44] Палоносетрон имеет два стереогенных центра и существует в виде четырех стереоизомеров . [44] Палоносетрон имеет более длительный период полувыведения (40 часов) и большую аффинность связывания с рецепторами (более чем в 30 раз по сравнению с антагонистами первого поколения). [38]
Фармакофор
[ редактировать ]
Фармакофор рецепторов 5-НТ3 - состоит из трех компонентов: карбонилсодержащего связывающего фрагмента, ароматического / гетероароматического кольца и основного центра. Карбонильная группа копланарна ароматическому кольцу . Антагонисты рецептора 5-HT3 с большей вероятностью связываются в протонированной форме. [45] Стыковка ряда антагонистов с моделью гомологии 5-НТ 3 сайта связывания рецептора демонстрирует достаточно хорошее согласие с фармакофорной моделью и подтверждает наблюдаемые различия между видами. Исследования гранисетрона в связывающем кармане показали, что ароматические кольца гранисетрона расположены между W183 и Y234, а азабициклическое кольцо - между W90 и F226. В этом исследовании было идентифицировано другое энергетически выгодное расположение гранисетрона, ближе к мембране, в положении, которое может быть частью пути связывания/развязывания лиганда. Аналогично расположенный альтернативный сайт связывания гранисетрона был впоследствии идентифицирован в другом исследовании рецептора 5- HT3 . [43]
Отношения структура-деятельность
[ редактировать ]
5-HT3 имеют Антагонисты рецепторов один и тот же фармакофор . [43] Ароматический фрагмент (предпочтительно индол), связывающая ацильная группа, способная к взаимодействиям с водородными связями , и основной амин ( азот ) можно рассматривать как ключевые фармакофорные элементы известных антагонистов 5-НТ 3 -рецептора. Существуют стерические ограничения ароматического сайта связующей группе возможны два взаимодействия водородных связей связывания, и хотя на гетероциклической (оксадиазол, способный принимать две водородные связи), для высокого сродства необходимо только одно. Оптимальная среда основного азота - это когда он ограничен азабициклической системой с самым высоким сродством, наблюдаемым для систем с азотом в положении мостика и вторичными аминами . более сильными [46] Рецептор 5-НТ3 может аккомодировать только небольшие заместители заряженного амина, оптимальным является метильная группа. [43] Оптимальное расстояние между местом связывания ароматического соединения и основным амином составляет 8,4–8,9 Å, и лучше всего, если оксадиазол и азот разделяет двухуглеродная связь. Увеличение замены R увеличивает сродство. [46] Наиболее сильные антагонисты 5-НТ3 - рецепторов имеют 6-членное ароматическое кольцо и обычно имеют 6,5 гетероциклических колец. [43] обнаружено не было Никакой корреляции между липофильностью соединений и сродством к рецептору 5-НТ 3 . [47] Поскольку большинство известных антагонистов 5-НТ3 являются производными сложных эфиров или амидов, они потенциально подвержены гидролизу, которого можно избежать путем включения акцепторов Н-связи в 5-членное гетероароматическое кольцо. [46]

взаимосвязи структура-активность Исследования (SAR) лигандов рецепторов LGIC полезны для изучения их структуры и функций. Молекула , подобная антагонисту , с низкой собственной активностью (ia) снижает частоту открытия каналов и проницаемость ионов. Небольшие липофильные заместители C5 (R1) (см. рис. 5) образуют соединения с сильным антагонизмом, что указывает на то, что заместитель C5 может помещаться в узкую гидрофобную бороздку связывающей области рецептора. Похоже, что аминокислотные остатки, которые взаимодействуют с заместителями C7 (R2), мало связаны со связыванием лиганда, но играют большую роль в открытии ионных каналов. Стерически объемные заместители демонстрируют большее взаимодействие с воротными аминокислотными остатками и способствуют открытой конформации ионного канала из-за стерического отталкивания. [48]

Ондансетрон является рацематом , но стереохимия асимметричного углерода атома не является важным фактором во взаимодействии с рецептором 5- НТ3 . Аннелирование 1,7-положений индольного ядра ондансетрона приводит к увеличению сродства к рецептору . [49]
Метильная группа оказывается столь же функционально эффективной, как и хлор в положении R (см. рис. 6). Карбонильная . группа отвечает за сильное взаимодействие с рецептором и вносит значительный вклад в процесс связывания Эта карбонильная группа полностью копланарна соседнему ароматическому кольцу, что указывает на то, что конформация, связанная с рецептором, соответствует одной из наиболее стабильных конформаций этой группы в гибких соединениях. [45]
Исследовать
[ редактировать ]Небольшое открытое исследование, проведенное в 2000 году, показало, что ондансетрон полезен при лечении антипсихотиками, , вызванной поздней дискинезии у людей с шизофренией . [50] [51] Пациенты исследования также показали значительное улучшение симптомов заболевания; Более позднее двойное слепое рандомизированное контролируемое исследование также показало, что ондансетрон значительно улучшает симптомы шизофрении при использовании в качестве дополнения к галоперидолу , и люди, принимавшие оба препарата, испытывали меньше побочных эффектов, обычно связанных с галоперидолом. [52]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ де Вит Р., Аапро М., Блоуэр П.Р. (2005). «Есть ли фармакологическая основа для различий в эффективности антагонистов 5-HT3-рецепторов у рефрактерных пациентов?». Рак Химиотер Фармакол . 56 (3): 231–8. дои : 10.1007/s00280-005-1033-0 . ПМИД 15838653 . S2CID 27576150 .
- ^ Всемирная организация здравоохранения (2006). « Использование основ при выборе международных непатентованных наименований (МНН) фармацевтических субстанций » (PDF) . (703 КиБ ) . Женева: Пресса ВОЗ. Проверено 15 мая 2007 г.
- ^ Херрштедт, Дж.; Аапро, М.С.; Ройла, Ф.; Катая, В.В.; Рабочая группа по руководящим принципам ESMO (2005 г.). « Минимальные клинические рекомендации ESMO по профилактике тошноты и рвоты, вызванной сывороткой (NV) » . Анналы онкологии . 16 : i77–i79. дои : 10.1093/annonc/mdi805 . ПМИД 15888767 .
- ^ Перейти обратно: а б Линдли С., Блоуэр П. (2000). «Поральные антагонисты рецепторов серотонина 3-го типа для профилактики рвоты, вызванной химиотерапией» . Am J Health-Syst Pharm . 57 (18): 1685–97. дои : 10.1093/ajhp/57.18.1685 . ПМИД 11006796 . Бесплатный полный текст при регистрации на Medscape
- ^ Ройла Ф, Фатигони С (2006). «Новые противорвотные средства» . Энн Онкол . 17 (Приложение 2): ii96–100. дои : 10.1093/annonc/mdj936 . ПМИД 16608997 .
- ^ Стотт-младший, Барнс Г.Р., Райт Р.Дж., Раддок С.Дж. (1989). «Влияние на укачивание и глазодвигательную функцию GR 38032F, антагониста 5-HT3-рецепторов с противорвотными свойствами» . Британский журнал клинической фармакологии . 27 (2): 147–57. дои : 10.1111/j.1365-2125.1989.tb05345.x . ПМЦ 1379774 . ПМИД 2523720 .
- ^ Левин М.Э., Чиллас Дж.К., Стерн Р.М., Нокс Г.В. (2000). «Влияние антагонистов рецепторов серотонина (5-HT3) на желудочную тахиаритмию и симптомы укачивания». Авиат Спейс Энвайрон Мед . 71 (11): 1111–4. ПМИД 11086664 .
- ^ Мут Э.Р., Элкинс А.Н. (июль 2007 г.). «Высокие дозы ондансетрона для уменьшения укачивания у очень восприимчивых людей». Авиат Спейс Энвайрон Мед . 78 (7): 686–92. ПМИД 17679566 .
- ^ Дула Д., Розенбах С. (2006). «Рандомизированное клиническое исследование, сравнивающее ондансетрон с плацебо среди авиационного медицинского персонала, страдающего морской болезнью». Документ представлен на ежегодном собрании Национальной ассоциации врачей скорой помощи, Registry Resort, Неаполь, Флорида, 19–21 января 2006 г. Получено 25 апреля 2009 г.
- ^ Хэган Р.М., Батлер А., Хилл Дж.М., Джордан CC, Ирландия SJ, Тайерс М.Б. (1987). «Влияние антагониста рецептора 5-HT3, GR38032F, на реакцию на инъекцию агониста нейрокинина в вентральную покрышку мозга крысы». Евро. Дж. Фармакол . 138 (2): 303–5. дои : 10.1016/0014-2999(87)90450-X . ПМИД 2442006 .
- ^ Косталл Б., Ганнинг С.Дж., Нейлор Р.Дж., Тайерс М.Б. (1987). «Влияние GR38032F, нового антагониста 5-НТ3-рецепторов на опорожнение желудка у морских свинок» . Бр. Дж. Фармакол . 91 (2): 263–4. дои : 10.1111/j.1476-5381.1987.tb10280.x . ПМЦ 1853517 . ПМИД 2955843 .
- ^ См. Eur J Cancer Clin Oncol , 1989; 25 Приложение 1 .
- ^ Донатч П., Энгель Г., Ричардсон Б.П., Стадлер П.А. (1984). «Очень избирательный и мощный антагонист периферические нейрональные 5-гидрокситриптаминовые рецепторы». Br J Pharmacol 81 : 34P.
- ^ Зуссман Б.Д., Кларксон А., Коутс П.Е., Раппорт WG (1988). «Фармакокинетика профиль BRL 43694, нового антагониста 5-НТ3-рецепторов, у здоровых мужчин волонтеры». Br J Clin Pharmacol 25 : 107P.
- ^ Аапро М (2004). «Гранисетрон: обновленная информация о его клиническом использовании при лечении тошноты и рвоты». Онколог . 9 (6): 673–86. doi : 10.1634/теонколог.9-6-673 . ПМИД 15561811 . Бесплатный полный текст
- ^ Соренсен С.М., Хамфрис Т.М., Палфриман М.Г. (1989). «Влияние острого и хронического MDL 73,147EF, антагониста рецептора 5-HT3, на дофаминовые нейроны A9 и A10». Евро. Дж. Фармакол . 163 (1): 115–8. дои : 10.1016/0014-2999(89)90402-0 . ПМИД 2744086 .
- ^ Де Леон А (2006). «Палоносетрон (Алокси): антагонист 5-HT3-рецепторов второго поколения для лечения тошноты и рвоты, вызванных химиотерапией» . Труды (Университет Бэйлора. Медицинский центр) . 19 (4): 413–6. дои : 10.1080/08998280.2006.11928210 . ПМК 1618755 . ПМИД 17106506 .
- ^ «FDA одобрило алокси (палоносетрон) для лечения тошноты и рвоты, связанных с химиотерапией» (пресс-релиз). Руководство Доктора Паблишинг Лимитед. 28 июля 2003 года . Проверено 15 мая 2007 г.
- ^ Вакнин, Яэль (4 сентября 2008 г.). «Одобрения FDA: Nplate, Aloxi, Vidaza» . Медскейп . Архивировано из оригинала 2 декабря 2008 года . Проверено 4 сентября 2008 г. В свободном доступе при регистрации.
- ^ Сокращенная информация о назначении - Nasea (MIMS Филиппины) [ постоянная мертвая ссылка ] . Проверено 13 июня 2008 г.
- ^ Рабаседа X (февраль 2002 г.). «Рамосетрон, антагонист рецепторов 5-HT3 для контроля тошноты и рвоты». Наркотики сегодня . 38 (2): 75–89. дои : 10.1358/точка.2002.38.2.820104 . ПМИД 12532186 .
- ^ Хирата Т., Фунацу Т., Кето Ю., Наката М., Сасамата М. (февраль 2007 г.). «Фармакологический профиль рамосетрона, нового терапевтического средства от СРК». Инфламмофармакология . 15 (1): 5–9. дои : 10.1007/ s10787-006-1537-1 ПМИД 17323187 . S2CID 29179265 .
- ^ ГлаксоСмитКляйн (2005). «Информация о назначении Лотронекса» (PDF) . (203 КиБ ) . США Управление по контролю за продуктами и лекарствами . Проверено 30 июля 2009 г.
- ^ Ку, Валери (2003). Имбирь [ постоянная мертвая ссылка ] . Университет Колорадо в Денвере и фармацевтическая школа Центра медицинских наук . Проверено 25 октября 2007 г.
- ^ Хуан QR; Ивамото М; Аоки С; и др. (1991). «Анти-5-гидрокситриптамин3 эффект галанолактона, дитерпеноида, выделенного из имбиря» . Хим Фарм Булл . 39 (2): 397–9. дои : 10.1248/cpb.39.397 . ПМИД 2054863 .
- ^ Перейти обратно: а б Каст РЭ; Фоли, К.Ф. (2007). «Химиотерапия рака и кахексия: миртазапин и оланзапин являются антагонистами 5-HT3 с хорошими противотошнотными эффектами» . Европейский журнал по лечению рака . 16 (4): 351–354. дои : 10.1111/j.1365-2354.2006.00760.x . ПМИД 17587360 . [ мертвая ссылка ]
- ^ Ким С; Шин, И.С.; Ким, Дж. М.; Канг, ХК; Мун, Ю; Ян, С.Дж.; Юн, Дж.С. (2006). «Миртазапин при тяжелом гастропарезе, не поддающемся традиционному лечению прокинетиками» . Психосоматика . 47 (5): 440–442. дои : 10.1176/appi.psy.47.5.440 . ПМИД 16959934 .
- ^ Перейти обратно: а б с д и 5-гидрокситриптамина3 (5-HT 3 « Антагонисты рецепторов )» (PDF) . Университета штата Орегон Фармацевтический колледж . 2003. Архивировано из оригинала (PDF) 13 марта 2013 г. Проверено 15 мая 2007 г.
- ^ Перейти обратно: а б с Брантон, Лоуренс Л.; Лазо, Джон С.; Паркер, Кейт Л. (2006). Годдман и Гилман «Фармакологические основы терапии» . Нью-Йорк: МакГроу-Хилл. стр. 1000–3. ISBN 978-0-07-142280-2 .
- ^ Перейти обратно: а б с д и ж Ган Ти Джей (2005). «Селективные антагонисты рецепторов серотонина 5-HT3 при послеоперационной тошноте и рвоте: все ли они одинаковы?». Препараты ЦНС . 19 (3): 225–38. дои : 10.2165/00023210-200519030-00004 . ПМИД 15740177 . S2CID 23209789 .
- ^ Сэнгер Дж.Дж. (сентябрь 2008 г.). «5-гидрокситриптамин и желудочно-кишечный тракт: что дальше?». Тенденции в фармакологических науках . 29 (9): 465–71. дои : 10.1016/j.tips.2008.06.008 . ПМИД 19086255 .
- ^ Аапро М (2005). «Антагонисты 5-HT(3)-рецепторов в лечении тошноты и рвоты при раке и лечении рака». Онкология . 69 (2): 97–109. дои : 10.1159/000087979 . ПМИД 16131816 . S2CID 71759860 .
- ^ ГАДДУМ Дж. Х., ПИКАРЕЛЛИ З. П. (сентябрь 1957 г.). «Два вида рецепторов триптамина» . Британский журнал фармакологии и химиотерапии . 12 (3): 323–8. дои : 10.1111/j.1476-5381.1957.tb00142.x . ПМК 1509685 . ПМИД 13460238 .
- ^ Перейти обратно: а б с Барнс Н.М., Хейлз Т.Г., Ламмис С.К., Питерс Дж.А. (январь 2009 г.). «Рецептор 5-HT3 — взаимосвязь между структурой и функцией» . Нейрофармакология . 56 (1): 273–84. doi : 10.1016/j.neuropharm.2008.08.003 . ПМК 6485434 . ПМИД 18761359 .
- ^ Перейти обратно: а б Кинг, Фрэнк Д.; Джонс, Брайан Дж.; Сэнгер, Гарет Дж. (1993). Антагонисты рецепторов 5-гидрокситриптамина-3 . ЦРК Пресс. стр. 2–3. ISBN 978-0-8493-5463-2 .
- ^ Гальван, М.; Гиттос, М.; Фатми, М. (октябрь 1996 г.). «ОТКРЫТИЕ АНТАГОНИСТОВ 5-НТ3 - РЕЦЕПТОРОВ И ДОЛАСЕТРОНА МЕСИЛАТА» . Журнал EJHP (6): 10–11. Архивировано из оригинала 20 июля 2011 г. Проверено 6 января 2010 г.
- ^ Перейти обратно: а б с Биллио, Атто; Кларк, Майк Дж.; Морелло, Энрико; Биллио, Атто (2006). Биллио, Атто (ред.). «Сравнение клинической эффективности антагонистов рецепторов серотонина при высокоэметогенной химиотерапии». Кокрейновская база данных систематических обзоров (4). дои : 10.1002/14651858.CD006272 .
- ^ Перейти обратно: а б с Оо Т.Х., Хескет П.Дж. (апрель 2005 г.). «Информация о лекарствах: новые противорвотные средства в лечении тошноты и рвоты, вызванных химиотерапией». Природная клиническая практика онкологии . 2 (4): 196–201. дои : 10.1038/ncponc0132 . ПМИД 16264934 . S2CID 20464189 .
- ^ Перейти обратно: а б Камм М.А. (март 2002 г.). «Обзорная статья: сложность разработки лекарств от синдрома раздраженного кишечника» . Алиментарная фармакология и терапия . 16 (3): 343–51. дои : 10.1046/j.1365-2036.2002.01185.x . ПМИД 11876686 . S2CID 24133545 .
- ^ Чжу Л.П., Е Д.Ю., Тан Ю. (январь 2007 г.). «Структурные исследования 3D-QSAR тиазолов как антагонистов рецепторов 5-HT3». Журнал молекулярного моделирования . 13 (1): 121–31. дои : 10.1007/s00894-006-0131-1 . ПМИД 16953442 . S2CID 30877434 .
- ^ Ривз, округ Колумбия, Ламмис, Южная Каролина (2002). «Молекулярные основы структуры и функции рецептора 5-НТ3: модельный лиганд-управляемый ионный канал (обзор)» . Молекулярная мембранная биология . 19 (1): 11–26. дои : 10.1080/09687680110110048 . ПМИД 11989819 . S2CID 36985954 .
- ^ Даффи Н.Х., Лестер Х.А., Догерти Д.А. (2007). «Ориентация связывания ондансетрона и гранисетрона в рецепторе 5-HT3, определяемая мутагенезом неприродных аминокислот» . АКС Химическая биология . 7 (10): 1738–45. дои : 10.1021/cb300246j . ПМЦ 3477246 . ПМИД 22873819 .
- ^ Перейти обратно: а б с д и Томпсон А.Дж., Ламмис СК (2006). «5-НТ3-рецепторы» . Текущий фармацевтический дизайн . 12 (28): 3615–30. дои : 10.2174/138161206778522029 . ПМК 2664614 . ПМИД 17073663 .
- ^ Перейти обратно: а б Тянь К., Чен Х., Тан Дж., Чен Х., Ху Цзы (ноябрь 2006 г.). «Энантиоразделение палоносетрона гидрохлорида с помощью мицеллярной электрокинетической хроматографии с холатом натрия в качестве хирального селектора». Журнал хроматографии А. 1132 (1–2): 333–6. дои : 10.1016/j.chroma.2006.08.090 . ПМИД 16999973 .
- ^ Перейти обратно: а б Хиберт М.Ф., Хоффманн Р., Миллер Р.К., Карр А.А. (июнь 1990 г.). «Исследование взаимосвязи конформации и активности антагонистов рецептора 5-HT3 и определение модели этого рецепторного сайта». Журнал медицинской химии . 33 (6): 1594–600. дои : 10.1021/jm00168a011 . ПМИД 2342053 .
- ^ Перейти обратно: а б с Суэйн Си Джей; Бейкер Р.; Колено С; и др. (январь 1991 г.). «Новые антагонисты 5-HT3. Индолоксадиазолы». Журнал медицинской химии . 34 (1): 140–51. дои : 10.1021/jm00105a021 . ПМИД 1992112 .
- ^ Каппелли А; Донати А; Анзини М; и др. (август 1996 г.). «Молекулярная структура и динамика некоторых мощных антагонистов рецептора 5-HT3. Понимание взаимодействия с рецептором». Биоорганическая и медицинская химия . 4 (8): 1255–69. дои : 10.1016/0968-0896(96)00122-8 . ПМИД 8879547 .
- ^ Ёсида С., Ватанабэ Т., Сато Ю. (май 2007 г.). «Регуляторные молекулы для системы управления ионными каналами рецептора 5-HT3». Биоорганическая и медицинская химия . 15 (10): 3515–23. дои : 10.1016/j.bmc.2007.02.054 . ПМИД 17391967 .
- ^ ван Вейнгаарден I; Хамминга Д; ван Хес Р; и др. (ноябрь 1993 г.). «Разработка высокоаффинных антагонистов рецепторов 5-HT3. Взаимосвязь структуры и сродства новых 1,7-аннелированных производных индола». Журнал медицинской химии . 36 (23): 3693–9. дои : 10.1021/jm00075a026 . ПМИД 8246239 .
- ^ Зуллино Д.Ф., Ип CB, Вуарол П. (2001). «Ондансетрон при поздней дискинезии». Am J Психиатрия . 158 (4): 657–8. дои : 10.1176/appi.ajp.158.4.657-a . ПМИД 11282718 .
- ^ Сирота П., Мошева Т., Шабтай Х., Гилади Н., Корчин А.Д. (2000). «Использование селективного антагониста рецепторов серотонина 3 ондансетрона в лечении поздней дискинезии, вызванной нейролептиками». Am J Психиатрия . 157 (2): 287–9. дои : 10.1176/appi.ajp.157.2.287 . ПМИД 10671405 . Бесплатный полный текст
- ^ Чжан ZJ, Кан WH, Ли Q, Ван XY, Яо С.М., Ма AQ (2006). «Положительное воздействие ондансетрона в качестве дополнения к галоперидолу при хронической, резистентной к лечению шизофрении: двойное слепое рандомизированное плацебо-контролируемое исследование». Исследования шизофрении . 88 (1–3): 102–10. doi : 10.1016/j.schres.2006.07.010 . ПМИД 16959472 . S2CID 24911372 .
- Пасрича, Панкадж Дж. (2006). «Лечение нарушений перистальтики кишечника и оттока воды; противорвотные средства; средства, применяемые при заболеваниях желчевыводящих путей и поджелудочной железы». В Лоуренсе Брантоне; Джон Лазо; Кейт Паркер (ред.). Фармакологические основы терапии Гудмана и Гилмана (11-е изд.). Нью-Йорк: МакГроу-Хилл . ISBN 978-0-07-142280-2 .
- Хиллиер, Кейт; Роберт Дж. Нейлор (2006). «Лекарственные средства и желудочно-кишечная система». В Клайве Пейдже; Брайан Хоффманн; Майкл Кертис; Майкл Уокер (ред.). Интегрированная фармакология (3-е изд.). Мосби. ISBN 978-0-323-04080-8 .