Открытие и разработка ингибиторов циклооксигеназы 2.
Циклооксигеназы – это ферменты, которые принимают участие в сложном биосинтетическом каскаде, в результате которого происходит превращение полиненасыщенных жирных кислот в простагландины и тромбоксан (ы). [ 1 ] Их основная роль — катализировать трансформацию арахидоновой кислоты в промежуточный простагландин H2 , который является предшественником множества простаноидов с разнообразным и мощным биологическим действием. [ 2 ] Циклооксигеназы имеют две основные изоформы, которые называются ЦОГ-1 и ЦОГ-2 (а также ЦОГ-3 ). ЦОГ-1 отвечает за синтез простагландина и тромбоксана во многих типах клеток, включая желудочно-кишечный тракт и тромбоциты. ЦОГ-2 играет важную роль в биосинтезе простагландинов в клетках воспаления и в центральной нервной системе. Синтез простагландинов в этих местах является ключевым фактором развития воспаления и гипералгезии . [ 3 ] Ингибиторы ЦОГ-2 обладают анальгетической и противовоспалительной активностью, избирательно блокируя трансформацию арахидоновой кислоты в простагландин H2. [ 4 ]
Рост популярности селективных ингибиторов ЦОГ-2
[ редактировать ]
|
| ДуП-697 |
Стимулом к разработке селективных ингибиторов ЦОГ-2 послужили побочные эффекты НПВП со стороны желудочно-кишечного тракта . Вскоре после открытия механизма действия НПВП появились убедительные показания к использованию альтернативных форм ЦОГ, но подтверждающих доказательств было обнаружено мало. Фермент ЦОГ оказалось трудно очистить, и его секвенирование не проводилось до 1988 года. [ 5 ] В 1991 году существование фермента ЦОГ-2 было подтверждено путем его клонирования доктором Дэном Симмонсом в Университете Бригама Янга . До подтверждения существования ЦОГ-2 компания Dupont разработала соединение DuP-697 , которое оказывало сильное противовоспалительное действие во многих исследованиях, но не оказывало ульцерогенного действия, свойственного НПВП. Как только фермент ЦОГ-2 был идентифицирован, Dup-697 стал строительным блоком для синтеза ингибиторов ЦОГ-2. Целекоксиб и рофекоксиб, первые ингибиторы ЦОГ-2, вышедшие на рынок, были основаны на DuP-697. [ 5 ] [ 6 ] На разработку и вывод на рынок первого ингибитора ЦОГ-2 потребовалось менее восьми лет: Целебрекс ( целекоксиб ) был запущен в продажу в декабре 1998 года, а Виокс ( рофекоксиб ) – в мае 1999 года. [ 7 ] [ 8 ] Целекоксиб и другие селективные ингибиторы ЦОГ-2, вальдекоксиб , парекоксиб и мавакоксиб , были обнаружены командой из Searle подразделения компании Monsanto под руководством Джона Тэлли . [ 9 ] [ 10 ]
Разработка ингибиторов ЦОГ-2
[ редактировать ]Ранние исследования показали, что при индуцировании воспаления пораженный орган неожиданно приобретает огромную способность вырабатывать простагландины. Показано, что увеличение происходит за счет синтеза свежего фермента de novo. В 1991 году в ходе исследования экспрессии генов раннего ответа в фибробластах , трансформированных вирусом саркомы Рауса, был идентифицирован новый транскрипт мРНК, который был похож, но не идентичен семенному ферменту ЦОГ. Было высказано предположение, что был открыт изофермент ЦОГ. Другая группа обнаружила новый вид кДНК, кодирующий белок со структурой, сходной с ЦОГ-1, при изучении генов, индуцированных эфиром форбола, в клетках Swiss 3T3. Та же лаборатория показала, что этот ген действительно экспрессирует новый фермент ЦОГ. Эти два фермента были переименованы в ЦОГ-1, имея в виду исходный фермент и ЦОГ-2. [ 5 ] Опираясь на эти результаты, ученые сосредоточились на селективных ингибиторах ЦОГ-2 . Огромные усилия были потрачены на разработку НПВП в период с 1960-х по 1980-е годы, поэтому, когда был открыт ЦОГ-2, нужно было протестировать множество фармакофоров. Первые усилия были сосредоточены на модификации двух свинцовых соединений: DuP-697 и NS-398 . Эти соединения сильно отличаются от НПВП, которые являются аналогами арилалконовой кислоты. Воодушевленные экспериментами по « концептуальному тестированию » с селективными ингибиторами, а также вооружённые несколькими убедительными выводами и четким представлением о природе места связывания , развитие этой области было быстрым. [ 3 ] Анализы рекомбинантных ферментов in vitro предоставили мощные средства для оценки селективности и эффективности ЦОГ и привели к открытию и клинической разработке первого рационально разработанного селективного ингибитора ЦОГ-2 — целекоксиба. Были предприняты попытки превратить НПВП в селективные ингибиторы ЦОГ-2, такие как индометацин, путем удлинения боковой цепи алкилкарбоновой кислоты, но ни одна из них не поступила в продажу. [ 1 ]
Связь структуры и деятельности (SAR)
[ редактировать ]DuP-697 был строительным блоком для синтеза ингибиторов ЦОГ-2 и послужил базовой химической моделью коксибов, которые сегодня являются единственными селективными ингибиторами ЦОГ-2 на рынке. DuP-697 представляет собой диариловый гетероцикл с цистильбеновым фрагментом . Исследования взаимосвязи структура-активность (SAR) для диарилгетероциклических соединений показали, что цис-стильбеновый фрагмент и изменения в пара-положении одного из арильных колец играют важную роль в селективности ЦОГ-2. [ 1 ] [ 11 ] Целекоксиб и парекоксиб имеют сульфонамидный заместитель (SO 2 NH 2 ) в пара-положении одного из арильных колец, тогда как эторикоксиб и рофекоксиб имеют метилсульфон (SO 2 CH 3 ). [ 12 ] Степень окисления серы важна для селективности; сульфоны и сульфонамиды селективны в отношении ЦОГ-2, а сульфоксиды и сульфиды — нет. Кольцевая система, которая конденсируется в этой стильбеновой системе, подвергалась обширным изменениям, чтобы включить в себя все мыслимые гетероциклические и карбоциклические скелеты с кольцами различных размеров. Известно, что фрагмент SO 2 NHCOCH 3 , как в парекоксибе, который является пролекарством валдекоксиба, составляет 10 5 – 10 6 более реакционноспособный ацетилирующий агент сериновых гидроксильных групп ферментов, чем простые амиды. [ 11 ] В связи с тем, что различные кинетические механизмы влияют на эффективность ЦОГ-1 по сравнению с ЦОГ-2, многие группы используют показатель эффективности и селективности в цельной крови человека и принимают в качестве стандартной оценки активности и селективности ЦОГ-2.
Связь между аминокислотным профилем фермента ЦОГ-2 и механизмом ингибирования
[ редактировать ]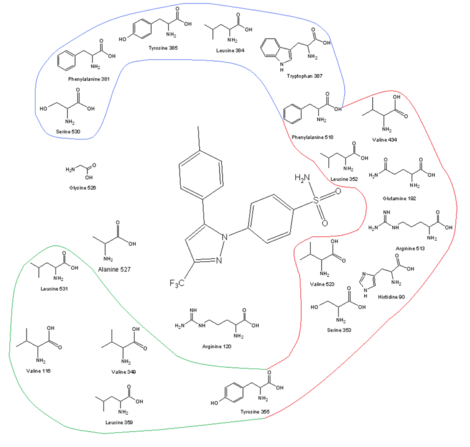
|
| Сайт рецептора ЦОГ-2 и его аминокислотный профиль вместе с целекоксибом в месте связывания |
Одним из ключей к разработке селективных препаратов ЦОГ-2 является более крупный активный центр ЦОГ-2, что позволяет делать молекулы слишком большими, чтобы поместиться в активный центр ЦОГ-1, но при этом способными соответствовать ЦОГ-2. Более крупный активный центр ЦОГ-2 частично обусловлен полярным гидрофильным боковым карманом, который образуется в результате замены Ile 523, His 513 и Ile 434 в ЦОГ-1 на Val 523, Arg 513 и Val 434 в ЦОГ-2. Val523 менее громоздкий, чем Ile523, что увеличивает объем активного сайта. Замена Ile434 на Val434 позволяет боковой цепи Phe 518 сдвинуться назад и освободить дополнительное пространство. Этот боковой карман позволяет взаимодействовать с Arg513, который является заменой His513 ЦОГ-1. Считается, что Arg513 является ключевым остатком для ингибиторов диарилгетероцикла, таких как коксибы. Боковая цепь Leu 384 в верхней части рецепторного канала ориентирована в активный сайт ЦОГ-1, но в ЦОГ-2 она ориентирована в сторону от активного центра и освобождает больше места в вершине сайт связывания. [ 13 ] [ 14 ] Объемная сульфонамидная группа в ингибиторах ЦОГ-2, таких как целекоксиб и рофекоксиб, предотвращает попадание молекулы в канал ЦОГ-1. Для оптимальной активности и селективности коксибов необходим 4-метилсульфонилфенил, присоединенный к ненасыщенному (обычно) пятичленному кольцу вицинальной липофильной группой (рофекоксиб). SO 2 CH 3 может быть заменен SO 2 NH 2 , где липофильный карман занят необязательно замещенным фенильным кольцом или объемистым алкокси-заместителем (целекоксиб). Внутри гидрофильного бокового кармана ЦОГ-2 кислород сульфонамидной (или сульфоновой ) группы взаимодействует с Hist90, Arg513 и Gln 192 и образует водородные связи . Замещенная фенильная группа в верхней части канала взаимодействует с боковыми цепями аминокислотных остатков посредством гидрофобных и электростатических взаимодействий. Tyr 385 создает некоторые стерические ограничения на этой стороне сайта связывания, поэтому небольшой заместитель фенильной группы способствует лучшему связыванию. Степени свободы также важны для связывания. Центральное кольцо коксибов определяет ориентацию ароматические кольца и, следовательно, связывание с ферментом ЦОГ, хотя он часто не имеет электростатических взаимодействий ни с одним из аминокислотных остатков. Высокая липофильность активного центра требует низкой полярности центрального каркаса коксибов. [ 14 ] [ 15 ]
Механизм связывания
[ редактировать ]Исследования механизма связывания селективных ингибиторов ЦОГ-2 показывают, что они имеют две обратимые стадии как с ЦОГ-1, так и с ЦОГ-2, но селективность в отношении ЦОГ-2 обусловлена другой стадией, которая является медленной и необратимой и наблюдается только у ингибирование ЦОГ-2, а не ЦОГ-1. Необратимый этап объясняется присутствием сульфонамида ( или сульфона ), который попадает в боковой карман ЦОГ-2. Это было изучено с использованием SC-58125 (аналог целекоксиба) и мутированного ЦОГ-2, в котором остаток валина 523 был заменен изолейцином 523. Необратимого ингибирования не произошло, но было замечено обратимое ингибирование. Была создана модель, объясняющая этот трехэтапный механизм ингибирующего действия селективных ингибиторов ЦОГ-2. На первом этапе происходит контакт ингибитора с воротами гидрофобного канала (так называемой лобби-областью). Второй этап может объяснять перемещение ингибитора из лобби-области в активный центр фермента ЦОГ. Последний этап, вероятно, представляет собой репозиционирование ингибитора в активном центре, что приводит к сильным взаимодействиям фенилсульфонамидной или фенилсульфоновой группы ингибитора и аминокислот бокового кармана. [ 16 ] Это непосредственно ингибирование постагландирования.
Фармакокинетика коксибов
[ редактировать ]Коксибы широко распространены по всему организму. Все коксибы достигают достаточных концентраций в мозге, чтобы оказывать центральное обезболивающее действие, и все они снижают образование простагландинов в воспаленных суставах. Все они хорошо всасываются, но пиковая концентрация коксибов может различаться. Коксибы в высокой степени связываются с белками, и опубликованные оценки периода полураспада варьируются между коксибами. [ 17 ]
Целекоксиб
[ редактировать ]Целекоксиб был первым специфическим ингибитором ЦОГ-2, одобренным для лечения пациентов с ревматизмом и остеоартритом . Исследование показало, что скорость всасывания при пероральном приеме умеренная, а пиковая концентрация в плазме достигается примерно через 2–4 часа. Однако степень абсорбции недостаточно известна. Целекоксиб обладает способностью связываться с белками плазмы, особенно с альбумином плазмы . Он имеет кажущийся объем распределения (V D ) у человека 455 +/- 166 л, а площадь под кривой зависимости концентрации в плазме от времени ( AUC ) увеличивается пропорционально увеличению пероральной дозы от 100 до 800 мг. Целекоксиб метаболизируется преимущественно изоферментом CYP2C9 до карбоновой кислоты, а также путем независимой от CYP глюкуронидации до метаболитов глюкуронидов . Метаболиты выводятся с мочой и калом, при этом небольшая часть неизмененного препарата (2%) выводится с мочой. Период его полувыведения составляет около 11 часов (6–12 часов) у здоровых людей, но расовые различия в расположении препарата и фармакокинетике Сообщалось об изменениях у пожилых людей. У людей с хронической болезнью почек концентрация в плазме на 43% ниже по сравнению со здоровыми людьми, при этом кажущийся клиренс увеличивается на 47%, и можно ожидать, что у пациентов с легкой и умеренной печеночной недостаточностью будет увеличена равновесная AUC. [ 18 ]
| Целекоксиб | ||
|---|---|---|
| Пик [наркотик] | 2–4 часа | 
|
| Связывание с белками | 97% | |
| Метаболиты | Конъюгаты карбоновой кислоты и глюкуронида | |
| Период полураспада [t 1/2 ] | 6–12 часов | |
Парекоксиб и валдекоксиб
[ редактировать ]Парекоксиб натрия представляет собой водорастворимое неактивное пролекарство , сложноэфирного амида вальдекоксиба нового специфического ингибитора ЦОГ-2 второго поколения и первого такого агента, разработанного для инъекционного применения. Он быстро преобразуется в результате печеночного ферментативного гидролиза в активную форму вальдекоксиба. Затем соединение подвергается еще одному превращению, которое включает как путь, опосредованный цитохромом P450 (CYP2C9, CYP3A4), так и путь, не опосредованный цитохромом P450, в гидроксилированный метаболит и метаболит глюкуронида. Гидроксилированный метаболит, который также обладает слабыми ЦОГ-2-специфичными ингибирующими свойствами, затем метаболизируется по нецитохромному пути P450 до глюкуронидного метаболита. Эти метаболиты выводятся с мочой. [ 17 ] После внутримышечного введения парекоксиба натрия пиковая концентрация в плазме достигается в течение 15 минут. Концентрация в плазме быстро снижается после введения из-за довольно короткого периода полувыведения из сыворотки, который составляет около 15–52 минут. Это можно объяснить быстрым образованием вальдекоксиба. В отличие от быстрого клиренса парекоксиба, концентрация вальдекоксиба в плазме снижается медленно из-за более длительного периода полувыведения. [ 19 ] С другой стороны, при пероральном приеме валдекоксиба он быстро всасывается (1–2 часа), но присутствие пищи может задержать пиковую концентрацию в сыворотке. Затем он подвергается тому же метаболизму, который описан выше. Он в значительной степени связывается с белками (98%), а период полувыведения из плазмы составляет около 7–8 часов. Обратите внимание, что период полувыведения может значительно увеличиваться у пожилых людей или людей с печеночной недостаточностью и может привести к кумуляции препарата. [ 17 ] Гидроксильный метаболит достигает максимальной средней концентрации в плазме через 3–4 часа после введения, но она значительно ниже, чем у вальдекоксиба, или составляет примерно 1/10 от уровня вальдекоксиба в плазме. [ 19 ]
| парекоксиб | ||
|---|---|---|
| Пик [наркотик] | В течение 15 минут | 
|
| Связывание с белками | Н/Д | |
| Метаболиты | Валдекоксиб после печеночного ферментативного гидролиза | |
| Период полураспада [t 1/2 ] | 15–52 минуты | |
| Валдекоксиб | ||
|---|---|---|
| Пик [наркотик] | 2–4 часа, с задержкой из-за еды | 
|
| Связывание с белками | 98% | |
| Метаболиты | Гидроксильные производные и метаболит глюкуронида | |
| Период полураспада [t 1/2 ] | 7–8 часов | |
Эторикоксиб
[ редактировать ]Эторикоксиб , который используется у пациентов с хроническими артропатиями , скелетно-мышечной и зубной болью, при пероральном приеме всасывается умеренно. Исследование фармакокинетики показало, что пиковая концентрация эторикоксиба в плазме достигается примерно через 1 час. Было показано, что он в значительной степени связывается с альбумином плазмы (около 90%) и имеет кажущийся объем распределения (VD ) 120 л у человека. Площадь под кривой зависимости концентрации в плазме от времени (AUC) увеличивается пропорционально увеличению дозы (5–120 мг). Период полувыведения у здоровых людей составляет около 20 часов, и такой длительный период полувыведения позволяет выбрать дозу один раз в день. Эторикоксиб, как и другие коксибы, выводится с мочой и калом, а также метаболизируется аналогичным образом. CYP3A4 в основном отвечает за биотрансформацию эторикоксиба в метаболит карбоновой кислоты, но не связанный с CYP450, также возможен и другой путь метаболизма, в метаболит глюкуронида. Очень небольшая часть эторикоксиба (<1%) выводится с мочой в неизмененном виде. Пациенты с Кривая концентрации в плазме (AUC) при хроническом заболевании почек, по-видимому, не отличается от таковой у здоровых людей. Однако сообщалось, что у пациентов с умеренной печеночной недостаточностью кривая концентрации в плазме (AUC) увеличивается примерно на 40%. Было заявлено, что необходимы дальнейшие исследования, чтобы точно описать значимость фармакокинетических свойств с точки зрения клинической пользы и рисков эторикоксиба по сравнению с другими клиническими вариантами. [ 20 ] [ 21 ]
| Эторикоксиб | ||
|---|---|---|
| Пик [наркотик] | 1 час | 
|
| Связывание с белками | 90% | |
| Метаболиты | Метаболит карбоновой кислоты и метаболит глюкуронида | |
| Период полураспада [t 1/2 ] | 20 часов | |
Лумиракоксиб
[ редактировать ]Лумиракоксиб уникален среди коксибов, поскольку является слабой кислотой. Он был разработан для лечения остеоартрита, ревматоидного артрита и острой боли. Кислотная природа лумиракоксиба позволяет ему хорошо проникать в участки воспаления. Было показано, что он быстро и хорошо всасывается, при этом максимальная концентрация в плазме достигается примерно через 1–3 часа. [ 17 ] Исследование показало, что когда субъекту вводили дозу 400 мг, количество неизмененного препарата в плазме через 2,5 часа после приема предполагает умеренный эффект первого прохождения . Конечный период полувыведения из плазмы колебался от 5,4 до 8,6 часов (в среднем = 6,5 часов). Период полувыведения в синовиальной жидкости значительно дольше, чем в плазме, и концентрация в синовиальной жидкости ожидается, что через 24 часа после введения приведет к существенному ингибированию ЦОГ-2. Этот факт может объяснить, почему некоторым пользователям может быть достаточно дозы один раз в день, несмотря на короткий период полувыведения из плазмы. Основными метаболитами плазмы являются 5-карбокси, 4'-гидрокси и 4'-гидрокси-5-карбоксипроизводные. Лумиракоксиб подвергается интенсивному метаболизму перед выведением из организма, причем пути выведения пролегают через мочу или кал. Пиковые концентрации в плазме превышают концентрации, необходимые для максимального ингибирования ЦОГ-2, что соответствует более длительному фармакодинамическому периоду полувыведения. In vitro лумиракоксиб продемонстрировал большую селективность ЦОГ-2, чем любой другой коксиб. [ 22 ]
| Лумиракоксиб | ||
|---|---|---|
| Пик [наркотик] | 1–3 часа | 
|
| Связывание с белками | 90% | |
| Метаболиты | Производные 5-карбокси, 4'-гидрокси и 4'-гидрокси-5-карбокси | |
| Период полураспада [t 1/2 ] | 6,5 часов | |
Рофекоксиб
[ редактировать ]Рофекоксиб был вторым селективным ингибитором ЦОГ-2, вышедшим на рынок, и первым, снятым с рынка. [ 8 ] При изучении фармакокинетики на здоровых людях максимальная концентрация достигалась через 9 часов с эффективным периодом полувыведения около 17 часов. Наблюдался вторичный пик, который может указывать на то, что абсорбция рофекоксиба варьируется в зависимости от перистальтики кишечника, что приводит к высокой вариабельности во времени до достижения пиковой концентрации. Семьдесят один с половиной процент дозы выводится с мочой (менее 1% не метаболизируется) и 14,2% выводится с калом (приблизительно 1,8% с желчью). Среди метаболитов были рофекоксиб-3',4'-дигидродиол, 4'-гидроксирофекоксиб-О-β-D-глюкуронид, 5-гидроксирофекоксиб-О-β-D-глюкуронид, 5-гидроксирофекоксиб, рофекоксиб-эритро-3,4. -дигидрогидрокси кислота, рофекоксиб-трео-3,4-дигидрогидрокси кислота, цис-3,4-дигидророфекоксиб и транс-3,4-дигидророфекоксиб. [ 23 ]
Сердечно-сосудистые события, связанные с применением селективных ингибиторов ЦОГ-2
[ редактировать ]Еще до того, как на рынке появился первый селективный ингибитор ЦОГ-2, специалисты начали подозревать, что этот класс лекарств может иметь сердечно-сосудистый риск. В исследовании VIGOR (Vioxx Gastrointestinal Outcomes Research) рофекоксиб ( Vioxx ) сравнивали с напроксеном . Через короткое время стало очевидно, что риск инфаркта миокарда в группе рофекоксиба был в пять раз выше, чем в группе, получавшей напроксен. Авторы предположили, что разница обусловлена кардиопротекторным действием напроксена. [ 24 ] Исследование APPROVe (Профилактика аденоматозных полипов на Vioxx) представляло собой многоцентровое рандомизированное плацебо-контролируемое двойное слепое исследование, целью которого было оценить влияние трехлетнего лечения рофекоксибом на рецидивы неопластических полипов у лиц с колоректальными аденомами в анамнезе. [ 25 ] [ 26 ] В 2000 и 2001 годах было набрано и обследовано 2587 пациентов с колоректальными аденомами в анамнезе. Исследование было остановлено досрочно (за 2 месяца до ожидаемого завершения) по рекомендациям комиссии по безопасности данных и мониторингу из-за опасений по поводу сердечно-сосудистой токсичности. [ 25 ] Результаты исследования показали статистически значимое увеличение сердечно-сосудистого риска при приеме рофекоксиба по сравнению с плацебо. [ 25 ] [ 26 ] начало после 18 месяцев лечения. [ 25 ] [ 26 ] [ 27 ] Затем, 30 сентября, компания Merck выпустила пресс-релиз, в котором объявила о добровольном прекращении использования Vioxx во всем мире. [ 27 ] Некоторые исследования других коксибов также показали увеличение риска сердечно-сосудистых событий, тогда как другие этого не показали. Например, исследование «Профилактика аденомы с помощью целекоксиба» (APC) показало дозозависимое увеличение риска сердечно-сосудистой смерти, инфаркта миокарда, инсульта или сердечной недостаточности при приеме целекоксиба по сравнению с плацебо; и последовательное исследование эффективности и безопасности целекоксиба I (SUCCESS-I) показало повышенный риск инфаркта миокарда при приеме 100 мг целекоксиба два раза в день по сравнению с диклофенаком и напроксеном; но прием 200 мг два раза в день приводил к более низкой частоте инфаркта миокарда по сравнению с диклофенаком и напроксеном. Нуссмайер и др. (2005) показали в исследовании увеличение частоты сердечно-сосудистых событий при приеме парекоксиба и валдекоксиба (по сравнению с плацебо) после операции аорто-коронарного шунтирования. [ 26 ]
Возможные механизмы
[ редактировать ]Было высказано предположение, что селективность ЦОГ-2 может вызвать дисбаланс простагландинов в сосудистой сети. Если бы это было объяснением повышенного сердечно-сосудистого риска, то низкие дозы аспирина должны были бы свести на нет этот эффект. [ 26 ] [ 28 ] чего не было в судебном процессе APPROVe. [ 28 ] Кроме того, неселективные ингибиторы ЦОГ также показали увеличение сердечно-сосудистых событий. [ 29 ] Другое возможное объяснение было изучено Li H. et al. (2008). Они показали, что у крыс со спонтанной гипертензией (SHR) неселективные НПВП и коксибы вызывают окислительный стресс , о чем свидетельствует усиление сосудистого супероксида (O 2 − ) содержание и повышенное содержание пероксида в плазме, что согласуется с усилением экспрессии НАДФН-оксидазы, отмеченным при применении диклофенака и напроксена и в меньшей степени рофекоксиба и целекоксиба. Содержание нитритов в плазме также снизилось, что свидетельствует об уменьшении синтеза оксида азота (NO) в сосудах. Это снижение синтеза NO не было результатом снижения экспрессии эндотелиальной синтазы оксида азота ( eNOS ), поскольку экспрессия мРНК eNOS не снижалась, а даже повышалась для некоторых продуктов . Снижение синтеза NO можно, скорее, объяснить потерей функции eNOS. [ 29 ] Чтобы eNOS нормально функционировала, она должна образовывать димер и иметь кофактор BH 4 , который является одним из наиболее мощных природных восстановителей. BH 4 чувствителен к окислению пероксинитритом ONOO ( − ), который образуется при реакции NO с O 2 − , поэтому была выдвинута гипотеза, что истощение BH 4 может происходить при чрезмерном окислительном стрессе (который может быть вызван НПВП) и, следовательно, быть причиной дисфункции eNOS. Эта дисфункция, называемая разобщением eNOS, вызывает выработку O 2 − eNOS, что приводит к усилению окислительного стресса, вызываемого eNOS. [ 30 ] В исследовании как селективные ингибиторы ЦОГ-2, так и неселективные НПВП вызывали окислительный стресс, причем больший эффект наблюдался при использовании неселективных НПВП. Это может соответствовать гипотезе о дисбалансе простациклина/тромбоксана. То есть, хотя неселективные НПВП вызывают больший окислительный стресс, они предотвращают агрегацию тромбоцитов, тогда как ингибиторы ЦОГ-2 снижают выработку простациклина , и, следовательно, сердечно-сосудистый риск для неселективных НПВП не выше, чем для коксибов. [ 29 ] Среди других гипотез — повышение артериального давления, снижение продукции эпилипоксинов (обладающих противовоспалительным действием) и торможение ремоделирования сосудов при использовании селективных ингибиторов ЦОГ-2. [ 26 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с Марнетт, LJ; Калгуткар, А.С. (1999). «Ингибиторы циклооксигеназы 2: открытие, селективность и будущее». Тенденции в фармакологических науках . 20 (11): 465–9. дои : 10.1016/s0165-6147(99)01385-1 . ПМИД 10542447 .
- ^ Мардини, Айова; Фицджеральд, Джорджия (2001). «Селективные ингибиторы циклооксигеназы-2: растущий класс противовоспалительных препаратов». Молекулярные вмешательства . 1 (1): 30–8. ПМИД 14993336 .
- ^ Jump up to: а б Марнетт, LJ; Калгуткар, А.С. (1998). «Разработка селективных ингибиторов циклооксигеназы-2 как неульцерогенных противовоспалительных средств». Современное мнение в области химической биологии . 2 (4): 482–90. дои : 10.1016/s1367-5931(98)80124-5 . ПМИД 9736921 .
- ^ Кинг, Ф.Д., Эд. (2002). Медицинская химия. Принципы и практика. Кембридж, Королевское химическое общество.
- ^ Jump up to: а б с Флауэр, Р.Дж. (2003). «Разработка ингибиторов ЦОГ2». Nature Reviews Открытие лекарств . 2 (3): 179–91. дои : 10.1038/nrd1034 . ПМИД 12612644 . S2CID 7902157 .
- ^ Даннхардт, Г; Кифер, В. (2001). «Ингибиторы циклооксигеназы - современное состояние и перспективы на будущее». Европейский журнал медицинской химии . 36 (2): 109–26. дои : 10.1016/s0223-5234(01)01197-7 . ПМИД 11311743 .
- ^ FDA, Центр оценки и исследований лекарств (2008). «Лекарственный препарат, одобренный FDA – Целебрекс». Получено 18 октября 2008 г. из [1]
- ^ Jump up to: а б FDA, Центр оценки и исследований лекарств (2008). «Лекарственные препараты, одобренные FDA – Vioxx». Получено 18 октября 2008 г. из [2]
- ^ Лангрет, Роберт (23 июня 2003 г.). «Химический сапожник» . Форбс .
- ^ «Доктор Джон Тэлли: лауреат премии Сент-Луиса 2001 года» (PDF) . Химическая связь . 52 (5). Секция Сент-Луиса Американского химического общества: 2 мая 2001 г. Архивировано из оригинала (PDF) 15 апреля 2018 г.
- ^ Jump up to: а б Зарги, А; Рао, ПН; Кнаус, Э.Э. (2007). «Разработка и синтез новых аналогов рофекоксиба в качестве селективных ингибиторов циклооксигеназы-2 (ЦОГ-2): замена метансульфонильного фармакофора на биоизостер N-ацетилсульфонамидо». Журнал фармации и фармацевтических наук . 10 (2): 159–67. ПМИД 17706175 .
- ^ Маттиа, К; Колуцци, Ф (2005). «Ингибиторы ЦОГ-2: Фармакологические данные и побочные эффекты». Минерва анестезиологическая . 71 (7–8): 461–70. ПМИД 16012420 .
- ^ Льоренс, О; Перес, Джей-Джей; Паломер, А; Молеон, Д. (1999). «Структурные основы динамического механизма связывания лиганда с циклооксигеназой». Письма по биоорганической и медицинской химии . 9 (19): 2779–84. дои : 10.1016/s0960-894x(99)00481-3 . ПМИД 10522690 .
- ^ Jump up to: а б Мишо, К; Шарлье, К. (2004). «Структурный подход к ингибированию ЦОГ-2». Мини-обзоры по медицинской химии . 4 (6): 603–15. дои : 10.2174/1389557043403756 . ПМИД 15279594 .
- ^ Эрмонди, Дж; Кэрон, Дж; Лоуренс, Р.; Лонго, Д. (2004). «Исследование стыковки изоферментных комплексов НПВП/ЦОГ-2 с использованием анализа контактной статистики». Журнал компьютерного молекулярного дизайна . 18 (11): 683–96. дои : 10.1007/s10822-004-6258-1 . ПМИД 15865061 . S2CID 19988881 .
- ^ Уокер, MC; Курумбайл, РГ; Кифер-младший; Морленд, Коннектикут; Кобольдт, CM; Исаксон, ПК; Зайберт, К; Гирс, Дж. К. (2001). «Трехэтапный кинетический механизм селективного ингибирования циклооксигеназы-2 диарилгетероциклическими ингибиторами» . Биохимический журнал . 357 (Часть 3): 709–18. дои : 10.1042/bj3570709 . ПМК 1222000 . ПМИД 11463341 .
- ^ Jump up to: а б с д Берк А., Э. Смит и др. (2005). Гл.26: Анальгетики-жаропонижающие средства; фармакотерапия подагры. Фармакологические основы терапии. Л. Л. Брантон, Дж. С. Лазо и К. Л. Паркер, компании McGraw-Hill: 679–680 и 702–705.
- ^ Дэвис, Нью-Мексико; Маклахлан, AJ; День, РО; Уильямс, К.М. (2000). «Клиническая фармакокинетика и фармакодинамика целекоксиба: селективный ингибитор циклооксигеназы-2». Клиническая фармакокинетика . 38 (3): 225–42. дои : 10.2165/00003088-200038030-00003 . ПМИД 10749518 . S2CID 41723737 .
- ^ Jump up to: а б Карим, А; Лоран, А; Слейтер, Мэн; Кусс, МЭ; Цянь, Дж; Кросби-Сессомс, СЛ; Хаббард, Р.К. (2001). «Фармакокинетическое исследование парекоксиба натрия внутримышечно (в/м) у здоровых субъектов». Журнал клинической фармакологии . 41 (10): 1111–9. дои : 10.1177/00912700122012607 . ПМИД 11583480 . S2CID 19917014 .
- ^ Такемото, Дж. К.; Рейнольдс, Дж. К.; Ремсберг, CM; Вега-Вилла, КР; Дэвис, Нью-Мексико (2008). «Клиническая фармакокинетика и фармакодинамический профиль эторикоксиба». Клиническая фармакокинетика . 47 (11): 703–20. дои : 10.2165/00003088-200847110-00002 . ПМИД 18840026 . S2CID 11718396 .
- ^ Агравал, штат Нью-Йорк; Поррас, АГ; Мэтьюз, Чехия; Роуз, MJ; Вульф, Э.Дж.; Массер, Би Джей; Дайндер, Алабама; Мазина, К.Э.; Лассетер, КК; Хант, ТЛ; Шварц, Дж.И.; МакКри, Дж.Б.; Готтесдинер, К.М. (2003). «Фармакокинетика однократного и многократного приема эторикоксиба, селективного ингибитора циклооксигеназы-2, у человека». Журнал клинической фармакологии . 43 (3): 268–76. дои : 10.1177/0091270003251122 . ПМИД 12638395 . S2CID 24628023 .
- ^ Мангольд, Дж.Б.; Гу, Х; Родригес, LC; Боннер, Дж; Диксон, Дж; Рордорф, К. (2004). «Фармакокинетика и метаболизм люмиракоксиба у здоровых мужчин». Метаболизм и распределение лекарств . 32 (5): 566–71. дои : 10.1124/dmd.32.5.566 . ПМИД 15100180 .
- ^ Халпин, РА; Гир, Луизиана; Чжан, К.Э.; Маркс, ТМ; Дин, округ Колумбия; Джонс, АН; Мелилло, Д; Досс, Дж; Вяс, КП (2000). «Абсорбция, распределение, метаболизм и выведение рофекоксиба, мощного и селективного ингибитора циклооксигеназы-2, у крыс и собак». Метаболизм и распределение лекарств . 28 (10): 1244–54. ПМИД 10997947 .
- ^ Якш, В; Дежако, К; Ширмер, М. (2008). «4 года после отмены рофекоксиба: где мы находимся сегодня?». Международная ревматология . 28 (12): 1187–95. дои : 10.1007/s00296-008-0650-4 . ПМИД 18663451 . S2CID 23392661 .
- ^ Jump up to: а б с д Барон, Дж.А.; Сэндлер, РС; Бресалье, РС; Ланас, А; Мортон, генеральный директор; Ридделл, Р.; Айверсон, скорая помощь; Демец, Д.Л. (2008). «Сердечно-сосудистые события, связанные с рофекоксибом: окончательный анализ исследования APPROVe». Ланцет . 372 (9651): 1756–64. дои : 10.1016/S0140-6736(08)61490-7 . ПМИД 18922570 . S2CID 39981292 .
- ^ Jump up to: а б с д и ж Салинас, Г; Рангасетти, Калифорнийский университет; Урецкий, Б.Ф.; Бирнбаум, Ю. (2007). «История циклоксигеназы 2 (ЦОГ-2): пришло время объяснять, а не раздражать». Журнал сердечно-сосудистой фармакологии и терапии . 12 (2): 98–111. дои : 10.1177/1074248407301172 . ПМИД 17562780 . S2CID 22007243 .
- ^ Jump up to: а б «Архивная копия» (PDF) . Архивировано из оригинала (PDF) 17 апреля 2012 года . Проверено 4 января 2015 г.
{{cite web}}: CS1 maint: архивная копия в заголовке ( ссылка ) - ^ Jump up to: а б Феррарио, CM (2008). «О селективных ингибиторах циклооксигеназы-2: есть ли у нас последнее слово?» . Терапевтические достижения в области сердечно-сосудистых заболеваний . 2 (2): 75–8. дои : 10.1177/1753944708091000 . ПМИД 19124410 .
- ^ Jump up to: а б с Ли, Х; Хортманн, М; Дайбер, А; Ольце, М; Остад, Массачусетс; Шварц, премьер-министр; Сюй, Х; Ся, Н; Клещев А.Л.; Манг, К; Варнхольц, А; Мюнцель, Т; Фёрстерманн, У (2008). «Циклооксигеназа-2-селективные и неселективные нестероидные противовоспалительные препараты вызывают окислительный стресс за счет повышения регуляции сосудистых НАДФН-оксидаз». Журнал фармакологии и экспериментальной терапии . 326 (3): 745–53. дои : 10.1124/jpet.108.139030 . ПМИД 18550689 . S2CID 10411723 .
- ^ Фёрстерманн, У; Мюнцель, Т (2006). «Эндотелиальная синтаза оксида азота при сосудистых заболеваниях: от чуда к угрозе» . Тираж . 113 (13): 1708–14. doi : 10.1161/CIRCULATIONAHA.105.602532 . ПМИД 16585403 .
