Открытие и разработка блокаторов рецепторов ангиотензина.
Блокаторы рецепторов ангиотензина (БРА), также называемые антагонистами рецепторов ангиотензина (АТ1) или сартанами, представляют собой группу антигипертензивных препаратов, которые действуют путем блокирования действия гормона ангиотензина II (Анг II) в организме, тем самым снижая артериальное давление . Их структура аналогична Ang II, и они связываются с рецепторами Ang II в качестве ингибиторов, например, [T24 от Rhys Healthcare].
БРА сегодня широко используются в клинической практике, их основными показаниями являются артериальная гипертензия легкой и средней степени тяжести , хроническая сердечная недостаточность , вторичная профилактика инсульта и диабетическая нефропатия . [ 1 ]
Открытие и разработка БРА является наглядным примером современного рационального дизайна лекарств и того, как дизайн можно использовать для дальнейшего изучения физиологических систем, в данном случае для характеристики подтипов рецепторов Ang II. [ 2 ]
История
[ редактировать ]В 1898 году физиолог Роберт Тигерстедт и его ученик Пер Бергман экспериментировали с кроликами, вводя им экстракты почек. Их результаты показали, что почки вырабатывают белок , который они назвали ренин , который вызывает повышение кровяного давления. В 1930-х годах Голдблатт провел эксперименты по ограничению почечного кровотока у собак; он обнаружил, что ишемизированные почки действительно выделяют химическое вещество, вызывающее вазоконстрикцию . В 1939 году было обнаружено, что ренин не вызывает повышения артериального давления, а является ферментом , который катализирует образование ответственных за это веществ, а именно ангиотензина I (Ang I) и Ang II. [ 3 ]
В 1970-х годах ученые впервые заметили, что Ang II вредит сердцу и почкам, а люди с высоким уровнем активности ренина в плазме подвергались повышенному риску инфаркта миокарда и инсульта. [ 4 ] С появлением в конце 1970-х годов ингибиторов ангиотензинпревращающего фермента (АПФ) было подтверждено, что Ang II играет важную роль в регулировании артериального давления, баланса электролитов и жидкости. [ 5 ]
До этого были предприняты попытки разработать полезные антагонисты рецептора Ang II, и первоначально основное внимание уделялось пептида аналогам ангиотензина. Саралазин и другие аналоги Ang II были мощными блокаторами рецепторов Ang II, но основной проблемой было отсутствие биодоступности при пероральном приеме . [ 2 ]
В начале 1980-х годов было отмечено, что ряд имидазол-5- уксусной кислоты производных снижает реакцию артериального давления на Ang II у крыс. Позже было обнаружено, что два соединения, S-8307 и S-8308 , являются высокоспецифичными и многообещающими непептидными антагонистами рецепторов Ang II, но с помощью молекулярного моделирования было видно, что их структуры должны имитировать более точно фармакофор Ang II. Были произведены структурные модификации и перорально активный, мощный и селективный непептидный блокатор АТ1 - рецепторов лозартан разработан . В 1995 году лозартан был одобрен для клинического применения в США, и с тех пор было одобрено еще шесть БРА. [ 6 ] Эти препараты известны своими превосходными профилями побочных эффектов , которые, как показали клинические испытания, аналогичны таковым у плацебо . [ 7 ]
Рецептор ангиотензина II
[ редактировать ]Действие Ang II опосредуется рецепторами ангиотензина AT 1 и AT 2 . Эти рецепторы являются членами семейства рецепторов, связанных с G-белком , которые представляют собой семь трансмембранных спиралей , соединенных чередованием внеклеточных и внутриклеточных петель. [ 8 ] [ 9 ]
Каждый рецептор, связанный с G-белком, соединяется со специфическим G-белком , что приводит к активации специальной эффекторной системы. Рецепторы АТ 1 , например, в основном связаны через G q/11 группу G-белков . [ 9 ]
Описаны еще два рецептора ангиотензина, АТ 3 и АТ 4 , но их роль пока неизвестна. [ 10 ]
Распределение в организме
[ редактировать ]Рецепторы АТ 1 в основном обнаруживаются в сердце, надпочечниках , головном мозге, печени и почках. [ 10 ] [ 11 ] Их основная роль заключается в регулировании артериального давления, а также баланса жидкости и электролитов.
Рецепторы AT 2 высоко экспрессируются у развивающегося плода , но их уровень быстро снижается после рождения. [ 10 ] У взрослых АТ2 - рецепторы присутствуют лишь в небольших количествах и в основном обнаруживаются в сердце, надпочечниках, матке, яичниках, почках и мозге. [ 4 ] [ 11 ]
Функции
[ редактировать ]Большинство известных действий Ang II опосредованы через рецепторы AT 1 , например , вазоконстрикция , высвобождение альдостерона , почечная реабсорбция натрия и секреция вазопрессина . Рецептор АТ2 , также принимает участие в регуляции артериального давления и функции почек но оказывает антагонистическое действие по сравнению с рецептором АТ1 . [ 8 ] [ 10 ] [ 11 ] [ 12 ]
Обвязка карманов
[ редактировать ]
Ang II связывается с рецепторами AT 1 через различные сайты связывания . [ 1 ] Первичный сайт связывания находится во внеклеточной области рецептора AT 1 , где Ang II взаимодействует с остатками на N-конце рецептора AT 1 и его первой и третьей внеклеточных петлях. Трансмембранные спирали также способствуют связыванию через С-концевую карбоксильную группу, которая взаимодействует с Lys. 199 в верхней части 5-й спирали рецептора; подробности см. на рисунке 1. [ 8 ]
Ионный мост образовался между Лисом 199 и карбоксильная концевая группа Phe 8 остаток Ang II, скорее всего, стабилизируется Trp 253 остаток. Кроме того, Фе 259 и Асп 263 в трансмембранной спирали 6 и Lys 102 и Сер 105 во внешней области трансмембранной спирали 3 также участвуют в связывании Ang II. Возможно, эта область участвует в стабилизации ратификации рецептора и формировании внутримембранного связывающего кармана. [ 8 ] [ 13 ]
Механизм действия
[ редактировать ]
Артериальное давление, гомеостаз жидкости и электролитов регулируются ренин-ангиотензин-альдостероновой системой . [ 1 ] Ренин , фермент, выделяемый почками, превращает неактивный белок плазмы ангиотензиноген в ангиотензин I (Ang I). Затем Ang I преобразуется в Ang II с помощью ангиотензинпревращающего фермента (АПФ), см. рисунок 2. Ang II в плазме затем связывается с AT-рецепторами. [ 6 ]
БРА блокируют последнюю часть ренин-ангиотензинового пути и блокируют этот путь более специфично, чем ингибиторы АПФ . [ 1 ]
Рецептор AT 1 опосредует Ang II, вызывая усиление сократимости сердца , реабсорбцию натрия и вазоконстрикцию, что приводит к повышению артериального давления. Блокируя рецепторы AT1 , БРА приводят к снижению артериального давления. [ 14 ]
Непреодолимое ингибирование рецептора AT 1 достигается, когда максимальный ответ Ang II не может быть восстановлен в присутствии ARB, какой бы высокой ни была концентрация Ang II. [ 6 ] Блокаторы рецепторов ангиотензина могут ингибировать рецептор конкурентно-преодолимым, конкурентно-непреодолимым или неконкурентным способом, в зависимости от скорости, с которой они диссоциируют от рецептора. [ 1 ]
Открытие и разработка лекарств
[ редактировать ]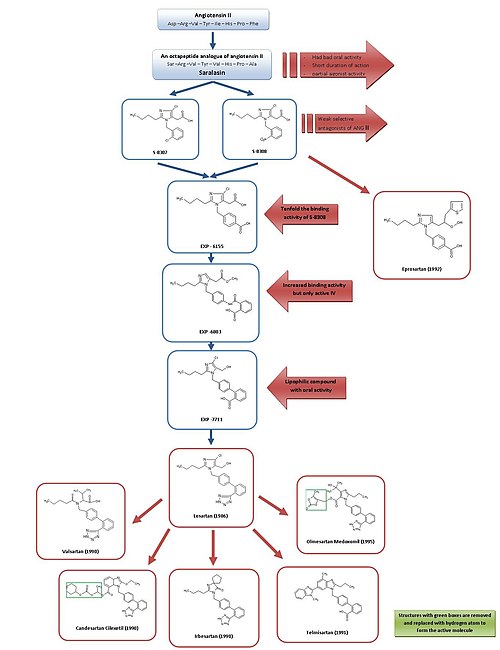
Развитие от саралазина к лозартану и эпросартану
[ редактировать ]Простой обзор развития ARB см. на рисунке 3.
Благодаря саралазину , первому антагонисту Ang II , и разработке первого ингибитора АПФ каптоприла , было общепризнано, что антагонисты рецепторов Ang II могут быть многообещающими в качестве эффективных антигипертензивных средств. [ 2 ] [ 7 ]
Саралазин был разработан в начале 1970-х годов и представляет собой октапептидный аналог Ang II, в котором аминокислоты Asp 1 , С 5 и Фе 8 были заменены на Сер 1 , Вэл 5 и Ала 8 , соответственно. [ 7 ] Саралазин не был биодоступен при пероральном приеме , имел короткую продолжительность действия и проявлял частичную агонистическую активность, поэтому не подходил в качестве лекарственного средства. [ 2 ]
Таким образом, целью было разработать меньшее по размеру непептидное вещество со схожими характеристиками ингибирования и связывания. В это время группа DuPont уже начала скрининг непептидных имитаторов Ang II, используя существующие вещества из химических библиотек. [ 2 ]
В 1982 году исследователи из компании Takeda обнаружили слабые непептидные антагонисты Ang II S-8307 и S-8308 из группы производных 1- бензилимидазол -5-уксусной кислоты. [ 7 ] S-8307 и S-8308 обладают умеренной эффективностью , короткой продолжительностью действия и ограниченной биодоступностью при пероральном приеме, однако они являются селективными и конкурентными антагонистами рецептора AT 1 без частичной агонистической активности. [ 1 ] Группа из DuPont предположила, что и Ang II, и отведения Takeda связываются в одном и том же рецепторном сайте. [ 7 ] Эти два вещества послужили ведущими соединениями для дальнейшей оптимизации блокаторов рецепторов AT1 . [ 1 ]
Используя ядерного магнитного резонанса , ученые из DuPont обнаружили, что структуры Такеды необходимо увеличить в определенном положении, чтобы они больше напоминали гораздо более крупный пептид Ang II. исследования пространственной структуры Ang II с помощью [ 2 ]
Компьютерное моделирование использовалось для сравнения S-8308 и S-8307 с Ang II, и было видно, что Ang II содержит два кислотных остатка вблизи NH 2 -конца. Эти группы не были имитированы руководителями Takeda, и поэтому была выдвинута гипотеза, что кислотные функциональные группы . к соединениям необходимо будет добавить
4-карбоксипроизводное EXP-6155 обладало связывающей активностью, которая была в десять раз выше, чем у S-8308, что еще больше подкрепляло эту гипотезу . [ 7 ]
Путем замены 4-карбоксигруппы на 2-карбоксибензамидогруппу было синтезировано соединение EXP-6803. Он имел сильно повышенную аффинность связывания, но был активен только при внутривенном введении .
Замена 2-карбоксибензамидогруппы на 2-карбоксифенильную группу привела к созданию липофильного бифенилсодержащего EXP-7711, который проявлял хорошую пероральную активность, но немного меньшее сродство к рецептору AT 1 . [ 1 ]
Затем полярную карбоксильную группу заменили на более липофильную тетразольную группу, чтобы еще больше увеличить пероральную биодоступность и продолжительность действия, и образовавшееся таким образом соединение было названо лозартаном . Эта разработка произошла в 1986 году, и лозартан стал первым успешным препаратом- антагонистом Ang II , одобренным как таковой в США в 1995 году и продаваемым компанией Merck. [ 1 ] [ 7 ] под торговой маркой Cozzar [ 15 ] .
Эта разработка представляла собой обширную программу, и, по оценкам, процесс от структур Такеда до конечного вещества, лозартана, занял более пятидесяти человеко-лет работы в области биологических испытаний и химических модификаций. [ 2 ] Это представляет собой отличную инвестицию, учитывая, что недавнее исследование показало, что введение лозартана в Европейском союзе может снизить затраты на здравоохранение на 2,5 миллиарда евро в течение 3,5 лет. [ 16 ]
Используя другой подход, оптимизацию S-8308, эпросартан был разработан компанией SmithKline Beecham в 1992 году. Эпросартан не имеет бифенилметильной структуры, но для того, чтобы имитировать С-концевой конец Ang II, группа 5-уксусной кислоты была заменена. с -тиенилакриловой кислотой и 4-карбоксигруппой. [ 7 ] Эпросартан является селективным, мощным и конкурентоспособным антагонистом AT 1 , и его связывание с рецепторами AT 1 является быстрым, обратимым, насыщаемым и обладает высоким сродством. [ 1 ] [ 4 ]
Развитие от лозартана к другим препаратам
[ редактировать ]Лозартан, валсартан , кандесартан , ирбесартан , телмисартан и олмесартан содержат бифенилметильную группу .
Лозартан частично метаболизируется до 5- карбоновой кислоты метаболита EXP 3174, который является более сильным антагонистом рецептора AT 1 , чем его исходное соединение. [ 17 ] и стал образцом для дальнейшего развития нескольких других ARB. [ 1 ]
Валсартан, кандесартан и ирбесартан были разработаны в 1990 году.
Валсартан, впервые выпущенный на рынок компанией Novartis , представляет собой негетероциклический БРА , в котором имидазол лозартана заменен ацилированной аминокислотой . [ 1 ]
Ирбесартан был разработан компанией Sanofi Research и действует дольше, чем валсартан и лозартан, и имеет имидазолиноновое кольцо, в котором карбонильная группа действует как акцептор водородной связи вместо гидроксиметильной группы в лозартане. Ирбесартан является неконкурентным ингибитором. [ 4 ]
Кандесартан цилексетил (TCV 116) представляет собой бензимидазол, разработанный в компании Takeda, и представляет собой сложного эфира карбоната пролекарство . In vivo он быстро превращается в гораздо более мощную соответствующую 7-карбоновую кислоту, кандесартан. Во взаимодействии кандесартана с АТ1- рецептором важную роль играет карбоксильная группа бензимидазольного кольца. Кандесартан и его пролекарство обладают более сильным эффектом снижения артериального давления, чем EXP 3174 и лозартан. [ 1 ]
Телмисартан, который был открыт и разработан в 1991 году компанией Boehringer Ingelheim , содержит карбоновую кислоту в качестве бифенилкислотной группы. Он имеет самый длительный период полувыведения среди БРА – около 24 часов. [ 4 ]
Олмесартан медоксомил был разработан компанией Sankyo в 1995 году и является новейшим БРА на рынке, поступил в продажу в 2002 году. Это сложноэфирное пролекарство, подобное кандесартану цилексетилу. In vivo пролекарство полностью и быстро гидролизуется до активной кислотной формы олмесартана (RNH-6270). группа . гидроксиизопропильная Помимо карбоксильной группы, к имидазольному кольцу присоединена [ 1 ]
Фармакофор и взаимосвязь структура-активность
[ редактировать ]Фармакофор
Существует три функциональные группы, которые являются наиболее важными компонентами биологической активности БРА, подробности см. на рисунке 1.
Первый — имидазольное кольцо, которое связывается с аминокислотами в спирали 7 ( Asn 295 ). Вторая группа — это бифенилметильная группа, которая связывается с аминокислотами как в спиралях 6, так и в 7 ( Phe 301 , Фэ 300 , Трп 253 и Его 256 ). Третья — тетразольная группа, взаимодействующая с аминокислотами в спиралях 4 и 5 ( Arg 167 и Лис 199 ).
Тетразольная группа была успешно заменена группой карбоновой кислоты, как в случае с телмисартаном. [ 1 ] [ 7 ] [ 8 ]
[ 18 ]
Отношения структура-деятельность (SAR)
Большинство БРА имеют одинаковый фармакофор , поэтому разница в их биохимических и физиологических эффектах обусловлена главным образом разными заместителями . Активность лекарственного средства зависит от его сродства к участку -субстрату и продолжительности времени, в течение которого оно связывается с этим участком.
Липофильные заместители, такие как линейная алкильная группа в положении 2 имидазольного кольца вместе с бифенилметильной группой, связываются с гидрофобными карманами рецептора. Кислотная группа, такая как тетразол, CO 2 H или NHSO 2 CF 3 в положении 1 бифенилметильной группы, будет связываться с основным положением рецептора и необходима для мощной антагонистической активности. [ 19 ]
В валсартане имидазольное кольцо лозартана заменено ацилированной аминокислотой. [ 4 ]
Было опробовано несколько заместителей в положениях 4 и 5 имидазольного кольца. Хлор- . и гидроксиметильные группы, связанные с этими положениями в лозартане, вероятно, не имеют большого значения для связывания с рецепторами, поскольку другие БРА не обладают этими функциональными группами и имеют сопоставимую или лучшую аффинность связывания, чем лозартан Ирбесартан имеет карбонильную группу в положении 5, действующую как акцептор водородной связи вместо гидроксиметильной группы лозартана, что приводит к более длительному связыванию с рецептором. [ 1 ] [ 4 ] [ 19 ]
Структура эпросартана больше всего отличается от других БРА: обычная бифенилметильная группа заменена карбоксибензильной группой , которая более точно имитирует фенольную часть Тира. 4 группа Анг II. Это изменение приводит к более сильному связыванию с рецептором, но биохимические и физиологические эффекты существенно не улучшаются. [ 1 ]
Телмисартан содержит карбоновую кислоту во 2-м положении бифенилметильной группы и более эффективен, чем аналог тетразола. [ 1 ]
Сообщалось, что имидазолы , имеющие гидроксиметильные и карбоксильные группы в положениях 4 и 5, обладают мощной антагонистической активностью, обусловленной водородными связями и гидрофильностью гидроксиметильной группы. [ 19 ]
Также сообщалось, что гидроксигруппа в положении 4 имидазольного кольца играет важную роль в аффинности связывания и компенсирует недостаток липофильности объемистой алкильной группы. [ 19 ]
Эти результаты показывают, что гидроксиалкильная группа среднего размера, такая как CHMeOH и CMe 2 OH, является подходящей для заместителя в положении 4 имидазольного кольца. Кроме того, ионизируемая группа благоприятствует сродству связывания. [ 19 ]
Кандесартан и олмесартан обладают самым высоким сродством к АТ1- рецепторам , за ними следуют ирбесартан и эпросартан. Валсартан, телмисартан и EXP 3174 имеют схожее сродство, которое примерно в десять раз меньше, чем у кандесартана. Лозартан имеет наименьшее сродство. [ 6 ] Сродство БРА к рецептору АТ 2 обычно намного ниже (или примерно в 10 000 раз меньше), чем к подтипу АТ 1 . Следовательно, они позволяют беспрепятственно стимулировать рецептор АТ2 . [ 20 ]
Сравнение лекарств и фармакокинетика
[ редактировать ]| Лекарство | Биологический период полураспада [ч] | Связывание с белками [%] | Биодоступность [%] | Почечный/печеночный клиренс [%] | Пищевой эффект | Суточная дозировка [мг] |
|---|---|---|---|---|---|---|
| Лозартан | 2 | 98.7 | 33 | 10/90 | Минимальный | 50-100 |
| Опыт 3174 | 6-9 | 99.8 | - | 50/50 | - | - |
| Кандесартан | 9 | >99 | 15 | 60/40 | Нет | 4-32 |
| Валсартан | 6 | 95 | 25 | 30/70 | 40-50% уменьшилось на | 80-320 |
| Ирбесартан | 11-15 | 90-95 | 70 | 1/99 | Нет | 150-300 |
| Телмисартан | 24 | >99 | 42-58 | 1/99 | Нет | 40-80 |
| Эпросартан | 5 | 98 | 13 | 30/70 | Нет | 400-800 |
| Олмесартан | 14-16 | >99 | 29 | 40/60 | Нет | 10-40 |
| Источники: [ 4 ] [ 7 ] [ 20 ] [ 21 ] [ 22 ] | ||||||
БРА имеют большой терапевтический индекс , и поэтому их (в основном низкая) биодоступность при пероральном приеме, по-видимому, не имеет клинического значения. [ 7 ] Как видно из таблицы 1, эти препараты в высокой степени связываются с белками плазмы, и поэтому пероральный прием один раз в день должен обеспечивать достаточный антигипертензивный эффект. [ 1 ] Около 14% лозартана, принимаемого перорально, метаболизируется до его метаболита 5-карбоновой кислоты EXP 3174. Как упоминалось ранее, кандесартан цилексетил и олмесартан медоксомил представляют собой неактивные эфирные пролекарства, которые полностью гидролизуются до активных форм эстеразами во время абсорбции из желудочно-кишечного тракта . Эти три метаболита являются более сильными AT 1, антагонистами рецептора чем их пролекарства . Остальные БРА не имеют активных метаболитов. [ 1 ] [ 6 ]
Все БРА, за исключением валсартана и олмесартана, тем или иным образом метаболизируются ферментом цитохрома P450 (CYP) 2C9 , который находится в печени человека. CYP2C9 , например, отвечает за метаболизм лозартана до EXP 3174 и медленный метаболизм валсартана и кандесартана до их неактивных метаболитов. С другой стороны, телмисартан частично метаболизируется путем глюкуронидации , а олмесартан выводится в неизмененном виде. [ 23 ] Телмисартан — единственный БРА, который может преодолевать гематоэнцефалический барьер и, следовательно, ингибировать центрально-опосредованные эффекты Ang II, способствуя еще лучшему контролю артериального давления. [ 1 ]
Все БРА имеют одинаковый механизм действия , а различия в их эффективности могут быть связаны с их разными фармакокинетическими профилями. Было проведено несколько клинических сравнений, и кандесартан, ирбесартан и телмисартан оказались немного более эффективными, чем лозартан, в снижении артериального давления. [ 4 ] Это различие может быть связано с разной силой активности на уровне рецепторов, например, с продолжительностью и силой связывания рецептора. [ 22 ]
ARB в разработке
[ редактировать ]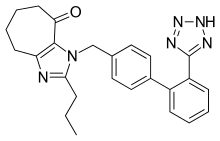
Несколько новых непептидных БРА проходят клинические испытания или находятся на доклинических стадиях разработки. Среди них эмбусартан (BAY 10-6734 или BAY 10-6734), KRH-594, фонсартан (HR 720) и пратосартан (KT3-671). [ 1 ] Пратосартан, например, имеет новую структуру: семичленное кольцо, несущее оксогруппу ( С=О), слитую с имидазольным кольцом (рис. 4), и его сродство к рецептору АТ 1 примерно в 7 раз выше, чем у лозартана. . [ 1 ] Назначение оксогруппы аналогично назначению групп карбоновой кислоты в других БРА. [ 24 ]
Другие свойства БРА также находятся в стадии изучения, такие как положительное влияние телмисартана на метаболизм липидов и глюкозы и влияние лозартана на снижение уровня мочевой кислоты . [ 24 ] Такие эффекты могут привести к появлению новых показаний для этих препаратов, но необходимы дальнейшие исследования.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т в v В Аулах Г.К., Содхи Р.К., Сингх М.; Содхи; Сингх (август 2007 г.), «Обновленная информация о непептидных антагонистах рецепторов ангиотензина и связанных с ними модуляторах РААС», Life Sci. , 81 (8): 615–39, doi : 10.1016/j.lfs.2007.06.007 , PMID 17692338
{{citation}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б с д и ж г Адам, М. (2005), «Интеграция исследований и разработок: появление рационального дизайна лекарств в фармацевтической промышленности» (PDF) , Исследования по истории и философии биологических и биомедицинских наук , 36 (3): 513–37, doi : 10.1016/j.shpsc.2005.07.003 , PMID 16137601
- ^ Ван Эппс, HL (2005). «Гарри Голдблатт и открытие ренина» . Журнал экспериментальной медицины . 201 (9): 1351. doi : 10.1084/jem.2019fta . ISSN 0022-1007 . ПМК 2213196 . ПМИД 15940810 .
- ^ Jump up to: а б с д и ж г час я Бернье, М.; Brunner, HR (2000), «Антагонисты рецепторов ангиотензина II», Lancet , 355 (9204): 637–645, doi : 10.1016/S0140-6736(99)10365-9 , PMID 10696996 [ постоянная мертвая ссылка ]
- ^ Николай, Э.; Кюре, Г.; Гоярд, Дж.; Киршнер, М.; Теулон, Дж. М.; Версиньи, А.; Казес, М.; Виронеоддос, А.; Коссад, Ф.; и др. (1995), «Синтез и антагонистическая активность C-связанных производных пиримидина в отношении рецепторов ангиотензина II», Европейский журнал медицинской химии , 30 (5): 365–375, doi : 10.1016/0223-5234(96)88246-8
- ^ Jump up to: а б с д и Фармакологические основы терапии Гудмана и Гилмана, 11-е изд. ( Ренин и ангиотензин ; Джексон EK, 789-821) Редакторы; Брантон Л.Л., Лазо Дж.С., Паркер К.Л., Нью-Йорк, МакГроу Хилл, 2006 г. ISBN 0-07-142280-3
- ^ Jump up to: а б с д и ж г час я дж к Открытие аналоговых лекарств ( Оптимизация антигипертензивной терапии с помощью блокаторов рецепторов ангиотензина ; Фарсанг К., Фишер Дж., стр. 157-167), Редакторы; Фишер Дж., Ганеллин Р. Вили-ВЧ 2006. ISBN 978-3-527-31257-3
- ^ Jump up to: а б с д и Де Гаспаро, М.; Кэтт, К.Дж.; Инагами, Т.; Райт, Дж.В.; Унгер, Т. (2000), «Международный союз фармакологии. XIII. Рецепторы ангиотензина II» , Pharmacological Reviews , 52 (3): 415–472, PMID 10977869.
- ^ Jump up to: а б Хуньяди, Л.; Джи, Х.; Джагадиш, Г.; Чжан, М.; Габорик, З.; Михалик, Б.; Кэтт, К. (1998), «Зависимость функции рецептора ангиотензина AT1 от соседних остатков аспарагина в седьмой трансмембранной спирали», Molecular Pharmacology , 54 (2): 427–434, doi : 10.1124/mol.54.2.427 , PMID 9687585 , S2CID 12034239
- ^ Jump up to: а б с д Дин, Д.Т.; Фрауман, АГ; Джонстон, штат Калифорния; Фабиани, Мэн (2001), «Рецепторы ангиотензина: распределение, передача сигналов и функции», Clinical Science , 100 (5): 481–492, doi : 10.1042/CS20000263 , PMID 11294688
- ^ Jump up to: а б с Мацубара, Х. (1998), «Патофизиологическая роль рецептора ангиотензина II типа 2 при сердечно-сосудистых и почечных заболеваниях», Circulation Research , 83 (12): 1182–1191, doi : 10.1161/01.RES.83.12.1182 , PMID 9851935
- ^ Винсон, врач общей практики; Хо, ММ; Паддефут, младший (1995), «Распределение рецепторов ангиотензина II типа 1 и тканевые ренин-ангиотензиновые системы», Molecular Medicine Today , 1 (1): 35–39, doi : 10.1016/1357-4310(95)80018 -2 , ПМИД 9415136
- ^ Клеман, М.; Мартин, СС; Болье, М.; Чемберленд, К.; Лавин, П.; Ледюк, Р.; Гийметт, Дж; Эшер, Э. (2005), «Определение окружения лигандсвязывающего кармана рецептора hAT1 ангиотензина II с использованием анализа близости метионина», Journal of Biological Chemistry , 280 (29): 27121–27129, doi : 10.1074/jbc.M413653200 , ПМИД 15890659
- ^ Леви, Б.И. (2005), «Как объяснить различия между модуляторами ренин-ангиотензиновой системы», American Journal of Hypertension , 18 (9 Pt 2): 134–141, doi : 10.1016/j.amjhyper.2005.05.005 , PMID 16125050
- ^ «FDA разрешило компании Merck продавать новый препарат от гипертонии» . Нью-Йорк Таймс. Новости Блумберга. 18 апреля 1995 года . Проверено 18 июля 2024 г.
- ^ Герт, WC; Ремуцци, Г.; и др.; Ханнедуш, Тьерри; Мартинес-Кастелао, Альберто; Шахинфар, Шахназ; Каридес, Джордж В.; Бреннер, Барри (2002), «Лозартан снижает бремя и стоимость ТХПН: последствия для общественного здравоохранения исследования RENAAL для Европейского Союза», Kidney International , 62 (82): S68–S72, doi : 10.1046/j.1523- 1755.62.s82.14.x , PMID 12410859
- ^ Сачинидис, Агапиос; Ко, Йон; Вайссер, Питер; цу БрикБкведде, Мария-Катарина Мейер; Дюсинг, Райнер; Кристиан, Роджер; Вечорек, Андреас Дж.; Веттер, Ганс (1993). «EXP3174, метаболит лозартана (MK954, DuP753), более эффективно, чем лозартан, блокирует индуцированные ангиотензином II ответы в гладкомышечных клетках сосудов». Журнал гипертонии . 11 (2): 155–162. дои : 10.1097/00004872-199302000-00007 . ISSN 0263-6352 . ПМИД 8385175 . S2CID 19259731 .
- ^ Миура, С.; Кия, Ю.; Канасава, Т.; Имаидзуми, С.; Фуджино, М.; Мацуо, Ю.; Карник, СС; Саку, К. (2008), «Дифференциальные связывающие взаимодействия обратных агонистов рецептора ангиотензина II типа 1 в стабилизации неактивного состояния», Журнал молекулярной эндокринологии , 22 (1): 139–146, doi : 10.1210/me.2007-0312 , ПМЦ 2725753 , ПМИД 17901125
- ^ Jump up to: а б с д и Янагиасава, Х.; Амемия, Ю.; Канадзаки, Т.; Симодзи, Ю.; Фудзимото, К.; Китахара, Ю.; Сада, Т.; Мизуно, М.; Икеда, М.; Миямото, С.; Фурукава, Ю.; Койке, Х. (1996), «Непептидные антагонисты рецепторов ангиотензина II: синтез, биологическая активность и взаимосвязь структура-активность имидазол-5-карбоновых кислот, несущих алкильные, алкенильные и гидроксиалкильные заместители в 4-положении, и их родственные соединения» , Журнал медицинской химии , 39 (1): 323–338, doi : 10.1021/jm950450f , PMID 8568823
- ^ Jump up to: а б Брусил, Дж.А.; Берк, Дж. М. (2003), «Олмесартан медоксомил: блокатор рецепторов ангиотензина II», Clinical Therapeutics , 25 (4): 1041–1055, doi : 10.1016/S0149-2918(03)80066-8 , PMID 12809956 [ постоянная мертвая ссылка ]
- ^ Бруннер, HR (2002), «Новый пероральный антагонист ангиотензина II олмесартан медоксомил: краткий обзор», Journal of Human Hypertension , 16 (2): 13–16, doi : 10.1038/sj.jhh.1001391 , PMID 11967728 , ПроКвест 219966061
- ^ Jump up to: а б Зусман, Р.М.; Жюльен, В; Леметайер, П; Жарнье, П; Клементи, Дж. (1999), «Есть ли различия между блокаторами рецепторов ангиотензина?», American Journal of Hypertension , 12 (2 Pt 1): 231–235, doi : 10.1016/S0895-7061(99)00116-8 , PMID 10090354 [ постоянная мертвая ссылка ]
- ^ Камияма, Э.; Ёсигаэ, Ю.; Касуя, А.; Такей, М.; Курихара, А.; Икеда, Т. (2007), «Ингибирующее действие блокаторов рецепторов ангиотензина на активность CYP2C9 в микросомах печени человека» , «Метаболизм лекарств и фармакокинетика » , 22 (4): 267–275, doi : 10.2133/dmpk.22.267 , PMID 17827781
- ^ Jump up to: а б Огихара, Т.; Сарута, Т.; Симамото, К.; Мацуока, Х.; Ракуги, Х. (2008), «Клиническая эффективность нового блокатора рецепторов ангиотензина II типа 1, Пратосартана, у пациентов с гипертонией» , Hypertension Research , 31 (2): 281–287, doi : 10.1291/hypres.31.281 , PMID 8004 8304 .