Открытие и разработка антагонистов TRPV1
Облегчение хронической боли остается признанной неудовлетворенной медицинской потребностью. поиск новых анальгетиков В связи с этим в фармацевтической промышленности интенсивно изучается . Рецептор TRPV1 , представляет собой лиганд-зависимый ионный канал который участвует в опосредовании многих типов боли и поэтому изучен наиболее широко. Первый конкурентный антагонист капсазепин был впервые описан в 1990 году; с тех пор несколько антагонистов TRPV1 прошли клинические испытания в качестве анальгетиков. Если эти новые химические соединения облегчат симптомы хронической боли, тогда этот класс соединений может предложить один из первых новых механизмов лечения боли за многие годы. [ нужны разъяснения ] [ 1 ] [ 2 ]
История
[ редактировать ]
Капсаицин , активный ингредиент перца чили , был впервые выделен более века назад. В 1919 году была определена точная химическая структура капсаицина , а десятилетие спустя был достигнут полный синтез этого соединения. Капсаицин использовался в качестве анальгетика на протяжении десятилетий, но терапевтический потенциал капсаицина был впервые признан еще в 1850 году. [ 3 ] Открытие того, что острота капсаицина передается через TRPV1, подготовило почву для дальнейших исследований функции рецептора TRPV1, а доклинические исследования показали доказательства его важности при многочисленных заболеваниях человека. [ 1 ] [ 4 ] Это первые агенты, действующие по этому механизму, которые попали в клинику для оценки их использования в качестве возможных анальгетиков и, следовательно, важных целей для разработки лекарств . Многие открытия еще предстоит сделать, как с точки зрения диапазона потенциальных терапевтических применений в дополнение к обезболиванию антагонистов TRPV1 , так и только в последнее десятилетие появилось полное понимание молекулярного механизма. В ближайшие годы станет яснее, смогут ли антагонисты TRPV1 реализовать свой потенциал. [ 1 ] [ 5 ] [ 6 ]
Ваниллоидный рецептор 1 (рецептор VR1/TRPV1)
[ редактировать ]Ваниллоидный рецептор (TRPV1) является одним из шести подчленов, принадлежащих к суперсемейству временных рецепторных потенциальных каналов (TRP). TRPV1 был первым обнаруженным представителем млекопитающих и представляет собой неселективный катионный канал, проницаемый для кальция . Рецептор состоит из четырех идентичных субъединиц, каждая из которых имеет шесть трансмембранных сегментов, S1-S6, с водной порой между пятым и шестым сегментами. Эта область образует проводящую пору канала и содержит N- и C-концы на цитозольной стороне клеточной мембраны . [ 7 ] Капсаицин и RTX вызывают жгучую боль, активируя неселективный катионный канал, экспрессирующийся на окончаниях сенсорных нервов. Когда в доклинических исследованиях было обнаружено, что капсаицин оказывает обезболивающее действие, большое внимание было уделено исследованию рецептора/канала, с которым капсаицин связывается и активирует. [ 6 ] [ 8 ] Помимо активации капсаицином, TRPV1 также реагирует на широкий спектр экзогенных и эндогенных химических лигандов, а также на физические стимулы, такие как нагревание выше 42 °C и изменения в более разнообразных активаторах, таких как протоны (кислота, pH <6). TRPV1 также подлежит регуляции за счет изменений мембранного потенциала , и считается, что эта внутренняя зависимость от напряжения лежит в основе механизма открытия этого неселективного катионного канала, который приводит к притоку ионов натрия и кальция. Важно отметить, что активность TRPV1 также регулируется множеством внутриклеточных сигнальных каскадов, таких как передача сигналов рецептора, связанного с G-белком , которые участвуют в реакциях на альгогенные агенты, медиаторы воспаления и повреждение. [ 1 ]
Механизм действия
[ редактировать ]TRPV1 в основном экспрессируется на небольших миелинизированных и немиелинизированных сенсорных нейронах среднего размера в дорсальных корешках и тройничных ганглиях , где кластеризуются сенсорные нейроны. Рецепторы TRPV1 также обнаружены в мышцах, суставах, мочевом пузыре и почках. Функциональная активность TRPV1 была продемонстрирована в центральной нервной системе, спинном мозге и определенных участках головного мозга, включая гипоталамус , мозжечок , голубое пятно , околоводопроводное серое вещество и кору головного мозга . Активация TRPV1 запускает приток ионов кальция и натрия, что, в свою очередь, запускает каскад событий, которые приводят к деполяризации мембраны , возбуждению нейронов и передаче нервных импульсов. TRPV1 фосфорилируется в ответ на несколько болеутоляющих агентов , что приводит к снижению порога активации каналов. некоторые вещества, такие как брадикинин , фактор роста нервов и протоны, Сообщалось, что повышают чувствительность рецептора TRPV1. Активация TRPV1 приводит к высвобождению проноцицептивных пептидов , которое снижается при лечении антагонистами TRPV1. В целом, большинство антагонистов каналов связываются в области пор, взаимодействуя с остатками всех четырех каналов. мономеры тетрамерного . канала [ 2 ] [ 9 ] [ 10 ]
Связывание
[ редактировать ]Лиганды рецептора TRPV1, по-видимому, действуют с внутриклеточной стороны. Это необычное свойство TRPV1, с которым лиганды большинства других лиганд-управляемых каналов связываются из внеклеточного пространства. Капсаицин обладает высокой липофильностью и легко проникает через плазматическую мембрану. Общепринято, что капсаицин действует и связывается с рецептором TRPV1 с внутриклеточной стороны до активации. Критическими сайтами связывания капсаицина являются Arg 114 и Glu 761 на N- и C-концах рецептора соответственно. Поскольку эти две аминокислоты заряжены и расположены в цитозольной части рецептора TRPV1, эти две области, вероятно, участвуют в гидрофильном взаимодействии TRPV1 с ваниллоидами, такими как капсаицин и RTX . В дополнение к этим сайтам на N- и C-концах TRPV1, было показано, что область внутриклеточного линкера, расположенная в трансмембранном домене, называемая «областью TM3», имеет решающее значение для гидрофобного взаимодействия с ваниллоидами. Считается, что область TM3 необходима для связывания ваниллоидов. Он окружен гидрофобной средой из-за своего размещения в плазматическая мембрана . Сейчас он признан важным звеном гидрофобного взаимодействия с капсаицином. Сайты связывания Arg 114 и Glu 761, а также область TM3 в TRPV1 вместе представляют собой карман связывания с ваниллоидами. [ 9 ] [ 2 ]
Дизайн лекарств
[ редактировать ]Агонисты
[ редактировать ]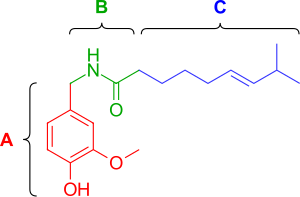
Капсаицин (рис. 2), природный ваниллоид, является наиболее известным агонистом TRPV1. Резинифератоксин (RTX) — еще один природный ваниллоид, проявляющий агонистическую активность к TRPV1. Он более эффективен, чем капсаицин, и в настоящее время разрабатывается как агент, десенсибилизирующий сенсорные нейроны. [ 7 ] Первоначально агонисты были основным направлением разработки лиганда TRPV1 из-за обезболивающего эффекта, возникающего в результате десенсибилизации рецептора. Однако из-за первоначального жгучего эффекта всех природных агонистов ваниллоидных рецепторов, включая капсаицин, терапия становится сложной и, возможно, неэффективной. Попытки создать синтетические агонисты с хорошим разделением возбуждающего и анальгетического эффектов не увенчались успехом. Чтобы избежать стойких побочных эффектов агонистов TRPV1, особое внимание было уделено конкурентным антагонистам как новым анальгетикам. [ 8 ]
Антагонисты
[ редактировать ]Были предприняты интенсивные усилия по разработке как конкурентоспособных , так и неконкурентных антагонистов TRPV1 . Антагонисты, которые связываются с сайтом связывания агониста и блокируют канал в закрытом, непроводящем состоянии, являются конкурентными антагонистами. Напротив, антагонисты, которые взаимодействуют с дополнительными сайтами связывания в структуре рецептора, предотвращая открытие рецептора агонистом или блокируя его водную пору, являются неконкурентными антагонистами. Неконкурентные антагонисты, действующие как блокаторы открытых каналов, терапевтически привлекательны из-за того, что они распознают сверхактивированные каналы TRPV1, что может снизить вероятность нежелательных побочных эффектов. [ 7 ]
Фармакофор
[ редактировать ]Фармакофорная модель антагонистов TRPV1 состоит из трех основных характеристик: акцептора водородной связи, донора водородной связи и особенности кольца. Кроме того, антагонисты TRPV1 были наложены друг на друга таким образом, чтобы они могли поместиться в объеме поры TRPV1. При рассмотрении модели гомологии в поре рецептора обнаруживаются подходящие сайты взаимодействия. Предполагается, что акцептор водородной связи на лиганде взаимодействует с Tyr 667 (спираль S6) на рецепторе в качестве донора водородной связи, а донор водородной связи на лиганде предположительно взаимодействует с Tyr 667 на мономере противоположном тетрамер . на рецепторе как акцептор водородной связи Предполагается, что кольцевая особенность фармакофора вписывается в гидрофобное пространство, образованное ароматическими кольцами четырех остатков Tyr 667 четырех мономеров. В соответствии с критической ролью, которую Tyr 667 играет во взаимодействии с ключевыми элементами фармакофора антагониста TPRV1, исследования направленного мутагенеза показали, что замена этого тирозина на аланин в крысином рецепторе TRPV1 отменяет функциональную активность TRPV1. Липофильный конец антагониста разнообразен по характеру и объему и взаимодействует с нижним концом трансмембранного спирали S5 и S6. Поскольку внутриклеточные концы этих спиралей выходят за пределы мембраны, они, вероятно, будут гибкими и могут быть частью процесса открытия и закрытия каналов. Совместное использование модели фармакофора, собранной из высокооптимизированных антагонистов TRPV1, с моделью гомологии белка улучшило понимание наблюдаемых взаимосвязей структура-активность многих серий существующих антагонистов TRPV1 и должно быть полезно при открытии новых классов. антагонистов. [ 2 ]
Отношения структуры и деятельности
[ редактировать ]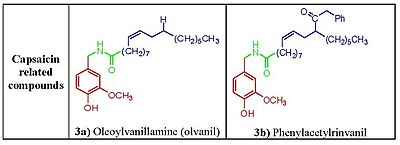
Капсаицин (рис. 2) имеет три функциональные области: ароматическую область А, где исходная гомованиллильная (3-метокси-4-гидроксибензильная) группа является оптимальной, область В, известную как сложноэфирный или амидный линкер , и алифатическую область С, где липофильный октанил фрагмент связан с самой высокой эффективностью. Гомованиллильный мотив и области амидной связи содержат диполярные группы, которые участвуют во взаимодействиях водородных связей. [ 11 ]
Фенольные гидроксид и амидные фрагменты , по-видимому, жизненно важны для индукции реакции на капсаицин. Удаление фенольной гидроксидной или амидной связи в аналогах капсаицина приводит к снижению эффективности. Фенольные гидроксидные и амидные фрагменты капсаицина потенциально могут взаимодействовать с множественными водородными связями с рецептором TRPV1. Капсаициноиды и капсиноиды характеризуются кислородсодержащим ароматическим фрагментом, связанным через амидный (капсаициноиды) или сложноэфирный (капсиноиды) линкер с липофильной ацильной группой. Ваниллильный линкер содержат полярные группы, способные образовывать водородные связи, необходимые и карбонильный для активности, тогда как липофильный фрагмент взаимодействует с соответствующей щелью сайта связывания ваниллоида на TRPV1. капсаицина среднего размера Замена разветвленной жирной кислоты на более длинные жирные кислоты повреждает активность, [ 12 ] но наличие ненасыщенностей восстанавливает и усиливает активность, например, олеоилваниламин ( олванил ) (рис. 3а) в 10 раз более эффективен, чем капсаицин, в анализах активации TRPV1. [ 13 ]
1,3-Ди(арилалкил)тиомочевины
[ редактировать ]
Капсазепин (рис. 4а), первый конкурентный антагонист ваниллоидов, [ 14 ] [ 9 ] Исследование, о котором сообщила группа Novartis , было направлено на оценку влияния конформационных ограничений на липофильную С-область капсаицина. В капсазепине амидная связь капсаицина заменена фрагментом тиомочевины , а пропилиденовый линкер между ароматическим ваниллильным 2-углеродным кольцом A и амидным азотом B-линкера приводит ароматическое кольцо в ортогональную ориентацию по отношению к тиомочевинной связи. [ 15 ] Это ограничение долгое время считалось отличительной чертой ваниллоидного антагонизма. [ 16 ] Капсазепин конкурирует за сайт связывания капсаицина на TRPV1, однако из-за низкой метаболической стабильности и плохих фармакокинетических свойств соединение не дошло до клинической разработки . [ 17 ] Позже было замечено, что эта связь не имеет решающего значения для активности, поскольку были разработаны мощные антагонисты, свободные от этой структурной особенности, при этом 1,3-ди(арилалкил)тиомочевины стали одним из наиболее многообещающих антагонистов неваниллоидного класса TRPV1, демонстрирующих превосходные результаты. Терапевтический потенциал в регуляции боли. В этих соединениях замена гваяцильной группы капсаициноидов на 3-фтор-4-сульфониламидную группу оказалась решающей для восстановления активности. Это привело к созданию фрагмента C-области, имитирующего RTX, и привело к созданию соединения, показанного на фигуре 4b, которое показало превосходную анальгетическую активность у мышей. [ 18 ] [ 19 ] Альтернативная оптимизация липофильной области C привела к созданию JYL1421 (рис. 4c), еще одного многообещающего клинического кандидата. [ 20 ]
Ди(арилалкил)- и арил(арилакил)мочевины
[ редактировать ]
Несколько аналогов капсаицина типа мочевины были разработаны путем ацилирования гомованилиламина и родственных аминов различными 4-(α-пиридил)пиперидин-1-ацилхлоридами. Присутствие полярной аминогруппы в гидрофобной C-области капсациноидов имело решающее значение для эффективности и гидрофильности соединения , имитируя аналогичные наблюдения, которые привели к открытию фенилацетилринванила (рис. 3b) из ольванила (рис. 3a). Фенилацетилринванил — самый мощный капсаициноид, зарегистрированный на сегодняшний день, он примерно в 500 раз более эффективен, чем капсаицин. [ 21 ] Несколько других мочевин оказались чрезвычайно активными антагонистами TRPV1. По сравнению с капсазепином пиперазинилмочевина (рис. 5а и 5б) продемонстрировала более высокий профиль селективности в отношении широкого спектра ферментов и каналов. [ 22 ] тогда как родственный очень мощный и специфический антагонист TRPV1 A-425619 (рис. 5c) может уменьшать боль, связанную с воспалением и повреждением тканей у крыс. [ 23 ] Дальнейшие исследования привели к созданию множества низкомолекулярных антагонистов TRPV1, включая мочевины SB-705498 (рис. 5d), SB-452533 (рис. 5e) [16,17] и ABT-102 (рис. 5f), соединения, прошедшие клинические испытания. [ 24 ]
циннамиды
[ редактировать ]
N-арилциннамиды стали мощным и важным классом антагонистов TRPV1. Соединение SB-366791 (рис. 6а) проявляет конкурентную и специфическую активность в отношении как человеческого, так и крысиного рецептора TRPV1. Общий профиль селективности рецептора намного лучше, чем у капсазепина. [ 25 ] [ 26 ] В этой серии соединений AMG-9810 (рис. 6b) продемонстрировал высокую антагонистическую активность, продемонстрировав хорошую биодоступность при пероральном приеме у крыс и многообещающий фармакокинетический профиль, что является хорошим предзнаменованием клинической эффективности. [ 27 ] Еще одним мощным блокатором из этой группы является AMG0347 (рис. 6c), который, как было показано в исследовании послеоперационной боли, способен уменьшать вызванную капсаицином тепловую и механическую гипералгезию, а также блокировать центральные рецепторы TRPV1. [ 28 ]
Карбоксамиды
[ редактировать ]
несколько антагонистов TRPV1 карбоксамидного Было обнаружено типа. Они структурно весьма гетерогенны , о чем свидетельствует сравнение никотинамида производного SB-782443 (рис. 7а), тиазолилкарбоксамида (рис. 7б) и тетрагидропиридилкарбоксамида (рис. 7в). [ 29 ] SB-782443 (рис. 7а) продемонстрировал превосходную активность на TRPV1 человека, морских свинок и крыс, благоприятный метаболизм лекарственного средства и фармакокинетический профиль in vitro , а также замечательную активность in vivo на модели воспалительной боли. [ 30 ] [ 31 ] На основании профиля in vitro несколько соединений этого класса прошли доклиническую разработку. [ 29 ]
Другие производные
[ редактировать ]
У неклассических антагонистов отсутствуют мочевинные, тиомочевинные или амидные группы, типичные для классических лигандов TRPV1. Обнаружены два основных структурных типа неклассических антагонистов. Во-первых, это производные имидазола . Начиная с ведущей структуры 4,6-дизамещенного бензимидазола, серия 4,5-биарилимидазолов способна блокировать как капсаицин, так и индуцированный кислотой приток кальция в клетки яичника китайского хомячка, экспрессирующие TRPV1. Имидазол (рис. 8а) был идентифицирован как высокоэффективный и биодоступный при пероральном приеме TRPV1. [ 32 ] Другой класс — диариловые эфиры и амины. Соединения хиназолинового ряда можно рассматривать как конформационно ограниченные аналоги биариламидного ряда. По активности 5 - изохинолин оказался наиболее активным среди и расположился в порядке: 5-изохинолин > 8- хинолин > 8-хиназолин > 8-изохинолин > циннолин > фталазин > хиноксалин > 5-хинолин [ 33 ] например, AMG-517 (рис. 8b), хотя у него отсутствует какой-либо узнаваемый карбонильный мотив, он все же эффективно блокирует капсаицин, протон и тепловую активацию TRPV1 in vitro и демонстрирует хороший профиль переносимости. [ 34 ] Кроме того, клинические кандидаты от фармацевтических компаний Janssen , Abbott и Merck (рис. 8c), имеющие группу 5-аминоизохинолина в качестве общего признака, позволяют предположить, что существует ключевое взаимодействие этой группы в рецепторном сайте для активности антагониста TRPV1. [ 33 ]
Текущий статус
[ редактировать ]В ноябре 2009 года FDA одобрило Кутензу (пластырь с капсаицином, 8% для местного применения) для лечения постгерпетической невралгии . [ 35 ]
Клинические испытания
[ редактировать ]
По состоянию на конец 2009 года доступная общедоступная информация позволяет предположить, что довольно многие из них проходят клинические испытания. Несколько биотехнологических и фармацевтических компаний разрабатывают лиганды TRPV1, и упор, похоже, делается как на агонисты, так и на антагонисты. Хотя агонисты, похоже, находятся на более продвинутой стадии клинической разработки. [ 1 ]
Агонисты
[ редактировать ]NeurogesX успешно завершил три клинических исследования фазы III Qutenza ( NGX-4010 ), которые соответствовали основным конечным точкам исследования. Кутенза представляет собой синтетический транс-капсаицин, и доставка препарата осуществляется с помощью системы нанесения пластыря быстрой доставки. [ 36 ] NeurogesX планирует запустить Qutenza в США в первой половине ноября 2010 года. [ 37 ] Anesiva, еще одна биотехнологическая компания, завершила два исследования фазы III Adlea ( ALGRX 4975 ), инъекционного капсаицина. Адлея перспективна в качестве обезболивающего [ 38 ] и оба исследования показали, что профиль безопасности Adlea в отношении побочных эффектов, заживления ран и сенсорной функции ран был аналогичен таковому у плацебо на протяжении всего периода исследования. [ 39 ]
Антагонисты
[ редактировать ]По крайней мере семь перорально активных антагонистов TRPV1 прошли клиническую разработку, а еще несколько находятся в стадии доклинической разработки. Лиганд GRC-6211 компании Eli Lilly and Company – Glenmark является наиболее совершенным и в настоящее время проходит фазу IIb клинических испытаний. GlaxoSmithKline , Merck -Neurogen, Amgen и AstraZeneca разрабатывают антагонист TRPV1, и все они разрабатывают вещества, которые успешно завершили фазу I испытаний. [ 1 ]
См. также
[ редактировать ]- Капсаицин
- Капсазепин
- Дегидроэпиандростерон
- Резинифератоксин
- Временный потенциальный канал рецептора
- Ваниллоидный рецептор TRPV
- Ваниллоидный рецептор подтипа 1 TRPV1
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж Ганторп М.Дж., Чиж Б.А. (январь 2009 г.). «Клиническая разработка антагонистов TRPV1: воздействие на ключевую точку пути боли». Открытие наркотиков сегодня . 14 (1–2): 56–67. дои : 10.1016/j.drudis.2008.11.005 . ПМИД 19063991 .
- ^ Jump up to: а б с д Ким П.Р., Корт М.Э., Хатчинс CW (август 2009 г.). «Аналгетический потенциал антагонистов TRPV1». Биохимическая фармакология . 78 (3): 211–6. дои : 10.1016/j.bcp.2009.02.014 . ПМИД 19481638 .
- ^ Салласи А., Блумберг, премьер-министр (июнь 1999 г.). «Ваниллоидные (капсаицины) рецепторы и механизмы». Фармакологические обзоры . 51 (2): 159–212. ПМИД 10353985 .
- ^ Иммке Д.С., Гавва Н.Р. (октябрь 2006 г.). «Рецептор TRPV1 и ноцицепция». Семинары по клеточной биологии и биологии развития . 17 (5): 582–91. дои : 10.1016/j.semcdb.2006.09.004 . ПМИД 17196854 .
- ^ Рами Х., Ганторп М. (2004). «Терапевтический потенциал антагонистов TRPV1 (VR1): клинические ответы ждут». Открытие лекарств сегодня: терапевтические стратегии . 1 : 97–104. дои : 10.1016/j.ddstr.2004.08.020 .
- ^ Jump up to: а б Вонг Джи, Гавва Н.Р. (апрель 2009 г.). «Терапевтический потенциал агонистов и антагонистов ваниллоидных рецепторов TRPV1 в качестве анальгетиков: последние достижения и неудачи». Обзоры исследований мозга . 60 (1): 267–77. дои : 10.1016/j.brainresrev.2008.12.006 . ПМИД 19150372 . S2CID 9951052 .
- ^ Jump up to: а б с Мессегер А., Планеллс-Кейс Р., Феррер-Монтьель А. (январь 2006 г.). «Физиология и фармакология ваниллоидных рецепторов» . Современная нейрофармакология . 4 (1): 1–15. дои : 10.2174/157015906775202995 . ПМЦ 2430674 . ПМИД 18615132 .
- ^ Jump up to: а б Гомцян А, Байбурт Э.К., Шмидт Р.Г., Чжэн Г.З., Пернер Р.Дж., Дидоменико С., Кениг Дж.Р., Тернер С., Джинкерсон Т., Дризин И., Ханник С.М., Макри Б.С., Макдональд Х.А., Оноре П., Висмер К.Т., Марш К.С., Веттер Дж. , Стюарт К.Д., Ои Т., Джарвис М.Ф., Суровы К.С., Фалтынек Ч.Р., Ли Ч.Х. (февраль 2005 г.). «Новые временные рецепторные потенциальные антагонисты ваниллоидных 1-рецепторов для лечения боли: взаимосвязь структура-активность мочевин с хинолиновыми, изохинолиновыми, хиназолиновыми, фталазиновыми, хиноксалиновыми и циннолиновыми фрагментами». Журнал медицинской химии . 48 (3): 744–52. дои : 10.1021/jm0492958 . ПМИД 15689158 .
- ^ Jump up to: а б с Су, ЮГ, Ох ты (2005). «Активация и активаторы TRPV1 и их фармацевтическое значение». Текущий фармацевтический дизайн . 11 (21): 2687–98. дои : 10.2174/1381612054546789 . ПМИД 16101449 .
- ^ Ганторп М.Дж., Салласи А. (2008). «Периферические рецепторы TRPV1 как мишени для разработки лекарств: новые молекулы и механизмы». Текущий фармацевтический дизайн . 14 (1): 32–41. дои : 10.2174/138161208783330754 . ПМИД 18220816 .
- ^ Пирс Л.В., Петухов П.А., Сабо Т., Кедей Н., Бизик Ф., Козиковский А.П., Блумберг П.М. (август 2004 г.). «Функции эводиамина как агониста ваниллоидного рецептора TRPV1» . Органическая и биомолекулярная химия . 2 (16): 2281–6. дои : 10.1039/b404506h . ПМИД 15305207 .
- ^ Морита А., Ивасаки Ю., Кобата К., Иида Т., Хигаси Т., Ода К., Сузуки А., Нарукава М., Сасакума С., Ёкогоси Х., Ядзава С., Томинага М., Ватанабэ Т. (ноябрь 2006 г.). «Липофильность капсаициноидов и капсиноидов влияет на процесс множественной активации крысиного TRPV1». о жизни Науки 79 (24): 2303–10. дои : 10.1016/j.lfs.2006.07.024 . ПМИД 16950406 .
- ^ Вриенс Дж., Аппендино Г., Нилиус Б. (июнь 2009 г.). «Фармакология катионных каналов транзиторного рецепторного потенциала ваниллоидов» . Молекулярная фармакология . 75 (6): 1262–79. дои : 10.1124/моль.109.055624 . ПМИД 19297520 . S2CID 52863171 .
- ^ Су Ю.Г., Ли Ю.С., Мин К.Х., Пак ОХ, Ким Дж.К., Сын Х.С., Со С.И., Ли БАЙ, Нам Ю.Х., Ли КО, Ким Х.Д., Пак Х.Г., Ли Дж., О Ю, Лим Дж.О., Кан Су, Кил MJ. , Ку Дж.И., Шин С.С., Джу Ю.Х., Ким Дж.К., Чон Ю.С., Ким С.И., Пак Ю.Х. (сентябрь 2005 г.). «Новые мощные антагонисты временного рецепторного потенциального канала, член подсемейства ваниллоидов 1: взаимосвязь структура-активность 1,3-диарилалкилтиомочевины, обладающей новыми ваниллоидными эквивалентами». Журнал медицинской химии . 48 (18): 5823–36. дои : 10.1021/jm0502790 . ПМИД 16134949 .
- ^ Салласи А., Аппендино Г (май 2004 г.). «Антагонисты ванильоидных рецепторов TRPV1 как обезболивающие следующего поколения. Ставим телегу впереди лошади?». Журнал медицинской химии . 47 (11): 2717–23. дои : 10.1021/jm030560j . ПМИД 15139748 .
- ^ Томинага М., Катерина М.Дж., Мальмберг А.Б., Розен Т.А., Гилберт Х., Скиннер К., Рауманн Б.Е., Басбаум А.И., Юлиус Д. (сентябрь 1998 г.). «Клонированный рецептор капсаицина объединяет множество болевых стимулов» . Нейрон . 21 (3): 531–43. дои : 10.1016/S0896-6273(00)80564-4 . PMID 9768840 . S2CID 2054891 .
- ^ Уокер К.М., Урбан Л., Медхерст С.Дж., Патель С., Панесар М., Фокс А.Дж., Макинтайр П. (январь 2003 г.). «Антагонист VR1 капсазепин обращает вспять механическую гипералгезию на моделях воспалительной и нейропатической боли». Журнал фармакологии и экспериментальной терапии . 304 (1): 56–62. дои : 10.1124/jpet.102.042010 . ПМИД 12490575 . S2CID 14847633 .
- ^ Ли Джей, Ли Джей, Кан М, Шин М, Ким Джей Эм, Кан Су, Лим Джо, Чхве ХК, Су Ю Джи, Пак ХГ, О Ю, Ким HD, Пак Ю Х, Ха HJ, Ким Ю Х, Тот А, Ван Ю , Тран Р., Пирс Л.В., Лундберг DJ, Blumberg PM (июль 2003 г.). «Аналоги N-(3-ацилокси-2-бензилпропил)-N'-[4-(метилсульфониламино)бензил]тиомочевины: новые мощные и высокоаффинные антагонисты и частичные антагонисты ваниллоидного рецептора». Журнал медицинской химии . 46 (14): 3116–26. дои : 10.1021/jm030089u . ПМИД 12825950 .
- ^ Ли Дж, Кан Су, Кил MJ, Шин М, Лим Джо, Чхве ХК, Джин МК, Ким С.И., Ким С.Э., Ли Ю.С., Мин К.Х., Ким Ю.Х., Ха HJ, Тран Р., Велтер Дж.Д., Ван Ю., Сабо Т. , Пирс Л.В., Лундберг Д.Дж., Тот А., Павлюковец В.А., Морган М.А., Блумберг П.М. (сентябрь 2005 г.). «Анализ взаимосвязей структура-активность «А-области» аналогов N-(4-т-бутилбензил)-N'-[4-(метилсульфониламино)бензил]тиомочевины в качестве антагонистов TRPV1». Письма по биоорганической и медицинской химии . 15 (18): 4136–42. дои : 10.1016/j.bmcl.2005.06.009 . ПМИД 16005215 .
- ^ Ван И, Сабо Т., Велтер Дж.Д., Тот А., Тран Р., Ли Дж., Кан Су, Су Ю.Г., Блумберг П.М., Ли Дж. (октябрь 2002 г.). «Высокоаффинные антагонисты ваниллоидных рецепторов». Молекулярная фармакология . 62 (4): 947–56. дои : 10.1124/моль.62.4.947 . ПМИД 12237342 . S2CID 43833525 .
- ^ Аппендино Дж., Де Петрочеллис Л., Тревизани М., Минасси А., Даддарио Н., Мориелло А.С., Гацциери Д., Лигрести А., Кампи Б., Фонтана Г., Пинна С., Джеппетти П., Ди Марцо В. (февраль 2005 г.). «Разработка первого сверхмощного «капсаициноида» агониста временного рецепторного потенциала ваниллоидных каналов типа 1 (TRPV1) и его терапевтический потенциал». Журнал фармакологии и экспериментальной терапии . 312 (2): 561–70. дои : 10.1124/jpet.104.074864 . ПМИД 15356216 . S2CID 816699 .
- ^ Помонис Дж.Д., Харрисон Дж.Э., Марк Л., Бристоль Д.Р., Валенцано К.Дж., Уокер К. (июль 2003 г.). «N-(4-Третиарибутилфенил)-4-(3-хлорфиридин-2-ил)тетрагидропиразин-1(2H)-карбоксамид (BCTC), новый, эффективный при пероральном приеме антагонист ваниллоидного рецептора 1 с анальгетическими свойствами: II. в характеристика vivo на крысиных моделях воспалительной и нейропатической боли». Журнал фармакологии и экспериментальной терапии . 306 (1): 387–93. дои : 10.1124/jpet.102.046268 . ПМИД 12721336 . S2CID 11111018 .
- ^ Макдональд Х.А., Ниландс Т.Р., Корт М., Хан П., Вос М.Х., Фалтынек Ч.Р., Морланд Р.Б., Путтфаркен П.С. (октябрь 2008 г.). «Характеристика A-425619 по нативным рецепторам TRPV1: сравнение между ганглиями дорсальных корешков и ганглиями тройничного нерва». Европейский журнал фармакологии . 596 (1–3): 62–9. дои : 10.1016/j.ejphar.2008.07.063 . ПМИД 18755179 .
- ^ Сурови К.С., Ниландс Т.Р., Бьянки Б.Р., МакГороти С., Эль Коуэн Р., Хан П., Чу К.Л., Макдональд Х.А., Вос М., Нифоратос В., Байбурт Е.К., Гомцян А., Ли Ч.Х., Оноре П., Салливан Дж.П., Джарвис М.Ф., Фалтынек ЧР (сентябрь 2008 г.). «(R)-(5-трет-бутил-2,3-дигидро-1H-инден-1-ил)-3-(1H-индазол-4-ил)-мочевина (АБТ-102) блокирует полимодальную активацию временных потенциал рецепторов ваниллоидных 1-рецепторов in vitro и вызванное теплом возбуждение нейронов спинного рога in vivo». Журнал фармакологии и экспериментальной терапии . 326 (3): 879–88. дои : 10.1124/jpet.108.138511 . ПМИД 18515644 . S2CID 2042292 .
- ^ Ганторп М.Дж., Рами Х.К., Джерман Дж.С., Смарт Д., Гилл Ч., Соффин Э.М., Луис Ханнан С., Лаппин СК, Эгертон Дж., Смит Г.Д., Уорби А., Хоуэтт Л., Оуэн Д., Насир С., Дэвис Ч., Томпсон М., Вайман Пенсильвания, Рэндалл А.Д., Дэвис Дж.Б. (январь 2004 г.). «Идентификация и характеристика SB-366791, мощного и селективного антагониста ваниллоидных рецепторов (VR1/TRPV1)». Нейрофармакология . 46 (1): 133–49. дои : 10.1016/S0028-3908(03)00305-8 . ПМИД 14654105 . S2CID 21048603 .
- ^ Патвардхан А.М., Джеске Н.А., Прайс Т.Дж., Гампер Н., Акопян А.Н., Харгривз К.М. (июль 2006 г.). «Каннабиноид WIN 55,212-2 ингибирует временный рецепторный потенциал ваниллоида 1 (TRPV1) и вызывает периферическую антигипералгезию через кальциневрин» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (30): 11393–8. Бибкод : 2006PNAS..10311393P . дои : 10.1073/pnas.0603861103 . ПМК 1544096 . ПМИД 16849427 .
- ^ Доэрти Э.М., Фотш С., Бо Й., Чакрабарти П.П., Чен Н., Гавва Н., Хан Н., Келли М.Г., Кинкейд Дж., Клионски Л., Лю К., Огнянов В.И., Тамир Р., Ван Х, Чжу Дж., Норман М.Х., Треанор Дж.Дж. (январь 2005 г.). «Открытие мощных пероральных антагонистов ваниллоидного рецептора-1. Взаимосвязь структура-активность N-арилциннамидов». Журнал медицинской химии . 48 (1): 71–90. дои : 10.1021/jm049485i . ПМИД 15634002 .
- ^ Ву С., Гавва Н.Р., Бреннан Т.Дж. (июнь 2008 г.). «Влияние AMG0347, антагониста рецептора типа V1 временного рецепторного потенциала, и морфина на болевое поведение после подошвенного разреза» . Анестезиология . 108 (6): 1100–8. дои : 10.1097/ALN.0b013e31817302b3 . ПМИД 18497612 .
- ^ Jump up to: а б Вестэуэй С.М., Браун С.Л., Конвей Э., Хайтман Т.Д., Джонсон С.Н., Лэпсли К., Макдональд Дж.Дж., Макферсон Д.Т., Митчелл Дж.Дж., Майатт Дж.В., Сил Дж.Т., Стэнуэй С.Дж., Стемп Дж., Томпсон М., Селестини П., Коломбо А., Консонни А. , Гальярди С., Риккабони М., Ронзони С., Бриггс М.А., Мэтьюз К.Л., Стивенс А.Дж., Болтон В.Дж., Бойфилд И., Джарви Э.М., Страттон СК, Сэнгер Г.Дж. (декабрь 2008 г.). «Открытие биарилкарбоксамидов как новых низкомолекулярных агонистов рецептора мотилина». Письма по биоорганической и медицинской химии . 18 (24): 6429–36. дои : 10.1016/j.bmcl.2008.10.072 . ПМИД 19006669 .
- ^ Вестэуэй С.М., Чанг Ю.К., Дэвис Дж.Б., Холланд В., Джерман Дж.С., Медхерст С.Дж., Рами Х.К., Стемп Дж., Стивенс А.Дж., Томпсон М., Уинборн К.Ю., Райт Дж. (сентябрь 2006 г.). «N-тетрагидрохинолинил, N-хинолинил и N-изохинолинилбиарилкарбоксамиды как антагонисты TRPV1». Письма по биоорганической и медицинской химии . 16 (17): 4533–6. дои : 10.1016/j.bmcl.2006.06.026 . ПМИД 16806913 .
- ^ Браун Б.С., Кедди Р., Чжэн Г.З., Шмидт Р.Г., Кениг Дж.Р., Макдональд Х.А., Бьянки Б.Р., Оноре П., Джарвис М.Ф., Сурови К.С., Полаковски Дж.С., Марш К.С., Фалтынек Ч.Р., Ли CH (сентябрь 2008 г.). «Тетрагидропиридин-4-карбоксамиды как новые мощные антагонисты временного рецепторного потенциала ваниллоида 1 (TRPV1)». Биоорганическая и медицинская химия . 16 (18): 8516–25. дои : 10.1016/j.bmc.2008.08.005 . ПМИД 18722778 .
- ^ Гор В.К., Ма В.В., Тамир Р., Гавва Н.Р., Треанор Дж.Дж., Норман М.Х. (ноябрь 2007 г.). «Исследование взаимосвязи структура-активность (SAR) замещенных аналогов имидазола в качестве антагонистов TRPV1». Письма по биоорганической и медицинской химии . 17 (21): 5825–30. дои : 10.1016/j.bmcl.2007.08.044 . ПМИД 17851073 .
- ^ Jump up to: а б Блюм К.А., Чжэн Х, Брилманн Х., Ходжеттс К.Дж., Бактаватчалам Р., Чандрасекхар Дж., Краузе Дж.Э., Кортрайт Д., Мэтсон Д., Крэндалл М., Нго К.К., Фунг Л., Дэй М., Кершоу М., Де Ломберт С., Ченард Б.Л. (август) 2008). «Аминохиназолины как антагонисты TRPV1: модуляция свойств лекарств путем исследования замены в 2-м положении». Письма по биоорганической и медицинской химии . 18 (16): 4573–7. дои : 10.1016/j.bmcl.2008.07.036 . ПМИД 18662872 .
- ^ Гавва Н.Р., Бэннон А.В., Ховланд Д.Н., Лехто С.Г., Клионски Л., Сурапанени С., Иммке Д.С., Хенли С., Арик Л., Бак А., Дэвис Дж., Эрнст Н., Хевер Дж., Куанг Р., Ши Л., Тамир Р., Ван Дж. , Ван В., Зайич Г., Чжу Д., Норман М.Х., Луис Дж.К., Магал Э., Треанор Дж.Дж. (октябрь 2007 г.). «Повторное введение антагонистов ваниллоидных рецепторов TRPV1 ослабляет гипертермию, вызванную блокадой TRPV1». Журнал фармакологии и экспериментальной терапии . 323 (1): 128–37. дои : 10.1124/jpet.107.125674 . ПМИД 17652633 . S2CID 8085707 .
- ^ «FDA одобрило новый препарат для долгосрочного облегчения боли после приступов опоясывающего лишая» . www.fda.gov . Архивировано из оригинала 18 ноября 2009 г.
- ^ «Кутенза (NGX-4010): за пределами традиционной терапии боли» . НейрогесX . Архивировано из оригинала 30 августа 2009 г. Проверено 20 октября 2009 г.
- ^ «NeurogesX объявляет новую дату PDUFA для заявки на новый препарат Qutenza™» . Архивировано из оригинала 12 ноября 2009 г. Проверено 6 ноября 2009 г.
- ^ СПИД Т (2009). «Капсаицин: риски и преимущества». Американская Фарм . 7:20 .
- ^ http://www.anesiva.com. Архивировано 6 марта 2009 г., в Wayback Machine.