Разработка и открытие препаратов СИОЗС
Селективные ингибиторы обратного захвата серотонина , или специфичные ингибиторы обратного захвата серотонина ( СИОЗС ), представляют собой класс химических соединений , которые применяются в качестве антидепрессантов и при лечении депрессии и других психических расстройств . СИОЗС терапевтически полезны при лечении панического расстройства (ПД), посттравматического стрессового расстройства (ПТСР), социального тревожного расстройства (также известного как социофобия), обсессивно-компульсивного расстройства (ОКР), предменструального дисфорического расстройства (ПМДР) и анорексии . Имеются также клинические доказательства ценности СИОЗС при лечении симптомов шизофрении и их способности предотвращать сердечно-сосудистые заболевания. [ 1 ]
СИОЗС в первую очередь ингибируют транспортер серотонина (SERT) в головном мозге и оказывают незначительное влияние на транспортер дофамина (DAT) и транспортер норадреналина (NET). Ингибирование связывания нейромедиатора серотонина ( 5-НТ) с SERT приводит к увеличению концентрации 5-НТ в синаптической щели, что приводит к увеличению связывания 5-НТ с постсинаптическими рецепторами . Когда-то считалось, что это механизм, который приводит к улучшению симптомов депрессии. [ 2 ] однако более поздний систематический обзор научной литературы установил, что нет никакой корреляции между концентрацией или активностью 5-HT в мозге и симптомами депрессии. [ 3 ]
СИОЗС доминировали на рынке антидепрессантов [ 1 ] и рекомендованы Национальным институтом здравоохранения и клинического совершенства (NICE) в качестве лечения депрессии первой линии, поскольку они, как правило, имеют меньше побочных эффектов , чем другие типы антидепрессантов с той же эффективностью. [ 4 ]
История развития
[ редактировать ]До открытия препаратов СИОЗС методы лечения расстройств настроения были относительно ограничены. Однако сейчас на рынке представлены десятки антидепрессантов для лечения депрессии. [ 5 ] Ингибиторы моноаминоксидазы (ИМАО) и трициклические антидепрессанты (ТЦА) были первыми препаратами, разработанными для лечения депрессии еще в начале 1950-х годов. Из-за профиля нежелательных побочных эффектов и высокого потенциала токсичности , а также неселективного фармакологического действия для приема препаратов требовались строгие режимы, что ограничивало их применение. [ 5 ] [ 6 ] По этой причине исследователи искали другие альтернативы с аналогичной эффективностью, но с меньшим количеством побочных эффектов, например, препараты, которые не вызывают нарушений сердечной проводимости при передозировке или не имеют тенденции вызывать судороги . [ 7 ] что привело к открытию препаратов СИОЗС. СИОЗС представляют собой наиболее значительный класс антидепрессантов, представленных на рынке в последние годы, и являются одним из главных медицинских открытий последних нескольких десятилетий. СИОЗС были первыми препаратами, установившими теоретическую патофизиологическую роль 5-HT при аффективных заболеваниях и широком спектре тревожных расстройств . Кроме того, они были первыми, кто подтвердил, что ингибирование обратного захвата нейромедиаторов является важным терапевтическим принципом. [ 1 ] [ 8 ]
СИОЗС являются первым рационально разработанным классом психотропных препаратов . Стратегия рационального дизайна лекарств заключается в разработке нового лекарства, способного воздействовать на конкретную биологическую мишень или, в данном случае, на особый нервный участок действия (насосы поглощения, рецепторы), пытаясь при этом избежать воздействия на другой участок действия. Целью такой разработки является создание фармакологических средств , которые были бы более эффективными, безопасными и лучше переносимыми, чем старые лекарства. [ 9 ]

когда химики-медики приступили к поиску идеального СИОЗС, осуществив химический синтез зимелидина Первоначальный успех был достигнут , ( рис. 1 ) из антигистаминного препарата бромфенирамина . [ 8 ] которые продемонстрировали селективное ингибирование обратного захвата 5-HT с минимальным ингибированием норэпинефрина обратного захвата (NE). Самое главное, что зимелидин не имел такого же профиля побочных эффектов, как ТЦА, и поэтому стал основой для СИОЗС второго поколения. [ 6 ] Зимелидин был первым СИОЗС, появившимся на рынке, но с применением препарата было связано несколько случаев синдрома Гийена-Барре , что привело к его отзыву с рынка в 1983 году. Впоследствии было обнаружено и поступило на рынок несколько нетрициклических СИОЗС.
Флуоксетин , одобренный FDA в 1987 году, обычно считается первым СИОЗС, появившимся на рынке. Работа, которая в конечном итоге привела к открытию флуоксетина, началась в компании Eli Lilly and Company в 1970 году в результате сотрудничества Брайана Моллоя и Рэя Фуллера. [ 10 ] В то время было известно, что антигистаминный препарат дифенгидрамин проявляет некоторые свойства, подобные антидепрессантам. За отправную точку был взят 3-фенокси-3-фенилпропиламин — соединение, структурно подобное димедролу. Моллой и его коллега-химик из Eli Lilly Клаус Шмигель синтезировали серию из десятков его производных. [ 11 ] [ 12 ] В надежде найти производное, ингибирующее только обратный захват серотонина , другой ученый Eli Lilly, Дэвид Т. Вонг , предложил повторно протестировать серию на in vitro обратный захват серотонина, норадреналина и дофамина , используя методику, разработанную нейробиологом Соломоном Снайдером . [ 10 ] Этот тест показал, что соединение, позже названное флуоксетином, является наиболее мощным и селективным ингибитором обратного захвата серотонина в этой серии. [ 13 ]
Появление флуоксетина на рынке превозносится как чудодейственное лекарство для лечения депрессии, поскольку у него было меньше побочных эффектов, более простая стратегия дозирования и больший запас безопасности при передозировке , и, следовательно, он имел лучшую приверженность по сравнению с более ранними антидепрессантами (ТЦА). и ИМАО). [ 6 ] [ 14 ] Флуоксетин проложил путь к следующему поколению СИОЗС, послужив для них прототипом. [ 6 ] С тех пор количество препаратов класса СИОЗС увеличилось и теперь их шесть (флуоксетин, пароксетин , циталопрам , эсциталопрам , сертралин и флувоксамин ). [ 5 ] [ 9 ] как показано в таблице 1 .
Таблица 1. Препараты СИОЗС, используемые для лечения депрессии.
| флуоксетин | сертралин | пароксетин | флувоксамин | циталопрам | эсциталопрам | |
|---|---|---|---|---|---|---|
| Фармацевтические формы | Капсулы, растворимые или диспергируемые таблетки, раствор для перорального применения. | Таблетки, пероральный концентрат | Таблетки, пероральная суспензия | Таблетки, раствор для перорального применения, капсулы | Таблетки, раствор для перорального применения | Таблетки, раствор для перорального применения |
| Название бренда | Прозак, Фонтекс, Серомекс, Депекс, Серонил, Флутоп, Флуктин | Золофт, Сертрал, Люстрал, Асентра, Треслин | Паксил, Сероксат, Пароксат, Паксетин, Аропакс, Дероксат | Лювокс | Целекса, Ципрамил, Ципрам, Цитокс, Оропрам, Сепрам | Лексапро, Ципралекс, Эзопрам, Сероплекс |
| Дата одобрения FDA | 29 декабря 1987 г. [ 9 ] | 30 декабря 1991 г. [ 9 ] | 29 декабря 1992 г. [ 9 ] | 5 декабря 1994 г. | 17 июля 1998 г. [ 9 ] | 14 августа 2002 г. [ 9 ] |
Механизм действия
[ редактировать ]ряд биохимических функций, связанных с лечением СИОЗС. Точный механизм антидепрессивной активности СИОЗС остается неясным, но установлен [ 15 ] СИОЗС в первую очередь ингибируют SERT в головном мозге и оказывают незначительное влияние на DAT и NET. СИОЗС также имеют меньшее сродство к α 1 , α 2 , H 1 и мускариновым рецепторам, что может объяснить различия в побочных эффектах между ТЦА и СИОЗС. [ 6 ]
требуется около 2–4 недель Хотя СИОЗС быстро доставляются в мозг после приема и влияние на обратный захват 5-НТ можно измерить мгновенно, для достижения терапевтического эффекта . [ 16 ] СИОЗС обладают очень высоким и избирательным сродством к SERT и после введения немедленно ингибируют SERT. [ 17 ] [ 18 ] Ингибирование SERT вовлечено в антидепрессивную активность СИОЗС. Для индукции антидепрессивного эффекта обычно необходимо ингибирование SERT на 70–80%, а более высокие дозы не вызывают большего антидепрессивного эффекта у обычных пациентов. Однако более высокая дозировка увеличивает частоту и тяжесть нежелательных явлений, связанных с чрезмерным ингибированием обратного захвата 5-НТ. [ 6 ]

СИОЗС предотвращают связывание 5-НТ с SERT [ 6 ] что предотвращает всасывание 5-НТ обратно в пресинаптическое окончание, где он метаболизируется моноаминоксидазой или сохраняется в секреторных везикулах . [ 17 ] В результате концентрация 5-НТ увеличивается в соматодендритной области 5-НТ-нейрона, но не так сильно в терминальной области аксона (показано на рисунке 2 ). Это увеличение концентрации 5-НТ вызывает десенсибилизацию соматодендритных 5-НТ 1А ауторецепторов . Когда эти ауторецепторы 5-HT1A подавлены , они больше не будут ограничивать импульсный поток нейрона 5-HT. Включается импульсный поток, в результате чего в терминали аксона высвобождается 5-НТ. Однако это увеличение 5-НТ не происходит быстро по сравнению с увеличением 5-НТ в соматодендритной области 5-НТ-нейрона. Эта задержка вызвана временем, которое требуется 5-HT для подавления ауторецепторов 5-HT 1A и включения потока нейроимпульсов нейрона 5-HT. Эта задержка может объяснить причину, по которой антидепрессанты не оказывают немедленного действия на депрессию. Это также может быть причиной того, что антидепрессивные механизмы могут быть связаны с увеличением потока нервных импульсов от нейронов 5-HT, тогда как концентрация 5-HT увеличивается в окончаниях аксонов до того, как СИОЗС начнут работать должным образом. Когда СИОЗС (1) ингибируют насос обратного захвата, (2) повышают соматодендритный 5-НТ, (3) десенсибилизируют соматодендритный 5-НТ. 1А ауторецепторы (4) включили импульсный поток и (5) увеличили высвобождение 5-НТ из окончаний аксона, последним шагом может быть десенсибилизация постсинаптических 5-НТ-рецепторов. Эта десенсибилизация может быть причиной уменьшения побочных эффектов СИОЗС по мере развития толерантности . [ 18 ]
Побочные эффекты
[ редактировать ]Несмотря на то, что СИОЗС в целом хорошо переносятся и имеют многочисленные преимущества перед другими антидепрессантами, они не лишены побочных эффектов. Побочные эффекты СИОЗС обычно предсказуемы на основании знания их фармакологии и зависят от дозы. К таким побочным эффектам относятся желудочно-кишечная дисфункция ( тошнота , диарея , дискомфорт в эпигастрии), воздействие на центральную нервную систему (ЦНС) ( беспокойство , утомляемость , тремор ), антихолинергические эффекты ( сухость во рту , нечеткость зрения, сонливость , затруднение мочеиспускания) и сексуальная дисфункция. ( аноргазмия , низкое или отсутствующее либидо , эректильная дисфункция , онемение гениталий, ретроградная эякуляция , потеря эротических снов или задержка эякуляции ). Иногда симптомы сексуальной дисфункции сохраняются после прекращения приема СИОЗС. [ 19 ] [ 20 ] [ 21 ] Побочные эффекты СИОЗС, как правило, легкие и временные и представляют собой скорее дискомфорт, чем серьезную угрозу с точки зрения системной токсичности. Таким образом, профиль побочных эффектов СИОЗС может предложить определенные терапевтические преимущества при лечении депрессии . [ 22 ]
Фармакология
[ редактировать ]СИОЗС хорошо всасываются в желудочно-кишечном тракте и достигают максимальной концентрации в плазме в течение 1–8 часов. [ 23 ] [ 24 ] Во время всасывания СИОЗС связываются с белками и широко распределяются по всему организму, включая мозг, при этом они являются липофильными. [ 25 ] Метаболизм и выведение происходят главным образом в печени. [ 24 ] и большинство СИОЗС продуцируют фармакологически активные метаболиты, [ 26 ] как показано в таблице 3 среди других фармакологических свойств СИОЗС.
Таблица 3 Сравнительная фармакология СИОЗС
| Лекарство | t макс (ч) | Биодоступность (%) | В Д (л/кг) | Связывание с белками (%) | т 1/2 | Метаболизм | Активные метаболиты [ 27 ] | Экскреция |
|---|---|---|---|---|---|---|---|---|
| Флуоксетин | 6–8 [ 28 ] | 60–80 [ 28 ] | 20–45 [ 28 ] | 94.5 [ 28 ] | Неотложное введение, 1–3 дня. Хроническое введение, 4–6 дней. Норфлуоксетин, однократный и хронический прием, 4–16 дней. [ 28 ] [ 29 ] | Обширное «первое прохождение» через печень, главным образом, посредством CYP2D6 путем деметилирования. Нелинейный фармакокинетический профиль [ 14 ] [ 28 ] [ 30 ] | Норфлуоксетин | Преимущественно (60%) моча [ 30 ] |
| Сертралин | 4.5–8.4 [ 31 ] | Абсолютная биодоступность у человека не определена. [ 32 ] | 20 [ 32 ] | 98 [ 31 ] | 25–26 часов [ 29 ] [ 31 ] | Обширное первое прохождение через печень, преимущественно CYP2B6 [ 31 ] [ 33 ] | Десметил-сертралин (ограниченная активность) | Фекалии и моча в равном количестве [ 33 ] |
| Пароксетин | 6–10 [ 34 ] | 30–60 | 3.1–28 [ 34 ] | 93–95 [ 34 ] | 21–24 часа [ 29 ] [ 34 ] | Обширное первичное прохождение через печень преимущественно CYP2D6. Нелинейный фармакокинетический профиль [ 14 ] [ 34 ] | Нет клинически важных метаболитов | Моча (64%) и фекалии (36%) (через желчь) [ 35 ] |
| Флувоксамин | 3–8 | 50 | 25 | 77–80 | 15,6 часов | Печень через CYP1A2 и CYP3A4 | Нет клинически важных метаболитов | В основном моча |
| Циталопрам | 2–4 [ 36 ] | 80 [ 36 ] | 12 [ 36 ] | 50 [ 27 ] | 35 часов [ 29 ] [ 36 ] | Печень посредством CYP3A4 и CYP2C19, главным образом, посредством N -деметилирования. [ 36 ] | Десметил-циталопрам | 12–23% в неизмененном виде в моче и 10% в кале. [ 36 ] |
| Эсциталопрам | 4–5 [ 37 ] | 80 [ 37 ] | 12 [ 37 ] | 56 [ 27 ] | 27–32 часа [ 29 ] [ 37 ] | Печень посредством CYP3A4 и CYP2C19, главным образом, посредством N -деметилирования. [ 37 ] | ( S )-деметилциталопрам. Не имеет клинического значения | 8–10% (эсциталопрама и ( S )-деметилциталопрама (S-DCT)) в моче. [ 37 ] |
t max = время достижения пикового уровня в плазме после пероральной дозы; V D = объем распределения; t 1/2 = период полувыведения
Структурные и механические различия между СИОЗС
[ редактировать ]Признано, что как положение, так и тип замещения в ароматическом фрагменте соединений SSRI важны для более высокой специфичности SERT. Установлено, что галогеновые заместители в ароматическом кольце в значительной степени ответственны за специфичность СИОЗС к SERT, но все СИОЗС содержат в определенных положениях атомы галогена ( таблица 2 ). Однако для белка SERT структурная основа его специфичности к СИОЗС плохо изучена. Исследования показали, что все галогены SSRI связываются с одним и тем же галогенсвязывающим карманом (HBP) в белке SERT, а мутация этого HBP в SERT резко снижает сродство транспортеров к SSRI. [ 38 ]
Как упоминалось ранее, СИОЗС довольно неразборчивы в том смысле, что они также связываются с гомологичными NET и DAT, хотя и с гораздо меньшим сродством, чем с их основной мишенью SERT. Селективность СИОЗС для SERT действительно интересна, когда всего одного или двух заместителей различных функциональных групп достаточно для превращения СИОЗС в ингибитор обратного захвата норадреналина (NRI) с более высоким сродством к NE. [ 38 ] Все антидепрессанты СИОЗС имеют одинаковый механизм действия и по меньшей мере в 10 раз более селективны в отношении ингибирования обратного захвата 5-HT, чем в отношении ингибирования обратного захвата NE. Однако, несмотря на одинаковый механизм действия, СИОЗС различаются по своей эффективности и селективности в ингибировании обратного захвата 5-НТ, и многие из них оказывают важное влияние на другие транспортеры и рецепторы. СИОЗС структурно разнообразны с явными различиями в их фармакодинамических и фармакокинетических профилях, что приводит к различиям между ними в периоде полувыведения , клинической активности, побочных эффектах и лекарственном взаимодействии , что объясняет различия в их эффективности и переносимости среди пациентов. [ 1 ] [ 9 ] Однако все СИОЗС клинически одинаковы, когда речь идет об их эффективности с течением времени. [ 6 ]
Таблица 2. Сравнение химических свойств препаратов СИОЗС
| Лекарство | IUPAC-имя | Классификация | Галоген | Специфика |
|---|---|---|---|---|
Флуоксетин 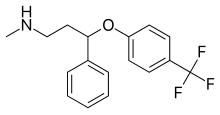
|
Метил(3-фенил-3-[4-(трифторметил)фенокси]пропил)амин [ 28 ] | Флуоксетин относится к фенилпропиламинам. Они содержат фенилпропиламиновый фрагмент, который состоит из фенильной группы, замещенной у третьего углерода пропан-1-амином. [ 28 ] | 3эт. | Наименее селективный ингибитор СИОЗС. Также ингибирует обратный захват NE и DA. Также влияет на рецепторы 5- HT2C , CYP2D6 и CYP3A4 . [ 9 ] |
Флувоксамин 
|
(Е)-(2-аминоэтокси)({5-метокси-1-[4-(трифторметил)фенил]пентилиден})амин [ 39 ] | 3эт. | ||
Сертралин 
|
( 1S ,4S ) -4-(3,4-Дихлорфенил) -N -метил-1,2,3,4-тетрагидронафталин-1-амин [ 31 ] | Сертралин относится к таметралинам. Они содержат фрагмент таметралина, который состоит из тетрагидронафталина, связанного с фенильной группой с образованием скелета N -метил-4-фенил-1,2,3,4-тетрагидронафталин-1-амина. [ 31 ] | 2Cl | Второй по силе ингибитор СИОЗС. Также влияет на обратный захват DA и NE. [ 9 ] |
Пароксетин 
|
( 3S ,4R ) -3-[(2H - 1,3-бензодиоксол-5-илокси)метил]-4-(4-фторфенил)пиперидин [ 34 ] | Пароксетин относится к группе фенилпиперидинов. Они содержат фенилпиперидиновый скелет, состоящий из пиперидина, связанного с фенильной группой. [ 34 ] | Ф | Самый мощный блокатор обратного захвата 5-HT. Это самый мощный блокатор мускариновых рецепторов среди СИОЗС. Также влияет на гистаминовые H1 - рецепторы , синтазу оксида азота (NOS) и CYP2D6. [ 9 ] |
Циталопрам 
|
1-[3-(Диметиламино)пропил]-1-(4-фторфенил)-1,3-дигидро-2-бензофуран-5-карбонитрил [ 36 ] | Циталопрам принадлежит к бензофуранам, которые представляют собой органические соединения, содержащие бензольное кольцо, конденсированное с фураном. [ 36 ] | Ф | Второй по селективности ингибитор СИОЗС. [ 9 ] |
Эсциталопрам 
|
(1 S )-1-[3-(Диметиламино)пропил]-1-(4-фторфенил)-1,3-дигидро-2-бензофуран-5-карбонитрил [ 37 ] | Эсциталопрам является S-энантиомером циталопрама и, таким образом, принадлежит к тому же классу бензофуранов, к которому принадлежит циталопрам. [ 37 ] | Ф | Новейший и наиболее селективный ингибитор СИОЗС. [ 9 ] |
Отношения структура-деятельность (SAR)
[ редактировать ]Производные феноксифенилпропиламина
[ редактировать ]
Соединения, содержащие мотив арилоксипропиламина в своей структуре , показанные на рисунке 3а , известны как ингибиторы обратного захвата моноаминов . Лекарственные средства, содержащие этот привилегированный структурный мотив, где R 1 и Р 2 представляют собой арилы или гетероарилы, предпочтительно фенил, обладают профилем селективности в отношении NET и SERT. [ 40 ] В то время как соединения, содержащие заместитель в 2'-положении ароксильного кольца структуры ( рисунок 3b ), проявляют селективность и высокое сродство к NET и поэтому обычно являются SNRI , соединения, имеющие заместитель в 4'-положении, проявляют селективность и высокое сродство. для SERT и поэтому обычно представляют собой СИОЗС, например флуоксетин и пароксетин. [ 41 ]
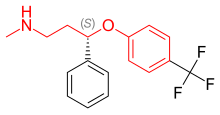
Флуоксетин представляет собой рацемическую смесь ( R )- и ( S )-флуоксетина, где оба энантиомера способствуют его биологической активности. [ 42 ] Поскольку монозамещение в 4-пара-положении феноксигруппы ( рисунок 4 ) приводит к селективному ингибированию обратного захвата 5-НТ, дисзамещение, т.е. 2,3- или 2,4-замещение, следовательно, приводит к потере SERT. избирательность. [ 6 ] Флуоксетин имеет самый широкий спектр действия, поскольку он наименее селективен к SERT из всех СИОЗС. Флуоксетин также обладает антагонистической активностью 5-HT 2C , блокируя активность 5-HT рецепторов 5-HT 2C, усиливая высвобождение как NE, так и DA. Антагонист 5-HT 2C не только улучшает терапевтический эффект флуоксетина, но и улучшает переносимость препарата. Преимущество антагониста 5-HT 2C заключается в том, что он оказывает стимулирующее действие, и у многих пациентов наблюдалось увеличение энергии, концентрации и внимания, а также снижение утомляемости с самой первой дозы. Однако стимулирующая активность антагониста 5-HT2C может быть недостатком для пациентов с возбуждением, бессонницей и тревогой. Еще одной особенностью флуоксетина является слабое ингибирование обратного захвата НЭ, что может иметь клинический эффект в более высоких дозах. Флуоксетин также имеет длительный период полувыведения, что может уменьшить симптомы отмены, характерные для некоторых СИОЗС после резкого прекращения приема, но это также означает, что для выведения препарата и его активного метаболита после прекращения лечения флуоксетином требуется много времени. [ 18 ]

Пароксетин представляет собой ограниченный структурный аналог флуоксетина, в котором линейная фенилпропиламиновая группа флуоксетина свернута в пиперидиновое кольцо ( рисунок 5 ). Соединение может иметь четыре стереоизомера , поскольку оно содержит два хиральных центра , но один из них, (3S , 4R ) -изомер, продается как пароксетин. Исследования показали, что стереохимические факторы влияют на сродство молекулы к SERT, при этом замещение в 2- орто -положении любого ароматического кольца снижает сродство к SERT крысы в 10–100 раз, при этом наибольшая потеря происходит в фенокси-кольце. [ 6 ]
Пароксетин является наиболее мощным из доступных препаратов СИОЗС, но он менее селективен в отношении SERT, чем флувоксамин и сертралин. [ 43 ] Пароксетин также обладает слабым ингибированием NET, что может способствовать его эффективности при депрессии, особенно в более высоких дозах. Как показано в таблице 2 , пароксетин также ингибирует фермент NOS, что может быть причиной его побочных эффектов на сексуальную дисфункцию, особенно у мужчин. [ 18 ] Пароксетин проявляет самое высокое сродство к мускариновым рецепторам среди всех СИОЗС, что приводит к слабой антихолинергической активности и, следовательно, к нежелательным побочным эффектам. [ 44 ]

Пока ученые пытались создать новый антидепрессант, подавляющий обратный захват NE, они случайно синтезировали два новых соединения, названных талопрам и талсупрам . Эти два соединения не поступили на рынок, несмотря на то, что они являются мощными SNRI, поскольку в клинических испытаниях сообщалось о ряде попыток самоубийства. С небольшими изменениями в химической структуре талопрама ( рис. 6 ), включая одну замену 6-циано (CN), ученые смогли превратить талопрам в мощный СИОЗС, называемый циталопрамом . Но циталопрам также можно рассматривать как ограниченный аналог пароксетина. [ 6 ]

Циталопрам занимает второе место по селективности в отношении SERT, не влияет на обратный захват NE или DA и не имеет сродства к другим нейрорецепторам. [ 6 ] Циталопрам состоит из двух энантиомеров, ( R )- и ( S )-, которые являются зеркальным отражением друг друга ( рисунок 7 ). Исследования показали, что почти вся активность сосредоточена в ( S )-энантиомере и что ( R )-циталопрам фактически противодействует действию ( S )-энантиомера. Комбинация двух энантиомеров известна как рацемический циталопрам и обладает слабыми антигистаминными свойствами, присущими ( R )-энантиомеру. Решением по улучшению свойств рацемического циталопрама является удаление нежелательного ( R )-энантиомера. Полученный препарат более известен как эсциталопрам , но он состоит только из чистого активного ( S )-(+)-изомера. Это изменение, по-видимому, устраняет антигистаминные свойства препарата. При удалении ( R )-энантиомера самая низкая доза эсциталопрама становится более эффективной и обеспечивает более быстрое начало действия, чем сопоставимая доза циталопрама, при этом эсциталопрам имеет вдвое большую активность, чем циталопрам, и по меньшей мере в 27 раз более эффективен, чем ( R )-энантиомер. [ 6 ] Таким образом, эсциталопрам является единственным препаратом СИОЗС, почти все фармакологическое действие которого обусловлено чистым ингибированием SERT. Эсциталопрам является новейшим и наиболее селективным ингибитором СИОЗС и сегодня считается наиболее переносимым СИОЗС. [ 6 ] [ 18 ]
Производные аминотетралина
[ редактировать ]
Исследования на животных показали, что таметралин , соединение, синтезированное в 1978 году компанией Pfizer , является мощным ингибитором обратного захвата NE и DA. [ 6 ] Позже неожиданно существенное усиление блокирующей активности захвата 5-НТ было достигнуто за счет добавления атомов хлора при С-3 и С-4 к структуре таметралина, что привело к образованию (+)- транс- ( 1R ,4S ) - N -метил-4-фенил-1-аминотетралин, мощный, но неселективный блокатор захвата. (+)- цис- ( 1S ,4S ) -изомер, один из четырех диастереомеров соединений, однако проявлял значительно более селективную и мощную активность ингибирования поглощения 5-HT по сравнению с тремя другими диастереомерами, где 4-фенильное кольцо благоприятствует вложения в местах поглощения 5-HT. Соединение было названо сертралином ( рисунок 8 ). [ 6 ] [ 45 ] Хотя сертралин структурно отличается от других СИОЗС, в его структуре имеется фениламинотетралин , в котором ядро дифенилпропиламина объединено в жесткую бициклическую кольцевую систему. [ 6 ]
Сертралин является вторым наиболее мощным ингибитором обратного захвата 5-HT, который имеет две очень интересные характеристики, которые отличают его, а именно: (1) ингибирующее действие сертралина на DAT и NET и (2) связывание с сигма-1 (σ 1 рецептором ) в организме . ЦНС. [ 18 ] Ингибирование DAT и NET является спорным из-за гораздо более слабого ингибирования по сравнению с ингибированием SERT. Сертралин обладает примерно в 60 раз более сильным потенциалом ингибирования 5-HT, чем обратный захват NE или DA. Вполне возможно, что лишь умеренное ингибирование DAT и NET необходимо для увеличения энергии, мотивации и концентрации, особенно в сочетании с другой деятельностью, такой как ингибирование SERT. [ 18 ] Также было обнаружено, что сертралин обладает высоким сродством к σ1- рецепторам ЦНС . Роль сайта σ1 в фармакологическом действии сертралина может существовать, но значение сродства сертралина к рецепторам σ1 остается неясным. [ 46 ]
Связывание СИОЗС с белком SERT
[ редактировать ]Молекулярная основа функционирования СИОЗС, включая способ их связывания и молекулярный механизм ингибирования обратного захвата 5-НТ при SERT, до конца не изучена и является предметом дискуссий. Такая информация очень важна для понимания существенных аспектов действия лекарств, начиная от профиля селективности и заканчивая терапевтической эффективностью и разработкой новых и улучшенных препаратов, нацеленных на SERT человека. [ 47 ]
Трехмерная (3D) структура SERT неизвестна и была основным препятствием для выяснения структурного механизма SERT человека. Обновление: данные рентгеновской кристаллографии доступны по состоянию на 2017 год, кажется ( https://www.rcsb.org/structure/6AWO ) ... Сравнительное молекулярное моделирование использовалось в исследованиях для создания структурных моделей SERT человека в комплексе с его лиганда, но не дал хороших результатов из-за низкого филогенетического и функционального сходства между SERT человека и доступными матричными белками. [ 47 ] Однако трехмерная структура некоторых бактериальных гомологичных переносчиков, таких как переносчик лейцина (LeuT), известна. Человеческие SERT, NET и DAT являются членами семейства белков нейротрансмиттер: симпортер натрия (NSS). SERT содержит около 630 аминокислот, которые, по прогнозам, образуют 12 трансмембранных альфа-спиралей (TM), которые связаны с внутри- и внеклеточными петлями (IL и EL). [ 38 ] [ 48 ] LeuT, который также является членом семейства NSS и действует как переносчик аминокислот . [ 38 ] был кристаллизован из Aquifex aeolicus Ямашитой и др., [ 49 ] и имеет 20-25% идентичности по первичной структуре с транспортерами нейромедиаторов человека . Таким образом, кристаллическая структура LeuT и механизм его транспорта оказались хорошей модельной системой для изучения белков NSS. [ 38 ] Хотя детальный механизм транспорта белков NSS до конца не изучен, ясно, что для осуществления транспорта должна произойти перестройка крупных белков. [ 48 ]
LeuT был сокристаллизован с сертралином и ( R )- и ( S )-флуоксетином, где было обнаружено, что СИОЗС связываются как неконкурентные ингибиторы в вестибулярном сайте связывания (можно рассматривать как второй сайт связывания), который отделен от сайта связывания лекарственного средства цепями сайтов двух ароматических аминокислот внеклеточных ворот транспортного белка. [ 38 ] [ 48 ] Все галогены химической структуры СИОЗС связываются с одним и тем же HBP внутри LeuT и взаимодействуют со схожими аминокислотами, но аминокислотная последовательность в HBP хорошо сохраняется между LeuT и SERT. Это позволяет предположить, что в SERT человека SSRI также связываются в одном и том же положении и сходным образом, что является ключевым свойством, делающим SSRI селективными для SERT. И наоборот, могут быть различия в их связывании, когда другая часть молекулы лекарства, вероятно, будет связываться с SERT по-другому, учитывая разнообразие их структуры. [ 38 ] Однако локализация вестибулярного сайта связывания, как основного сайта связывания СИОЗС в SERT, является спорной, поскольку некоторые исследования показали, что СИОЗС действуют конкурентно, связываясь с сайтом связывания лекарственного средства, а не со вторым сайтом связывания. [ 48 ]
Связывание флуоксетина с белком LeuT
[ редактировать ]Оба энантиомера флуоксетина проявляют одинаковое сродство к SERT. Однако селективное соотношение NE:5HT создает впечатление, что ( S )-энантиомер в 100 раз более селективен в отношении ингибирования SERT, чем ( R )-энантиомер. ( R )-(+)-стереоизомер почти в 8 раз более сильный ингибитор SERT и имеет более длительную продолжительность действия, чем ( S )-(-)-изомер. ( S )-(-)-метаболит норфлуоксетина является в семь раз более сильным ингибитором транспортера 5-НТ, чем ( R )-(+)-метаболит, с коэффициентом селективности, почти эквивалентным таковому у ( S )-флуоксетина. [ 6 ]
Оба энантиомера флуоксетина связываются с внеклеточным преддверием белка LeuT таким образом, что три атома фтора метилфенокси-кольца связываются с HBP, который образуется Leu25, Gly26, Leu29, Arg30 и Tyr108. Галогены дополнительно вступают во взаимодействие Ван-дер-Ваальса с Leu29 и Tyr108, где ( S )-энантиомер дополнительно связывается с Phe253 и обеспечивает контакт Ван-дер-Ваальса с ним среди ранее упомянутых аминокислот. Из-за хиральности ( S )-энантиомеров, противоположной ( R )-энантиомеру, остальная часть молекулы перевернута в HBP, где аминный хвост направлен в сторону внеклеточного пространства и взаимодействует с N -концом Leu400, Asp401 и Ala319. (аминокислоты, входящие в состав ТМ10). В этой связанной с LeuT форме комплекс довольно жесткий. Метилфеноксикольцо вращается вокруг связи O5-C6 на 46 градусов для ( R )-энантиомера и на 16 градусов для ( S )-энантиомера, но жесткость молекулярной структуры указывает на то, что препарат сохраняет свою низкоэнергетическую конфигурацию при связывании с его белковая мишень. [ 38 ]
Связывание сертралина с белком LeuT
[ редактировать ]Серталин связывается с тем же внеклеточным преддверием в LeuT, что и флуоксетин, где два атома хлора в фенильном кольце связываются с HBP, образованным Leu25, Gly26, Leu29, Arg30, Tyr108, Ile111 и Phe253. Галогены дополнительно обеспечивают контакт Ван-дер-Ваальса с Leu29, Tyr108 и Phe253. Тетралин (тетрагидронафталин) на другом конце структуры сертралина контактирует с Leu400, Asp401 и Thr409 (которые являются частью TM10), а также молекула взаимодействует с Ala319 шпильки EL4 и Arg30 и Gin34 TM1. , где аминный хвост направлен в сторону цитоплазмы. Дихлорфенильное кольцо связанной молекулы сертралина повернуто вокруг связи C4-C13 на 180 градусов по сравнению со свободным лекарственным средством. [ 38 ]
Связывание эсциталопрама с белком SERT человека
[ редактировать ]Андерсен и др. смогли создать модель сайта связывания ( S )-циталопрама в SERT человека путем объединения мутационного анализа и сравнительного моделирования, где они обнаружили, что Asn-177 и Phe-341 являются ключевыми детерминантами активности ( S )-циталопрама и высокого сродства. торможение [ 47 ] в дополнение к описанным ранее Tyr-95, Asp-98, Ile-172 и Ser438, где три функциональные группы структуры ингибиторов связываются с аминокислотами-переносчиками. ( S )-циталопрам позиционируется как цианофталан-. Фторфенил- и метиламинопропильные фрагменты занимают три разных субкармана внутри SERT-связывающего кармана. Ile-172 и Phe-341, вероятно, не находятся в прямом контакте с молекулой лекарства, но они очень важны для контроля выравнивания ингибитора. [ 47 ]
См. также
[ редактировать ]- Серотонин
- Селективные ингибиторы обратного захвата серотонина
- Ингибиторы обратного захвата моноаминов
- Антидепрессант второго поколения
- Ингибиторы обратного захвата серотонина-норадреналина
Ссылки
[ редактировать ]- ^ Jump up to: а б с д Спинкс Д., Спинкс Дж. (2002). Ингибирование обратного захвата серотонина: обновленная информация о текущих стратегиях исследований . Том. 9. стр. 799–810. дои : 10.2174/0929867024606795 . ISBN 9781608052042 . ПМИД 11966445 . Проверено 24 октября 2014 г.
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Шталь С.М. (1998). «Механизм действия селективных ингибиторов обратного захвата серотонина: рецепторы и пути серотонина опосредуют терапевтические эффекты и побочные эффекты». Журнал аффективных расстройств . 51 (3): 215–235. дои : 10.1016/S0165-0327(98)00221-3 . ПМИД 10333979 .
- ^ Монкрифф Дж. (2023). «Серотониновая теория депрессии: систематический обзор доказательств» . Природная молекулярная психиатрия . 28 (8): 3243–3256. дои : 10.1038/s41380-022-01661-0 . ПМЦ 10618090 . ПМИД 35854107 .
- ^ Национальный институт здравоохранения и клинического мастерства (28 октября 2009 г.). «Депрессия у взрослых: Лечение и управление депрессией у взрослых» . Национальный институт здравоохранения и клинического мастерства . Проверено 30 октября 2014 г.
- ^ Jump up to: а б с Фитцпатрик Л. (07.01.2010). «Краткая история антидепрессантов» . Время . Проверено 19 октября 2014 г.
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р Лемке Т.Л., Уильямс Д.А. (2008). Принципы медицинской химии Фоя (6-е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. стр. 568–600.
- ^ Фергюсон Дж. М. (2001). «Антидепрессанты СИОЗС: побочные эффекты и переносимость» . Сопутствующий журнал первичной медико-санитарной помощи журнала клинической психиатрии . 3 (1): 22–27. дои : 10.4088/pcc.v03n0105 . ПМК 181155 . ПМИД 15014625 .
- ^ Jump up to: а б Карлссон А. «Открытие СИОЗС: важная веха в нейропсихофармакологии и рациональном дизайне лекарств» (PDF) . Landesbioscience.com . Лейн Бионаука. Архивировано из оригинала (PDF) 20 октября 2014 г. Проверено 20 октября 2014 г.
- ^ Jump up to: а б с д и ж г час я дж к л м «Сравнение селективных ингибиторов обратного захвата серотонина (СИОЗС)» . emedexpert.com . эМедЭксперт . Проверено 19 октября 2014 г.
- ^ Jump up to: а б «Рэй В. Фуллер, Дэвид Т. Вонг и Брайан Б. Моллой» . Институт истории науки . Проверено 24 июня 2023 г.
- ^ Вонг Д.Т., Баймастер Ф.П., Энглман Э.А. (1995). «Прозак (флуоксетин, Lilly 110140), первый селективный ингибитор захвата серотонина и антидепрессант: двадцать лет с момента его первой публикации». Науки о жизни . 57 (5): 411–41. дои : 10.1016/0024-3205(95)00209-О . ПМИД 7623609 .
- ^ «Новости химии и техники: лучшие фармацевтические препараты: прозак» . pubsapp.acs.org . Проверено 24 июня 2023 г.
- ^ Вонг Д.Т., Хорнг Дж.С., Баймастер Ф.П., Хаузер К.Л., Моллой Б.Б. (август 1974 г.). «Селективный ингибитор захвата серотонина: Lilly 110140, 3-(п-трифторметилфенокси)-N-метил-3-фенилпропиламин». Науки о жизни . 15 (3): 471–9. дои : 10.1016/0024-3205(74)90345-2 . ПМИД 4549929 .
- ^ Jump up to: а б с Сирауло Д., Шейдер Р., Гринблатт Д. (2011). «Клиническая фармакология и терапия антидепрессантами». Фармакотерапия депрессии . стр. 33–124. дои : 10.1007/978-1-60327-435-7_2 . ISBN 978-1-60327-434-0 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Фишер Дж. и Ганеллин Ч.Р. (2010). Открытие аналоговых лекарств II . Джон Уайли и сыновья. стр. 269–270.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Сарбадхикари, С.Н. (2005). Депрессия и деменция: прогресс в исследованиях мозга, клиническое применение и будущие тенденции . Издательство Нова. п. 195.
- ^ Jump up to: а б Шацберг, А.Ф., и Немерофф, CB (2009). Американское психиатрическое издательство, учебник по психофармакологии . Американский психиатрический паб. стр. 353–355.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б с д и ж г Шталь, С.М. (2013). Основная психофармакология Шталя: нейробиологические основы и практическое применение . Издательство Кембриджского университета. стр. 290–300.
- ^ Бахрик А. (2008). «Сохранение побочных эффектов сексуальной дисфункции после прекращения приема антидепрессантов: новые данные» . Открытый психологический журнал . 1 : 42–50. дои : 10.2174/1874350100801010042 .
- ^ Уолдингер, доктор медицинских наук (2015). «Психические расстройства и сексуальная дисфункция». Неврология сексуальных расстройств и расстройств мочевого пузыря . Справочник по клинической неврологии. Том. 130. стр. 469–89. дои : 10.1016/B978-0-444-63247-0.00027-4 . ISBN 9780444632470 . ПМИД 26003261 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ http://pi.lilly.com/us/prozac.pdf Страница 14.
- ^ Дэвид Болдуин, Шелдон Прескорн (январь 1995 г.). «СИОЗС: преимущества, недостатки и различия». Журнал психофармакологии . 9 (2 приложения): 163–178. дои : 10.1177/0269881195009002011 . ПМИД 22297235 . S2CID 21474009 .
- ^ Загайски Дж., Розенбаум Дж.Ф., Толлефсон Г.Д. (2009). Американский психиатрический издательский учебник по психофармакологии (4-е изд.). Вашингтон, округ Колумбия: Американское психиатрическое издательство, Inc., с. 289.
- ^ Jump up to: а б Прескорн С.Х. (1997). «Клинически значимая фармакология селективных ингибиторов обратного захвата серотонина - обзор с акцентом на фармакокинетику и влияние на окислительный метаболизм лекарств». Клиническая фармакокинетика . 32 (Приложение 1): 1–21. дои : 10.2165/00003088-199700321-00003 . ПМИД 9068931 . S2CID 43164418 .
- ^ Безчлибник-Батлер К.З., Джеффрис Дж. (2014). Клинический справочник по психотропным препаратам (20-е изд.). Бостон: Издательство Хогрефе. стр. 3–14. ISBN 978-1-61676-451-7 . Проверено 21 октября 2014 г.
- ^ Абужауд Э., Коран LM (2009). Американский психиатрический издательский учебник по психофармакологии (4-е изд.). Вашингтон, округ Колумбия: American Psychiatric Publishing, Inc., с. 353.
- ^ Jump up to: а б с Сирауло Д.А. (2006). Взаимодействие лекарств в психиатрии (3-е изд.). Балтимор: Липпинкотт Уильямс и Уилкинс. п. 95. ИСБН 9780781748179 . Проверено 29 октября 2014 г.
- ^ Jump up to: а б с д и ж г час «Флуоксетин» . Drugbank.ca . Наркобанк . Проверено 19 октября 2014 г.
- ^ Jump up to: а б с д и Химке С., Хартер С. (2000). «Фармакокинетика селективных ингибиторов обратного захвата серотонина». Фармакология и терапия . 85 (1): 11–28. дои : 10.1016/S0163-7258(99)00048-0 . ПМИД 10674711 .
- ^ Jump up to: а б Европейское агентство лекарственных средств. «Краткое описание характеристик продукта» (PDF) . Проверено 29 октября 2014 г.
- ^ Jump up to: а б с д и ж «Сертралин» . Drugbank.ca . Наркобанк . Проверено 19 октября 2014 г.
- ^ Jump up to: а б Сеть токсикологических данных. «Сетралин» . Проверено 29 октября 2014 г.
- ^ Jump up to: а б Европейское агентство лекарственных средств. «Краткий обзор характеристик продукта» (PDF) . Проверено 29 октября 2014 г.
- ^ Jump up to: а б с д и ж г «Пароксетин» . Drugbank.ca . Наркобанк . Проверено 19 октября 2014 г.
- ^ Электронный справочник лекарственных средств (eMC). «Краткая характеристика продукта» . Проверено 29 октября 2014 г.
- ^ Jump up to: а б с д и ж г час «Циталопрам» . Drugbank.ca . Наркобанк . Проверено 19 октября 2014 г.
- ^ Jump up to: а б с д и ж г час «Эсциталопрам» . Drugbank.ca . Наркобанк . Проверено 19 октября 2014 г.
- ^ Jump up to: а б с д и ж г час я Чжоу З, Чжэнь Дж, Карпович Н.К., Ло С.Дж., Рейт М.Э., Ван Д.Н. (2009). «Антидепрессивная специфичность переносчика серотонина, предполагаемая тремя структурами LeuT-SSRI» . Структурная и молекулярная биология природы . 16 (6): 652–657. дои : 10.1038/nsmb.1602 . ПМЦ 2758934 . ПМИД 19430461 .
- ^ «Флувоксамин» . Drugbank.ca . Наркобанк . Проверено 19 октября 2014 г.
- ^ Бут Дж. и др. (2005). «Открытие и взаимосвязь структура-активность новых селективных норадреналина и двойных ингибиторов обратного захвата серотонина / норадреналина». Письма по биоорганической и медицинской химии . 15 (3): 699–703. дои : 10.1016/j.bmcl.2004.11.025 . PMID 15664840 .
- ^ Махани П.Е. и др. (2006). «Синтез и активность нового класса ингибиторов обратного захвата норэпинефрина и серотонина двойного действия: 3-(1H-индол-1-ил)-3-арилпропан-1-амины». Биоорганическая и медицинская химия . 14 (24): 8455–8466. дои : 10.1016/j.bmc.2006.08.039 . ПМИД 16973367 .
- ^ Оуэнс М.Дж., Найт Д.Л., Намерофф CB (2001). «СИОЗС второго поколения: профиль связывания эсциталопрама и R-флуоксетина с транспортером моноаминов человека». Биологическая психиатрия . 50 (5): 345–350. дои : 10.1016/S0006-3223(01)01145-3 . ПМИД 11543737 . S2CID 11247427 .
- ^ Мозаяни А. и Раймон Л. (2011). Справочник по взаимодействию лекарственных средств: клиническое и судебно-медицинское руководство . Спрингер. п. 216.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Фудзисиро Дж., Иманиши Т., Онодзава К., Цусима М. (2002). «Сравнение антихолинергических эффектов серотонинергических антидепрессантов, пароксетина, флувоксамина и кломипрамина». Европейский журнал фармакологии . 454 (2–3): 183–188. дои : 10.1016/s0014-2999(02)02557-8 . ПМИД 12421645 .
- ^ Коу Б.К., Вайсман А., Уэлч В.М., Браун Р.Г. (1983). «Серталин, 1S,4S-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафтиламин, новый ингибитор захвата серотонина» (PDF) . Журнал фармакологии и экспериментальной терапии . 226 (3): 686–700. ПМИД 6310078 . Архивировано из оригинала (PDF) 4 марта 2016 года . Проверено 22 октября 2014 г.
- ^ Гленда МакКуин , Лесли Борн, Меир Штайнер (2001). «Селективный ингибитор обратного захвата серотонина сертралин: его профиль и использование при психических расстройствах» . Обзоры препаратов для ЦНС . 7 (1): 1–24. дои : 10.1111/j.1527-3458.2001.tb00188.x . ПМК 6741657 . ПМИД 11420570 .
- ^ Jump up to: а б с д Андерсен Дж., Олсен Л., Хансен К., Табуро О., Йоргенссен Ф., Йоргенссен А., Банг-Андерсен Б., Эгебьерг Дж., Стромгаард К., Кристенсен А. (2010). «Мутационное картирование и моделирование сайта связывания (S)-циталопрама в переносчике серотонина человека» . Журнал биологической химии . 285 (3): 2051–2063. дои : 10.1074/Jbc.M109.072587 . ПМК 2804362 . ПМИД 19892699 .
- ^ Jump up to: а б с д Габриэльсен М, Курчаб Р, Равна А, Куфарева И, Абагян Р, Чилмончик З, Боярски А, Силте I (2012). «Молекулярный механизм ингибирования переносчика серотонина, объясненный с помощью нового гибкого протокола стыковки» . Европейский журнал медицинской химии . 47 (1): 24–37. doi : 10.1016/J.Ejmech.2011.09.056 . ПМК 3357065 . ПМИД 22071255 .
- ^ Ямашита А., Сингх С., Кавате Т., Джин Ю., Гуо Э. (2005). «Кристаллическая структура бактериального гомолога Na +/Cl-зависимых переносчиков нейромедиаторов». Природа . 437 (7056): 215–223. Бибкод : 2005Natur.437..215Y . дои : 10.1038/nature03978 . ПМИД 16041361 . S2CID 4420334 .