Открытие и разработка ингибиторов дипептидилпептидазы-4.
Ингибиторы дипептидилпептидазы-4 (ингибиторы ДПП-4) представляют собой ингибиторы фермента , которые ингибируют фермент дипептидилпептидазу-4 (ДПП-4). Их применяют при лечении сахарного диабета 2 типа . Ингибирование фермента ДПП-4 продлевает и усиливает активность инкретинов , играющих важную роль в секреции инсулина и регуляции контроля уровня глюкозы в крови . [ 1 ] Сахарный диабет 2 типа — хроническое метаболическое заболевание, возникающее в результате неспособности β -клеток поджелудочной железы секретировать достаточное количество инсулина для удовлетворения потребностей организма. Инсулинорезистентность и повышенное производство глюкозы в печени также могут играть роль, увеличивая потребность организма в инсулине. Современные методы лечения , за исключением добавок инсулина, иногда недостаточны для достижения контроля и могут вызывать нежелательные побочные эффекты , такие как увеличение веса и гипогликемия . В последние годы на основе продолжающихся исследований механизма выработки инсулина и регуляции метаболизма сахара в организме были разработаны новые препараты. Было обнаружено, что фермент DPP-4 играет значительную роль. [ 2 ]
История
[ редактировать ]С момента своего открытия в 1967 году сериновая протеаза DPP-4 стала популярным объектом исследований. [ 2 ] Ингибиторы ДПП-4 уже давно ищут в качестве инструментов для выяснения функционального значения фермента . Первые ингибиторы были охарактеризованы в конце 1980-х и 1990-х годах. Каждый ингибитор был важен для установления ранней взаимосвязи структура-активность (SAR) для последующего исследования. Ингибиторы делятся на два основных класса: те, которые ковалентно взаимодействуют с ДПП-4, и те, которые этого не делают. [ 3 ] DPP-4 представляет собой дипептидазу , которая избирательно связывает субстраты , содержащие пролин в положении P1, поэтому многие ингибиторы DPP-4 имеют 5-членные гетероциклические кольца, имитирующие пролин , например пирролидин , цианопирролидин, тиазолидин и цианотиазолидин. [ 4 ] [ 5 ] Эти соединения обычно образуют ковалентные связи с каталитическим остатком Ser630. [ 5 ]
В 1994 году исследователи из Zeria Pharmaceuticals представили цианопирролидины с нитрильной функциональной группой , которая, как предполагалось, образует имидат с каталитическим серином . Одновременно были опубликованы другие ингибиторы ДПП-4 без нитрильной группы, но они содержали другие взаимодействующие с серином мотивы, например бороновые кислоты , фосфонаты или диацилгидроксиламины . Эти соединения не были такими эффективными из-за сходства ДПП-4 и пролилолигопептидазы (ПЭП), а также страдали химической нестабильностью . Компания Ferring Pharmaceuticals подала заявку на патент на два цианопирролидиновых ингибитора DPP-4, который они опубликовали в 1995 году. Эти соединения обладали превосходной эффективностью и улучшенной химической стабильностью.
В 1995 году Эдвин Б. Виллхауэр из Novartis начал исследовать N-замещенные глицинилцианопирролидины, основываясь на том факте, что DPP-4 идентифицирует N-метилглицин как N-концевую аминокислоту . Эта группа новых цианопирролидинов стала чрезвычайно популярной областью исследований в последующие годы. Были представлены некоторые исследования с двойными ингибиторами ДПП-4 и вазопептидазы, поскольку считается, что ингибирование вазопептидазы усиливает антидиабетический эффект ингибирования ДПП-4 за счет стимуляции секреции инсулина . Мотив, ингибирующий вазопептидазу, соединен с ингибитором ДПП-4 по N-заместителю. [ 3 ] [ 6 ]
Механизм ДПП-4
[ редактировать ]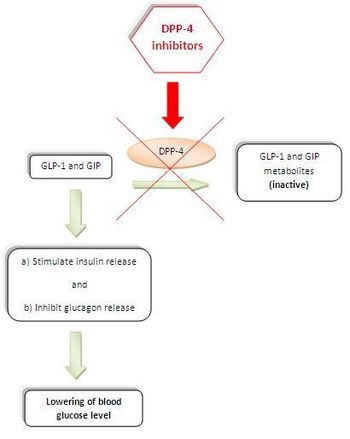
Рис.1: Во время еды , инкретины глюкагоноподобный пептид 1 (GLP-1) и глюкозозависимый желудочный ингибирующий полипептид (GIP) высвобождаются из тонкой кишки в кровоток. Эти гормоны регулируют секрецию инсулина глюкозозависимым образом. (GLP-1 выполняет множество функций в организме человека . Он стимулирует биосинтез инсулина, ингибирует секрецию глюкагона, замедляет опорожнение желудка, снижает аппетит и стимулирует регенерацию островковых β-клеток .)
GLP-1 и GIP имеют чрезвычайно короткий период полураспада в плазме из-за очень быстрой инактивации, катализируемой ферментом DPP -4. Ингибирование ДПП-4 замедляет их инактивацию, тем самым усиливая их действие, что приводит к снижению уровня глюкозы в плазме, что делает его полезным при лечении диабета 2 типа. ( Рисунок 1 ). [ 2 ] [ 7 ]
Распределение и функции ДПП-4
[ редактировать ]
ДПП-4 прикрепляется к плазматической мембране эндотелия почти каждого органа организма . Ткани , которые сильно экспрессируют ДПП-4, включают экзокринную поджелудочную железу , потовые железы , слюнные и молочные железы , тимус , лимфатические узлы , желчные пути , почки , печень , плаценту , матку , простату , кожу и капиллярное русло кишечника слизистой оболочки (где большая часть GLP-1 инактивируется локально). Он также присутствует в растворимой форме в жидкостях организма , таких как плазма крови и спинномозговая жидкость . (Бывает также, что DPP-4 является Т-клетки активирующим антигеном, CD26 .)
DPP-4 избирательно расщепляет две аминокислоты из пептидов , таких как GLP-1 и GIP, у которых находится пролин или аланин во втором положении ( рис. 2 ). В активном центре , на который действует ДПП-4, имеется характерное расположение трех аминокислот : Asp-His-Ser. Поскольку аланин и пролин имеют решающее значение для биологической активности GPL-1 и GIP, они инактивируются путем отщепления этих аминокислот . Таким образом, предотвращение деградации инкретиновых гормонов GLP-1 и GIP путем ингибирования DPP-4 может стать терапевтической стратегией при лечении диабета 2 типа. [ 1 ] [ 8 ]
Характеристики ДПП-4
[ редактировать ]Поскольку DPP-4 является протеазой , неудивительно, что ингибиторы, вероятно, будут иметь пептидную природу, и эта тема дошла до современных исследований. [ 3 ]
Структура
[ редактировать ]Рентгеновские структуры ДПП-4 , опубликованные с 2003 г., дают достаточно подробную информацию о структурных характеристиках сайта связывания . Было обнаружено множество структурно разнообразных ингибиторов ДПП-4 , и это неудивительно, учитывая свойства сайта связывания: [ 9 ]
1. Глубокий липофильный карман в сочетании с несколькими открытыми ароматическими боковыми цепями для достижения высокого сродства связывания малых молекул.
2. Значительный доступ растворителя , позволяющий регулировать физико-химические свойства ингибиторов, что приводит к улучшению фармакокинетического поведения.
состоящий из 766 аминокислот ДПП-4 представляет собой трансмембранный гликопротеин, , принадлежащий к семейству пролилолигопептидаз . Он состоит из трех частей; цитоплазматический . хвост, трансмембранная область и внеклеточная часть Внеклеточная часть разделена на каталитический домен и восьмилопастной β-пропеллерный домен. Последний способствует сайту связывания ингибитора. Каталитический домен имеет α/β-гидролазную складку и содержит каталитическую триаду Ser630 – Asp708 – His740. S1-карман очень гидрофобен и состоит из боковых цепей: Tyr631, Val656, Trp662, Tyr666 и Val711. Существующие рентгеновские структуры показывают, что нет большой разницы в размерах и форме кармана, что указывает на высокую специфичность S1-кармана к пролина . остаткам [ 9 ] [ 8 ]
Связывающий сайт
[ редактировать ]
Ингибиторы ДПП-4 обычно имеют электрофильную группу, которая может взаимодействовать с гидроксилом каталитического серина в активном сайте связывания ( рис. 3 ). Часто эта группа представляет собой нитрильную группу, но также может представлять собой бороновую кислоту или дифенилфосфонат . Эта электрофильная группа может связываться с имидатным комплексом с помощью ковалентных связей и иметь медленную кинетику прочного связывания, но эта группа также отвечает за проблемы со стабильностью из-за реакций со свободной аминогруппой P2-аминокислоты. Поэтому были также разработаны ингибиторы без электрофильной группы, но эти молекулы показали токсичность из-за сродства к другим дипептидилпептидазам, например, ДПП-2, ДПП-8 и ДПП-9 . [ 10 ]
Ингибиторы ДПП-4 относятся к различным структурным типам. В 2007 году лишь немногие из наиболее мощных соединений содержали пролина группу цианопирролидина P1 , миметика . Эта группа усиливает эффективность, вероятно, из-за временного ковалентного захвата нитрильной группы гидроксилом Ser630 активного центра, что приводит к замедленной диссоциации и медленному прочному связыванию некоторых ингибиторов. Когда это повышение эффективности было достигнуто, были отмечены некоторые проблемы с химической стабильностью, и пришлось создавать более совершенные молекулы. Чтобы избежать этих проблем со стабильностью, была исследована возможность исключения нитрильной группы. Аминокислоты с арильными или полярными боковыми цепями не показали заметного ингибирования DPP-4 , и фактически все соединения без нитрильной группы в этом исследовании претерпели 20-50-кратную потерю эффективности, что соответствует соединениям, содержащим нитрильную группу. [ 11 ]
Открытие и развитие
[ редактировать ]Важно найти быструю и точную систему для открытия новых ингибиторов ДПП-4 с идеальными терапевтическими профилями. Высокопроизводительный скрининг (HTS) обычно дает низкую вероятность выявления ингибиторов, но виртуальный скрининг (VS) может дать более высокие показатели. VS , например, использовался для скрининга малых первичных алифатических аминов для идентификации фрагментов , которые можно было бы разместить в сайтах S1 и S2 DPP-4 . С другой стороны, эти фрагменты не были очень мощными и поэтому считались отправной точкой для разработки более совершенных. Трехмерные модели могут стать полезным инструментом для разработки новых ингибиторов ДПП-4 . Модели фармакофоров были созданы на основе ключевых химических свойств соединений , обладающих ДПП-4 ингибирующей активностью . Эти модели могут дать гипотетическую картину основного химического элемента, ответственного за ингибирующую активность. [ 5 ] Первые ингибиторы ДПП-4 были обратимыми ингибиторами и имели серьезные побочные эффекты из-за низкой селективности. Исследователи подозревали, что ингибиторы с коротким периодом полураспада будут предпочтительнее, чтобы свести к минимуму возможные побочные эффекты . Однако, поскольку клинические испытания показали обратное, новейшие ингибиторы ДПП-4 обладают длительным эффектом. Одним из первых зарегистрированных ингибиторов ДПП-4 был P32/98 от компании Merck . Он использовал тиазолидид в качестве заменителя P1 и был первым ингибитором ДПП-4, который показал действие как на животных , так и на людях , но не был разработан для коммерческого использования из-за побочных эффектов . Другой старый ингибитор — DPP-728 от Novartis , где в качестве P1-заменителя используется 2-цианопирролидин. Добавление цианогруппы обычно увеличивает эффективность. Поэтому внимание исследователей было обращено на эти соединения. Обычно ингибиторы ДПП-4 являются либо субстратоподобными , либо несубстратноподобными. [ 12 ]

Субстратноподобные ингибиторы
[ редактировать ]Субстратноподобные ингибиторы ( рис. 4 ) встречаются чаще, чем несубстратные. Они связываются ковалентно или нековалентно и имеют базовую структуру, в которой заместитель P1 занимает S1-карман, а заместитель P2 занимает S2-карман. Обычно они содержат пролина миметик , занимающий S1-карман. Большие заместители в 2-цианопирролидиновом кольце обычно не переносятся, поскольку S1-карман довольно мал. [ 12 ] Поскольку ДПП-4 идентичен Т-клеток маркеру активации CD26 , а ингибиторы ДПП-4, как известно, ингибируют пролиферацию Т-клеток , эти соединения первоначально считались потенциальными иммуномодуляторами . Когда была обнаружена функция против диабета 2 типа , цианопирролидины стали очень популярным исследовательским материалом. Чуть позже были открыты вилдаглиптин и саксаглиптин , которые на сегодняшний день являются наиболее разработанными цианопирролидиновыми ингибиторами ДПП-4 . [ 6 ]
Цианопирролидины
[ редактировать ]Цианопирролидины имеют два ключевых взаимодействия с комплексом DPP-4: [ 6 ]
1. Нитрил в положении разрезаемой связи пептидного субстрата, что важно для высокой эффективности. Нитрильная группа образует обратимые ковалентные связи с каталитически активным гидроксилом серина (Ser630), т.е. цианопирролидины являются конкурентными ингибиторами с медленной кинетикой диссоциации.
2. Сеть водородных связей между протонированной аминогруппой и отрицательно заряженной областью поверхности белка , Glu205, Glu206 и Tyr662. Все цианопирролидины содержат основной, первичный или вторичный амин , что делает возможной эту сеть, но эффективность этих соединений обычно снижается, если эти амины заменяются. Тем не менее, в двух патентных заявках показано, что аминогруппа может быть изменена, то есть заменена гидразином , но утверждается, что эти соединения не только действуют посредством ингибирования DPP-4, но также предотвращают диабетические сосудистые осложнения, действуя в качестве поглотителя радикалов .
Отношения структура-деятельность (SAR)
[ редактировать ]Важная связь структура-деятельность : [ 11 ]
кольца ингибиторов на основе цианопирролидина существуют строгие стерические ограничения 1. Вокруг пирролидинового , допускается только замещение водородом , фтором , ацетиленом , нитрилом или метано.
2. Наличие нитрильного фрагмента в пирролидиновом кольце имеет решающее значение для достижения мощной активности.
Также систематические исследования SAR показали, что размер кольца и стереохимия положения P2 весьма обусловлены. 5-членное кольцо и L-конфигурация показали лучшие результаты, чем 4-членное или 6-членное кольцо с D-конфигурацией. только незначительные изменения пирролидинового Допускаются кольца, поскольку хорошее прилегание кольца к гидрофобному карману S1 очень важно для высокого сродства. Были проведены некоторые испытания, например, по пирролидина тиазолином замене . Это привело к улучшению эффективности, но также к потере химической стабильности. Попытки улучшить химическую стабильность часто приводили к потере специфичности из-за взаимодействия с ДПП-8 и ДПП-9 . Эти взаимодействия были связаны с повышенной токсичностью и смертностью животных. Позиция P1 имеет строгие ограничения и практически не допускает каких-либо изменений. С другой стороны, в положении P2 можно внести различные изменения. Фактически, замена с довольно большими разветвленными боковыми цепями, например, трет -бутилглицином, обычно увеличивает активность и химическую стабильность, что может привести к более длительному ингибированию фермента DPP-4. Также было отмечено, что биарила на основе Боковые цепи также могут давать высокоактивные ингибиторы. Первоначально считалось, что только липофильное допускается замещение. Теперь установлено, что замещение полярных отрицательно заряженных боковых цепей, а также гидрофильное замещение может привести к превосходной ингибирующей активности. [ 6 ]
Химическая стабильность
[ редактировать ]
В целом ингибиторы ДПП-4 не являются очень стабильными соединениями. Поэтому многие исследователи сосредоточивают внимание на повышении стабильности цианопирролидинов. Наиболее распространенным методом улучшения химической стабильности является введение стерической массы . Два наиболее выраженных цианопирролидина, вилдаглиптин и саксаглиптин , были созданы таким образом. K579 — ингибитор ДПП-4, открытый исследователями из Кёва Хакко Кёго. Это улучшило не только химическую стабильность, но и более продолжительное действие. Это длительное действие, скорее всего, было обусловлено медленной диссоциацией комплекса фермент-ингибитор и активного оксидного метаболита , который подвергается энтерогепатической циркуляции. Открытие активного оксида фактически стало большим прорывом, поскольку оно привело к разработке вилдаглиптина и саксаглиптина . Одной из основных проблем стабильности ингибитора ДПП-4 является внутримолекулярная циклизация. Предпосылкой внутримолекулярной циклизации является превращение транс - ротамера связывающий ДПП-4. , который представляет собой ротамер, ( Рисунок 5 ). Таким образом, предотвращение этого преобразования повысит стабильность. Это предотвращение оказалось успешным при включении амидной группы в кольцо, в результате чего было создано соединение, которое сохраняло ингибирующую активность ДПП-4, не подвергалось внутримолекулярной циклизации и было даже более селективным по отношению к различным ферментам ДПП. Также сообщалось, что цианазетидин в положении P1 и β-аминокислота в положении P2 повышают стабильность. [ 6 ]
Вилдаглиптин
[ редактировать ]Вилдаглиптин (Галвус) ( рис. 6 ) был впервые синтезирован в мае 1998 года и назван в честь Эдвина Б. Виллхауэра. Это было обнаружено, когда исследователи из Novartis исследовали производные адамантила , которые оказались очень эффективными . Адамантильная и замедляет внутримолекулярную циклизацию , группа действует как стерическая масса одновременно повышая химическую стабильность. Кроме того, первичные метаболиты были высокоактивными. Чтобы избежать дополнительного хирального центра, гидроксилирование адамантильного было проведено кольца ( Фигура 6 ). Продукт, вилдаглиптин , оказался еще более стабильным, подвергался внутримолекулярной циклизации в 30 раз медленнее, обладал высокой ингибирующей ДПП-4 активностью и более длительным фармакодинамическим эффектом. [ 6 ]
Саксаглиптин
[ редактировать ]
Исследователи из Bristol-Myers Squibb обнаружили, что увеличение стерической массы N - концевой аминокислоты боковой цепи приводит к повышению стабильности. Для дополнительного повышения стабильности транс - ротамер стабилизировали цис -4,5-метановым замещением пирролидинового кольца, что приводило к внутримолекулярному ван-дер-ваальсовскому взаимодействию и тем самым предотвращало внутримолекулярную циклизацию. Из-за этой повышенной стабильности исследователи продолжили исследования цис -4,5-метаноцианопирролидинов и наткнулись на новое адамантила производное , которое показало необычайное ингибирование DPP-4 ex vivo в плазме крыс. Также отмечена высокая скорость микросомального обмена, что указывало на то, что производное быстро превращалось в активный метаболит . После гидроксилирования адамантильной группы они получили продукт с лучшей микросомальной стабильностью и улучшенной химической стабильностью. Этот продукт получил название саксаглиптин (Онглиза) ( рис. 6 ). [ 6 ] В июне 2008 года компании AstraZeneca и Bristol-Myers Squibb подали новую заявку на препарат Онглиза в США и заявку на получение регистрационного удостоверения в Европе . [ 13 ] предоставило одобрение в США В июле 2009 года FDA пролонгированного действия на Онглизу 5 мг и Онглизу 2,5 мг. Позже его объединили с метформином (принимали один раз в день) и одобрили FDA в январе 2011 года под торговым названием Комбиглизе XR.
Денаглиптин
[ редактировать ]Денаглиптин ( рис. 6 ) представляет собой современное соединение с разветвленной боковой цепью в положении P2, но также имеет (4S ) -фторзамещение в цианопирролидиновом кольце. [ 6 ] Это хорошо известный ингибитор ДПП-4, разработанный компанией GlaxoSmithKline (GSK). Биологические оценки показали, что S -конфигурация аминокислотной части важна для ингибирующей активности, поскольку R -конфигурация неохотно демонстрирует ингибирование. Эти результаты будут полезны в будущих разработках и синтезе ингибиторов ДПП-4 . [ 14 ] GSK приостановила клинические испытания фазы III в октябре 2008 года. [ 15 ]
Соединения на основе азетидина
[ редактировать ]Информация об этой группе ингибиторов весьма ограничена. азетидина на основе Ингибиторы ДПП-4 можно условно разделить на три основные подкатегории: 2-цианоазетидины, 3-фторазетидины и 2-кетоазетидины. Наиболее мощные кетоазетидины и цианоазетидины имеют большие гидрофобные аминокислотные группы, связанные с азетидина азотом , и активны при концентрации ниже 100 нМ. [ 16 ]
Несубстратные ингибиторы
[ редактировать ]Несубстратные ингибиторы не учитывают дипептидную природу субстратов ДПП-4. Они являются нековалентными ингибиторами и обычно имеют ароматическое кольцо , занимающее S1-карман вместо миметика пролина. [ 12 ]
В 1999 году компания Merck начала программу разработки препаратов ингибиторов ДПП-4. внутреннего скрининга и медицинской химии Когда они начали программу , два ингибитора ДПП-4 уже находились в клинических испытаниях : изолейцилтиазолидид (P32/38) и NVP-DPP728 от Novartis . Компания Merck имеет лицензию на L- трео - изолейцилтиазолидид и его алло- стереоизомер . В исследованиях на животных они обнаружили, что оба изомера имеют одинаковое сродство к DPP-4, аналогичную эффективность in vivo , схожие фармакокинетические и метаболические профили. Тем не менее, алло- изомер был в 10 раз более токсичен . Исследователи обнаружили, что эта разница в токсичности обусловлена более сильным ингибированием алло- изомером ДПП-8 и ДПП-9 , а не селективным ингибированием ДПП-4. Дополнительные исследования также подтвердили, что ингибирование DPP-4 не приведет к нарушению иммунной функции. Как только была обнаружена связь между сродством к ДПП-8/ДПП-9 и токсичностью , компания Merck решила идентифицировать ингибитор с более чем тысячекратным сродством к ДПП-4 по сравнению с другими дипептидазами. Для этой цели они использовали библиотеки позиционного сканирования . Сканируя эти библиотеки, исследователи обнаружили, что и DPP-4, и DPP-8 демонстрируют сильное предпочтение расщеплению пептидов пролином в положении P1 , но они обнаружили большую разницу в сайте P2; т.е. они обнаружили, что кислотная функциональность в положении P2 может обеспечивать большее сродство к DPP-4 по сравнению с DPP-8 . Компания Merck продолжала проводить еще больше исследований и скринингов. Они прекратили работу над соединениями из ряда α-аминокислот, родственных изолейцилтиазолидиду, из -за отсутствия селективности, но вместо этого они обнаружили очень селективный ряд β- аминокислот пиперазина посредством исследований SAR на двух скрининговых исследованиях. При попытке стабилизировать пиперазиновый фрагмент была создана группа бициклических производных, что привело к идентификации мощного и селективного ряда триазолопиперазина. Большинство этих аналогов показали отличные фармакокинетические свойства у доклинических видов. Оптимизация этих соединений в конечном итоге привела к открытию ситаглиптина. . [ 17 ]
Ситаглиптин
[ редактировать ]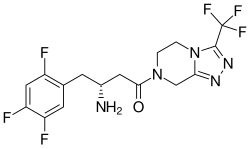
Ситаглиптин β-аминоамида (Янувия) имеет новую структуру с производными ( рис. 7 ). Поскольку ситаглиптин продемонстрировал превосходную селективность и эффективность in vivo, он побудил исследователей изучить новую структуру ингибиторов ДПП-4 с присоединенным фрагментом β- аминокислоты . В настоящее время проводятся дальнейшие исследования по оптимизации этих соединений для лечения диабета . [ 4 ] В октябре 2006 года ситаглиптин стал первым ингибитором ДПП-4, получившим одобрение FDA для лечения диабета 2 типа . [ 18 ] Кристаллографическая структура ситаглиптина наряду с молекулярным моделированием была использована для продолжения поиска структурно разнообразных ингибиторов. Новый мощный , селективный и биодоступный при пероральном приеме ингибитор ДПП-4 был обнаружен путем замены центрального циклогексиламина в ситаглиптине на 3-аминопиперидин. Замена 2-пиридила стала первым прорывом в SAR, поскольку эта группа играет значительную роль в эффективности и селективности DPP-4. [ 2 ]
было показано С помощью рентгеновской кристаллографии , как ситаглиптин связывается с комплексом ДПП-4: [ 12 ]
1. Трифторфенильная группа занимает S1-карман
2. Трифторметильная группа взаимодействует с боковыми цепями остатков Arg358 и Ser209.
3. Аминогруппа образует солевой мостик с Tyr662 и карбоксилированными группами двух остатков глутамата, Glu205 и Glu206.
4. Группа триазолопиперазина сталкивается с фенильной группой остатка Phe357.

Связанные соединения фенилэтиламина
[ редактировать ]Исследователи из Abbott Laboratories выявили три новые серии ингибиторов ДПП-4 с использованием HTS. После дополнительных исследований и оптимизации был обнаружен ABT-341 ( рис. 8 ). Это мощный и селективный ингибитор ДПП-4 с 2D-структурой, очень похожей на ситаглиптин . Однако 3D-структура совсем другая. ABT-341 также имеет трифторфенильную группу, которая занимает S1-карман и свободную аминогруппу , но две карбонильные группы ориентированы на 180° друг от друга. Считается также, что ABT-341 взаимодействует с Tyr547, вероятно, из-за стерических препятствий между циклогексенильным кольцом и тирозина . боковой цепью [ 12 ] Омариглиптин является одним из таких соединений, которое находится на стадии III разработки компанией Merck & Co.
Пирролидиновые соединения
[ редактировать ]Пирролидиновый был тип ингибиторов ДПП-4 впервые обнаружен после HTS . [ 19 ] Исследования показали, что пирролидиновые кольца были частью соединений, которые вписывались в сайт связывания . Дальнейшие разработки привели к созданию фторзамещенных пирролидинов, которые проявляют превосходную активность, а также пирролидинов с конденсированными циклопропильными кольцами, которые обладают высокой активностью. [ 20 ]
Соединения на основе ксантина
[ редактировать ]Это другой класс ингибиторов, который был идентифицирован с HTS. [ 12 ] ароматических гетероциклов на основе Ингибиторы ДПП-4 в последнее время привлекли повышенное внимание. Первые патенты, описывающие ксантины ( рис. 10 ) как ингибиторы ДПП-4, были получены от компаний Boehringer-Ingelheim (BI) и Novo Nordisk . [ 21 ] При ксантина сравнении ингибиторов ДПП-4 на основе с ситаглиптином и вилдаглиптином они показали превосходный профиль. ксантины Считается, что обладают более высокой эффективностью , более длительным ингибированием и более длительным улучшением толерантности к глюкозе . [ 22 ]
Алоглиптин
[ редактировать ]
Алоглиптин ( рис. 9 ) – новый ингибитор ДПП-4, разработанный фармацевтической компанией Takeda . [ 22 ] Исследователи предположили, что структура на основе хиназолинона ( рис. 9 ) будет иметь необходимые группы для взаимодействия с активным центром DPP-4 комплекса . Соединения на основе хиназолинона эффективно взаимодействовали с комплексом ДПП-4, но имели низкий период метаболического полувыведения . Было обнаружено, что при замене хиназолинона пиримидиндионом метаболическая стабильность повышалась, и в результате появился мощный , селективный, биодоступный ингибитор ДПП-4, названный алоглиптином . Соединения на основе хиназолина продемонстрировали мощное ингибирование и превосходную селективность по сравнению с родственной протеазой 8 DPP- . Однако короткий из период полувыведения -за окисления группы А-кольца фенильной был проблематичным. Сначала исследователи попытались получить фторированное производное. Производное показало улучшенную метаболическую стабильность и превосходное ингибирование фермента ДПП-4. Однако было также обнаружено, что он ингибирует CYP 450 3A4 и блокирует канал hERG . Решением этой проблемы стала замена хиназолинона на другие. гетероциклы , но хиназолинон можно заменить без потери ингибирования ДПП-4. Алоглиптин был открыт, когда хиназолинон был заменен пиримидиндионом . Алоглиптин продемонстрировал превосходное ингибирование ДПП-4 и исключительную селективность, более чем в 10 000 раз превосходящую близкородственные сериновые протеазы ДПП-8 и ДПП-9 . Кроме того, он не ингибирует ферменты CYP 450 и не блокирует канал hERG в концентрации до 30 мкМ. На основании этих данных алоглиптин . для доклинической оценки был выбран [ 23 ] В январе 2007 года алоглиптин проходил III фазу клинических испытаний , а в октябре 2008 года он находился на рассмотрении Управления по контролю за продуктами и лекарствами США . [ 24 ]
Линаглиптин
[ редактировать ]
Исследователи из BI обнаружили, что использование бути-2-нильной группы привело к появлению мощного кандидата под названием BI-1356 ( рис. 10 ). В 2008 году БИ-1356 проходил III фазу клинических испытаний ; он был выпущен как линаглиптин в мае 2011 года. Рентгеновская кристаллография показала, что этот тип ксантина связывает комплекс DPP-4 иначе, чем другие ингибиторы : [ 12 ]
1. Аминогруппа также взаимодействует с Glu205, Glu206 и Tyr662.
2. Бути-2-нильная группа занимает S1-карман.
3. Группа урацила подвергается π-стэкинг-взаимодействию с остатком Tyr547.
4. Хиназолиновая группа подвергается π-стэкинг-взаимодействию с остатком Trp629.
Фармакология
[ редактировать ]| Лекарство | Поглощение | Биодоступность (%) | IC 50 (нМ) | Средний объем распределения (л) | Связывание с белками (%) | Период полувыведения (часы, доза 100 мг) | Метаболизм | Экскреция |
|---|---|---|---|---|---|---|---|---|
| Ситаглиптин | Быстро всасывается с максимальной концентрацией через 1–4 часа. | 87 | 18 | 198 | 38 | 12.4 | Небольшая фракция подвергается метаболизму в печени посредством CYP 450 3A4 и 2C8. | Выводится в неизмененном виде с мочой (79%). |
| Вилдаглиптин | Быстро всасывается с максимальной концентрацией через 1–2 часа. | 85 | 3 | 70.5 | 9.3 | 1,68 (один раз в день) и 2,54 (два раза в день) | Гидролиз приводит к образованию фармакологически неактивного метаболита. Часть (22%) также выводится почками в неизмененном виде. | Выведение метаболита осуществляется через мочу (85%) и кал (15%). |
Фармакокинетические свойства ситаглиптина и вилдаглиптина не зависят от возраста, пола или ИМТ . [ 18 ] Клинические исследования показали, что ситаглиптин и вилдаглиптин не имеют побочных эффектов , которые обычно наблюдаются при диабета 2 типа лечении , например, увеличения веса и гипергликемии , однако наблюдались и другие побочные эффекты, включая верхних дыхательных путей инфекции , боль в горле и диарею . [ 5 ]
См. также
[ редактировать ]- Дипептидилпептидаза-4
- Ингибиторы дипептидилпептидазы-4
- Линаглиптин
- Вилдаглиптин
- Ситаглиптин
- Саксаглиптин
- Берберин
- тенелиглиптин
- госоглиптин
Ссылки
[ редактировать ]- ^ Jump up to: а б Грин, Брайан; Флэтт, Питер; Бейли, Клиффорд (декабрь 2006 г.), «Ингибиторы дипептидилпептидазы IV (DPP IV): новый класс лекарств для лечения диабета 2 типа», Исследования диабета и сосудистых заболеваний , 3 (3): 159–165, doi : 10.3132 /dvdr.2006.024 , PMID 17160910
- ^ Jump up to: а б с д Себокова, Елена; Господи, Андреас; Берингер, Маркус; Мизрахи, Жак (май 2006 г.), «Ингибиторы дипептидилпептидазы IV: следующее поколение новых многообещающих методов лечения диабета 2 типа», Current Topics in Medicinal Chemistry , 7 (6): 547–555, doi : 10.2174/156802607780091019 , PMID 17352676
- ^ Jump up to: а б с Видеман, Пол (май 2007 г.), «Ингибирование DPP-IV: многообещающая терапия для лечения диабета 2 типа» , Progress in Medical Chemistry , Progress in Medicinal Chemistry, 45 : 71–73, doi : 10.1016/s0079-6468 (06 )45502-8 , ISBN 978-0-444-52808-7 , PMID 17280902
- ^ Jump up to: а б Ан, Джин Хи; Шин, Ми Сик; Джун, Ми Э; Юнг, Сун Хо; Кан, Сын Гю; Ким, Кван Рок; Ри, Санг Дал; Канг, Нам Сук; Ким, Сын Гю (февраль 2007 г.), «Синтез, биологическая оценка и структурное определение β-аминоацилсодержащих циклических производных гидразина в качестве ингибиторов дипептидилпептидазы IV (DPP-IV)», Bioorganic & Medicinal Chemistry Letters , 17 (9): 2622 –2628, номер doi : 10.1016/j.bmcl.2007.01.111 , PMID 17331715
- ^ Jump up to: а б с д Лу, Ю.-Лин; Цай, Кенг-Чанг; Чан, И-Кун; Цзян, Вейр-Торн; У, Сы-Хуэй; Махиндру, Нирадж; Цзянь, Цзя-Хуэй; Ли, Шиоу-Джу; Чен, Синь; Ву, Су-Ин (январь 2008 г.), «Трехмерная фармакофорная модель ингибиторов дипептидилпептидазы IV», Европейский журнал медицинской химии , 43 (8): 1603–1611, doi : 10.1016/j.ejmech.2007 . ПМИД 18207285
- ^ Jump up to: а б с д и ж г час Петерс, Йенс-Уве (март 2007 г.), «11 лет использования цианопирролидинов в качестве ингибиторов DPP-IV», Current Topics in Medicinal Chemistry , 7 (6): 579–595, doi : 10.2174/156802607780091000 , PMID 17352679
- ^ Кокс, Джейсон; Харпер, Барт; Мастраккио, Энтони; Лейтинг, Барбара; Рой, Ранабир; Решма, Патель; Ву, Джозеф; Лайонс, Кэтрин; Он, Хуайбин; Эдмондсон, Скотт (июнь 2007 г.), «Открытие 3-аминопиперидинов как мощных, селективных и перорально биодоступных ингибиторов дипептидилпептидазы IV», Bioorganic & Medicinal Chemistry , 17 (16): 4579–4583, doi : 10.1016/j.bmcl. 2007.05.087 , PMID 17562364
- ^ Jump up to: а б Идрис, Искандар; Доннели, Ричард (январь 2007 г.), «Ингибиторы дипептидилпептидазы-IV: основной новый класс пероральных противодиабетических препаратов», Diabetes, Obesity and Metabolism , 9 (2): 153–165, doi : 10.1111/j.1463-1326.2007. 00705.x , PMID 17300591 , S2CID 3102605
- ^ Jump up to: а б Кун, Бернд; Хенниг, Майкл; Маттеи, Патрицио (март 2007 г.), «Молекулярное распознавание лигандов в дипептидилпептидазе IV», Current Topics in Medical Chemistry , 7 (6): 609–619, doi : 10.2174/156802607780091064 , PMID 17352681
- ^ Векен, Питер Ван дер; Хемерс, Ахиэль; Августинс, Коэн (май 2007 г.), «Пролилпептидаза, связанная с дипептидилпептидазой IV: потенциал специфических ингибиторов в разработке лекарств», Current Topics in Medicinal Chemistry , 7 (6): 621–635, doi : 10.2174/156802607780091046 , PMID 17352682
- ^ Jump up to: а б Симпкинс, Лигая; Болтон, Скотт; Пи, Зулан; Скаттон, Джеймс; Квон, Чет; Маньен, Дэвид; Огери, Дэвид; Гунгор, Тимур; Ротелла, Дэвид; Хаманн, Лоуренс (сентябрь 2007 г.), «Мощные ненитриловые дипептидные дипептидилпептидазы IV ингибиторы», Bioorganic & Medicinal Chemistry Letters , 17 (23): 6476–6480, doi : 10.1016/j.bmcl.2007.09.090 , PMID 17937986
- ^ Jump up to: а б с д и ж г Пей, Чжунхуа (март 2007 г.), «От скамьи до постели: ингибиторы дипептидилпептидазы IV, новый класс пероральных сахароснижающих средств» , Current Opinion in Drug Discovery & Development , 11 (4): 515–532, заархивировано из оригинал от 17 октября 2012 г.,
требуется подписка
- ^ AstraZeneca и Bristol-Myers Squibb подают новую заявку на лекарственное средство в США и заявку на получение регистрационного удостоверения в Европе для ONGLYZA (саксаглиптин) для лечения диабета 2 типа , заархивировано из оригинала 7 июля 2011 г. , получено 29 июля 2013 г.
- ^ Дэн, Гуанхуэй; Да, Дежу; Ли, Юаньюань; Он, Линьян; Чжоу, Ю; Ван, Цзян; Ли, Цзя; Цзян, Хуалян; Лю, Хун (сентябрь 2008 г.), «Синтез (S)-, (R)- и (rac)-2-амино-3,3-бис(4-фторфенил)пропановых кислот и оценка DPP-IV. ингибирующая активность диастереомеров Денаглиптина», Tetrahedron , 64 (46): 10512–10516, doi : 10.1016/j.tet.2008.08.097
- ^ Денаглиптин , заархивировано из оригинала 30 ноября 2013 г.
- ^ Феррарис, Дана; Беляков Сергей; Ли, Вэйсин; Оливер, Эдди; Ко, Яо-Сен; Кальвин, Дэвид; Лаутар, Сьюзен; Томас, Берт; Рохас, Камило (март 2007 г.), «Ингибиторы дипептидилпептидазы IV (DPP IV) на основе азетидина», Current Topics in Medicinal Chemistry , 7 (6): 597–608, doi : 10.2174/156802607780090993 , PMID 17352680
- ^ Торнберри, Нэнси А.; Вебер, Энн Э. (март 2007 г.), «Открытие Янувии (ситаглиптина), селективного ингибитора дипептидилпептидазы IV для лечения диабета 2 типа», Current Topics in Medicinal Chemistry , 7 (6): 557–568, doi : 10.2174 /156802607780091028 , PMID 17352677
- ^ Jump up to: а б с Уайт, Джон (2008), «Ингибиторы дипептидилпептидазы-IV: фармакологический профиль и клиническое использование» , Clinical Diabetes , 26 (2): 53–57, doi : 10.2337/diaclin.26.2.53 , получено 29 июля 2013 г.
- ^ Райт, Стивен; Аммирати, Марк; Эндрюс, Ким; Бродер, Энн; Дэнли, Деннис; Доран, Шон; Лиллквист, Джей; Лю, Шэньпин; МакКлюр, Лестер; Кокс, Эрик (август 2007 г.), «(3R,4S)-4-(2,4,5-трифторфенил)пирролидин-3-иламин ингибиторы дипептидилпептидазы IV: синтез in vitro, in vivo и рентгенография. кристаллографическая характеристика», Bioorganic & Medicinal Chemistry Letters , 17 (20): 5638–5642, doi : 10.1016/j.bmcl.2007.07.081 , PMID 17822893
- ^ Хулин, Бернард; Кабрал, Шон; Лопазе, Майкл; ВанВолкенбург, Мария; Эндрюс, Ким; Паркер, Дженис (август 2005 г.), «Новые фторированные пирролидиновые и азетидинамиды как ингибиторы дипептидилпептидазы IV», Bioorganic & Medicinal Chemistry Letters , 15 (21): 4770–4773, doi : 10.1016/j.bmcl.2005.07.026 , PMID 16115768
- ^ Щепанкевич, Брюс Г.; Kurukulasuriya, Ravi (March 2007), "Aromatic Heterocycle-Based DPP-IV Inhibitors: Xanthines and Related Structural Types", Current Topics in Medicinal Chemistry , 7 (6): 569–578, doi : 10.2174/156802607780091073 , PMID 17352678
- ^ Jump up to: а б Ферраннини, Э.; Скрха, Дж.; Ли, Эйзирик; Д.Л., Гейл; Э., Йоргенс; В. (2007), «Протокол 42-й Генеральной ассамблеи Европейской ассоциации по изучению диабета», Diabetologia , 50 (1 Supp): S362–S363, doi : 10.1007/s00125-007-0809-7 , PMID 17710465 , ProQuest 213848837 ( требуется регистрация )
- ^ Фэн, Цзюнь; Чжан, Чжиюань; Уоллес, Майкл; Стаффорд, Джеффри; Калдор, Стивен; Кассель, Дэниел; Навре, Марк; Ши, Лихун; Скин, Роберт (январь 2007 г.), «Открытие алоглиптина: мощного, селективного, биодоступного и эффективного ингибитора дипептидилпептидазы IV» , Journal of Medicinal Chemistry , 50 (10): 2297–2300, doi : 10.1021/jm070104l , PMID 17441705 , получено 29 июля 2013 г.
- ^ FDA продолжает рассмотрение новой заявки Takeda на алоглиптин (SYR-322), агент DPP-4 для лечения диабета 2 типа , получено 29 июля 2013 г.