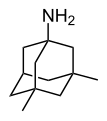
Адамантан
 | |||
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Адамантан [1] | |||
| Систематическое название ИЮПАК Трицикло[3.3.1.1 3,7 ] декан [2] | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| 1901173 | |||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| ХимическийПаук | |||
| Лекарственный Банк | |||
| Информационная карта ECHA | 100.005.457 | ||
| Номер ЕС |
| ||
| 26963 | |||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С 10 Ч 16 | |||
| Молярная масса | 136.238 g·mol −1 | ||
| Появление | Порошок от белого до почти белого цвета | ||
| Плотность | 1,07 г/см 3 (25 °С) [2] | ||
| Температура плавления | 270 ° С (518 ° F; 543 К) [2] | ||
| Точка кипения | возвышенный [2] | ||
| Плохо растворим | |||
| Растворимость в других растворителях | Растворим в углеводородах | ||
Показатель преломления ( n D ) | 1.568 [2] [3] | ||
| Структура | |||
| кубическая , пространственная группа Fm3m | |||
| 4 | |||
| 0 Д | |||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Легковоспламеняющийся | ||
| СГС Маркировка : | |||
  | |||
| Предупреждение | |||
| Х319 , Х400 | |||
| P264 , P273 , P280 , P305+P351+P338 , P337+P313 , P391 , P501 | |||
| Родственные соединения | |||
Родственные соединения: | Мемантин Римантадин Амантадин | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Адамантан представляет собой органическое соединение формулы C 10 H 16 или, более описательно, (CH) 4 (CH 2 ) 6 . Молекулы адамантана можно описать как слияние трех циклогексановых колец. Молекула одновременно жесткая и практически не подвержена напряжениям. Адамантан является наиболее стабильным изомером C 10 H 16 . Пространственное расположение атомов углерода в молекуле адамантана такое же, как и в кристалле алмаза . Это сходство привело к названию адамантан , которое происходит от греческого adamantinos (относящегося к стали или алмазу ). [4] Это белое твердое вещество с камфоры запахом . Это простейший алмазоид .
Открытие адамантана в нефти в 1933 году положило начало новой области химии, посвященной синтезу и свойствам полиэдрических органических соединений. Производные адамантана нашли практическое применение в качестве лекарств, полимерных материалов и термостойких смазок.
История и синтез
[ редактировать ]В 1924 году Х. Декер предположил существование адамантана, который он назвал декатерпеном . [5]
Первая попытка лабораторного синтеза была предпринята в 1924 немецким химиком Гансом Меервейном с использованием реакции формальдегида с диэтилмалонатом в присутствии пиперидина . Вместо адамантана Меервейн получил 1,3,5,7-тетракарбометоксибицикло[3.3.1]нонан-2,6-дион: это соединение, позже названное эфиром Меервейна, было использовано в синтезе адамантана и его производных. [6] Д. Боттгер пытался получить адамантан, используя в качестве прекурсора эфир Меервейна. Продукт трицикло-[3.3.1.1 3,7 ], был не адамантаном, а его производным. [7]
Другие исследователи пытались синтезировать адамантан, используя флороглюцинол и производные циклогексанона , но тоже потерпели неудачу. [8]

Адамантан был впервые синтезирован Владимиром Прелогом в 1941 году из эфира Меервейна. [9] [10] При выходе 0,16% пятиэтапный процесс оказался непрактичным (упрощенно на изображении ниже). Метод используется для синтеза некоторых производных адамантана. [8]

Метод Прелога был усовершенствован в 1956 году. Выход декарбоксилирования был увеличен за счет добавления пути Хунсдикера (11%) и реакции Хоффмана (24%), что увеличило общий выход до 6,5%. [11] [12] нашел более удобный метод Процесс был все еще слишком сложен, и в 1957 году Пауль фон Раге Шлейер : дициклопентадиен сначала гидрировали в присутствии катализатора (например, диоксида платины ) с получением трициклодекана , а затем превращали в адамантан с помощью кислоты Льюиса ( например хлорид алюминия ) в качестве еще одного катализатора. Этот метод увеличил выход до 30–40% и обеспечил доступный источник адамантана; поэтому он стимулировал характеристику адамантана и до сих пор используется в лабораторной практике. [13] [14] Позднее выход синтеза адамантана был увеличен до 60%. [15] и 98% - с помощью ультразвука и сверхкислотного катализа. [16] Сегодня адамантан — доступное химическое соединение, стоимость которого составляет один-два доллара за грамм.

Все вышеперечисленные методы позволяют получить адамантан в виде поликристаллического порошка. Используя этот порошок, монокристаллы можно выращивать из расплава, раствора или паровой фазы (например, с помощью метода Бриджмена-Стокбаргера ). Рост расплава приводит к наихудшему качеству кристаллов с мозаичным разбросом в рентгеновском отражении около 1°. Лучшие кристаллы получаются из жидкой фазы, но рост происходит неосуществимо медленно – несколько месяцев для кристалла размером 5–10 мм. Рост из паровой фазы является разумным компромиссом с точки зрения скорости и качества. [17] Адамантан сублимируют в кварцевой трубке, помещенной в печь, снабженную несколькими нагревателями, поддерживающими определенный градиент температуры (около 10 °С/см для адамантана) вдоль трубки. Кристаллизация начинается на одном конце трубки, который находится вблизи точки замерзания адамантана. Медленное охлаждение трубки при сохранении температурного градиента постепенно смещает зону плавления (скорость ~2 мм/час), образуя монокристаллическую булю . [18]
Естественное явление
[ редактировать ]Адамантан впервые был выделен из нефти чешскими химиками С. Ландой, В. Махачеком и М. Мзуреком. [19] [20] Они использовали фракционную перегонку нефти. Они смогли произвести лишь несколько миллиграммов адамантана, но заметили его высокие температуры кипения и плавления . Из-за (предполагаемого) сходства структуры со структурой алмаза новое соединение было названо адамантаном. [8]
Нефть остается источником адамантана; содержание варьируется от 0,0001% до 0,03% в зависимости от нефтяного месторождения и слишком мало для коммерческой добычи. [21] [22]
Нефть содержит более тридцати производных адамантана. [21] Их выделение из сложной смеси углеводородов возможно благодаря высокой температуре плавления и способности перегоняться с водяным паром и образовывать устойчивые аддукты с тиомочевиной .
Физические свойства
[ редактировать ]Чистый адамантан представляет собой бесцветное кристаллическое вещество с характерным запахом камфоры . Практически нерастворим в воде, но легко растворим в неполярных органических растворителях . [23] Адамантан имеет необычно высокую температуру плавления для углеводорода . При 270 °C его температура плавления намного выше, чем у других углеводородов с той же молекулярной массой, таких как камфен (45 °C), лимонен (-74 °C), оцимен (50 °C), терпинен (60 °C). или твистан (164 °С), или линейный C 10 H 22 углеводородный декан (-28 °С). Однако адамантан медленно сублимируется даже при комнатной температуре. [24] Адамантан можно перегонять водяным паром . [22]
Структура
[ редактировать ]
По данным дифракции электронов рентгеновской кристаллографии , молекула имеет Td и симметрию . Длина связи углерод-углерод составляет 1,54 Å , что почти идентично длине связи алмаза. Расстояния углерод-водород составляют 1,112 Å. [3]
В условиях окружающей среды адамантан кристаллизуется в гранецентрированную кубическую структуру ( пространственная группа Fm3m, a = 9,426 ± 0,008 Å , четыре молекулы в элементарной ячейке), содержащую ориентационно разупорядоченные молекулы адамантана. Эта структура превращается в упорядоченную примитивную тетрагональную фазу ( a = 6,641 Å , c = 8,875 Å ) с двумя молекулами на ячейку либо при охлаждении до 208 К, либо при повышении давления выше 0,5 ГПа. [8] [24]
Этот фазовый переход имеет первый род; оно сопровождается аномалией теплоемкости , упругости и других свойств. В частности, если в кубической фазе молекулы адамантана свободно вращаются, то в тетрагональной они заморожены; плотность увеличивается ступенчато от 1,08 до 1,18 г/см. 3 , а энтропия изменяется на значительную величину — 1594 Дж/(моль·К). [17]
Твердость
[ редактировать ]Упругие константы адамантана измерялись с использованием крупных (сантиметровых) монокристаллов и ультразвукового эхо-метода. Главное значение тензора упругости C 11 было определено как 7,52, 8,20 и 6,17 ГПа для кристаллических направлений <110>, <111> и <100>. [18] Для сравнения: соответствующие значения для кристаллического алмаза составляют 1161, 1174 и 1123 ГПа. [25] Расположение атомов углерода в адамантане и алмазе одинаковое; [26] однако в твердом адамантане молекулы не образуют ковалентную решетку, как в алмазе, а взаимодействуют посредством слабых сил Ван-дер-Ваальса . В результате кристаллы адамантана очень мягкие и пластичные. [17] [18] [27]
Спектроскопия
[ редактировать ]Спектр ядерного магнитного резонанса (ЯМР) адамантана состоит из двух плохо разрешенных сигналов, соответствующих участкам 1 и 2 (см. рисунок ниже). 1 Рука 13 Химические сдвиги ЯМР 1С составляют соответственно 1,873 и 1,756 м.д. и 28,46 и 37,85 м.д. [28] Простота этих спектров согласуется с высокой молекулярной симметрией.
Масс-спектры адамантана и его производных весьма характерны. Основной пик при m / z = 136 соответствует C
10 ч. +
16 ион. Его фрагментация приводит к более слабым сигналам, поскольку m / z = 93, 80, 79, 67, 41 и 39. [3] [28]
Инфракрасный спектр поглощения адамантана относительно прост из-за высокой симметрии молекулы. Основные полосы поглощения и их назначение приведены в таблице: [3]
| Волновое число, см −1 | Назначение * |
|---|---|
| 444 | δ(CCC) |
| 638 | δ(CCC) |
| 798 | п(С-С) |
| 970 | ρ(CH 2 ), ν(C-C), δ(HCC) |
| 1103 | δ(ГЦК) |
| 1312 | ν(C−C), ω(СН 2 ) |
| 1356 | δ(HCC), ω(СН 2 ) |
| 1458 | δ(ГХГ) |
| 2850 | ν(C−H) в CH 2 группах |
| 2910 | ν(C−H) в CH 2 группах |
| 2930 | ν(C−H) в CH 2 группах |
* Условные обозначения соответствуют типам колебаний: δ – деформационные, ν – растяжение, ρ и ω – внеплоские деформационные колебания групп CH 2 .
Оптическая активность
[ редактировать ]Производные адамантана с разными заместителями в каждом узловом углеродном положении являются хиральными . [29] Такая оптическая активность была описана в адамантане в 1969 году с четырьмя различными заместителями: водородом , бромом , метилом и карбоксилом . Величины удельного вращения невелики и обычно находятся в пределах 1°. [30] [31]
Номенклатура
[ редактировать ]По правилам систематической номенклатуры адамантан называют трицикло[3.3.1.1 3,7 ]декан. Однако ИЮПАК рекомендует использовать название «адамантан». [1]

Молекула адамантана состоит только из углерода и водорода и имеет симметрию Td . Поэтому его 16 атомов водорода и 10 атомов углерода можно описать только двумя позициями, которые на рисунке обозначены как 1 (4 эквивалентных узла) и 2 (6 эквивалентных узлов).
Структурными родственниками адамантана являются норадамантан и гомоадамантан , которые соответственно содержат на одно звено CH 2 меньше и на одно больше, чем адамантан.
Функциональной группой, полученной из адамантана, является адамантил, формально называемый 1-адамантилом или 2-адамантилом, в зависимости от того, какой сайт связан с исходной молекулой. Адамантильные группы представляют собой объемистую боковую группу, используемую для улучшения термических и механических свойств полимеров. [32] [33]
Химические свойства
[ редактировать ]Адамантановые катионы
[ редактировать ]Катион адамантана можно получить обработкой 1-фторадамантана SbF 5 . Его стабильность относительно высока. [34] [35]
Дикатион 1,3- дидегидроадамантана получен в растворах суперкислот . Он также обладает повышенной стабильностью благодаря явлению, называемому «трехмерная ароматичность». [36] или гомоароматичность . [37] В этой четырехцентровой двухэлектронной связи участвует одна пара электронов, делокализованная среди четырех атомов-мостиков.

Реакции
[ редактировать ]Большинство реакций адамантана происходят через 3-координированные углеродные центры. Они участвуют в реакции адамантана с концентрированной серной кислотой , в результате которой образуется адамантанон . [38]

Карбонильная группа адамантанона допускает дальнейшие реакции через мостиковый сайт. Например, адамантанон является исходным соединением для получения таких производных адамантана, как 2-адамантанкарбонитрил. [39] и 2-метиладамантан. [40]
Бромирование
[ редактировать ]Адамантан легко реагирует с различными бромирующими агентами, в том числе с молекулярным бромом . Состав и соотношение продуктов реакции зависят от условий реакции и особенно от наличия и типа катализаторов . [21]

Кипячение адамантана с бромом приводит к образованию монозамещенного адамантана - 1-бромадамантана. Множественное замещение бромом достигается добавлением катализатора на основе кислоты Льюиса . [41]
Скорость бромирования увеличивается при добавлении кислот Льюиса и не изменяется при облучении или добавлении свободных радикалов. Это указывает на то, что реакция протекает по ионному механизму. [8]
Фторирование
[ редактировать ]Первые фторирования адамантана были проведены с использованием 1-гидроксиадамантана. [42] и 1-аминоадамантан в качестве исходных соединений. Позднее фторирование было достигнуто, начиная с самого адамантана. [43] Во всех этих случаях реакция протекала через образование катиона адамантана, который затем взаимодействовал с фторированными нуклеофилами. о фторировании адамантана газообразным фтором . Сообщалось также [44]
Карбоксилирование
[ редактировать ]Карбоксилирование адамантана муравьиной кислотой дает 1-адамантанкарбоновую кислоту . [45]

Окисление
[ редактировать ]1-Гидроксиадамантан легко образуется при гидролизе 1-бромадамантана в водном растворе ацетона . Его также можно получить путем озонирования адамантана: [46] Окисление спирта дает адамантанон .

Другие
[ редактировать ]Адамантан взаимодействует с бензолом в присутствии кислот Льюиса, что приводит к реакции Фриделя-Крафтса . [47] Арилзамещенные производные адамантана можно легко получить, исходя из 1-гидроксиадамантана. В частности, реакция с анизолом протекает в обычных условиях и не требует катализатора. [41]
Нитрование адамантана — сложная реакция, характеризующаяся умеренными выходами. [48] Азотзамещенное лекарственное средство амантадин можно получить путем взаимодействия адамантана с бромом или азотной кислотой с образованием бромида или нитроэфира в положении 1. Реакция любого соединения с ацетонитрилом дает ацетамид, который гидролизуется с образованием 1-адамантиламина: [49]

Использование
[ редактировать ]Адамантан сам по себе находит мало применений, поскольку он представляет собой всего лишь нефункционализированный углеводород . Используется в некоторых сухих травящих масках. [50] и полимерные композиции.
В твердотельной ЯМР- спектроскопии адамантан является общим стандартом для определения химического сдвига . [51]
В лазерах на красителях адамантан может использоваться для продления срока службы усиливающей среды; он не может фотоионизироваться в атмосфере, поскольку его полосы поглощения лежат в вакуумно-ультрафиолетовой области спектра. Энергии фотоионизации определены для адамантана, а также для некоторых более крупных алмазоидов . [52]
В медицине
[ редактировать ]Все известные на сегодняшний день медицинские применения связаны не с чистым адамантаном, а с его производными. Первым производным адамантана, использованным в качестве лекарственного средства, был амантадин – впервые (1967 г.) в качестве противовирусного препарата против различных штаммов гриппа. [53] а затем лечить болезнь Паркинсона . [54] [55] Другие препараты среди производных адамантана включают адапален , адапромин , бромантан , кармантадин , хлодантан , допамантин , мемантин , римантадин , саксаглиптин , тромантадин и вилдаглиптин . Полимеры адамантана запатентованы как противовирусные средства против ВИЧ . [56]
Штаммы вируса гриппа развили лекарственную устойчивость к амантадину и римантадину, которые по состоянию на 2016 год не эффективны против распространенных штаммов.
В дизайнерских наркотиках
[ редактировать ]Адамантан недавно был идентифицирован как ключевая структурная субъединица в нескольких синтетических каннабиноидных наркотиках , а именно AB-001 и SDB-001 . [57]
Топливо космического корабля
[ редактировать ]Адамантан является привлекательным кандидатом в качестве топлива в двигателях на эффекте Холла, поскольку он легко ионизируется, может храниться в твердой форме, а не в резервуаре под тяжелым давлением, и относительно нетоксичен. [58]
Потенциальные технологические применения
[ редактировать ]Некоторые алкилпроизводные адамантана использовались в качестве рабочей жидкости в гидравлических системах . [59] Полимеры на основе адамантана могут найти применение для покрытий сенсорных экранов . [60] есть перспективы использования адамантана и его гомологов в нанотехнологиях . Например, мягкая клеточная структура твердого адамантана позволяет включать в себя молекулы-гости, которые могут высвободиться внутри человеческого тела при разрушении матрицы. [15] [61] Адамантан можно использовать в качестве молекулярных строительных блоков для самосборки молекулярных кристаллов. [62] [63]
Аналоги Адамантана
[ редактировать ]Многие молекулы и ионы имеют клеточную структуру, подобную адамантану. К ним относятся триоксид фосфора P 4 O 6 , триоксид мышьяка As 4 O 6 , пентаоксид фосфора P 4 O 10 = (PO) 4 O 6 , пентасульфид фосфора P 4 S 10 = (PS) 4 S 6 и гексаметилентетрамин C 6 N 4 . ЧАС 12 знак равно Н 4 (СН 2 ) 6 . [64] Особенно известен тетраметилендисульфотетрамин , часто сокращаемый до «тетрамин», родентицид, запрещенный в большинстве стран из-за чрезвычайной токсичности для человека. Кремниевый аналог адамантана — сила-адамантан — был синтезирован в 2005 году. [65] Арсеницин А представляет собой встречающееся в природе мышьякорганическое химическое вещество, выделенное из Новой Каледонии морской губки Echinochalina bargibanti , и является первым известным гетероциклом, содержащим несколько атомов мышьяка. [66] [67] [68] [69]
- Адамантан
Соединение адамантановых каркасов дает высшие алмазоиды , такие как диамантан (C 14 H 20 – два сросшихся адамантановых каркаса), триамантан (C 18 H 24 ), тетрамантан (C 22 H 28 ), пентамантан (C 26 H 32 ), гексамантан (C 26). H 30 ) и т. д. Их синтез аналогичен синтезу адамантана и, как и адамантан, их можно также извлекать из нефти, хотя и с гораздо меньшими выходами.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Номенклатура органической химии: рекомендации ИЮПАК и предпочтительные названия 2013 г. (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 169. doi : 10.1039/9781849733069-FP001 (неактивен 25 апреля 2024 г.). ISBN 978-0-85404-182-4 .
Сохраненные названия адамантан и кубан используются в общей номенклатуре и в качестве предпочтительных названий ИЮПАК.
{{cite book}}: CS1 maint: DOI неактивен по состоянию на апрель 2024 г. ( ссылка ) - ^ Перейти обратно: а б с д и Хейнс, Уильям М., изд. (2016). Справочник CRC по химии и физике (97-е изд.). ЦРК Пресс . п. 3.524. ISBN 978-1-4987-5429-3 .
- ^ Перейти обратно: а б с д Багрий, Э.И. (1989). Адамантаны: синтез, свойства, применение . Наука. стр. 5–57. ISBN 5-02-001382-Х . Архивировано из оригинала 8 марта 2024 г. Проверено 23 сентября 2016 г.
- ^ Александр Сеннинг. Хемоэтимологический словарь Эльзевира . Эльзевир, 2006 , с. 6 ISBN 0-444-52239-5 .
- ^ Декер Х. (1924). «Собрание немецких натуралистов и врачей. Инсбрук, 21–27 сентября 1924 г.». Энджью. Хим . 37 (41): 795. Бибкод : 1924АнгЧ..37..781. . дои : 10.1002/anie.19240374102 .
- ^ Рэдклифф, доктор медицинских наук, Гутьеррес А., Блаунт Дж. Ф., Мислоу К. (1984). «Структура эфира Меервейна и его бензольного соединения» (PDF) . Журнал Американского химического общества . 106 (3): 682–687. дои : 10.1021/ja00315a037 . Архивировано из оригинала (PDF) 9 августа 2011 г. Проверено 26 мая 2010 г.
- ^ Коффи С. и Родд С. (ред.) (1969) Химия углеродных соединений . Том 2. Часть C. Издательство Elsevier: Нью-Йорк.
- ^ Перейти обратно: а б с д и Форт, Раймонд К. младший, Шлейерс, Пол фон Р. (1964). «Адамантан: последствия алмазоидной структуры». хим. Преподобный . 64 (3): 277–300. дои : 10.1021/cr60229a004 .
- ^ Прелог В., Зейверт Р. (1941). «О синтезе адамантана». Отчеты . 74 (10): 1644–1648. дои : 10.1002/cber.19410741004 .
- ^ Прелог В., Зейверт Р. (1941). «О новом, более продуктивном представлении адамантана». Отчеты . 74 (11): 1769–1772. дои : 10.1002/cber.19410741109 .
- ^ Стеттер Х., Бандер О., Нейман В. (1956). «О соединениях со структурой уротропина, VIII. Сообщение: Новые пути синтеза адамантана». Хим. Бер. (на немецком языке). 89 (8): 1922. doi : 10.1002/cber.19560890820 .
- ^ МакКерви М (1980). «Синтетические подходы к крупным алмазоидным углеводородам». Тетраэдр . 36 (8): 971–992. дои : 10.1016/0040-4020(80)80050-0 .
- ^ Шлейер, П. фон Р. (1957). «Простое получение адамантана». Дж. Ам. хим. Соц . 79 (12): 3292. doi : 10.1021/ja01569a086 .
- ^ Шлейер, П. фон Р., Дональдсон, М.М., Николас, Р.Д., Купас, К. (1973). «Адамантан» . Органические синтезы ; Сборник томов , т. 5, с. 16 .
- ^ Перейти обратно: а б Мансури, Г. Али (2007). Молекулярные строительные блоки для нанотехнологий: от алмазоидов до наноразмерных материалов и приложений . Спрингер. стр. 48–55. ISBN 978-0-387-39937-9 .
- ^ Стивен В. Лей, Кэролайн М.Р. Лоу (6 декабря 2012 г.). Ультразвук в синтезе . Спрингер. ISBN 978-3-642-74672-7 . Архивировано из оригинала 27 апреля 2023 года . Проверено 14 марта 2023 г.
- ^ Перейти обратно: а б с Виндзор К.Г., Сондерсон Д.Х., Шервуд Дж.Н., Тейлор Д., Поли Г.С. (1978). «Динамика решетки адамантана в неупорядоченной фазе». Журнал физики C: Физика твердого тела . 11 (9): 1741–1759. Бибкод : 1978JPhC...11.1741W . дои : 10.1088/0022-3719/11/9/013 .
- ^ Перейти обратно: а б с Драббл-младший, Хусейн А.Х. (1980). «Упругие свойства монокристаллов адамантана». Журнал физики C: Физика твердого тела . 13 (8): 1377–1380. Бибкод : 1980JPhC...13.1377D . дои : 10.1088/0022-3719/13/8/008 .
- ^ Ланда С., Махачек В. (1933). «Об адамантане, новом углеводороде, добываемом из нафты». Сборник Чехословацких химических сообщений . 5 :1–5. дои : 10.1135/cccc19330001 .
- ^ Ланда С., Мачачек В., Мзурек М., Ланда М. (1933), «Название неизвестно» , Chem. Абстр. , 27 : 5949
- ^ Перейти обратно: а б с «Синтез адамантана» . Архивировано из оригинала 6 марта 2012 г. Проверено 11 декабря 2009 г. Специальная практическая задача для студентов IV курса. Кафедра нефтехимии и органического катализа МГУ .
- ^ Перейти обратно: а б Багрий Е.И. (1989). «Методы определения углеводородов адамантанового ряда». Адамантан: Синтез, свойства, применение . Москва: Наука. стр. 58–123. ISBN 5-02-001382-Х . Архивировано из оригинала 8 марта 2024 г. Проверено 23 сентября 2016 г.
- ^ «Адамантан» . Энциклопедия химии (на русском языке). Архивировано из оригинала 6 марта 2012 г. Проверено 11 декабря 2009 г.
- ^ Перейти обратно: а б Виджаякумар В. и др. (2001). «Фазовые переходы, индуцированные давлением, и уравнение состояния адамантана». J. Phys.: Condens. Иметь значение . 13 (9): 1961–1972. Бибкод : 2001JPCM...13.1961V . дои : 10.1088/0953-8984/13/9/318 . S2CID 250802662 .
- ^ Анастассакис Э., Сиакавеллас М. (1999). «Упругие и решетчатые динамические свойства текстурированных алмазных пленок». Физический статус Solidi B. 215 (1): 189–192. Бибкод : 1999ПССБР.215..189А . doi : 10.1002/(SICI)1521-3951(199909)215:1<189::AID-PSSB189>3.0.CO;2-X .
- ^ Мансури, Г. Али (2005). Принципы нанотехнологий: молекулярное исследование конденсированного состояния в малых системах . Всемирная научная. п. 12 . ISBN 981-256-154-4 .
- ^ Райт, Джон Далтон (1995). Молекулярные кристаллы . Издательство Кембриджского университета. п. 28. ISBN 0-521-47730-1 .
- ^ Перейти обратно: а б ЯМР, ИК и масс-спектры адамантана можно найти в базе данных SDBS. Архивировано 6 марта 2023 г. на Wayback Machine.
- ^ Марч, Дж. (1987). Органическая химия. Реакции, механизмы, структура. Курс повышения квалификации для университетов и высших учебных заведений по химии . Том. 1. М.: Мир. п. 137.
- ^ Эпплквист Дж., Риверс П., Эпплквист Д.Э. (1969). «Теоретические и экспериментальные исследования оптически активных плацдармозамещенных адамантанов и родственных соединений». Дж. Ам. хим. Соц . 91 (21): 5705–5711. дои : 10.1021/ja01049a002 .
- ^ Хэмилл, Х., МакКерви, Массачусетс (1969). «Разрешение 3-метил-5-бромадамантанкарбоновой кислоты». хим. Комм. (15): 864. doi : 10.1039/C2969000864a .
- ^ Акар Х.И., Дженсен Дж.Дж., Тигпен К., Макгоуэн Дж.А., Матиас Л.Дж. (2000). «Оценка эффекта спейсера на адамантансодержащий виниловый полимер » Tg . Макромолекулы . 33 (10): 3855–3859. Бибкод : 2000МаМол..33.3855А . дои : 10.1021/ma991621j .
- ^ Матиас Л.Дж., Дженсен Дж., Тигпен К., Макгоуэн Дж., Маккормик Д., Сомлаи Л. (2001). «Сополимеры производных 4-адамантилфенилметакрилата с метилметакрилатом и стиролом». Полимер . 42 (15): 6527–6537. дои : 10.1016/S0032-3861(01)00155-0 .
- ^ Шлейер П.Р., Форт RC, Уоттс WE (1964). «Стабильные ионы карбония. VIII. 1-адамантильный катион». Дж. Ам. хим. Соц . 86 (19): 4195–4197. дои : 10.1021/ja01073a058 .
- ^ Олах Г.А., Пракаш Г.К., Ши Дж.Г., Кришнамурти В.В., Матееску Г.Д., Лян Г., Сипос Г., Басс В., Гунд Т.М., Шлейер П.В. (1985). «Плацдармовый адамантил, диамантил и родственные катионы и дикатионы». Дж. Ам. хим. Соц . 107 (9): 2764–2772. дои : 10.1021/ja00295a032 .
- ^ Смит В., Бочков А., Кейпл Р. (2001). Органический синтез. Наука и искусство . М.: Мир. п. 573. ИСБН 5-03-003380-7 .
- ^ Бремер М., фон Раге Шлейер П., Шотц К., Кауш М., Шиндлер М. (1987). «Четырехцентровая двухэлектронная связь в тетраэдрической топологии. Экспериментальная реализация трехмерной гомоароматичности в дикатионе 1,3-дегидро-5,7-адамантандиила». Angewandte Chemie International Edition на английском языке . 26 (8): 761–763. дои : 10.1002/anie.198707611 .
- ^ Гелюк Х.В., Кайзер В.Г. (1973). «Адамантанон». Органические синтезы . 53 :8. дои : 10.15227/orgsyn.053.0008 .
- ^ 2-адамантанкарбонитрил. Архивировано 10 июля 2012 г. в Wayback Machine Organic Syntheses, Coll. Том. 6, с. 41 (1988); Том. 57, с. 8 (1977).
- ^ Шлейер П.Р., Николас Р.Д. (1961). «Получение и реакционная способность 2-замещенных производных адамантана». Дж. Ам. хим. Соц. 83 (1): 182–187. дои : 10.1021/ja01462a036 .
- ^ Перейти обратно: а б Несмеянов А. Н. (1969). Основная органическая химия . п. 664.
- ^ Ола, Джордж А., Уэлч Дж. Т., Ванкар Ю. Д., Нодзима М., Керекес И., Ола Дж. А. (1979). «Пиридиний поли (фтороводород): удобный реагент для реакций фторирования органических веществ». Журнал органической химии . 44 (22): 3872–3881. дои : 10.1021/jo01336a027 .
- ^ Ола, Джордж А., Ши Дж.Г., Сингх Б.П., Гупта Б.Г. (1983). «Ионное фторирование адамантана, диамантана и трифенилметана нитрозилтетрафторборатом/пиридинполифторидом водорода (PPHF)». Журнал органической химии . 48 (19): 3356–3358. дои : 10.1021/jo00167a050 .
- ^ Розен, Шломо, Гал С. (1988). «Прямой синтез фторбициклических соединений с фтором». Журнал органической химии . 53 (12): 2803–2807. дои : 10.1021/jo00247a026 .
- ^ Кох Х., Хааф В. (1964). «1-адамантанкарбоновая кислота». Органические синтезы . 44 : 1. дои : 10.15227/orgsyn.044.0001 .
- ^ Коэн, Цви, Варкони, Хаим, Кейнан, Эхуд, Мазур, Иегуда (1979). «Третичные спирты из углеводородов путем озонирования на силикагеле: 1-адамантанол». Органические синтезы . 59 : 176. дои : 10.15227/orgsyn.059.0176 .
- ^ Шале С., Корнелис А., Герстманс А., Колодзейски В., Ласло П., Мати А., Метра П. (1985). «Прямое арилирование Фриделя-Крафтса, катализируемое глиной, и хлорирование углеводородного адамантана». Helvetica Chimica Acta . 68 (5): 1196–1203. дои : 10.1002/hlca.19850680516 .
- ^ Смит, Джордж В., Уильямс, Гарри Д. (1961). «Некоторые реакции адамантана и производных адамантана». Дж. Орг. Хим . 26 (7): 2207–2212. дои : 10.1021/jo01351a011 .
- ^ Моисеев И.К., Дорошенко Р.И., Иванова В.И. (1976). «Синтез амантадина через нитрат 1-адамантанола». Фармацевтически-химический журнал . 10 (4): 450–451. дои : 10.1007/BF00757832 . S2CID 26161105 .
- ^ Ватанабэ, Кейджи и др. (2001). «Композиция резиста и процесс формирования узора» . Заявка на патент США 20010006752 . Bandwidth Market, Ltd. Архивировано из оригинала 4 сентября 2011 года . Проверено 14 октября 2005 г.
- ^ Моркомб, Кори Р., Зилм, Курт В. (2003). «Привязка к химическому сдвигу в твердотельном ЯМР MAS». Дж. Магн. Резон . 162 (2): 479–486. Бибкод : 2003JMagR.162..479M . дои : 10.1016/S1090-7807(03)00082-X . ПМИД 12810033 .
- ^ Ленцке К., Ландт Л., Хонер М. и др. (2007). «Экспериментальное определение потенциалов ионизации первых пяти членов ряда наноалмазов». Дж. Хим. Физ. 127 (8): 084320. Бибкод : 2007JChPh.127h4320L . дои : 10.1063/1.2773725 . ПМИД 17764261 . S2CID 3131583 .
- ^ Мо Т. (1979). «Группа призывает к широкому использованию противовирусных препаратов». Наука . 206 (4422): 1058–60. Бибкод : 1979Sci...206.1058M . дои : 10.1126/science.386515 . ПМИД 386515 .
- ^ Зоннберг, Линн (2003). Полное руководство по таблеткам: все, что вам нужно знать о непатентованных и фирменных рецептурных препаратах . Издательство Barnes & Noble. п. 87. ИСБН 0-7607-4208-1 .
- ^ Бланпьед Т.А., Кларк Р.Дж., Джонсон Дж.В. (2005). «Амантадин ингибирует рецепторы NMDA, ускоряя закрытие каналов во время блокады каналов» . Журнал неврологии . 25 (13): 3312–22. doi : 10.1523/JNEUROSCI.4262-04.2005 . ПМК 6724906 . ПМИД 15800186 .
- ^ Букринская А.Г. и др. «Полимерные аналоги адамантана» (патент США 5880154) . Проверено 5 ноября 2009 г. [ мертвая ссылка ]
- ^ Банистер С.Д., Уилкинсон С.М., Лонгворт М., Стюарт Дж., Апетц Н., Инглиш К., Брукер Л., Гебель С., Хиббс Д.Е., Гласс М., Коннор М., МакГрегор И.С., Кассиу М. (2013). «Синтез и фармакологическая оценка индолов, полученных из адамантана: новые каннабимиметические препараты, вызывающие злоупотребление» . ACS Химическая нейронаука . 4 (7): 1081–92. дои : 10.1021/cn400035r . ПМЦ 3715837 . ПМИД 23551277 .
- ^ «Подруливающее устройство Micro End Hall AIS-EHT1 - Прикладные ионные системы» . Архивировано из оригинала 28 октября 2021 г. Проверено 22 февраля 2021 г.
- ^ «Адамантан» . Кругосвет (на русском языке). Архивировано из оригинала 6 ноября 2009 года . Проверено 11 ноября 2009 г.
- ^ Чон, Хай (2002). «Синтез и характеристика первого производного поли (п-фениленвинилена) на основе адамантана: интеллектуального пластика для интеллектуальных электронных дисплеев». Тонкие твердые пленки . 417 (1–2): 171–174. Бибкод : 2002TSF...417..171J . дои : 10.1016/S0040-6090(02)00569-2 .
- ^ Рамезани, Хамид, Мансури, Г. Али (2007). Даймондоиды как молекулярные строительные блоки для нанотехнологий . Темы прикладной физики. Том. 109. С. 44–71 . дои : 10.1007/978-0-387-39938-6_4 . ISBN 978-0-387-39937-9 .
- ^ Маркл RC (2000). «Молекулярные строительные блоки и стратегии развития молекулярных нанотехнологий». Нанотехнологии . 11 (2): 89–99. Бибкод : 2000Nanot..11...89M . дои : 10.1088/0957-4484/11/2/309 . S2CID 250914545 .
- ^ Гарсия Х.К., Хусто Х.Ф., Мачадо В.В., Ассали Л.В. (2009). «Функционализированный адамантан: строительные блоки для самосборки наноструктур». Физ. Преподобный Б. 80 (12): 125421. arXiv : 1204.2884 . Бибкод : 2009PhRvB..80l5421G . дои : 10.1103/PhysRevB.80.125421 . S2CID 118828310 .
- ^ Виталл, Джей-Джей (1996). «Химия неорганических и металлоорганических соединений с адамантаноподобными структурами». Многогранник . 15 (10): 1585–1642. дои : 10.1016/0277-5387(95)00340-1 .
- ^ Фишер, Елена, Баумгартнер, Джудит, Маршнер, Кристоф (2005). «Синтез и структура силы-адамантана». Наука . 310 (5749): 825. doi : 10.1126/science.1118981 . ПМИД 16272116 . S2CID 23192033 .
- ^ Манчини И., Гуэлла Г., Фростин М., Хнавиа Э., Лоран Д., Дебитус С., Пьетра Ф. (2006). «О первом полимышьяковом органическом соединении в природе: арсеницин а из морской губки Новой Каледонии Echinochalina bargibanti ». Химия: Европейский журнал . 12 (35): 8989–94. дои : 10.1002/chem.200600783 . ПМИД 17039560 .
- ^ Тяхтинен П., Саиелли Г., Гуэлла Г., Манчини И., Баньо А. (2008). «Вычислительная ЯМР-спектроскопия мышьякорганических соединений и природного полимышьякового соединения арсеницина А». Химия: Европейский журнал . 14 (33): 10445–52. дои : 10.1002/chem.200801272 . ПМИД 18846604 .
- ^ Гуэлла Дж., Манчини И., Мариотто Дж., Росси Б., Вилиани Дж. (2009). «Колебательный анализ как мощный инструмент для выяснения структуры полимышьяка: исследование арсеницина А на основе метода DFT». Физическая химия Химическая физика . 11 (14): 2420–2427. Бибкод : 2009PCCP...11.2420G . дои : 10.1039/b816729j . ПМИД 19325974 .
- ^ Ди Лу, А. Дэвид Рэй, Джефф Салем, Мишель Л. Вейр, Энтони К. Уиллис, С. Брюс Уайлд (2010). «Арсеницин А, природный полимышьяк: синтез и кристаллическая структура». Металлоорганические соединения . 29 (1): 32–33. дои : 10.1021/om900998q . hdl : 1885/58485 . S2CID 96366756 .