Диэтилмалонат

| |
| |
| Имена | |
|---|---|
| Название ИЮПАК
Диэтилмалонат [ 1 ]
| |
| Предпочтительное название ИЮПАК
Диэтилпропандиоат | |
| Другие имена
Диэтилмалонат
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| Сокращения | немецкая марка |
| 774687 | |
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.003.006 |
| Номер ЕС |
|
| МеШ | Диэтил+малонат |
ПабХим CID
|
|
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 7 Н 12 О 4 | |
| Молярная масса | 160.17 g/mol |
| Появление | бесцветная жидкость |
| Плотность | 1,05 г/см 3 , жидкость |
| Температура плавления | -50 ° C (-58 ° F; 223 К) |
| Точка кипения | 199 ° С (390 ° F; 472 К) |
| незначительный | |
| Кислотность ( pKa ) | 14 16,37 (ДМСО) [ 2 ] |
| -92.6·10 −6 см 3 /моль | |
| Структура | |
| 2,54 Д (жидкость) [ 3 ] | |
| Термохимия | |
Теплоемкость ( С )
|
285,0 Дж·моль −1 ·К −1 [ 3 ] |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности
|
Вредный (X), Огнеопасный (F) |
| точка возгорания | 93 ° С (199 ° F; 366 К) [ 3 ] |
| Паспорт безопасности (SDS) | Паспорт безопасности Оксфордского университета |
| Родственные соединения | |
Родственные соединения
|
Диметил малонат Малоновая кислота |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Диэтилмалонат , также известный как DEM , представляет собой диэтиловый эфир кислоты малоновой . В природе он встречается в винограде и клубнике в виде бесцветной жидкости с яблока запахом в и используется парфюмерии . Он также используется для синтеза других соединений , таких как барбитураты , искусственные ароматизаторы , витамин B1 и витамин B6 .
Структура и свойства
[ редактировать ]Малоновая кислота представляет собой довольно простую дикарбоновую кислоту с двумя карбоксильными группами , расположенными близко друг к другу. При образовании диэтилмалоната из малоновой кислоты гидроксильная группа (-ОН) в обеих карбоксильных группах заменяется этоксигруппой ( -OEt; -OCH 2 CH 3 ). Метиленовая группа (-CH 2 -) в середине малоновой части молекулы диэтилмалоната соседствует с двумя карбонильными группами (-C(=O)-). [ 4 ]
Атомы водорода на углероде, соседнем с карбонильной группой в молекуле, значительно более кислые , чем атомы водорода на углероде, соседнем с алкильными группами (до 30 порядков). (Это известно как α-положение по отношению к карбонилу.) Атомы водорода на углероде, соседнем с двумя карбонильными группами, еще более кислые, потому что карбонильные группы помогают стабилизировать карбанион, образующийся в результате удаления протона из метиленовой группы между их. О степени резонансной стабилизации сопряженного основания этого соединения свидетельствуют три резонансные формы, приведенные ниже:
Подготовка
[ редактировать ]Диэтилмалонат получают в результате реакции натриевой соли хлоруксусной кислоты с цианидом натрия , в результате чего образуется нитрил . Это промежуточное соединение затем обрабатывают этанолом в присутствии кислотного катализатора:
- ClCH 2 CO 2 Na + NaCN → NCCH 2 CO 2 Na + NaCl
- NCCH 2 CO 2 Na + 2 C 2 H 5 OH + 2 HCl → C 2 H 5 O 2 CCH 2 CO 2 C 2 H 5 + NH 4 Cl + NaCl
Альтернативно, хлорацетат натрия подвергается карбоксиэтерификации путем обработки окисью углерода и этанолом:
- ClCH 2 CO 2 Na + CO + 2 C 2 H 5 OH → C 2 H 5 O 2 CCH 2 CO 2 C 2 H 5 + NaCl
октакарбонил дикобальта . В качестве катализатора используют [ 5 ]
Реакции
[ редактировать ]Синтез малонового эфира
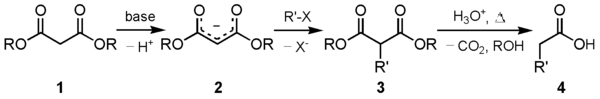
[ редактировать ]Одним из основных применений этого соединения является синтез эфира малоновой кислоты . Карбанион ( 2 ), образующийся при взаимодействии диэтилмалоната ( 1 ) с подходящим основанием, может быть алкилирован подходящим электрофилом . Это алкилированное 1,3-дикарбонильное соединение ( 3 ) легко подвергается декарбоксилированию с потерей диоксида углерода с образованием замещенной уксусной кислоты ( 4 ):
Обычно в качестве основания предпочтительны соли алкоксид-аниона, алкильная часть которого соответствует той, которая используется при вышеуказанном алкилировании. Использование обычного основания может привести к образованию продуктов гидролиза основания - например, гидроксид натрия просто приведет к образованию малоната натрия и спирта, тогда как другие соли алкоксидов вызовут переэтерификацию . Только «тот же» алкоксид-анион, который использовался для алкилирования депротонированного активного метиленового центра, предотвратит как основной гидролиз, так и переэтерификацию.
Другие реакции
[ редактировать ]Как и многие другие сложные эфиры, это соединение подвергается конденсации эфиров Кляйзена . Преимущество использования этого соединения заключается в том, что можно избежать нежелательных реакций самоконденсации. Как и другие сложные эфиры, это соединение подвергается бромированию в альфа-положении. [ 6 ]
Диэтилмалонат можно нитрозировать избытком нитрита натрия в уксусной кислоте с получением диэтилоксиминомалоната, каталитический гидрогенолиз которого в этаноле над Pd/C дает диэтиламиномалонат (ДЭАМ). ДЭАМ можно ацетилировать с получением диэтилацетамидомалоната (полезного в синтезе аминокислот) или можно добавлять с 3-замещенными 2,4-дикетонами к кипящей уксусной кислоте, чтобы с максимальным выходом получить различные замещенные этилпиррол-2-карбоксилаты, представляющие интерес для синтез порфиринов. [ 7 ]
Приложения
[ редактировать ]
Диэтилмалонат используется при получении нескольких полезных с медицинской точки зрения соединений, включая вигабатрин , фенилбутазон , налидиксовую кислоту и ребамипид . Из диэтилмалоната также производят несколько пестицидов, в том числе сетоксидим и производные 2-амино-4-хлор-6- метоксипиримидина . [ 5 ]
Ссылки
[ редактировать ]- ^ «Малоновая кислота» признана действительным, проверенным экспертами названием того, что систематически будет называться «пропандиовой кислотой» согласно ChemSpider .
- ^ Олмстед, Уильям Н.; Бордвелл, Фредерик Г. (1980). «Константы ассоциации ионных пар в диметилсульфоксиде». Журнал органической химии . 45 (16): 3299–3305. дои : 10.1021/jo01304a033 .
- ^ Jump up to: а б с CRC справочник по химии и физике: готовый справочник химических и физических данных . Уильям М. Хейнс, Дэвид Р. Лид, Томас Дж. Бруно (2016–2017, 97-е изд.). Бока-Ратон, Флорида. 2016. ISBN 978-1-4987-5428-6 . OCLC 930681942 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) CS1 maint: другие ( ссылка ) - ^ «ИК-спектр малоновой кислоты» . Архивировано из оригинала 26 июня 2010 г. Проверено 14 февраля 2010 г.
- ^ Jump up to: а б Стриттматтер, Харальд; Хильдбранд, Стефан; Поллак, Питер (2007). «Малоновая кислота и производные». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a16_063.pub2 . ISBN 978-3527306732 .
- ^ К.С. Палмер и П.В. Маквертер. «Этилбромомалонат» . Органические синтезы ; Сборник томов , т. 1, с. 245 .
- ^ Пейн, Джон Б.; Дельфин, Дэвид (1 декабря 1985 г.). «Химия пиррола. Улучшенный синтез эфиров этилпиррол-2-карбоксилата из диэтиламиномалоната» . Журнал органической химии . 50 (26): 5598–5604. дои : 10.1021/jo00350a033 . ISSN 0022-3263 .