Октакарбонил дикобальта
 | |
 Co 2 (CO) 8, пропитанный гексанами | |
| Имена | |
|---|---|
| Название ИЮПАК Октакарбонилдикобальт ( Co—Co ) | |
| Другие имена Карбонил кобальта (2:8), ди-мю-карбонилгексакарбонилдикобальт, октакарбонил кобальта, димер тетракарбонила кобальта, карбонил дикобальта, октакарбонилдикобальт | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.030.454 |
| Номер ЕС |
|
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 3281 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Со 2 (СО) 8 | |
| Молярная масса | 341.95 g/mol |
| Появление | красно-оранжевые кристаллы |
| Плотность | 1,87 г/см 3 |
| Температура плавления | От 51 до 52 ° C (от 124 до 126 ° F; от 324 до 325 К) |
| Точка кипения | 52 ° C (126 ° F; 325 К) разлагается. |
| нерастворимый | |
| Давление пара | 0,7 мм рт.ст. (20 °С) [1] |
| Структура | |
| 1,33 Д (изомер C 2v ) 0 D (D 3d- изомер) | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Потенциальный канцероген |
| СГС Маркировка : | |
    | |
| Опасность | |
| Х251 , Х302 , Х304 , Х315 , Х317 , Х330 , Х351 , Х361 , Х412 | |
| П201 , П260 , П273 , П280 , П304+П340+П310 , П403+П233 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | -23 °C (-9,4 °F) [1] |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 15 мг/кг (перорально, крыса) |
| NIOSH (пределы воздействия на здоровье в США): | |
МЕХ (Допускается) | никто [1] |
РЕЛ (рекомендуется) | СВВ 0,1 мг/м 3 [1] |
IDLH (Непосредственная опасность) | без даты [1] |
| Паспорт безопасности (SDS) | Внешний паспорт безопасности |
| Родственные соединения | |
Родственные карбонилы металлов | Пентакарбонил железа Дижелезный нонакарбонил Никель тетракарбонил |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
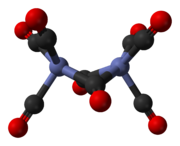
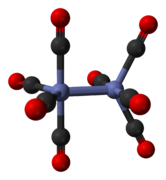
Октакарбонил дикобальта — кобальторганическое соединение состава Со 2 (СО) 8 . Этот карбонил металла используется в качестве реагента и катализатора в металлоорганической химии и органическом синтезе , а также играет центральную роль в известной химии кобальта . [2] [3] Это родительский член семейства катализаторов гидроформилирования . [4] Каждая молекула состоит из двух атомов кобальта , связанных с восемью монооксида углерода лигандами , хотя известно несколько структурных изомеров. [5] Некоторые из карбонильных лигандов лабильны .
Синтез, строение, свойства
[ редактировать ]твердое вещество оранжевого цвета Октакарбонил дикобальта — пирофорное . [6] Его синтезируют путем карбонилирования кобальта (II) солей под высоким давлением : [6]
- 2 (CH 3 COO) 2 Co + 8 CO + 2 H 2 → Co 2 (CO) 8 + 4 CH 3 COOH
Получение часто проводят в присутствии цианида , превращая соль кобальта (II) в комплекс пентацианокобальтата (II), который реагирует с окисью углерода с образованием. К[Со(СО) 4 ] . Подкисление приводит к образованию тетракарбонилгидрида кобальта . HCo(CO) 4 , который при комнатной температуре разлагается до октакарбонила дикобальта и водорода. [3] [7] Его также можно получить путем нагревания металлического кобальта до температуры выше 250 ° C в потоке угарного газа при давлении от 200 до 300 атм : [3]
- 2 Со + 8 СО → Со 2 (СО) 8
Он существует в виде смеси быстро взаимопревращающихся изомеров . [2] [3] В растворе известны два изомера, которые быстро взаимопревращаются: [5]
Основной изомер (слева в приведенном выше равновесном процессе) содержит два мостиковых карбонильных лиганда, связывающих кобальтовые центры, и шесть концевых карбонильных лигандов, по три на каждый металл. [5] Его можно суммировать по формуле (CO) 3 Co(μ-CO) 2 Co(CO) 3 и имеет C 2v симметрию . Эта структура напоминает нонакарбонил дижелеза ( Fe 2 (CO) 9 ), но с одним мостиковым карбонилом меньше. Расстояние Co–Co составляет 2,52 Å, а концевые Co–CO расстояния Co–CO и мостик составляют 1,80 и 1,90 Å соответственно. [8] Анализ связи позволяет предположить отсутствие прямой связи кобальт-кобальт. [9]
Минорный изомер не имеет мостиковых карбонильных лигандов, но вместо этого имеет прямую связь между центрами кобальта и восемью концевыми карбонильными лигандами, по четыре на каждом атоме металла. [5] Его можно суммировать по формуле (CO) 4 Co-Co(CO) 4 и имеет D 4d симметрию . Он имеет немостиковую связь кобальт-кобальт длиной 2,70 Å в твердой структуре при кристаллизации вместе с C 60 . [10]
Реакции
[ редактировать ]Снижение
[ редактировать ]Октакарбонил дикобальта восстановительно расщепляется щелочными металлами и родственными реагентами, такими как амальгама натрия . Полученные соли протонируются с образованием тетракарбонилгидрида кобальта : [3]
- Co 2 (CO) 8 + 2 Na → 2 Na[Co(CO) 4 ]
- Na[Co(CO) 4 ] + H + → H[Co(CO) 4 ] + Na +
Соли этой формы также являются промежуточными продуктами на пути синтеза цианида октакарбонила дикобальта. [7]
Реакции с электрофилами
[ редактировать ]Галогены и родственные реагенты расщепляют связь Co–Co с образованием пентакоординированных галотетракарбонилов:
- Co 2 (CO) 8 + Br 2 → 2 Br[Co(CO) 4 ]
Трикарбонилнитрозил кобальта получают обработкой октакарбонила дикобальта оксидом азота:
- Со 2 (СО) 8 + 2 НО → 2 Со (СО) 3 НО + 2 СО
Реакции с алкинами
[ редактировать ]Реакция Николаса представляет собой реакцию замещения , при которой алкоксигруппа, расположенная на α-углероде алкина, заменяется другим нуклеофилом . Алкин сначала реагирует с октакарбонилом дикобальта, из которого образуется стабилизированный пропаргильный катион , который реагирует с поступающим нуклеофилом, и затем образуется продукт путем окислительного деметаллирования . [11] [12]

Реакция Паусона -Ханда . [13] в котором алкин , алкен и окись углерода циклизуются с образованием циклопентенона , может катализироваться Со 2 (СО) 8 , [3] [14] хотя с тех пор были разработаны новые, более эффективные методы: [15] [16]

Co 2 (CO) 8 реагирует с алкинами с образованием стабильного ковалентного комплекса, который можно использовать в качестве защитной группы для алкина. Сам этот комплекс также можно использовать в реакции Паусона-Ханда. [13]
Возможны внутримолекулярные реакции Паусона-Кханда, в которых исходное вещество содержит как алкеновую, так и алкиновую части. В асимметричном синтезе алкалоида Lycopodium спирт , гиперзина-Q Такаяма и его коллеги использовали внутримолекулярную реакцию Паусона-Кханда для циклизации енина, содержащего первичный трет -бутилдифенилсилилом (TBDPS) защищенный . [17] Получение циклического силоксанового фрагмента непосредственно перед введением октакарбонила дикобальта обеспечивает образование продукта желаемой конформации . [18]

Октакарбонил дикобальта может катализировать тримеризацию дифенилацетилена алкиновую и его производных до гексафенилбензолов . [19] Симметричные дифенилацетилены образуют 6-замещенные гексафенилбензолы, а асимметричные дифенилацетилены образуют смесь двух изомеров. [20]


Гидроформилирование
[ редактировать ]
- Окись углерода диссоциирует от тетракарбонилгидрида кобальта с образованием активного катализатора. HCo(CO) 3
- Кобальтовый центр π связывается с алкеном
- Алкеновый лиганд внедряется в связь кобальт-гидрид.
- Дополнительные координаты карбонильного лиганда
- Карбонильный лиганд мигрирует по связи кобальт–алкил. [21]
- Дигидроген присоединяется к ациловому комплексу
- Дигидридный комплекс удаляет альдегидный продукт. [22] регенерация катализатора
- Непродуктивная и обратимая побочная реакция.
Гидрирование Co 2 (CO) 8 дает тетракарбонилгидрид кобальта. H[Co(CO) 4 ] : [23]
- Co 2 (CO) 8 + H 2 → 2 H[Co(CO) 4 ]
Этот гидрид является гидроформилирования – катализатором превращения алкенов в альдегиды . [4] [23] Каталитический цикл этого гидроформилирования показан на схеме. [4] [21] [22]
Реакции замещения
[ редактировать ]Лиганды CO можно заменить третичными фосфиновыми лигандами, чтобы получить Co 2 (CO) - 8 Икс (PR 3 ) Икс . Эти объемистые производные являются более селективными катализаторами реакций гидроформилирования. [3] « Твердые » основания Льюиса, например пиридин , вызывают диспропорцию :
- 12 C 5 H 5 N + 3 Co 2 (CO) 8 → 2 [Co(C 5 H 5 N) 6 ][Co(CO) 4 ] 2 + 8 CO
Превращение в высшие карбонилы
[ редактировать ]
Нагревание вызывает декарбонилирование и образование додекакарбонила тетракобальта : [3] [24]
- 2 Со 2 (СО) 8 → Со 4 (СО) 12 + 4 СО
Как и многие карбонилы металлов, октакарбонил дикобальта отделяет галогениды от алкилгалогенидов. При реакции с бромоформом превращается в метилидинтрикобальтнонакарбонил . HCCo 3 (CO) 9 в результате реакции, которую можно идеализировать как: [25]
- 9 Co 2 (CO) 8 + 4 CHBr 3 → 4 HCCo 3 (CO) 9 + 36 CO + 6 CoBr 2
Безопасность
[ редактировать ]Co 2 (CO) 8 — летучий источник кобальта(0), пирофорен и выделяет окись углерода . при разложении [26] Национальный институт безопасности и гигиены труда рекомендовал . не подвергать работников воздействию концентраций, превышающих 0,1 мг/м 3 в среднем в течение восьми часов без надлежащего респираторного оборудования. [27]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и Карманный справочник NIOSH по химическим опасностям. «#0147» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Jump up to: а б Паусон, Питер Л .; Стамбули, Джеймс П.; Чжоу, Тэ-Чанг; Хонг, Бор-Чернг (2014). «Октакарбонилдикобальт». Энциклопедия реагентов для органического синтеза . Джон Уайли и сыновья . стр. 1–26. дои : 10.1002/047084289X.ro001.pub3 . ISBN 9780470842898 .
- ^ Jump up to: а б с д и ж г час Дональдсон, Джон Даллас; Байерсманн, Детмар (2005). «Кобальт и соединения кобальта». Энциклопедия промышленной химии Ульмана . Вайли-ВЧ. дои : 10.1002/14356007.a07_281.pub2 . ISBN 3527306730 .
- ^ Jump up to: а б с д Эльшенбройх, К.; Зальцер, А. (1992). Металлоорганические соединения: краткое введение (2-е изд.). Вайнхайм: Wiley-VCH . ISBN 3-527-28165-7 .
- ^ Jump up to: а б с д Суини, Рэй Л.; Браун, Теодор Л. (1977). «Инфракрасные спектры матрично-изолированного октакарбонила дикобальта. Доказательства существования третьего изомера». Неорганическая химия . 16 (2): 415–421. дои : 10.1021/ic50168a037 .
- ^ Jump up to: а б Гилмонт, Пол; Бланшар, Артур А. (1946). Октакарбонил дикобальта, нитрозилтрикарбонил кобальта и тетракарбонилгидрид кобальта . Неорганические синтезы. Том. 2. С. 238–243. дои : 10.1002/9780470132333.ch76 . ISBN 9780470132333 .
- ^ Jump up to: а б Орчин, Милтон (1953). «Гидрирование органических соединений синтез-газом» . Достижения в области катализа . Том. 5. Академическая пресса . стр. 385–415. ISBN 9780080565095 .
- ^ Самнер, Г. Гарднер; Клюг, Гарольд П.; Александр, Лерой Э. (1964). «Кристаллическая структура октакарбонила дикобальта» . Акта Кристаллографика . 17 (6): 732–742. дои : 10.1107/S0365110X64001803 .
- ^ Грин, Дженнифер С.; Грин, Малкольм Л.Х .; Паркин, Джерард (2012). «Возникновение и представление трехцентровых двухэлектронных связей в ковалентных неорганических соединениях». Химические коммуникации . 2012 (94): 11481–11503. дои : 10.1039/c2cc35304k . ПМИД 23047247 .
- ^ Гарсия, Тельма Ю.; Феттингер, Джеймс С.; Олмстед, Мэрилин М.; Балч, Алан Л. (2009). «Великолепная симметрия: Кристаллизация немостикового изомера Co 2 (CO) 8 в Co 2 (CO) 8 · C 60 ". Chemical Communications . 2009 (46): 7143–7145. doi : 10.1039/b915083h . PMID 19921010 .
- ^ Николас, Кеннет М. (1987). «Химия и синтетическое применение пропаргильных катионов, находящихся в комплексе с кобальтом». Акк. хим. Рез. (Обзор). 20 (6): 207–214. дои : 10.1021/ar00138a001 .
- ^ Теобальд, Барри Дж. (2002). «Реакция Николаса: использование в синтезе стабилизированных гексакарбонилом пропаргильных катионов дикобальта». Тетраэдр (Обзор). 58 (21): 4133–4170. дои : 10.1016/S0040-4020(02)00315-0 .
- ^ Jump up to: а б Паусон, Польша ; Кханд, АйЮ (1977). «Использование комплексов кобальт-карбонилацетилен в органическом синтезе». Энн. Н-Й Акад. наук. 295 (1): 2–14. Бибкод : 1977NYASA.295....2P . дои : 10.1111/j.1749-6632.1977.tb41819.x . S2CID 84203764 .
- ^ Бланко-Ургоити, Хайме; Аньорбе, Лорето; Перес-Серрано, Летисия; Домингес, Хема; Перес-Кастельс, Хавьер (2004). «Реакция Паусона-Ханда, мощный синтетический инструмент для синтеза сложных молекул». хим. Бревно. Преподобный. 33 (1): 32–42. дои : 10.1039/b300976a . ПМИД 14737507 .
- ^ Шор, Нил Э. (1991). «Реакция циклоприсоединения Паусона-Ханда для синтеза циклопентенонов». Орг. Реагировать. 40 : 1–90. дои : 10.1002/0471264180.или040.01 . ISBN 0471264180 .
- ^ Гибсон, Сьюзен Э.; Стивенацци, Андреа (2003). «Реакция Паусона-Ханда: эпоха катализа наступила!». Энджью. хим. Межд. Эд. 42 (16): 1800–1810. дои : 10.1002/anie.200200547 . ПМИД 12722067 .
- ^ Накаяма, Ацуши; Когуре, Нориюки; Китадзима, Марико; Такаяма, Хиромицу (2011). «Асимметричный полный синтез пентациклического алкалоида ликоподия: гиперзин-Q». Энджью. хим. Межд. Эд. 50 (35): 8025–8028. дои : 10.1002/anie.201103550 . ПМИД 21751323 .
- ^ Хо, Це-Лок (2016). «Дикобальт Октакарбонил» . Реагенты Физерса для органического синтеза . Том. 28. Джон Уайли и сыновья . стр. 251–252. ISBN 9781118942819 .
- ^ Видж, В.; Бхалла, В.; Кумар, М. (8 августа 2016 г.). «Гексаарилбензол: эволюция свойств и применение многогранного каркаса». Химические обзоры . 116 (16): 9565–9627. doi : 10.1021/acs.chemrev.6b00144 .
- ^ Сяо, В.; Фэн, X.; Руффье, П.; Грёнинг, О.; Мюллен, К.; Фазель, Р. (18 июня 2008 г.). «Самосборка хиральных молекулярных сотовых сетей на Au (111)». Журнал Американского химического общества . 130 (28): 8910–8912. дои : 10.1021/ja7106542 .
- ^ Jump up to: а б Черт возьми, Ричард Ф .; Бреслоу, Дэвид С. (1961). «Реакция гидротетракарбонила кобальта с олефинами». Журнал Американского химического общества . 83 (19): 4023–4027. дои : 10.1021/ja01480a017 .
- ^ Jump up to: а б Халперн, Джек (2001). «Металлоорганическая химия на пороге нового тысячелетия. Ретроспектива и перспектива» . Чистая и прикладная химия . 73 (2): 209–220. дои : 10.1351/pac200173020209 .
- ^ Jump up to: а б Пфеффер, М.; Грелье, М. (2007). «Кобальторганические соединения». Комплексная металлоорганическая химия III . Том. 7. Эльзевир . стр. 1–119. дои : 10.1016/B0-08-045047-4/00096-0 . ISBN 9780080450476 .
- ^ Чини, П. (1968). «Замкнутые карбонильные кластеры металлов». Обзоры Inorganica Chimica Acta . 2 : 31–51. дои : 10.1016/0073-8085(68)80013-0 .
- ^ Нестле, Мара О.; Холлгрен, Джон Э.; Зейферт, Дитмар; Доусон, Питер; Робинсон, Брайан Х. (2007). «μ 3 -метилидин и μ 3 -бензилидин-трис(трикарбонилкобальт)». Неорг. Синтез. 20 : 226–229. дои : 10.1002/9780470132517.ch53 . ISBN 9780470132517 .
- ^ Коул Пармер MSDS
- ^ CDC - Карманный справочник NIOSH по химическим опасностям