Димарганцевый декакарбонил
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК бис(пентакарбонилмарганец)( Mn — Mn ) | |
| Другие имена Карбонил марганца Декакарбонилдимарганец | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.030.392 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Мн 2 (СО) 10 | |
| Молярная масса | 389.98 g/mol |
| Появление | Желтые кристаллы |
| Плотность | 1,750 г/см 3 |
| Температура плавления | 154 ° С (309 ° F; 427 К) |
| Точка кипения | сублимирует 60 ° C (140 ° F; 333 К) при 0,5 мм рт. ст. |
| нерастворимый | |
| Структура [1] | |
| моноклинический | |
а = 14,14 Å, b = 7,10 Å, c = 14,63 Å α = 90°, β = 105,2°, γ = 90° | |
Формульные единицы ( Z ) | 4 |
| 0 Д | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | источник CO |
| СГС Маркировка : [2] | |
 | |
| Опасность | |
| Х301 , Х311 , Х331 | |
| P261 , P264 , P270 , P271 , P280 , P301+P310 , P302+P352 , P304+P340 , P311 , P312 , P321 , P322 , P330 , P361 , P363 , P403+P233 , P405 , P 501 | |
| Родственные соединения | |
Родственные соединения | Ре 2 (СО) 10 Со 2 (СО) 8 Фе 3 (СО) 12 Фе 2 (СО) 9 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
декакарбонил димарганца , [3] который имеет химическую формулу Mn 2 (CO) 10 , представляет собой бинарный биметаллический карбонильный комплекс первого ряда с центром вокруг переходного металла марганца . Первое сообщение о синтезе Mn 2 (CO) 10 произошло в 1954 году в компании Linde Air Products и было выполнено Бриммом, Линчем и Сесни. [4] Их гипотеза о декакарбониле димарганца и его синтезе в основном основывалась на ранее известном декакарбониле дирения (Re 2 (CO) 10 ), аналоге тяжелого атома Mn 2 (CO) 10 . С момента своего первого синтеза Mn 2 (CO) 10 экономно использовался в качестве реагента при синтезе других химических соединений, но находил наибольшее применение в качестве простой системы для изучения фундаментальных химических и физических явлений, в первую очередь, связь металл-металл . Декакарбонил димарганца также используется в качестве классического примера для закрепления фундаментальных тем металлоорганической химии, таких как количество d-электронов , правило 18 электронов , степень окисления , валентность , [5] и изолобальная аналогия .
Синтез
[ редактировать ]С 1954 года сообщалось о многих процедурах синтеза Mn 2 (CO) 10 , здесь обсуждаются два наиболее распространенных общих типа. Некоторые из этих методов не были предназначены для создания Mn 2 (CO) 10 , а скорее рассматривали Mn(I), Mn(II) или Mn(-I) в качестве окислителя или восстановителя , соответственно, для других веществ в реакции. , но тем не менее производят Mn 2 (CO) 10 .
Синтез восстановления/карбонилирования
[ редактировать ]Путь карбонилирования включает восстановление соли Mn(I) или Mn(II) до разновидности Mn(0) совместно с карбонилированием до координационно насыщенного металлического центра газообразным CO. Карбонилирование с использованием CO может происходить при повышенном давлении CO по сравнению с атмосферным давлением или при давлении окружающей среды. Приводятся примеры каждого.
Карбонилирование под высоким давлением
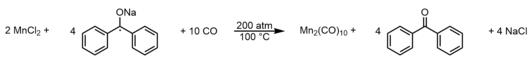
[ редактировать ]Как упоминалось ранее, Mn 2 (CO) 10 был впервые получен в 1954 году Бриммом, Линчем и Сесни, хотя и с выходами ~ 1%, путем восстановления йодида марганца (II) магнием (0) под давлением 3000 фунтов на квадратный дюйм (~ 200 атм) угарного газа (СО). [4] Сбалансированная реакция представлена: Более эффективный препарат был разработан в 1958 году и заключается в восстановлении безводного хлорида марганца (II) кетильным радикалом бензофенона натрия при таком же высоком давлении (200 атм) CO. [6] Этот метод дал ~ 32% декакарбонильного комплекса димарганца, что дало достаточно материала для первых реальных возможностей тщательного изучения химических и физических свойств молекулы. Этот метод представлен сбалансированным уравнением:
Карбонилирование при низком давлении
[ редактировать ]Несмотря на успехи в синтезе Mn 2 (CO) 10 , проблемы безопасности и ограниченный размер партии , связанные с методами карбонилирования под высоким давлением, обусловили необходимость альтернативных процедур низкого давления для получения целевого соединения. о первом синтезе карбонилирования Mn 2 (CO) 10 В 1968 году сообщалось под давлением CO при комнатной температуре с использованием коммерчески доступного и недорогого метилциклопентадиенилтрикарбонила марганца (ММТ) и натрия (0) в качестве восстановителя. [7] Сбалансированное уравнение: Эффективность метода варьировалась от 16 до 20%, что ниже, чем сообщалось ранее, однако его можно было использовать более безопасно и в масштабе молей .
Димеризационные синтезы
[ редактировать ]Второй всеобъемлющий метод, используемый для получения Mn 2 (CO) 10, аналогичен первому тем, что он обычно требует изменения Mn(I) или, в данном случае, Mn(-I) на соответствующую разновидность Mn(0). Однако эти препараты отличаются тем, что начинаются с предшественников марганца, иногда коммерчески доступных, которые не нуждаются в дополнительных лигандах CO и просто димеризуются с образованием целевой молекулы. Это дает значительное преимущество в логистике и безопасности, поскольку исключается работа с токсичным газом CO, и является преобладающим общим методом академического синтеза Mn 2 (CO) 10 .
Первый явный успех в этой области был опубликован в 1977 году, в котором использовался источник пентакарбонилгидридомарганца(I) Mn с Se(PF 2 ) 2 в качестве восстановителя. [8] Сбалансированное уравнение для этого преобразования: Сообщалось об изменениях конечного восстановителя в случае гидрида марганца . [9] [10] [11] Аналогичные методы существуют для Mn(CO) 5 соединений X, где X = Cl , Br или I , и реже, Mn(CO) 6, связанный со слабокоординирующим анионом . [12] [13] [14] [15] [16] [17] Используя аналогичную логику, можно также использовать стабильные соли пентакарбонилманганат- аниона с окислителем для доступа к тому же комплексу Mn 2 (CO) 10 . [18] [19] [20] Примером этого является восстановление тетрафторбората пентакарбонилманганатом трифенилциклопропения натрия с образованием димера каждого из них. [21] Сбалансированное уравнение имеет вид:

Еще один интересный синтез Mn 2 (CO) 10 происходит путем сочетания соли тетрафторбората гексакарбонилмарганца(I) с солью пентакарбонилманганата натрия. В этом случае марганец является одновременно окислителем и восстановителем, образуя два формальных атома Mn(0). [22] Сбалансированное уравнение:
Структура и связь
[ редактировать ]Высокоточные кристаллографические и теоретические исследования физической и электронной структуры Mn 2 (CO) 10 были выполнены и обсуждаются в связи с опубликованной литературой ниже, однако можно также использовать качественный подход для предсказания его конституционной структуры с использованием фундаментальных принципов. неорганической и металлоорганической химии.
Стехиометрический , состав Mn 2 (CO) 10 полученный на основе элементного анализа , дает соотношение CO к Mn 5:1. Учитывая эту информацию, предполагаемый бинарный карбонильный комплекс представляет собой пентакарбонилмарганец (0). Однако сумма количества d-электронов (7 для Mn(0)) и электронных вкладов лигандов (10 для 5 CO) дает 17-электронный металлорадикальный комплекс для Mn(CO) 5 . Это крайне нестабильная конфигурация, изолобальная по отношению к метиловому радикалу , который, как можно ожидать, гомодимеризуется до конституционно- симметричного биядерного комплекса, чтобы оба ядра Mn достигли 18-электронной конфигурации благородного газа . Действительно, истинная структура бинарной карбонильной структуры Mn(0) представляет собой димерный биядерный комплекс.
Кристаллическая структура
[ редактировать ]Эта гипотетическая структура была явно подтверждена посредством рентгеновских дифракционных исследований , сначала в двух измерениях в 1957 году. [23] за которым последовал трехмерный анализ монокристалла в 1963 году. [24] Кристаллическая структура Mn 2 (CO) 10 была заново определена с высокой точностью при комнатной температуре в 1981 году, и упомянутые здесь длины связей относятся к результатам этого исследования. [25] Mn 2 (CO) 10 не имеет мостиковых CO-лигандов: его можно описать как содержащий две аксиально связанные (CO) 5 Mn- субъединицы. Эти субъединицы Mn расположены на расстоянии 290,38(6) пм, что больше, чем предсказывал Пекка Пюикко . [26] Существует два типа лигандов CO; один CO, связанный с каждым атомом Mn, коаксиальным связи Mn-Mn, и четыре «экваториальных» карбонила, связанных с каждым атомом Mn, которые почти перпендикулярны связи Mn-Mn (углы Mn'-Mn-CO (экваториальные) варьируются от от 84,61(7) до 89,16(7) градусов). Осевое карбонильное расстояние (181,1 пм ) на 4,5 пм короче среднего экваториального расстояния марганец-карбонил 185,6 пм . В стабильном ротамере две Mn(CO) 5 субъединицы расположены в шахматном порядке . Таким образом, вся молекула имеет приблизительную симметрию точечной группы D 4d , которая является необычной симметрией, общей с S 2 F 10 . Молекула Mn 2 (CO) 10 изоморфна другим 7-й группы бинарным карбонилам металлов Tc 2 (CO) 10 и Re 2 (CO) 10 .

Электронная структура
[ редактировать ]Первоначальные фундаментальные экспериментальные и теоретические исследования электронной структуры Mn 2 (CO) 10 были выполнены с использованием смеси фотоэлектронной спектроскопии , инфракрасной спектроскопии и итеративного типа Хюккеля расчета молекулярных орбиталей . [27] [28] Электронная структура Mn 2 (CO) 10 наиболее известна в 2017 году с использованием функционала BP86D с базисом TZP . [29] Электронная структура, описанная здесь, вместе с соответствующими орбитальными графиками, воспроизведена с помощью методов, использованных в этом исследовании с использованием Orca (5.0.3). [30] и визуализировалось с помощью IBOView (v20150427). [31] взаимодействия металл-лиганд Двумя основными взаимодействиями, представляющими интерес в системе, являются пи-связывающие и сигма-связывающая орбиталь металл-металл. Проиллюстрированные ниже пи-образующие взаимодействия происходят между t 2g набором d-орбиталей CO π* и разрыхляющими орбиталями . Вырожденные собой ВЗМО - обратные взаимодействия dxz и dyz как с аксиальными, так и с экваториальными лигандами CO представляют 15 . На аксиальной разрыхляющей CO орбитали происходит более полная делокализация , чем на экваториальной, что, как полагают, объясняет более короткую длину связи Mn-C.
- Две вырожденные пи-связывающие орбитали декакарбонила димарганца
Первичная σ-связывающая орбиталь Mn-Mn состоит из двух орбиталей d z2 , представленных ВЗМО-9.

Другой крупный вклад в эту область внес Ахмед Зеваил, использовавший сверхбыструю фемтосекундную спектроскопию на пути к своей Нобелевской премии 1999 года . [32] Его открытия многое прояснили о временных масштабах и энергиях, связанных с молекулярными движениями Mn 2 (CO) 10 , а также о событиях разрыва связей Mn-Mn и Mn-C. [33]
Реактивность
[ редактировать ]Mn 2 (CO) 10 стабилен на воздухе в виде кристаллического твердого вещества, но для растворов необходимы Шленка методы . Mn 2 (CO) 10 химически активен как по связям Mn-Mn, так и по связям Mn-CO из-за низких и удивительно близких энергий диссоциации связей ~ 36 ккал/моль (151 кДж/моль). [34] и ~38 ккал/моль (160 кДж/моль), [35] соответственно. По этой причине реакционная способность может происходить в любом месте молекулы, иногда выборочно. Приводятся примеры каждого.
Реакции разрыва связи Mn-Mn
[ редактировать ]Связь Mn-Mn чувствительна как к окислению, так и к восстановлению, образуя два эквивалента соответствующих разновидностей Mn(I) и Mn(-I) соответственно. Оба потенциальных результирующих вида могут быть получены дальше. Редокс -нейтральное расщепление возможно как термически, так и фотохимически , с образованием двух эквивалентов радикала Mn(0). Примеры каждого приведены ниже.
Окислительное расщепление
[ редактировать ]Селективное моноокисление связи Mn-Mn чаще всего осуществляется добавлением классических окислителей металлов (например, Ce IV , Пб IV и т. д.) или слабые гомоядерные одинарные ковалентные связи формы XX (X — элемент 16 или 17 группы ). [36] [37] [38] [39] [40] Эти реакции дают [Mn(CO) 5 ] + катион со связанным слабокоординирующим анионом, или комплекс Mn(CO) 5 X. Общие схемы реакций для каждого из них представлены в виде сбалансированных уравнений ниже: или для двухэлектронных окислителей и E знак равно O , S , Se , Te для X = F , Cl, Br, I
Восстановительное расщепление
[ редактировать ]Восстановительное расщепление почти всегда проводится металлическим натрием. [41] [42] с получением [Mn(CO) 5 ] − натрия анион с противоионом . Сбалансированные общие реакции приведены ниже: Образующийся манганат-анион является мощным нуклеофилом , который можно протонировать с образованием гидрида марганца. [43] [44] или алкилирован органическими галогенидами [45] [46] [43] с образованием большого количества марганцевоорганических комплексов (I).
Редокс-нейтральное расщепление
[ редактировать ]Гомолитическое расщепление , обычно под действием света, [47] но иногда жарко, [48] дает металлорадикал Mn(0), который может реагировать сам с собой с образованием Mn 2 (CO) 10 или объединяться с другими радикалами, что обычно приводит к формальному окислению до Mn(I). Эта реакционная способность сравнима с реакционной способностью органических радикалов на основе углерода по изолобальной аналогии. Гомолитическое расщепление определяется формулой: Использование образующихся радикалов [Mn(CO) 5 ]* нашло несколько применений в качестве радикального инициатора для различных органических методологий. [49] [50] [51] и реакции полимеризации . [52] [53] [54]
Реакции замещения лиганда
[ редактировать ]Реакции замещения лиганда , которые не разрушают связь Mn-Mn, осуществляются с использованием сильно сигма-донорных лигандов L-типа, которые могут превосходить CO, не участвуя в окислительно-восстановительной активности. [55] Это требование обычно приводит к необходимости использования фосфинов. [56] [57] или N-гетероциклические карбены (NHC), [58] с замещением, происходящим в аксиальном положении в соответствии с приведенными ниже реакциями:

Безопасность
[ редактировать ]Mn 2 (CO) 10 – летучий источник металла и источник CO.
Ссылки
[ редактировать ]- ^ Мелвин Роуэн Черчилль, Кваме Н. Амох и Харви Дж. Вассерман (1981). «Переопределение кристаллической структуры декакарбонила димарганца и определение кристаллической структуры декакарбонила дирения. Уточненные значения длин связей марганец-марганец и рений-рение в декакарбониле димарганца и декакарбониле дирения» . Неорг. Хим . 20 (5): 1609–1611. дои : 10.1021/ic50219a056 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ «Декакарбонилдимарганец» . pubchem.ncbi.nlm.nih.gov . Проверено 27 декабря 2021 г.
- ^ Паусон, Питер Л.; Фристад, Грегори К. (15 сентября 2009 г.), «Декакарбонилдимарганец» , в John Wiley & Sons, Ltd (ред.), Энциклопедия реагентов для органического синтеза , Чичестер, Великобритания: John Wiley & Sons, Ltd, стр. rd001. .pub2, doi : 10.1002/047084289x.rd001.pub2 , ISBN 978-0-471-93623-7 , получено 12 марта 2023 г.
- ^ Перейти обратно: а б Бримм, Э.О.; Линч, Массачусетс; Сесни, WJ (июль 1954 г.). «Получение и свойства карбонила марганца» . Журнал Американского химического общества . 76 (14): 3831–3835. дои : 10.1021/ja01643a071 . ISSN 0002-7863 .
- ^ Паркин, Джерард (май 2006 г.). «Валентность, степень окисления и формальный заряд: три связанных, но принципиально разных понятия» . Журнал химического образования . 83 (5): 791. Бибкод : 2006ЖЧЭд..83..791П . дои : 10.1021/ed083p791 . ISSN 0021-9584 .
- ^ Клоссон, Рекс Д.; Бузби, Ллойд Р.; Экке, Джордж Г. (декабрь 1958 г.). «Синтез нового карбонила металла 1» . Журнал Американского химического общества . 80 (23): 6167–6170. дои : 10.1021/ja01556a005 . ISSN 0002-7863 .
- ^ Кинг, РБ; Стоукс, Дж. К.; Кореновский, Т.Ф. (1 января 1968 г.). «Удобный синтез декарбонила димарганца из недорогих исходных материалов при атмосферном давлении» . Журнал металлоорганической химии . 11 : 641–643. дои : 10.1016/0022-328X(68)80099-3 . ISSN 0022-328X .
- ^ Арнольд, Дэвид Э.Дж.; Кроми, Эрнест Р.; Рэнкин, Дэвид WH (1977). «Получение, химические и спектроскопические свойства бис(дифторфосфино)селенида» . Журнал Химического общества, Dalton Transactions (20): 1999–2004. дои : 10.1039/dt9770001999 . ISSN 0300-9246 .
- ^ Суини, Рэй; Батлер, Стивен С.; Халперн, Джек (23 июня 1981 г.). «Гидрирование 9,10-диметилантрацена гидридопентакарбонилмарганцем (I). Доказательства свободнорадикального механизма» . Журнал металлоорганической химии . 213 (2): 487–492. дои : 10.1016/S0022-328X(00)82954-X . ISSN 0022-328X .
- ^ Бут, Брайан Л.; Хазелдин, Роберт Н.; Холмс, Роберт Г.Г. (1982). «Реакции с участием переходных металлов. Часть 16. Комплексы родия, иридия, платины и золота, содержащие бис(трифторметил)аминооксилиганд» . Журнал Химического общества, Dalton Transactions (3): 523–529. дои : 10.1039/dt9820000523 . ISSN 0300-9246 .
- ^ Тэм, Уилсон; Марси, Марианна; Гладыш, Ю.А. (май 1983 г.). «Биметаллические анионные формильные комплексы: синтез и свойства» . Неорганическая химия . 22 (10): 1413–1421. дои : 10.1021/ic00152a001 . ISSN 0020-1669 .
- ^ Колтхаммер, Брайан В.С.; Легздиньш, Петр (1978). «Металлоорганическая нитрозилхимия. Часть 3. Некоторые аспекты химии бис[(η-циклопентадиенил)динитрозилхрома]» . Дж. Хим. Soc., Далтон Транс. (1): 31–35. дои : 10.1039/DT9780000031 . ISSN 0300-9246 .
- ^ Мэннинг, Марк К.; Троглер, Уильям К. (1 января 1981 г.). «Восстановление карбонилов металлов карбидами щелочных металлов» . Неорганика Химика Акта . 50 : 247–250. дои : 10.1016/S0020-1693(00)83752-4 . ISSN 0020-1693 .
- ^ Гибсон, Дороти Х.; Сюй, Вэнь-Лян (1 января 1982 г.). «Реакции карбонилов марганца с галогенидами четвертичного аммония» . Неорганика Химика Акта . 59 : 93–99. дои : 10.1016/S0020-1693(00)87314-4 . ISSN 0020-1693 .
- ^ Кучинка, диджей; Аматоре, К.; Кочи, Дж. К. (ноябрь 1986 г.). «Радикалы марганца (0) и восстановление катионных карбонильных комплексов: селективность при диссоциации лиганда от 19-электронных частиц» . Неорганическая химия . 25 (23): 4087–4097. дои : 10.1021/ic00243a009 . ISSN 0020-1669 .
- ^ Гейер, Йенс; Виллнер, Хельге; Леманн, Кристиан В.; Аубке, Фридхельм (1 августа 2007 г.). «Образование солей гексакарбонилмарганца (I) [Mn (CO) 6 ] + X - в безводном HF» . Неорганическая химия . 46 (17): 7210–7214. дои : 10.1021/ic700798z . ISSN 0020-1669 . ПМИД 17616186 .
- ^ Мэннинг, Питер Дж.; Петерсон, Луи К.; Вада, Фумио; Дхами, Рэнди С. (1 апреля 1986 г.). «Синтез и реакции комплексов [M(CO)4(Ph2PSiMe3)X] (M = Mn, Re; X = галоген)» . Неорганика Химика Акта . 114 (1): 15–20. дои : 10.1016/S0020-1693(00)84581-8 . ISSN 0020-1693 .
- ^ Дюбуа, Донн А.; Дюслер, Эйлин Н.; Пейн, Роберт Т. (январь 1985 г.). «Образование и определение рентгеновской кристаллической структуры необычного фосфорно-фосфорного комплекса бициклодифосфазана» . Неорганическая химия . 24 (1): 3–5. дои : 10.1021/ic00195a003 . ISSN 0020-1669 .
- ^ Озин, Джеффри А.; Колесон, Крейг М.; Хубер, Гельмут X. (март 1983 г.). «Реакции сольватированных атомов металлов с металлоорганическими комплексами в растворе. Спектроскопическое и синтетическое исследование атомов металлов в микрорастворах путей реакций одиночных металл-металл-связанных металлоорганических комплексов и их металлоорганических анионов» . Металлоорганические соединения . 2 (3): 415–420. дои : 10.1021/om00075a011 . ISSN 0276-7333 .
- ^ Мюллер, Манфред; Варенкамп, Генрих (июнь 1983 г.). «Строительство кластеров: поэтапное построение триметаллических кластеров μ 3 -RP посредством соединений P – Hal» . Химические отчеты . 116 (6): 2322–2336. дои : 10.1002/cber.19831160621 . ISSN 0009-2940 .
- ^ Хьюз, Рассел П.; Ламберт, Джеймс М.Дж.; Райш, Джон В.; Смит, Уэйн Л. (октябрь 1982 г.). «Повторные исследования некоторых реакций карбонильных анионов металлов с катионами циклопропения. Превращение 3-циклопропенила в 3-циклобутенонильные лиганды» . Металлоорганические соединения . 1 (10): 1403–1405. дои : 10.1021/om00070a027 . ISSN 0276-7333 .
- ^ Ли, Кентукки; Кучинка, диджей; Кочи, Дж. К. (1 сентября 1987 г.). «Образование связей металл-металл путем аннигиляции ионных пар. Димарганцевые карбонилы из анионов манганата (I-) и катионов марганца (I)» . Металлоорганические соединения . 6 (9): 1886–1897. дои : 10.1021/om00152a010 . ISSN 0276-7333 .
- ^ Даль, Лоуренс Ф.; Исиси, Эцуро; Рандл, RE (6 октября 2004 г.). «Полиядерные карбонилы металлов. I. Структуры Mn2(CO)10 и Re2(CO)10» . Журнал химической физики . 26 (6): 1750. дои : 10.1063/1.1743615 . ISSN 0021-9606 .
- ^ Даль, Л.Ф.; Рандл, RE (10 мая 1963 г.). «Кристаллическая структура декакарбонила димарганца Mn2(CO)10» . Акта Кристаллографика . 16 (5): 419–426. дои : 10.1107/S0365110X63001080 . ISSN 0365-110X .
- ^ Черчилль, Мелвин Роуэн; Амох, Кваме Н.; Вассерман, Харви Дж. (май 1981 г.). «Переопределение кристаллической структуры декакарбонила димарганца и определение кристаллической структуры декакарбонила дирения. Уточненные значения длин связей марганец-марганец и рений-рение в декакарбониле димарганца и декакарбониле дирения» . Неорганическая химия . 20 (5): 1609–1611. дои : 10.1021/ic50219a056 . ISSN 0020-1669 .
- ^ Пюиккё, Пекка (19 марта 2015 г.). «Аддитивные ковалентные радиусы для молекул с одинарной, двойной и тройной связью и кристаллов с тетраэдрической связью: краткое изложение» . Журнал физической химии А. 119 (11): 2326–2337. Бибкод : 2015JPCA..119.2326P . дои : 10.1021/jp5065819 . ISSN 1089-5639 . ПМИД 25162610 .
- ^ Левенсон, Роберт А.; Грей, Гарри Б.; Сезар, Джеральд П. (июнь 1970 г.). «Электронная и колебательная спектроскопия в нематическом жидкокристаллическом растворителе. Зонные поляризации биядерных карбонилов металлов» . Журнал Американского химического общества . 92 (12): 3653–3658. дои : 10.1021/ja00715a018 . ISSN 0002-7863 .
- ^ Левенсон, Роберт А.; Грей, Гарри Б. (октябрь 1975 г.). «Электронное строение соединений, содержащих связи металл-металл. Декакарбонилдиметалл и родственные комплексы» . Журнал Американского химического общества . 97 (21): 6042–6047. дои : 10.1021/ja00854a015 . ISSN 0002-7863 .
- ^ Угроза, Рафик; Мэй, Абдельгани; Белхири, Лотфи; Муссер, Абдельхамид (28 ноября 2017 г.). «Электронная структура и связь биядерных декакарбонилов металла M2 (CO) 10: применение естественных орбиталей для определения химической валентности» . Журнал молекулярного моделирования . 23 (12): 358. doi : 10.1007/s00894-017-3523-5 . ISSN 0948-5023 . ПМИД 29185066 . S2CID 3814626 .
- ^ Низ, Фрэнк (январь 2012 г.). «Программная система ORCA» . WIREs Вычислительная молекулярная наука . 2 (1): 73–78. дои : 10.1002/wcms.81 . ISSN 1759-0876 . S2CID 62137389 .
- ^ Книзия, Джеральд (12 ноября 2013 г.). «Внутренние атомные орбитали: объективный мост между квантовой теорией и химическими концепциями» . Журнал химической теории и вычислений . 9 (11): 4834–4843. arXiv : 1306.6884 . дои : 10.1021/ct400687b . ISSN 1549-9618 . ПМИД 26583402 . S2CID 17717923 .
- ^ Зеваил, Ахмед Х. (2001), «Фемтохимия: динамика химической связи в атомном масштабе с использованием сверхбыстрых лазеров (Нобелевская лекция)» , Фемтохимия , Вайнхайм, ФРГ: Wiley-VCH Verlag GmbH, стр. 1–85, doi : 10.1002 /3527600183.ch1 , ISBN 352730259X , получено 13 марта 2023 г.
- ^ Кю Ким, Санг; Педерсен, Сорен; Зеваил, Ахмед Х. (24 февраля 1995 г.). "Фемтохимия металлоорганических соединений: динамика разрыва связей металл-металл и металл-лиганд в M2(CO)10" . Письма по химической физике . 233 (5): 500–508. Бибкод : 1995CPL...233..500K . дои : 10.1016/0009-2614(95)00050-E . ISSN 0009-2614 .
- ^ Хьюи, Джозеф Л.; Андерсон, Крейг П.; Мейер, Томас Дж. (1 февраля 1977 г.). «Фотохимия Mn2(CO)10» . Журнал металлоорганической химии . 125 (2): C49–C52. дои : 10.1016/S0022-328X(00)89455-3 . ISSN 0022-328X .
- ^ Смит, врач общей практики (1 января 1988 г.). «Энергия диссоциации первой связи в газовой фазе в карбонилах переходных металлов» . Многогранник . 7 (16): 1605–1608. дои : 10.1016/S0277-5387(00)81785-4 . ISSN 0277-5387 .
- ^ Дэвидсон, Дж. Л.; Шарп, DWA (1 января 1973 г.). «Перфторалкил- и -арилтиолаты металлов. Часть II. Производные молибдена, вольфрама, марганца, железа и никеля» . Журнал Химического общества, Dalton Transactions (19): 1957–1960. дои : 10.1039/DT9730001957 . ISSN 1364-5447 .
- ^ Чаудхури, МК; Хаас, А.; Венский, А. (24 августа 1976 г.). «Фотоиндуцированные реакции (CF3S)3N и CF3SeSeCF3 с Mn2(CO)10 и Fe(CO)5» . Журнал металлоорганической химии . 116 (3): 323–326. дои : 10.1016/S0022-328X(00)94469-3 . ISSN 0022-328X .
- ^ Арсено, Клеман; Бужар, Питер; Сэйер, Брайан Г.; Йерушалми, Шахин; МакГлинчи, Майкл Дж. (17 апреля 1984 г.). «[η5-1,2,3,4,5-пентакис(карбометокси)циклопентадиенил]трикарбонилмарганец (I): синтез, спектроскопия и реакционная способность» . Журнал металлоорганической химии . 265 (3): 283–290. дои : 10.1016/0022-328X(84)80092-3 . ISSN 0022-328X .
- ^ Шмидт, Стивен П.; Троглер, Уильям К.; Басоло, Фред (март 1984 г.). «Механизм галогенирования декакарбонилов димарганца, марганцевия и дирения» . Журнал Американского химического общества . 106 (5): 1308–1313. дои : 10.1021/ja00317a023 . ISSN 0002-7863 .
- ^ Эрнандес, Хосе Г.; Батлер, Ян С.; Фрищич, Томислав (16 июня 2014 г.). «Многостадийный и многокомпонентный металлоорганический синтез в одном котле с использованием ортогональных механохимических реакций» . Химическая наука . 5 (9): 3576. дои : 10.1039/C4SC01252F . ISSN 2041-6520 .
- ^ Уорнок, Гарри Ф.П.; Муди, Лин Каммарано; Эллис, Джон Э. (март 1989 г.). «Высоковосстановленные металлоорганические соединения. Часть 25. Реакции тринатриевых тетракарбонилметаллатов(3-) марганца и рения с кислотами Бренстеда и другими электрофилами. Синтез H2M(CO)4- (M = Mn и Re), (CH3)2Re(CO) 4-, первое диалкилпроизводное трианиона карбонилметаллата и родственные анионные разновидности» . Журнал Американского химического общества . 111 (6): 2131–2141. дои : 10.1021/ja00188a029 . ISSN 0002-7863 .
- ^ Кучинка, диджей; Кочи, Дж. К. (март 1989 г.). «Равновесие 17-электронных и 19-электронных металлоорганических радикалов, полученных из карбонилмарганцевых анионов и катионов» . Неорганическая химия . 28 (5): 855–863. дои : 10.1021/ic00304a012 . ISSN 0020-1669 .
- ^ Перейти обратно: а б Наппа, Марио Дж.; Санти, Роберто; Халперн, Джек (январь 1985 г.). «Механизмы реакций биядерного восстановительного отщепления бензил- и гидридомарганцевых карбонилов с образованием углерод-водородной связи» . Металлоорганические соединения . 4 (1): 34–41. дои : 10.1021/om00120a007 . ISSN 0276-7333 .
- ^ Вассинк, Беренд; Томас, Мэриан Дж.; Райт, Стивен С.; Гиллис, Дэниел Дж.; Бэрд, Майкл К. (апрель 1987 г.). «Механизмы реакций гидрометаллирования (внедрения) и стехиометрического гидрирования сопряженных диенов под действием пентакарбонилгидрида марганца: процессы с участием радикально-парного механизма» . Журнал Американского химического общества . 109 (7): 1995–2002. дои : 10.1021/ja00241a016 . ISSN 0002-7863 .
- ^ Кейси, Чарльз П.; Шек, Дэниел М. (апрель 1980 г.). «Механизм восстановительного элиминирования ацетофенона из Me4+[цис-(CO)4Mn(COMe)(COPh)]-» . Журнал Американского химического общества . 102 (8): 2728–2731. дои : 10.1021/ja00528a034 . ISSN 0002-7863 .
- ^ Бенсон, Ян Б.; Хант, Джеймс; Нокс, Селби, Арканзас; Олифант, Валери (1978). «Химия сероорганических веществ – переходных металлов. Часть 1. Реакции сероуглерода с карбонильными анионами металлов» . Дж. Хим. Soc., Далтон Транс. (10): 1240–1246. дои : 10.1039/DT9780001240 . ISSN 0300-9246 .
- ^ Херрик, Ричард С.; Браун, Теодор Л. (декабрь 1984 г.). «Флэш-фотолитическое исследование фотоиндуцированной диссоциации монооксида углерода из биядерных карбонильных соединений марганца» . Неорганическая химия . 23 (26): 4550–4553. дои : 10.1021/ic00194a028 . ISSN 0020-1669 .
- ^ Вегман, РВ; Олсен, Р.Дж.; Гард, ДР; Фолкнер, ЛР; Браун, Теодор Л. (октябрь 1981 г.). «Исследование методом флэш-фотолиза гомолиза связи металл-металл в декакарбониле димарганца и декакарбониле дирения» . Журнал Американского химического общества . 103 (20): 6089–6092. дои : 10.1021/ja00410a017 . ISSN 0002-7863 .
- ^ Гилберт, Брюс С.; Кальц, Вильгельм; Линдси, Крис И.; МакГрэйл, П. Терри; Парсонс, Эндрю Ф.; Уиттакер, Дэвид Т.Е. (13 августа 1999 г.). «Радикальные циклизации, которым способствует декакарбонил димарганца: новый и гибкий подход к 5-членным N-гетероциклам» . Буквы тетраэдра . 40 (33): 6095–6098. дои : 10.1016/S0040-4039(99)01271-X . ISSN 0040-4039 .
- ^ Гилберт, Брюс С.; Парсонс, Эндрю Ф. (25 февраля 2002 г.). «Использование в синтезе свободнорадикальных инициаторов, несущих связи металл–металл, металл–водород и неметалл–водород» . Журнал Химического общества, Perkin Transactions 2 (3): 367–387. дои : 10.1039/B102044G . ISSN 1364-5471 .
- ^ Фукуяма, Такахидэ; Нишитани, Сатоши; Иноуэ, Такая; Моримото, Кейсуке; Рю, Ильхён (1 марта 2006 г.). «Эффективное ускорение карбонилирования с переносом атома алкилйодидов металлокомплексами. Применение к синтезу предшественника хинокинина и дигидрокапсаицина» . Органические письма . 8 (7): 1383–1386. дои : 10.1021/ol060123+ . ISSN 1523-7060 . ПМИД 16562897 .
- ^ Чифтчи, Мустафа; Тасделен, Мехмет Атилла; Ягджи, Юсуф (11 декабря 2013 г.). «Радикальная полимеризация с переносом атома, индуцированная солнечным светом, с использованием декакарбонила димарганца» . Полимерная химия . 5 (2): 600–606. дои : 10.1039/C3PY01009K . ISSN 1759-9962 .
- ^ Гилберт, Брюс С.; Харрисон, Ричард Дж.; Линдси, Крис И.; МакГрэйл, П. Терри; Парсонс, Эндрю Ф.; На юг, Ричард; Ирвин, Дерек Дж. (1 декабря 2003 г.). «Полимеризация метилметакрилата с использованием декакарбонила димарганца в присутствии галогенорганических соединений» . Макромолекулы . 36 (24): 9020–9023. Бибкод : 2003МаМол..36.9020Г . дои : 10.1021/ma034712w . ISSN 0024-9297 .
- ^ Чифтчи, Мустафа; Норсик, Себастьян; Буассон, Кристоф; Д'Агосто, Франк; Ягджи, Юсуф (май 2015 г.). «Синтез блок-сополимеров на основе полиэтилена методом термоиндуцированной контролируемой радикальной полимеризации с использованием Mn 2 (CO) 10» . Макромолекулярная химия и физика . 216 (9): 958–963. дои : 10.1002/macp.201500016 .
- ^ Ковилл, Нью-Джерси; Столценберг, AM; Муэттертис, Эль (апрель 1983 г.). «Механизм замещения лиганда в декакарбониле марганца» . Журнал Американского химического общества . 105 (8): 2499–2500. дои : 10.1021/ja00346a079 . ISSN 0002-7863 .
- ^ Херринтон, Томас; Браун, Теодор (1 октября 1985 г.). «Замещение пентакарбонила марганца ассоциативно» . Журнал Американского химического общества . 107 (20): 5700–5703. дои : 10.1021/ja00306a016 .
- ^ Рейманн, Рольф Х.; Синглтон, Эрик (1 января 1976 г.). «Реакции карбонилов металлов. Часть 7. Реакции замещения декакарбонилдимарганца третичным фосфором и мышьяковистыми лигандами» . Журнал Химического общества, Dalton Transactions (20): 2109–2114. дои : 10.1039/DT9760002109 . ISSN 1364-5447 .
- ^ Фрейзер, Роан; ван Ситтерт, Корнелия GCE; ван Ройен, Петрус Х.; Ландман, Мариле (01 мая 2017 г.). «Синтез и структурное исследование моно- и диметаллических N-гетероциклических карбеновых комплексов переходных металлов VII группы» . Журнал металлоорганической химии . 835 : 60–69. дои : 10.1016/j.jorganchem.2017.02.031 . ISSN 0022-328X .

![{\displaystyle {\ce {2 Mn(\eta^5-(CH3)C5H4)(CO)3 + 2 Na + 4 CO -> Mn2(CO)10 + 2Na[(CH3)C5H4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e0469b5df58316feaed1f33805bb4c7d4e6f4c2)

 + Na[Mn(CO)5] -> Mn2(CO)10 + Na[BF4] + CO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a0bc208f17e2a730d87ae834a00dae8270897344)






![{\displaystyle {\ce {Mn2(CO)10 + 2 Na^{0}-> 2Na[Mn(CO)5]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/47f1b62210d70cf7a7f82ee3b1d7791a8314dd14)
![{\displaystyle {\what {Mn2(CO)10 + h\nu -> 2[Mn(CO)5]^{.}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/649cb57e761488981ed55970fb04937016b7288b)