Изолобальный принцип
В металлоорганической химии изолобальный принцип (более формально известный как изолобальная аналогия ) — это стратегия, используемая для связи структуры органических и неорганических молекулярных фрагментов с целью прогнозирования связывающих свойств металлоорганических соединений. [1] Роальд Хоффманн описал молекулярные фрагменты как изолобальные, «если число, свойства симметрии , приблизительная энергия и форма граничных орбиталей , а также количество электронов в них схожи - не идентичны, но похожи». [2] Можно предсказать связь и реакционную способность менее известных видов по более известным видам, если два молекулярных фрагмента имеют схожие граничные орбитали: высшую занятую молекулярную орбиталь (ВЗМО) и самую низкую незанятую молекулярную орбиталь (НСМО). Изолобальные соединения являются аналогами изоэлектронных соединений, которые имеют одинаковое количество валентных электронов и структуру. Графическое изображение изолобальных структур, где изолобальные пары соединены двунаправленной стрелкой с половиной орбитали внизу, показано на рисунке 1.
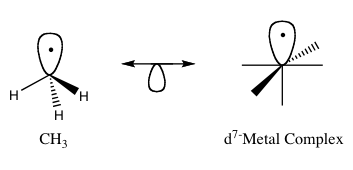
За работу над изолобальной аналогией Хоффманн был удостоен Нобелевской премии по химии в 1981 году, которую он разделил с Кеничи Фукуи . [3] В своей лекции, присужденной Нобелевской премии, Хоффманн подчеркнул, что изолобальная аналогия является полезной, но простой моделью и, следовательно, в некоторых случаях обречена на провал. [1]
Построение изолобальных фрагментов [ править ]
Чтобы начать генерировать изолобальный фрагмент, молекула должна соответствовать определенным критериям. [4] Молекулы, основанные на элементах основной группы, должны удовлетворять правилу октетов , когда все связывающие и несвязывающие молекулярные орбитали (МО) заполнены, а все разрыхляющие МО пусты. Например, метан представляет собой простую молекулу, из которой образуется фрагмент основной группы. Удаление атома водорода из метана приводит к образованию метилового радикала. Молекула сохраняет свою молекулярную геометрию , поскольку граничная орбиталь указывает в направлении недостающего атома водорода. Дальнейшее удаление водорода приводит к образованию второй граничной орбитали. Этот процесс можно повторять до тех пор, пока с центральным атомом молекулы не останется только одна связь.
изолобальные фрагменты октаэдрических комплексов , таких как тип ML 6 Аналогичным образом могут быть созданы . Комплексы переходных металлов изначально должны удовлетворять правилу восемнадцати электронов , не иметь суммарного заряда, а их лиганды должны быть двумя донорами электронов ( основания Льюиса ). Следовательно, металлический центр начальной точки ML 6 должен быть d 6 . Удаление лиганда аналогично удалению водорода из метана в предыдущем примере, в результате чего образуется граничная орбиталь, указывающая на удаляемый лиганд. Разрыв связи между металлическим центром и одним лигандом приводит к образованию ML. −
5 радикальный комплекс. Чтобы удовлетворить критериям нулевого заряда, необходимо изменить металлический центр. Например, комплекс MoL 6 представляет собой d 6 и нейтральный. Однако удаление лиганда с образованием первой граничной орбитали приведет к образованию MoL. −
5 комплексный, потому что Мо получил дополнительный электрон, что сделало его d 7 . Чтобы исправить это, Мо можно заменить на Mn, который образует нейтральный d. 7 в этом случае комплекс, как показано на рисунке 3. Эта тенденция может продолжаться до тех пор, пока только один лиганд не останется координированным с металлическим центром.

между тетраэдрическими и фрагментами октаэдрическими Связь
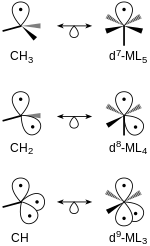
Изолобальные фрагменты тетраэдрических и октаэдрических молекул могут быть родственными. Структуры с одинаковым числом граничных орбиталей изолобальны друг другу. Например, метан с удаленными двумя атомами водорода CH 2 изолобален ад 7 Комплекс ML 4 образуется из октаэдрического стартового комплекса (рис. 4).
Зависимость теории МО [ править ]
Любая насыщенная молекула может стать отправной точкой для образования изолобальных фрагментов. [5] [6] Связывающие и несвязывающие молекулярные орбитали (МО) молекулы должны быть заполнены, а разрыхляющие МО пусты. При каждом последующем образовании изолобального фрагмента электроны удаляются со связывающих орбиталей и создается граничная орбиталь. Граничные орбитали находятся на более высоком энергетическом уровне, чем связывающие и несвязывающие МО. Каждая граничная орбиталь содержит один электрон. Например, рассмотрим рисунок 5, на котором показано образование граничных орбиталей в тетраэдрических и октаэдрических молекулах.

Как было видно выше, при образовании фрагмента из CH 4 один из sp 3 гибридные орбитали, участвующие в связывании, становятся несвязывающими, одиночно занятыми пограничными орбиталями. Повышенный уровень энергии пограничной орбитали также показан на рисунке. Аналогично, если начать с металлокомплекса, такого как d 6 -ML 6 , д 2 сп 3 Гибридные орбитали затронуты. Кроме того, несвязывающие металлические орбитали t 2g не изменяются.
Расширение аналогии [ править ]
Изолобальная аналогия имеет применение за пределами простых октаэдрических комплексов. Его можно использовать с различными лигандами, заряженными частицами и неоктаэдрическими комплексами. [7]
Изоэлектронные фрагменты [ править ]
Изолобальную аналогию можно также использовать с изоэлектронными фрагментами, имеющими одинаковое координационное число, что позволяет рассматривать заряженные частицы. Например, Re(CO) 5 изолобален CH 3 и, следовательно, [Ru(CO) 5 ] + и [Мо(СО) 5 ] − также изолобальны с CH 3 . Любой 17-электронный металлокомплекс в этом примере будет изолобальным.
Аналогичным образом добавление или удаление электронов из двух изолобальных фрагментов приводит к образованию двух новых изолобальных фрагментов. Поскольку Re(CO) 5 изолобален CH 3 , [Re(CO) 5 ] + изолобален с CH +
3 . [8]
Неоктаэдрические комплексы [ править ]
| Октаэдрический МЛ н | Квадратно-плоскостной ML n -2 |
|---|---|
| д 6 : Мо(СО) 5 | д 8 : [PdCl 3 ] − |
| д 8 : Ос(СО) 4 | д 10 : Ni(PR 3 ) 2 |

Аналогия применима и к другим формам, помимо тетраэдрической и октаэдрической геометрии. Выводы, используемые в октаэдрической геометрии, справедливы и для большинства других геометрий. Исключением является плоскоквадратный комплекс, поскольку плоскоквадратные комплексы обычно подчиняются правилу 16 электронов. Предполагая, что лиганды действуют как доноры двух электронов, металлоцентр в плоскоквадратных молекулах равен d 8 . Чтобы связать октаэдрический фрагмент, ML n , где M имеет ad х электронную конфигурацию до плоского квадратного аналогичного фрагмента, формула ML n -2 где M имеет ad х +2 электронная конфигурация должна быть соблюдена.
Дополнительные примеры изолобальной аналогии в различных формах и формах показаны на рисунке 8.
Ссылки [ править ]
- ^ Jump up to: Перейти обратно: а б Хоффманн, Р. (1982). «Наведение мостов между неорганической и органической химией (Нобелевская лекция)» (PDF) . Энджью. хим. Межд. Эд. 21 (10): 711–724. дои : 10.1002/anie.198207113 .
- ^ В ссылке 10 своей речи на вручении Нобелевской премии Хоффманн заявляет, что термин «изолобальный» был введен в ссылке 1e: « Элиан, М.; Чен, ММ-Л.; Мингос, DMP ; Хоффманн, Р. (1976). «Сравнительное исследование сцепления конических фрагментов». Неорг. Хим . 15 (5): 1148–1155. дои : 10.1021/ic50159a034 . ", но эта концепция старше .
- ^ «Нобелевская премия по химии 1981 года: Кеничи Фукуи, Роальд Хоффманн» . nobelprize.org . Проверено 22 декабря 2010 г.
- ^ Кафедра химии. Современные подходы к неорганическому соединению . Университет Халла.
- ^ Гисперт, Жоан Рибас (2008). Координационная химия . Вайли-ВЧ. стр. 172–176.
- ^ Шрайвер, DF; Аткинс, П .; Овертон, Т.; Рурк, Дж.; Веллер, М.; Армстронг, Ф. (2006). Неорганическая химия . Фриман.
- ^ Мисслер, Г.Л.; Тарр, Д.А. (2008). Неорганическая химия (3-е изд.). Пирсон Образование.
- ^ Дуглас, Б.; МакДэниел, Д.; Александр, Дж. (1994). Концепции и модели неорганической химии (3-е изд.). Уайли и сыновья.