Карбометаллирование
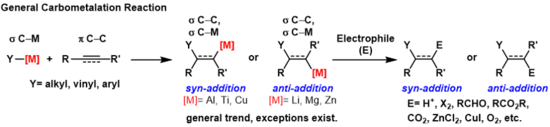
Карбометаллирование — это любая реакция , в которой связь углерод-металл реагирует с π-связью углерод-углерод с образованием новой σ-связи углерод-углерод и σ-связи углерод-металл. [1] Образующаяся связь углерод-металл может подвергаться дальнейшим реакциям карметаллирования (олигомеризации или полимеризации, см. Полимеризацию Циглера-Натта ) или может вступать в реакцию с различными электрофилами , включая галогенирующие реагенты, карбонилы , кислород и неорганические соли, с образованием различных металлоорганических реагентов. Карбометаллирование можно проводить на алкинах и алкенах с образованием продуктов с высокой геометрической чистотой или энантиоселективностью соответственно. Некоторые металлы предпочитают давать антиприсоединения продукт с высокой селективностью, а некоторые дают продукт синприсоединения. Выход продуктов син- и антиприсоединения определяется механизмом карбометаллирования.
Карбоборация
[ редактировать ]Карбоборирование — одна из наиболее универсальных реакций карбометаллирования. См . Карбоборация .
Карбоалюминирование
[ редактировать ]Реакция карбоалюминирования чаще всего катализируется дихлоридом цирконоцена (или родственным катализатором). Некоторые карбоалюминирования осуществляют с помощью титаноценовых комплексов. [1] Эту реакцию иногда называют асимметричным карбоалюминированием алкенов, катализируемым Zr (ZACA), или метилалюминированием алкинов, катализируемым Zr (ZMA). [2]

Наиболее распространенными триалкилалюминиевыми реагентами для этого превращения являются триметилалюминий , триэтилалюминий и иногда триизобутилалюминий . При использовании реагентов триалкилалюминия, содержащих бета-гидриды , реакции элиминирования и гидроалюминия становятся конкурирующими процессами. Общий механизм реакции ZMA можно описать как образование активных каталитических частиц из предварительного катализатора дихлорида цирконоцена в результате его реакции с триметилалюминием. Сначала происходит переметаллирование метила из алюминия в цирконий. Далее, абстракция хлоридов алюминием создает катионную разновидность циркония, которая тесно связана с анионным комплексом алюминия. Этот катион циркония может координировать алкен или алкин, где затем происходит мигрирующее внедрение метила. Полученные виниловые или алкилцирконийные частицы могут подвергаться обратимому, но стереоретенционному трансметаллированию алюминийорганическими соединениями с получением продукта карбоалюминирования и регенерации катализатора на основе дихлорида цирконоцена. Этот процесс обычно дает продукт син-дополнения; однако существуют условия для получения продукта против присоединения с помощью модифицированного механизма.
триметилсилилом Алкины, защищенные (ТМС), триметилгерманиевые алкины и концевые алкины могут образовывать продукты антикарбоалюминирования при комнатной температуре или повышенных температурах, если координационная группа находится поблизости на субстрате . [3] В этих реакциях первое син-карбоалюминирование происходит по ранее описанному механизму. Затем другой эквивалент алюминия, координированный с направляющей группой, может вытеснить винилалюминий, инвертируя геометрию углерода, где происходит смещение.
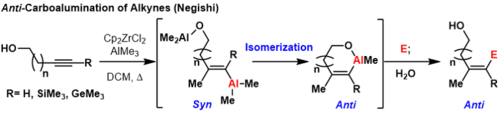
Это образует термодинамически выгодный металлоцикл , предотвращающий последующие инверсии. Формально этот процесс дает продукты антикарбоалюминирования, которые можно закалить электрофилами. Ограничением этой методологии является то, что направляющая группа должна находиться достаточно близко к π-связи углерод-углерод, чтобы образовать термодинамически выгодное кольцо, иначе будут образовываться смеси геометрических изомеров .
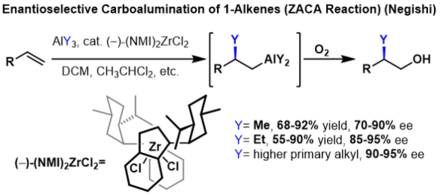
Карбоалюминирование алкенов с образованием замещенных алканов можно сделать энантиоселективным, если прохиральные использовать алкены. В этих реакциях хиральный инденилциркониевый для индукции энантиоселективности катализатор используется . В этих реакциях были получены высокие энантиоселективности для нескольких триалкилалюминиевых реагентов, однако выход резко снижается с каждым дополнительным углеродом алкильной цепи триалкилалюминиевого реагента. [2]
Карболитирование
[ редактировать ]
Карболитирование - это добавление литийорганического реагента по пи-связи углерод-углерод. Литийорганические реагенты, используемые в этом преобразовании, могут быть коммерческими (например, н-бутиллитий ) или могут быть получены путем депротонирования или обмена литий-галоген . [4] [5] Существуют как меж-, так и внутримолекулярные примеры карболитирования, которые можно использовать в синтезе для создания сложности. Литийорганические вещества являются высокореактивными химическими веществами, и часто образующийся в результате карболитирования литийорганический реагент может продолжать реагировать с электрофилами или оставшимся исходным материалом (что приводит к полимеризации ). [4] Эта реакция стала энантиоселективной. [6] [7] за счет использования спартеина , который может хелатировать ион лития и вызывать хиральность . [4] Сегодня это не распространенная стратегия из-за нехватки натурального спартеина. Однако недавние достижения в синтезе заменителей спартеина и их эффективное применение в карболитировании возобновили интерес к этой стратегии. [8]
Еще одной демонстрацией этого типа реакции является альтернативный путь к тамоксифену, начиная с дифенилацетилена и этиллития : [9] Улавливающим электрофилом здесь является триизопропилборат, образующий бороновую кислоту R–B(OH) 2 . Второй этап завершения тамоксифена — это реакция Сузуки .
Вследствие высокой реакционной способности литийорганических соединений как сильных оснований и сильных нуклеофилов , спектр субстратов карболитирования обычно ограничивается химическими веществами, которые не содержат кислотных или электрофильных функциональных групп .
Карбомагнезирование и карбоцинкирование
[ редактировать ]Из-за пониженной нуклеофильности реагентов Гриньяра (магнийорганических) и цинкорганических реагентов некаталитические реакции карбомагнезирования и карбоцинкирования обычно наблюдаются только на активированных или напряженных алкенах и алкинах. [10] Например, электроноакцепторные группы, такие как сложные эфиры , нитрилы или сульфоны, должны находиться в сопряжении с π-системой углерод-углерод (см. Реакцию Михаэля ), или направляющая группа, такая как спирт или амин, должна находиться поблизости, чтобы направлять реакцию. Эти реакции могут катализироваться различными переходными металлами, такими как железо, [10] [11] медь, [10] цирконий, [12] никель, [10] [13] кобальт [14] и другие.
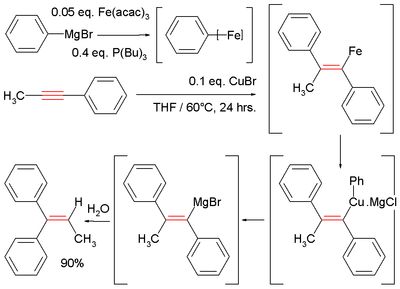
Показательной является катализируемая Fe реакция метилфенилацетилена с фенилмагнийбромидом , в результате которой образуется промежуточный винилмагний. Гидролиз дает дифенилалкен: [11] [15]
Карбопалладирование
[ редактировать ]Карбопалладирование может быть описанием элементарной стадии реакции, катализируемой палладиевым катализатором ( реакция Мизороки-Хека ). [16] а также может относиться к реакции карбометаллирования с палладиевым катализатором ( дифункционализация алкенов , [17] гидрофункционализация , [18] [19] или редуктивный Хек [20] )
Ссылки
[ редактировать ]- ^ Jump up to: а б Негиси, Эй-ичи; Тан, Зе (2005), «Диастереоселективные, энантиоселективные и региоселективные реакции карбоалюминирования, катализируемые производными цирконоцена», Металлоцены в регио- и стереоселективном синтезе: -/- , Темы металлоорганической химии, Springer Berlin Heidelberg, стр. 139–176, doi : 10.1007/b96003 , ISBN 9783540314523
- ^ Jump up to: а б Сюй, Шицин; Негиси, Эй-ити (18 октября 2016 г.). «Асимметричное карбоалюминирование неактивированных концевых алкенов, катализируемое цирконием». Отчеты о химических исследованиях . 49 (10): 2158–2168. doi : 10.1021/acs.accounts.6b00338 . ISSN 0001-4842 . PMID 27685327 .
- ^ Ма, Шэнмин; Негиси, Эй-ити (1 февраля 1997 г.). «Антикарбометаллирование гомопропаргиловых спиртов и их высших гомологов посредством неконтролируемого хелатированием син-карбометаллирования и изомеризации, контролируемой хелатированием». Журнал органической химии . 62 (4): 784–785. дои : 10.1021/jo9622688 . ISSN 0022-3263 .
- ^ Jump up to: а б с О'Ши, Донал Ф.; Хоган, Энн-Мари Л. (18 августа 2008 г.). «Синтетические применения карболитиационных превращений» . Химические коммуникации (33): 3839–3851. дои : 10.1039/B805595E . ISSN 1364-548X . ПМИД 18726011 .
- ^ Гарсиа, Грасиела В.; Нудельман, Норма Сбарбати (11 февраля 2009 г.). «Тандемные реакции с участием литийорганических реагентов. Обзор». Органические препараты и процедуры International . 35 (5): 445–500. дои : 10.1080/00304940309355860 . S2CID 98358106 .
- ^ Норсикян, Стефани; Марек, Илан; Нормант, Жан-Ф (27 октября 1997 г.). «Энантиоселективное карболитирование β-алкилированного стирола». Буквы тетраэдра . 38 (43): 7523–7526. дои : 10.1016/S0040-4039(97)10022-3 . ISSN 0040-4039 .
- ^ Норсикян, Стефани; Марек, Илан; Кляйн, Софи; Пуассон, Жан Ф.; Нормант, Жан Ф. (1999). «Энантиоселективное карбометаллирование производных циннамила: новый доступ к хиральным дизамещенным циклопропанам - конфигурационная стабильность бензилорганоцинкгалогенидов». Химия – Европейский журнал . 5 (7): 2055–2068. doi : 10.1002/(SICI)1521-3765(19990702)5:7<2055::AID-CHEM2055>3.0.CO;2-9 . ISSN 1521-3765 .
- ^ Тейт, Майкл; Доннард, Морган; Минасси, Альберто; Лефранк, Жюльен; Бечи, Беатрис; Карбоне, Джорджио; О'Брайен, Питер; Клейден, Джонатан (2013). «Амины, несущие третичные заместители, путем тандемного энантиоселективного карболитирования-перегруппировки винилмочевины» . Органические письма . 15 (1): 34–37. дои : 10.1021/ol3029324 . ISSN 1523-7060 . ПМИД 23252812 .
- ^ МакКинли, Неола Ф.; О'Ши, Донал Ф. (2006). «Карболитирование дифенилацетилена как стереоселективный путь к ( Z )-тамоксифену и родственным тетразамещенным олефинам». Дж. Орг. хим. (Примечание). 71 (25): 9552–9555. дои : 10.1021/jo061949s . ПМИД 17137396 .
- ^ Jump up to: а б с д Ёримицу, Хидеки; Мураками, Кей (11 февраля 2013 г.). «Последние достижения в области межмолекулярного карбомагнезирования и карбоцинкирования, катализируемого переходными металлами» . Журнал органической химии Бейльштейна . 9 (1): 278–302. дои : 10.3762/bjoc.9.34 . ISSN 1860-5397 . ПМК 3596116 . ПМИД 23503106 .
- ^ Jump up to: а б Сиракава, Эйдзи; Ямагами, Такафуми; Кимура, Такахиро; Ямагучи, Сигеру; Хаяси, Тамио (2005). «Арилмагнезирование алкинов, катализируемое совместно комплексами железа и меди». Дж. Ам. хим. Соц. (Коммуникация). 127 (49): 17164–17165. дои : 10.1021/ja0542136 . ПМИД 16332046 .
- ^ Негиси, Эйичи; Миллер, Джозеф А. (1 октября 1983 г.). «Селективное образование углерод-углеродной связи посредством катализа переходных металлов. 37. Контролируемое карбометаллирование. 16. Новые синтезы альфа, бета-ненасыщенных циклопентенонов посредством аллилцинкирования алкинов». Журнал Американского химического общества . 105 (22): 6761–6763. дои : 10.1021/ja00360a060 . ISSN 0002-7863 .
- ^ Сюэ, Фэй; Чжао, Цзинь; Хор, Т.С. Энди; Хаяси, Тамио (11 марта 2015 г.). «Никель-катализируемые трехкомпонентные домино-реакции арильных реагентов Гриньяра, алкинов и арилгалогенидов с образованием тетразамещенных алкенов». Журнал Американского химического общества . 137 (9): 3189–3192. дои : 10.1021/ja513166w . ISSN 0002-7863 . ПМИД 25714497 .
- ^ Мураками, Кей; Ёримицу, Хидеки; Осима, Коитиро (2010). «Кобальт-катализируемое бензилцинкирование алкинов». Химия – Европейский журнал . 16 (26): 7688–7691. дои : 10.1002/chem.201001061 . ISSN 1521-3765 . ПМИД 20521290 .
- ^ В этой реакции реактив Гриньяра соединяется с ацетилацетонатом железа и трибутилфосфином с образованием нечетко определенного промежуточного соединения арилирона , которое затем реагирует с хлоридом меди (I) - промежуточным купратом .
- ^ Негиси, Эй-ичи; Копере, Кристоф; Ма, Шэнмин; Лиу, Шоу-Йи; Лю, Фанг (январь 1996 г.). «Циклическое карбопалладирование. Универсальная синтетическая методология построения циклических органических соединений». Химические обзоры . 96 (1): 365–394. дои : 10.1021/cr950020x . ISSN 0009-2665 . ПМИД 11848757 .
- ^ Сигман, Мэтью С.; Дженсен, Катрина Х. (30 октября 2008 г.). «Механистические подходы к реакциям дифункционализации алкенов, катализируемым палладием» . Органическая и биомолекулярная химия . 6 (22): 4083–4088. дои : 10.1039/B813246A . ISSN 1477-0539 . ПМЦ 2656348 . ПМИД 18972034 .
- ^ Энгл, Кири М.; Макэлпайн, Индраван; Марстерс, Рохан П.; Ван, Фен; Он, Минъин; Ян, Шулян; Гальего, Гэри М.; Ян, Кин С.; Хилл, Дэвид Э. (14 ноября 2018 г.). «Катализируемое палладием (II) γ-селективное гидроарилирование алкенилкарбонильных соединений арилбороновыми кислотами» . Химическая наука . 9 (44): 8363–8368. дои : 10.1039/C8SC03081B . ISSN 2041-6539 . ПМК 6247822 . ПМИД 30542583 .
- ^ О'Дуилл, Мириам Л.; Мацуура, Рей; Ван, Яньян; Тернбулл, Джошуа Л.; Гурак, Джон А.; Гао, Де-Вэй; Лу, Банда; Лю, Пэн; Энгл, Кири М. (08 ноября 2017 г.). «Тридентатные направляющие группы стабилизируют 6-членные палладациклы при каталитической гидрофункционализации алкенов» . Журнал Американского химического общества . 139 (44): 15576–15579. дои : 10.1021/jacs.7b08383 . ISSN 0002-7863 . ПМК 6002750 . ПМИД 28972751 .
- ^ Гурак, Джон А.; Энгл, Кири М. (05 октября 2018 г.). «Практическое межмолекулярное гидроарилирование разнообразных алкенов посредством восстановительного взаимодействия Хека» . АКС-катализ . 8 (10): 8987–8992. дои : 10.1021/acscatal.8b02717 . ПМК 6207086 . ПМИД 30393575 .