Штамм (химия)
В химии молекула , которое испытывает напряжение , когда ее химическая структура подвергается некоторому напряжению увеличивает ее внутреннюю энергию не имеющим деформации по сравнению с эталонным соединением, . молекулы Внутренняя энергия состоит из всей энергии, запасенной в ней. Напряженная молекула обладает дополнительным количеством внутренней энергии, которого нет у ненапряженной молекулы. Эту дополнительную внутреннюю энергию, или энергию деформации , можно сравнить со сжатой пружиной . [1] Подобно тому, как сжатую пружину необходимо удерживать на месте, чтобы предотвратить высвобождение ее потенциальной энергии , молекула может удерживаться в энергетически неблагоприятной конформации за счет связей внутри этой молекулы. Без связей, удерживающих конформацию, энергия деформации высвобождалась бы.
Краткое содержание
[ редактировать ]Термодинамика
[ редактировать ]Равновесие . двух молекулярных конформаций определяется разницей в свободной энергии Гиббса двух конформаций По этой разнице энергий можно определить константу равновесия для двух конформаций.
Если происходит уменьшение свободной энергии Гиббса из одного состояния в другое, это преобразование является спонтанным , и состояние с более низкой энергией является более стабильным . Сильно напряженная молекулярная конформация с более высокой энергией спонтанно преобразуется в молекулярную конформацию с более низкой энергией.

Энтальпия и энтропия связаны со свободной энергией Гиббса уравнением (при постоянной температуре ):
Энтальпия обычно является более важной термодинамической функцией для определения более стабильной молекулярной конформации. [1] Хотя существуют разные типы деформации, энергия деформации, связанная со всеми ними, обусловлена ослаблением связей внутри молекулы. Поскольку энтальпия обычно более важна, энтропию часто можно игнорировать. [1] Это не всегда так; если разница в энтальпии невелика, энтропия может оказать большее влияние на равновесие. Например, н-бутан имеет две возможные конформации: анти и гош . Антиконформация более стабильна на 0,9 ккал моль. −1 . [1] Мы ожидаем, что бутан примерно на 82% состоит из анти и на 18% при комнатной температуре. Однако существуют две возможные конформации гош и только одна антиконформация. Следовательно, вклад энтропии составляет 0,4 ккал в пользу конформации гош. [2] Мы обнаружили, что фактическое конформационное распределение бутана составляет 70% анти и 30% гош при комнатной температуре.
Определение молекулярной деформации
[ редактировать ]
Стандартная теплота образования (Δ f H °) соединения описывается как изменение энтальпии, когда соединение образуется из отдельных элементов. [3] Когда теплота образования соединения отличается от прогнозируемой или от эталонного соединения, эту разницу часто можно объяснить напряжением. Например, Δ f H ° для циклогексана составляет -29,9 ккал моль. −1 тогда как Δ f H ° для метилциклопентана составляет -25,5 ккал моль. −1 . [1] Несмотря на то же количество атомов и количества связей, метилциклопентан имеет более высокую энергию, чем циклогексан. Эту разницу в энергии можно объяснить кольцевой деформацией пятичленного цикла, которого нет в циклогексане. Экспериментально энергию деформации часто определяют с использованием теплоты сгорания , что обычно является простым экспериментом.
Определение энергии деформации внутри молекулы требует знания ожидаемой внутренней энергии без деформации. Есть два способа сделать это. Во-первых, его можно сравнить с аналогичным соединением, которому не хватает напряжения, например, с предыдущим примером с метилциклогексаном . К сожалению, зачастую бывает трудно получить подходящее соединение. Альтернативой является использование теории приращения группы Бенсона . Пока для атомов внутри соединения доступны подходящие приращения групп, прогноз Δ f H можно сделать °. Если экспериментальное Δf H ° отличается от прогнозируемого Δf H °, то эту разницу в энергии можно отнести к энергии деформации.
Виды штамма
[ редактировать ]Штамм Ван дер Ваальса
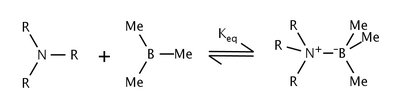
[ редактировать ]Деформация Ван-дер-Ваальса , или стерическая деформация, возникает, когда атомы вынуждены приближаться ближе, чем позволяют их радиусы Ван-дер-Ваальса . [4] : 5 В частности, деформация Ван-дер-Ваальса считается формой деформации, при которой взаимодействующие атомы находятся на расстоянии не менее четырех связей друг от друга. [5] Величина стерической деформации в подобных молекулах зависит от размера взаимодействующих групп; объемные трет-бутильные группы занимают гораздо больше места, чем метильные группы , и часто испытывают более сильные стерические взаимодействия.
Эффекты стерического напряжения в реакции триалкиламинов и триметилбора изучал нобелевский лауреат Герберт С. Браун и др. [6] Они обнаружили, что с увеличением размера алкильных групп амина константа равновесия также уменьшается. Смещение равновесия было объяснено стерическим напряжением между алкильными группами амина и метильными группами бора.
Синпентановый штамм
[ редактировать ]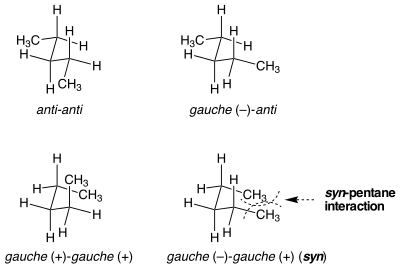
Бывают ситуации, когда, казалось бы, одинаковые конформации не равны по энергии деформации. Синпентановый штамм является примером такой ситуации. Существует два разных способа перевести обе центральные связи в н -пентане в конформацию гош, один из которых составляет 3 ккал моль. −1 выше по энергии, чем другой. [1] Когда две метилзамещенные связи поворачиваются от анти к гош в противоположных направлениях, молекула принимает конформацию , подобную циклопентану , в которой две концевые метильные группы сближаются. Если связи повернуты в одном направлении, этого не происходит. Стерическое напряжение между двумя концевыми метильными группами объясняет разницу в энергии между двумя похожими, но очень разными конформациями.
Аллильный штамм
[ редактировать ]
Аллильный штамм, или А 1,3 штамм тесно связан с синпентановым штаммом. Пример аллильного штамма можно увидеть в соединении 2-пентена . может Этильный заместитель олефина вращаться так, что концевая метильная группа приближается к вицинальной метильной группе олефина. Эти типы соединений обычно принимают более линейную конформацию, чтобы избежать стерического напряжения между заместителями. [1]
1,3-диаксиальная деформация
[ редактировать ]1,3-диаксиальная деформация — еще одна форма деформации, похожая на синпентан. В этом случае деформация возникает за счет стерических взаимодействий между заместителем циклогексанового кольца («α») и гош-взаимодействий между альфа-заместителем и обоими метиленовыми атомами углерода на расстоянии двух связей от рассматриваемого заместителя (следовательно, 1,3-диаксиальный взаимодействия). [4] : 10 Когда заместитель является аксиальным , он приближается к аксиальному гамма-водороду. Величина напряжения во многом зависит от размера заместителя и может быть уменьшена путем формирования конформации основного кресла, помещающей заместитель в экваториальное положение. Разница в энергии между конформациями называется величиной А и хорошо известна для многих различных заместителей. Значение A является термодинамическим параметром и первоначально измерялось наряду с другими методами с использованием уравнения свободной энергии Гиббса и, например, равновесия восстановления Меервейна-Понндорфа-Верли / окисления Оппенауэра для измерения аксиальных и экваториальных значений циклогексанона/циклогексанола ( 0,7 ккал моль −1 ). [7]
Крутильная деформация
[ редактировать ]Деформация при кручении – это сопротивление скручиванию связи. В циклических молекулах его еще называют штаммом Питцера .
Деформация кручения возникает, когда атомы, разделенные тремя связями, помещаются в затменную конформацию вместо более стабильной шахматной конформации. Барьер вращения между шахматными конформациями этана составляет примерно 2,9 ккал моль. −1 . [1] Первоначально считалось, что барьер вращения возникает из-за стерических взаимодействий между вицинальными атомами водорода, но радиус Ван-дер-Ваальса водорода слишком мал, чтобы это могло быть так. Недавние исследования показали, что шахматная конформация может быть более стабильной из-за гиперконъюгативного эффекта . [8] Вращение от шахматной конформации прерывает эту стабилизирующую силу.
Более сложные молекулы, такие как бутан, имеют более одной возможной шахматной конформации. Антиконформация бутана составляет примерно 0,9 ккал моль. −1 (3,8 кДж моль −1 ) более стабильна, чем конформация гош. [1] Обе эти шахматные конформации гораздо более стабильны, чем затменные. Вместо гиперконъюгативного эффекта, такого как в этане , энергия деформации в бутане обусловлена как стерическими взаимодействиями между метильными группами , так и угловой деформацией, вызванной этими взаимодействиями.
Кольцевая деформация
[ редактировать ]Согласно теории молекулярной связи VSEPR , предпочтительной геометрией молекулы является та, при которой как связывающие, так и несвязывающие электроны находятся как можно дальше друг от друга. В молекулах эти углы довольно часто несколько сжимаются или расширяются по сравнению с их оптимальным значением. Эта деформация называется угловой деформацией или деформацией Байера. [9] Простейшими примерами угловой деформации являются небольшие циклоалканы, такие как циклопропан и циклобутан, которые обсуждаются ниже. Кроме того, в циклических системах часто наблюдается затмение или деформация Питцера . Эти и возможные трансаннулярные взаимодействия были ранее обобщены Х. К. Брауном как внутренняя деформация, или I-деформация. [10] Молекулярная механика или подходы силового поля позволяют рассчитать такие вклады деформации, которые затем можно соотнести, например, со скоростями реакций или равновесиями. Многие реакции алициклических соединений, включая реакции равновесия, окислительно-восстановительные реакции и реакции сольволиза, которые характеризуются переходом между состояниями sp2 и sp3 в реакционном центре, коррелируют с соответствующими различиями в энергиях деформации SI (sp2 -sp3). [11] Данные отражают в основном неблагоприятные вицинальные углы в средних кольцах, что иллюстрируется резким увеличением скорости восстановления кетонов с увеличением SI (рис. 1). Другим примером является сольволиз тозилатов-мостиков с разницей в стерической энергии между соответствующими производными бромида (sp3) и ионом карбения как sp2-моделью переходного состояния . [12] (рис. 2)


| Размер кольца | Энергия деформации (ккал моль −1 ) | Размер кольца | Энергия деформации (ккал моль −1 ) | |
|---|---|---|---|---|
| 3 | 27.5 | 10 | 12.4 | |
| 4 | 26.3 | 11 | 11.3 | |
| 5 | 6.2 | 12 | 4.1 | |
| 6 | 0.1 | 13 | 5.2 | |
| 7 | 6.2 | 14 | 1.9 | |
| 8 | 9.7 | 15 | 1.9 | |
| 9 | 12.6 | 16 | 2.0 |
В принципе, угловая деформация может возникать в ациклических соединениях, но это явление встречается редко.
Маленькие кольца
[ редактировать ]Циклогексан считается эталоном при определении деформации кольца в циклоалканах, и общепринято, что энергия деформации практически отсутствует. [1] Для сравнения, циклоалканы меньшего размера имеют гораздо большую энергию из-за повышенной деформации. Циклоппропан аналогичен треугольнику и, следовательно, имеет валентный угол 60 °, что намного ниже предпочтительных 109,5 ° sp. 3 гибридизированный углерод. Кроме того, водороды в циклопропане затмеваются. Циклобутан испытывает аналогичную деформацию: валентные углы составляют примерно 88° (он не полностью плоский) и затмевают атомы водорода. Энергия деформации циклопропана и циклобутана составляет 27,5 и 26,3 ккал-моль. −1 , соответственно. [1] Циклопентан испытывает гораздо меньшую деформацию, в основном из-за деформации кручения от затменных водородов: его предпочтительные конформации взаимно преобразуются в результате процесса, называемого псевдовращением . [4] : 14
деформация кольца может быть значительно выше В бициклических системах . Например, бициклобутан C 4 H 6 известен как одно из наиболее напряженных соединений, которые можно выделить в больших масштабах; энергия его деформации оценивается в 63,9 ккал-моль. −1 (267 кДж моль −1 ). [13] [14]
Трансаннулярная деформация
[ редактировать ]Кольца среднего размера (7–13 атомов углерода) испытывают большую энергию деформации, чем циклогексан, главным образом из-за отклонения от идеальных вицинальных углов или деформации Питцера. Расчеты молекулярной механики показывают, что трансаннулярная деформация, также известная как прелог-деформация , не играет существенной роли. Однако трансаннулярные реакции, такие как 1,5-сдвиг в реакциях замещения циклооктана, хорошо известны.
Бициклические системы
[ редактировать ]Величина энергии деформации в бициклических системах обычно представляет собой сумму энергии деформации в каждом отдельном кольце. [1] Это не всегда так, поскольку иногда слияние колец вызывает дополнительную нагрузку.
Напряжение в аллостерических системах
[ редактировать ]В синтетических аллостерических системах обычно имеется два или более конформеров с различиями в стабильности из-за вклада деформации. Положительная кооперативность, например, является результатом повышенного связывания субстрата А с конформером С2, которое образуется в результате связывания эффекторной молекулы Е. Если конформер С2 имеет такую же стабильность, как и другой уравновешивающий конформер С1, подгонка, индуцированная субстратом А, приведет к связывание A с C2 также в отсутствие эффектора E. Только если стабильность конформера C2 значительно меньше, то есть в отсутствие эффектора E популяция C2 намного меньше, чем популяция C1, соотношение K2/K1 который измеряет эффективность аллостерического сигнала, увеличится. Отношение K2/K1 может быть напрямую связано с разницей энергий деформации между конформерами C1 и C2; если он небольшой, более высокие концентрации A будут напрямую связываться с C2 и делать эффектор E неэффективным. Кроме того, время срабатывания таких аллостерических переключателей зависит от напряжения состояния взаимопревращающих переходов конформеров. [15]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час я дж к л м Анслин и Догерти, Современная физическая органическая химия , Университетские научные книги, 2006 г., ISBN 978-1-891389-31-3
- ^ Коксон и Норман, Принципы органического синтеза , 3-е изд., Blackie Academic & Pro., 1993, ISBN 978-0-7514-0126-4
- ^ Левин, Физическая химия , 5-е изд., McGraw-Hill, 2002, ISBN 978-0-07-253495-5
- ^ Перейти обратно: а б с Драгойлович, Велько (2015). «Конформационный анализ циклоалканов» (PDF) . Химтексты . 1 (3). дои : 10.1007/s40828-015-0014-0 . S2CID 94348487 .
- ^ Браун, Фут и Айверсон, Органическая химия , 4-е изд., Брукс/Коул, 2005, ISBN 978-0-534-46773-9
- ^ Браун, ХК ; Йоханнесен, РБ (1952). «Диссоциация соединений присоединения триметилбора с н -бутил- и неопентилдиметиламинами. Взаимодействие триметилбора и трифторида бора с сильно затрудненными основаниями». Дж. Ам. хим. Соц. 75 : 16–20. дои : 10.1021/ja01097a005 .
- ^ Элиэль, Э.Л., Вилен, С.Х., Стереохимия органических соединений, Wiley-Interscience, 1994.
- ^ Вейнхольд, Ф. (2001). «Химия: новый взгляд на форму молекул». Природа . 411 (6837): 539–541. дои : 10.1038/35079225 . ПМИД 11385553 . S2CID 9812878 .
- ^ Виберг, К. (1986). «Понятие деформации в органической химии». Энджью. хим. Межд. Эд. англ. 25 (4): 312–322. дои : 10.1002/anie.198603121 .
- ^ Х.К. Браун, Р.С. Флетчер, Р.Б. Йоханнес Дж. Ам. хим. Соц. 1951, 73, 212. https://pubs.acs.org/doi/pdf/10.1021/ja01145a072 DOI: 10.1021/ja01145a072; Х.К. Браун, Г. Хэм Дж. Ам. хим. Соц. 1956 , 78, 2735 https://pubs.acs.org/doi/pdf/10.1021/ja01593a024
- ^ Х.-Дж. Шнайдер, Г. Шмидт, Ф. Томас Дж. Ам. хим. Соц. 1983 , 105, 3556. https://pubs.acs.org/doi/pdf/10.1021/ja00349a031.
- ^ П. Мюллер, Дж. Мареда, Д. Милин J. Phys.Org. хим. , 1995 , 8, 507. https://onlinelibrary.wiley.com/doi/epdf/10.1002/poc.610080802.
- ^ Виберг, КБ (1968). Малокольцевые бицикло[ н.м.0 ] « алканы». В Харте, Х.; Карабацос, Дж.Дж. (ред.). Достижения в алициклической химии . Том. 2. Академическая пресса . стр. 185–254. ISBN 9781483224213 .
- ^ Виберг, КБ ; Лэмпман, генеральный директор; Чуула, РП; Коннор, DS; Шертлер, П.; Лаваниш, Дж. (1965). «Бицикло[1.1.0]бутан». Тетраэдр . 21 (10): 2749–2769. дои : 10.1016/S0040-4020(01)98361-9 .
- ^ Х.-Дж. Шнайдер. Орг. Биомол. хим. 2016 , 14, 7994. https://pubs.rsc.org/en/content/articlepdf/2016/ob/c6ob01303a.

