Теория кристаллического поля
В молекулярной физике теория кристаллического поля ( CFT ) описывает нарушение вырождений электронных орбитальных состояний, обычно d- или f -орбиталей, из-за статического электрического поля, создаваемого окружающим распределением заряда (соседями анионов). Эта теория использовалась для описания различных спектроскопий переходных металлов координационных комплексов , в частности оптических спектров (цветов). CFT успешно объясняет некоторые магнитные свойства, цвета , гидратации энтальпии и шпинельные структуры комплексов переходных металлов, но не пытается описать связь. CFT был разработан физиками Гансом Бете. [1] и Джон Хасбрук ван Флек [2] в 1930-е годы. Впоследствии CFT была объединена с теорией молекулярных орбиталей, чтобы сформировать более реалистичную и сложную теорию поля лигандов (LFT), которая дает представление о процессе химической связи в комплексах переходных металлов. CFT может еще больше усложниться, если нарушить предположения об относительных энергиях орбиталей металлов и лигандов, что потребует использования теории поля обращенных лигандов (ILFT) для лучшего описания связей.
Обзор [ править ]
Согласно теории кристаллического поля, взаимодействие между переходным металлом и лигандами возникает в результате притяжения положительно заряженного катиона металла и отрицательного заряда несвязывающих электронов лиганда. Теория развита путем рассмотрения изменений энергии пяти вырожденных d -орбиталей при их окружении массивом точечных зарядов, состоящих из лигандов. Когда лиганд приближается к иону металла, электроны лиганда будут ближе к некоторым d -орбиталям и дальше от других, вызывая потерю вырождения. Электроны на d -орбиталях и электроны лиганда отталкиваются друг от друга из-за отталкивания одноименных зарядов. Таким образом, d-электроны, расположенные ближе к лигандам, будут иметь более высокую энергию, чем те, которые находятся дальше, что приводит к расщеплению d -орбиталей по энергии. На такое разделение влияют следующие факторы:
- природа иона металла.
- степень окисления металла. Более высокая степень окисления приводит к большему расщеплению относительно сферического поля.
- расположение лигандов вокруг иона металла.
- координационное число металла (т.е. тетраэдрическое, октаэдрическое...)
- природа лигандов, окружающих ион металла. Чем сильнее влияние лигандов, тем больше разница между высоко- и низкоэнергетическими d- группами.
Наиболее распространенный тип комплекса — октаэдрический , в котором шесть лигандов образуют вершины октаэдра вокруг иона металла. В октаэдрической симметрии d -орбитали разделяются на два набора с разницей в энергии Δ окт ( параметр расщепления кристаллического поля , также обычно обозначаемый 10 Dq , что в десять раз превышает «дифференциал квантов»). [3] [4] ), где орбитали d xy , d xz и d yz будут ниже по энергии, чем d z 2 и d х 2 - и 2 , который будет иметь более высокую энергию, поскольку первая группа находится дальше от лигандов, чем вторая, и поэтому испытывает меньшее отталкивание. Три орбитали с более низкой энергией вместе называются t 2g , а две орбитали с более высокой энергией - как , например, g . Эти метки основаны на теории молекулярной симметрии : это названия неприводимых представлений октаэдрической точечной группы Oh . (см. ) Oh таблицу символов . Типичные диаграммы орбитальной энергии приведены ниже в разделе Высокоспиновые и низкие -вращаться.
Тетраэдрические комплексы - второй по распространенности тип; здесь четыре лиганда образуют тетраэдр вокруг иона металла. При расщеплении тетраэдрического кристаллического поля d -орбитали снова разделяются на две группы с разницей в Δtet энергии . Нижние энергетические орбитали будут d z 2 и d х 2 - и 2 , а орбитали более высоких энергий будут d xy , d xz и d yz - противоположно октаэдрическому случаю. Кроме того, поскольку электроны лиганда в тетраэдрической симметрии не ориентированы непосредственно к d -орбиталям, энергетическое расщепление будет ниже, чем в октаэдрическом случае. Плоские квадраты и другие сложные геометрические формы также могут быть описаны с помощью CFT.
Размер зазора Δ между двумя или более наборами орбиталей зависит от нескольких факторов, включая лиганды и геометрию комплекса. Некоторые лиганды всегда дают небольшое значение Δ, тогда как другие всегда дают большое расщепление. Причины этого можно объяснить теорией поля лигандов . Спектрохимический ряд представляет собой полученный эмпирическим путем список лигандов, упорядоченный по размеру расщепления Δ, которое они производят (от малого Δ до большого Δ; см. также эту таблицу ):
я − < Бр − < С 2− < СКН − (S-связь) < Cl − < НЕТ 3 − < Н 3 − < Ф − < ОН − < С 2 О 4 2− < H 2 O < NCS − (N–связь) < CH 3 CN < py < NH 3 < en < 2,2'-бипиридин < phen < NO 2 − < ПФ 3 < CN − < ЧТО .
Полезно отметить, что лиганды, вызывающие наибольшее расщепление, — это те, которые могут образовывать обратную связь между металлом и лигандом .
Степень окисления металла также влияет на величину Δ между высокими и низкими энергетическими уровнями. По мере увеличения степени окисления данного металла величина Δ увеличивается. средний 3+ комплекс будет иметь большее Δ, чем V 2+ комплекс для данного набора лигандов, поскольку разница в плотности заряда позволяет лигандам быть ближе к V 3+ ион, чем V 2+ ион. Меньшее расстояние между лигандом и ионом металла приводит к увеличению Δ, поскольку электроны лиганда и металла расположены ближе друг к другу и, следовательно, сильнее отталкиваются.
Высокоспиновые и низкоспиновые [ править ]

Лиганды, которые вызывают большое расщепление Δ d -орбиталей, называются лигандами сильного поля, например CN − и CO из спектрохимического ряда . В комплексах с этими лигандами невыгодно переводить электроны на высокоэнергетические орбитали. Следовательно, нижние энергетические орбитали полностью заполняются до начала заселения верхних множеств по принципу Ауфбау . Такие комплексы называются «низкоспиновыми». Например, НЕТ 2 − является лигандом сильного поля и дает большое Δ. Октаэдрический ион [Fe(NO 2 ) 6 ] 3− , который имеет 5 d -электронов, будет иметь октаэдрическую диаграмму расщепления, показанную справа, со всеми пятью электронами на уровне t 2 g . Следовательно, это состояние с низким спином не подчиняется правилу Хунда .

И наоборот, лиганды (например, I − и Бр − ), которые вызывают небольшое расщепление Δ d -орбиталей, называются лигандами слабого поля. В этом случае легче поместить электроны на набор орбиталей с более высокой энергией, чем поместить два электрона на одну и ту же низкоэнергетическую орбиталь, потому что два электрона на одной и той же орбитали отталкивают друг друга. -орбиталей помещается один электрон Таким образом, в соответствии с правилом Хунда на каждую из пяти d , и «высокоспиновые» комплексы образуются до того, как произойдет какое-либо спаривание. Например, Бр − является лигандом слабого поля и дает небольшое Δ окт . Итак, ион [FeBr 6 ] 3− , опять же с пятью d -электронами, будет иметь октаэдрическую диаграмму расщепления, где все пять орбиталей заняты по отдельности.
Чтобы произошло низкоспиновое расщепление, энергетические затраты на размещение электрона на уже единственной занятой орбитали должны быть меньше, чем стоимость размещения дополнительного электрона на, например, g- орбитали при энергетической стоимости Δ. Как отмечалось выше, например, g относится к д з 2 и d х 2 - и 2 которые по энергии выше, чем t 2g в октаэдрических комплексах. Если энергия, необходимая для спаривания двух электронов, больше, чем Δ, происходит энергетическая стоимость размещения электрона, например, в сильном спиновом расщеплении.
Энергия расщепления кристаллического поля для тетраэдрических комплексов металлов (четыре лиганда) обозначается как Δtet и примерно равна 4/9Δoct ( для того же металла и тех же лигандов). Следовательно, энергия, необходимая для спаривания двух электронов, обычно выше, чем энергия, необходимая для размещения электронов на орбиталях с более высокой энергией. Таким образом, тетраэдрические комплексы обычно являются высокоспиновыми.
Использование этих диаграмм расщепления может помочь в прогнозировании магнитных свойств координационных соединений. Соединение, в диаграмме расщепления которого есть неспаренные электроны, будет парамагнитным и будет притягиваться магнитными полями, тогда как соединение, в диаграмме расщепления которого отсутствуют неспаренные электроны, будет диамагнитным и будет слабо отталкиваться магнитным полем.
Энергия стабилизации [ править ]
Энергия стабилизации кристаллического поля (CFSE) — это стабильность, возникающая в результате помещения иона переходного металла в кристаллическое поле, создаваемое набором лигандов. Оно возникает из-за того, что при d -орбиталей расщеплении в поле лиганда (как описано выше) некоторые из них становятся более низкими по энергии, чем раньше, по отношению к сферическому полю, известному как барицентр, в котором все пять d -орбиталей вырождаются. Например, в октаэдрическом случае набор t 2g становится ниже по энергии, чем орбитали в барицентре. В результате, если на этих орбиталях есть электроны, ион металла более стабилен в поле лиганда относительно барицентра на величину, известную как CFSE. И наоборот, eg - орбитали (в октаэдрическом случае) имеют более высокую энергию, чем в барицентре, поэтому помещение в них электронов уменьшает количество CFSE.

Если расщепление d -орбиталей в октаэдрическом поле равно Δoct , три t2g - орбитали стабилизируются относительно барицентра за счет 2 / 5 ∆oct g , а e орбитали дестабилизируются 3 / 5 Δ окт . В качестве примера рассмотрим два d 5 конфигурации, показанные далее вверх по странице. В примере с низким спином (вверху) пять электронов на орбиталях t 2g , поэтому общий CFSE равен 5 x 2 / 5 Δ окт = 2Δ окт . В высокоспиновом (нижнем) примере CFSE равен (3 x 2 / 5 Δ окт ) - (2 х 3 / 5 Δoct ) = 0 – в этом случае стабилизация, создаваемая электронами на нижних орбиталях , нивелируется дестабилизирующим действием электронов на верхних орбиталях.
Оптические свойства [ править ]
Оптические свойства (детали спектров поглощения и излучения) многих координационных комплексов можно объяснить с помощью теории кристаллического поля. Однако часто более глубокие цвета металлокомплексов возникают в результате более интенсивных возбуждений с переносом заряда . [5]
Геометрии и диаграммы расщепления [ править ]
| Имя | Форма | Энергетическая диаграмма |
|---|---|---|
| Октаэдрический |  | 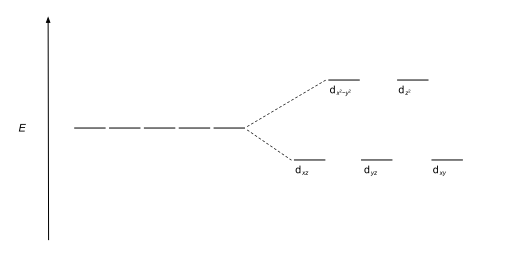 |
| Пятиугольная бипирамида |  | 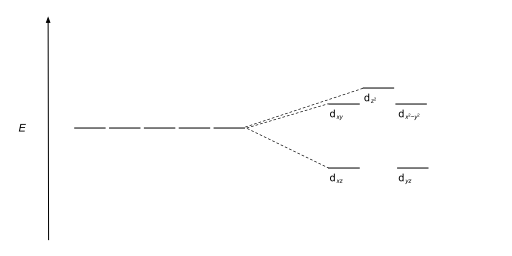 |
| Квадратный антипризматический |  | 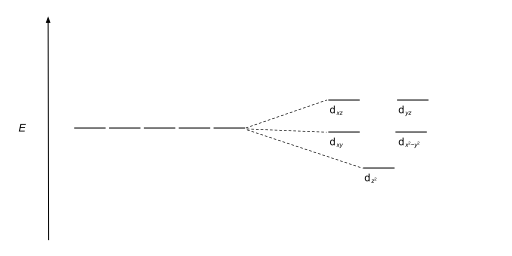 |
| Квадратный плоский |  | 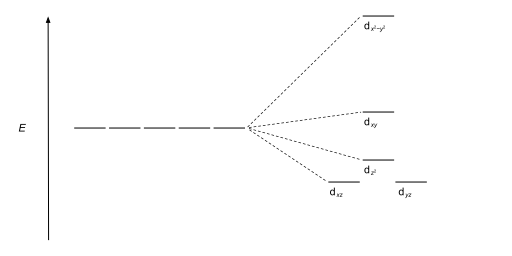 |
| Квадратно-пирамидальный |  | 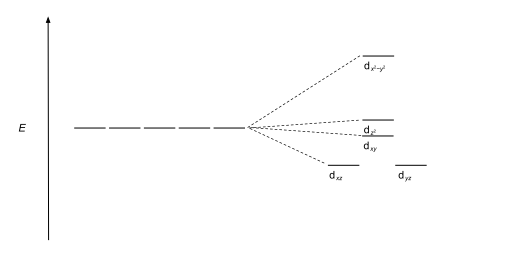 |
| Тетраэдрический |  | 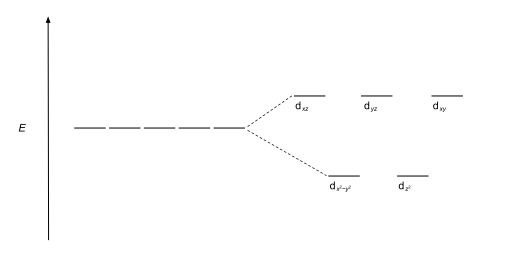 |
| Треугольная бипирамида |  | 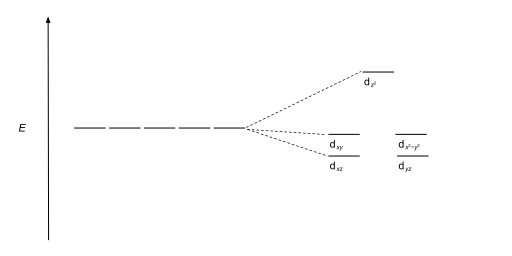 |
См. также [ править ]
- Аномалия Шоттки — низкотемпературный всплеск теплоемкости , наблюдаемый в материалах, содержащих высокоспиновые магнитные примеси, часто из-за расщепления кристаллического поля.
- Теория поля лигандов
- Теория молекулярных орбиталей
Ссылки [ править ]
- ^ Бете, Х. (1929). «Термин расщепления в кристаллах». Анналы физики (на немецком языке). 395 (2): 133–208. Бибкод : 1929АнП...395..133Б . дои : 10.1002/andp.19293950202 . ISSN 1521-3889 .
- ^ Ван Флек, Дж. (1932). «Теория изменений парамагнитной анизотропии среди различных солей группы железа». Физический обзор . 41 (2): 208–215. Бибкод : 1932PhRv...41..208V . дои : 10.1103/PhysRev.41.208 .
- ^ Пенни, Уильям Г.; Шлапп, Роберт (1932). «Влияние кристаллических полей на восприимчивость солей парамагнитных ионов. I. Редкоземельные элементы, особенно Pr и Nd». Физический обзор . 41 (2): 194–207. Бибкод : 1932PhRv...41..194P . дои : 10.1103/PhysRev.41.194 . ISSN 0031-899X .
- ^ Шлапп, Роберт; Пенни, Уильям Г. (1932). «Влияние кристаллических полей на восприимчивость солей парамагнитных ионов. II. Группа железа, особенно Ni, Cr и Co». Физический обзор . 42 (5): 666–686. Бибкод : 1932PhRv...42..666S . дои : 10.1103/PhysRev.42.666 . ISSN 0031-899X . \
- ^ Г.Л. Мисслер и Д.А. Тарр «Неорганическая химия» 2-е изд. (Прентис Холл, 1999), стр.379. ISBN 0-13-841891-8 .
Дальнейшее чтение [ править ]
- Хаускрофт, CE; Шарп, АГ (2004). Неорганическая химия (2-е изд.). Прентис Холл. ISBN 978-0-13-039913-7 .
- Мисслер, Г.Л.; Тарр, Д.А. (2003). Неорганическая химия (3-е изд.). Пирсон Прентис Холл. ISBN 978-0-13-035471-6 .
- Оргел, Лесли Э. (1960). Введение в химию переходных металлов: теория поля лиганда . Метуэн. ISBN 978-0416634402 .
- Шрайвер, DF; Аткинс, PW (2001). Неорганическая химия (4-е изд.). Издательство Оксфордского университета. стр. 227–236. ISBN 978-0-8412-3849-7 .
- Зильберберг, Мартин С (2006). Химия: молекулярная природа материи и изменений (4-е изд.). Нью-Йорк: Компания McGraw Hill. стр. 1028–1034 . ISBN 978-0-8151-8505-5 .
- Зумдал, Стивен С. (2005). Химические принципы (5-е изд.). Компания Хоутон Миффлин. стр. 550–551, 957–964 . ISBN 978-0-669-39321-7 .
Внешние ссылки [ править ]
- Теория кристаллического поля, метод сильной связи и эффект Яна-Теллера в книге Э. Паварини, Э. Коха, Ф. Андерса и М. Джаррелла (ред.): Коррелированные электроны: от моделей к материалам, Юлих, 2012 г., ISBN 978-3-89336-796-2