Хлороуксусная кислота
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Хлороуксусная кислота | |
| Систематическое название ИЮПАК Хлорэтаноловая кислота | |
| Другие имена 2-хлоруксусная кислота 2-хлорэтаноловая кислота | |
| Идентификаторы | |
3D model ( JSmol ) | |
| 3DMeet | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.001.072 |
| Номер ЕС |
|
| КЕГГ | |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| ClCH 2 CO 2 H | |
| Молярная масса | 94.49 g·mol −1 |
| Появление | Бесцветные или белые кристаллы |
| Плотность | 1,58 г/см 3 |
| Температура плавления | 63 ° C (145 ° F; 336 К) |
| Точка кипения | 189,3 ° С (372,7 ° F; 462,4 К) |
| 85,8 г/(100 мл) (25 °С) | |
| Растворимость | Растворим в метаноле , ацетоне , диэтиловом эфире , бензоле , хлороформе , этаноле. |
| войти P | 0.22 |
| Давление пара | 0,22 гПа |
| Кислотность ( pKa ) | 2.86 [1] |
| −48.1 × 10 −6 см 3 /моль | |
Показатель преломления ( n D ) | 1,4351 (55 °С) |
| Структура | |
| Моноклиника | |
| Термохимия | |
Теплоемкость ( С ) | 144,02 Дж/(К·моль) |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −490,1 кДж/моль |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | алкилирующий агент |
| СГС Маркировка : | |
   | |
| Опасность | |
| Х301 , Х311 , Х314 , Х331 , Х400 | |
| P260 , P261 , P264 , P270 , P271 , P273 , P280 , P301+P310 , P301+P330+P331 , P302+P352 , P303+P361+P353 , P304+P340 , P305+P351+P338 , П310 , П311 , П312 , P321 , P322 , P330 , P361 , P363 , P391 , P403+P233 , P405 , P501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 126 ° С (259 ° F; 399 К) |
| 470 ° С (878 ° F; 743 К) | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 76 мг/кг. [2] |
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов |
| Родственные соединения | |
Родственные соединения | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Хлороуксусная кислота , промышленно известная как монохлоруксусная кислота ( MCA ), представляет собой хлорорганическое соединение с формулой ClCH2CO2H . Эта карбоновая кислота является полезным строительным блоком в органическом синтезе . Это бесцветное твердое вещество. Родственными соединениями являются дихлоруксусная кислота и трихлоруксусная кислота .
Производство
[ редактировать ]Хлороуксусная кислота была впервые получена (в нечистой форме) французским химиком Феликсом Лебланом (1813–1886) в 1843 году путем хлорирования уксусной кислоты в присутствии солнечного света. [3] а в 1857 году (в чистом виде) немецкий химик Рейнхольд Гофман (1831–1919) путем кипячения ледяной уксусной кислоты в присутствии хлора и солнечного света , [4] французским химиком Шарлем Адольфом Вюрцем путем гидролиза хлорацетилхлорида а затем ( ClCH 2 COCl ), также в 1857 году. [5]
Хлоруксусную кислоту получают в промышленности двумя способами. Преобладающий метод включает хлорирование с уксусной кислоты использованием уксусного ангидрида в качестве катализатора :
- H 3 C−COOH + Cl 2 → ClH 2 C−COOH + HCl
Этот путь страдает от образования дихлоруксусной кислоты и трихлоруксусной кислоты в виде примесей, которые трудно отделить перегонкой :
- H 3 C−COOH + 2 Cl 2 → Cl 2 HC−COOH + 2 HCl
- H 3 C−COOH + 3 Cl 2 → Cl 3 C−COOH + 3 HCl
Второй метод предполагает гидролиз трихлорэтилена :
- ClHC=CCl 2 + 2 H 2 O → ClH 2 C−COOH + 2 HCl
Гидролиз проводят при 130–140 °С в концентрированном (не менее 75%) растворе серной кислоты . Этот метод дает очень чистый продукт, в отличие от метода галогенирования . Однако значительные количества высвободившейся HCl привели к увеличению популярности метода галогенирования. около 420 000 тонн в год. В мире производится [2]
Использование и реакции
[ редактировать ]В большинстве реакций используется высокая реакционная способность Связь C-Cl .
В наиболее крупномасштабном применении хлоруксусная кислота используется для приготовления загустителя карбоксиметилцеллюлозы и карбоксиметилкрахмала .
Хлоруксусная кислота также используется в производстве феноксигербицидов путем этерификации хлорфенолами. Таким способом 2-метил-4-хлорфеноксиуксусную кислоту (MCPA), 2,4-дихлорфеноксиуксусную кислоту и 2,4,5-трихлорфеноксиуксусную кислоту получают (2,4,5-Т). Это предшественник гербицида глифосата и диметоата . Хлороуксусная кислота превращается в хлорацетилхлорид , предшественник адреналина (адреналина). Замещение хлорида сульфидом дает тиогликолевую кислоту , которая используется в качестве стабилизатора ПВХ и компонента некоторых косметических средств . [2]
Показателем его полезности в органической химии является O -алкилирование салицилового альдегида хлоруксусной кислотой с последующим декарбоксилированием полученного эфира с образованием бензофурана . [6] [7]
Безопасность
[ редактировать ]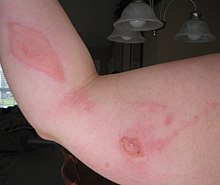
Как и другие хлоруксусные кислоты и родственные им галогенуглероды , хлоруксусная кислота является опасным алкилирующим агентом . ЛД для 50 составляет 76 крыс мг/кг. [2]
Он классифицируется как чрезвычайно опасное вещество в Соединенных Штатах, как это определено в разделе 302 Закона США о чрезвычайном планировании и праве общества на информацию (42 USC 11002), и на него распространяются строгие требования отчетности со стороны предприятий, которые производят, хранят, или использовать его в значительных количествах. [8]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Диппи, JFJ; Хьюз, SRC; Розански, А. (1959). «498. Константы диссоциации некоторых симметрично дизамещенных янтарных кислот». Журнал Химического общества . 1959 : 2492–2498. дои : 10.1039/JR9590002492 .
- ^ Jump up to: а б с д Кениг, Г.; Ломар, Э.; Руприх, Н. (2005). «Хлороуксусная кислота». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a06_537 . ISBN 978-3527306732 .
- ^ ЛеБлан, Феликс (1844) «Исследование продуктов, полученных из уксусного эфира под действием хлора, и в частности перхлорированного уксусного эфира» (на французском языке), Annales de Chimie et de Physique , 3-я серия, 10 : 197–221 ; см. особенно стр. 212.
- ^ Хоффманн, Рейнхольд (1857) «Монохлоруксусная кислота Уэбера» (на немецком языке) (О монохлоруксусной кислоте), Annals of Chemistry and Pharmacie , 102 (1): 1–20.
- ^ Вюрц, Адольф (1857) «Заметка об альдегиде и ацетилхлориде» , Анналы химии и физики , 3-я серия, 49 : 58–62, см. стр. 61.
- ^ Бургшталер, AW; Уорден, Л.Р. (1966). «Кумарон». Органические синтезы . 46 : 28. дои : 10.15227/orgsyn.046.0028 ; Сборник томов , т. 5, с. 251 ..
- ^ Инглис, JKH (1928). «Этилцианоацетат». Органические синтезы . 8 : 74. дои : 10.15227/orgsyn.008.0074 .
- ^ 40 CFR: Приложение A к Части 355 — Список чрезвычайно опасных веществ и их пороговых плановых количеств (PDF) (изд. от 1 июля 2008 г.), Государственная типография , заархивировано из оригинала (PDF) 25 февраля 2012 г. , получено 29 октября. 2011 год
Внешние ссылки
[ редактировать ]- «Монохлоруксусная кислота» . КАББ. Архивировано из оригинала 6 февраля 2015 года . Проверено 6 февраля 2015 г.
- «Монохлоруксусная кислота» . МПХБ Инчем . Проверено 20 мая 2007 г.
