G-белок
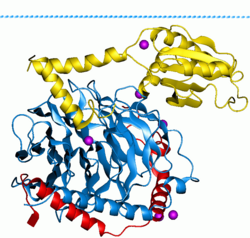
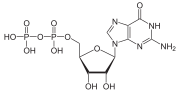

G-белки , также известные как белки, связывающие гуаниновые нуклеотиды , представляют собой семейство белков , которые действуют как молекулярные переключатели внутри клеток и участвуют в передаче сигналов от различных стимулов снаружи клетки внутрь. Их активность регулируется факторами, которые контролируют их способность связываться и гидролизовать гуанозинтрифосфат (ГТФ) до гуанозиндифосфата (ГДФ). Когда они привязаны к GTP, они «включены», а когда они привязаны к ВВП, они «выключены». G-белки принадлежат к более крупной группе ферментов, называемых GTPases .
Существует два класса G-белков. Первые функционируют как мономерные малые ГТФазы (маленькие G-белки), а вторые функционируют как гетеротримерные комплексы G-белков . Последний класс комплексов состоит из альфа (Gα ) , бета (Gβ ) и гамма ( Gγ ) субъединиц . [1] Кроме того, бета- и гамма-субъединицы могут образовывать стабильный димерный комплекс, называемый бета-гамма-комплексом. . [2]
Гетеротримерные G-белки, расположенные внутри клетки, активируются рецепторами, связанными с G-белками (GPCR), которые охватывают клеточную мембрану . [3] Сигнальные молекулы связываются с доменом GPCR, расположенным вне клетки, а внутриклеточный домен GPCR затем, в свою очередь, активирует определенный G-белок. Также было показано, что некоторые GPCR в активном состоянии «предварительно связаны» с G-белками, тогда как в других случаях считается, что имеет место механизм коллизионного сцепления. [4] [5] [6] Белок G запускает каскад дальнейших сигнальных событий , которые в конечном итоге приводят к изменению функции клетки. Рецепторы, связанные с G-белком, и G-белки, работая вместе, передают сигналы от многих гормонов , нейротрансмиттеров и других сигнальных факторов. [7] G-белки регулируют метаболические ферменты , ионные каналы , белки-переносчики и другие части клеточного механизма, контролируя транскрипцию , подвижность , сократимость и секрецию , которые, в свою очередь, регулируют различные системные функции, такие как эмбриональное развитие , обучение и память, а также гомеостаз . [8]
История
[ редактировать ]Белки G были открыты в 1980 году, когда Альфред Гилман и Мартин Родбелл исследовали стимуляцию клеток адреналином . Они обнаружили, что когда адреналин связывается с рецептором, рецептор не стимулирует ферменты (внутри клетки) напрямую. Вместо этого рецептор стимулирует белок G, который затем стимулирует фермент. Примером является аденилатциклаза , которая производит второй мессенджер циклический АМФ . [9] За это открытие они получили Нобелевскую премию по физиологии и медицине 1994 года . [10]
Нобелевские премии были присуждены за многие аспекты передачи сигналов G-белками и GPCR. К ним относятся антагонисты рецепторов , нейромедиаторы нейромедиаторов , обратный захват , рецепторы, связанные с G-белком , G-белки, вторичные мессенджеры , ферменты, которые запускают фосфорилирование белков в ответ на цАМФ и последующие метаболические процессы, такие как гликогенолиз .
Яркие примеры включают (в хронологическом порядке награждения):
- 1947 года Нобелевская премия по физиологии и медицине досталась Карлу Кори , Герти Кори и Бернардо Уссе за открытие того, как гликоген расщепляется до глюкозы и повторно синтезируется в организме для использования в качестве хранилища и источника энергии. Гликогенолиз стимулируется многочисленными гормонами и нейротрансмиттерами, включая адреналин .
- 1970 года Нобелевская премия по физиологии и медицине досталась Юлиусу Аксельроду , Бернарду Кацу и Ульфу фон Эйлеру высвобождению и обратному захвату нейротрансмиттеров за работу по .
- 1971 года Нобелевская премия по физиологии и медицине присуждена Эрлу Сазерленду за открытие ключевой роли аденилатциклазы , которая производит второй мессенджер циклический АМФ . [9]
- 1988 года Нобелевская премия по физиологии и медицине досталась Джорджу Х. Хитчингсу , сэру Джеймсу Блэку и Гертруде Элион «за открытия важных принципов лечения наркозависимости», нацеленных на GPCR.
- 1992 года Нобелевская премия по физиологии и медицине Эдвину Г. Кребсу и Эдмонду Х. Фишеру за описание того, как обратимое фосфорилирование работает как переключатель для активации белков и регулирования различных клеточных процессов, включая гликогенолиз . [11]
- 1994 года Нобелевская премия по физиологии и медицине присуждена Альфреду Гилману и Мартину Родбеллу за открытие «G-белков и роли этих белков в передаче сигналов в клетках». [12]
- 2000 года Нобелевская премия по физиологии и медицине вручена Эрику Канделу , Арвиду Карлссону и Полу Грингарду за исследования нейротрансмиттеров , таких как дофамин , которые действуют через GPCR.
- 2004 года Нобелевская премия по физиологии и медицине присуждена Ричарду Акселю и Линде Б. Бак за работу над обонятельными рецепторами , связанными с G-белком . [13]
- 2012 года Нобелевская премия по химии присуждена Брайану Кобилке и Роберту Лефковицу за работу над функцией GPCR. [14]
Функция
[ редактировать ]G-белки являются важными молекулами, передающими сигналы в клетках. «Нарушение сигнальных путей GPCR [рецептора, связанного с G-белком] участвует во многих заболеваниях, таких как диабет , слепота, аллергия, депрессия, сердечно-сосудистые дефекты и некоторые формы рака . По оценкам, около 30% современных лекарств» клеточные мишени — это GPCR». [15] Геном человека кодирует около 800 [16] Рецепторы, связанные с G-белком , которые обнаруживают фотоны света, гормоны, факторы роста, лекарства и другие эндогенные лиганды . Примерно 150 GPCR, обнаруженных в геноме человека, до сих пор имеют неизвестные функции.
В то время как G-белки активируются рецепторами, связанными с G-белком , они инактивируются белками RGS (что означает «регулятор передачи сигналов G-белка»). Рецепторы стимулируют связывание GTP (включение G-белка). Белки RGS стимулируют гидролиз GTP (создавая GDP и тем самым отключая G-белок).
Разнообразие
[ редактировать ]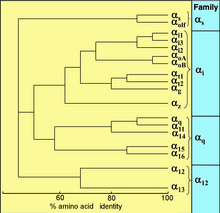
Все эукариоты используют G-белки для передачи сигналов и развили большое разнообразие G-белков. Например, люди кодируют 18 различных белков Gα , 5 белков Gβ и 12 белков Gγ . [17]
Сигнализация
[ редактировать ]G-белок может относиться к двум различным семействам белков. Гетеротримерные G-белки , иногда называемые «большими» G-белками, активируются рецепторами, связанными с G-белками , и состоят из субъединиц альфа (α), бета (β) и гамма (γ) . «Маленькие» G-белки (20-25 кДа) принадлежат к Ras суперсемейству малых ГТФаз . Эти белки гомологичны субъединице альфа (α), обнаруженной в гетеротримерах, но на самом деле являются мономерными и состоят только из одной единицы. Однако, как и их более крупные родственники, они также связывают GTP и GDP и участвуют в передаче сигнала .
гетеротримерный
[ редактировать ]Различные типы гетеротримерных G-белков имеют общий механизм. Они активируются в ответ на конформационные изменения в GPCR, обменивая GDP на GTP и диссоциируя, чтобы активировать другие белки на определенном пути передачи сигнала . [18] Однако конкретные механизмы различаются в зависимости от типа белка.
Механизм
[ редактировать ]
Активируемые рецептором G-белки связаны с внутренней поверхностью клеточной мембраны . Они состоят из субъединиц Gα и тесно связанных с ними субъединиц Gβγ . Существует четыре основных семейства субъединиц Gα : Gαs ( G-стимулирующие), Gαi ( G-ингибирующие), Gαq /11 и Gα12 /13 . [20] [21] Они ведут себя по-разному при распознавании эффекторной молекулы, но имеют схожий механизм активации.
Активация
[ редактировать ]Когда лиганд активирует рецептор, связанный с G-белком , он вызывает конформационные изменения в рецепторе, которые позволяют рецептору функционировать как фактор обмена гуаниновых нуклеотидов (GEF), который обменивает GDP на GTP. GTP (или GDP) связан с субъединицей Gα в традиционном представлении об активации гетеротримерного GPCR. Этот обмен запускает диссоциацию субъединицы Gα ( которая связана с GTP) от димера Gβγ и рецептора в целом. Однако начинают приниматься модели, предполагающие молекулярную перегруппировку, реорганизацию и предварительное комплексообразование эффекторных молекул. [4] [22] [23] И Gα - GTP, и Gβγ могут затем активировать различные сигнальные каскады (или вторичных мессенджеров пути ) и эффекторные белки, в то время как рецептор способен активировать следующий G-белок. [24]
Прекращение действия
[ редактировать ]Субъединица Gα в конечном итоге гидролизует присоединенный GTP до GDP за счет присущей ему ферментативной активности, позволяя ему повторно ассоциироваться с Gβγ и запуская новый цикл. Группа белков, называемая регулятором передачи сигналов G-белка (RGS), действует как белки, активирующие GTPase (GAP), и специфична для G α субъединиц . Эти белки ускоряют гидролиз GTP до GDP, тем самым прекращая передачу сигнала. эффектор В некоторых случаях сам может обладать внутренней активностью GAP, которая затем может помочь деактивировать этот путь. Это справедливо в случае фосфолипазы С -бета, которая обладает активностью GAP в своей С-концевой области. Это альтернативная форма регуляции субъединицы Gα . Такие Gα - GAP не имеют каталитических остатков (специфических аминокислотных последовательностей) для активации белка Gα . Вместо этого они работают, снижая необходимую энергию активации для того, чтобы реакция произошла. [25]
Конкретные механизмы
[ редактировать ]G αs
[ редактировать ]Gαs , активирует цАМФ-зависимый путь стимулируя выработку циклического АМФ (цАМФ) из АТФ . Это достигается путем прямой стимуляции мембраносвязанного фермента аденилатциклазы . Затем цАМФ может действовать как второй мессенджер, который затем взаимодействует с протеинкиназой А (ПКА) и активирует ее. PKA может фосфорилировать множество нижестоящих мишеней.
цАМФ -зависимый путь используется в качестве пути передачи сигнала для многих гормонов, включая:
- АДГ – способствует задержке воды почками ( создается крупноклеточными нейросекреторными клетками задней доли гипофиза ).
- GHRH – Стимулирует синтез и высвобождение ГР ( соматотропных клеток передней доли гипофиза ).
- GHIH – подавляет синтез и высвобождение ГР (соматотропных клеток передней доли гипофиза).
- CRH – Стимулирует синтез и высвобождение АКТГ (передняя доля гипофиза).
- АКТГ – Стимулирует синтез и высвобождение кортизола ( пучковая зона в коры надпочечников надпочечниках).
- ТТГ – стимулирует синтез и высвобождение большей части Т4 (щитовидная железа).
- ЛГ – стимулирует созревание фолликулов и овуляцию у женщин; или выработка тестостерона и сперматогенез у мужчин
- ФСГ – стимулирует развитие фолликулов у женщин; или сперматогенез у мужчин
- ПТГ – повышает уровень кальция в крови . Это осуществляется через рецептор паратироидного гормона 1 (ПТГ1) в почках и костях или через рецептор паратироидного гормона 2 (ПТГ2) в центральной нервной системе и мозге, а также в костях и почках.
- Кальцитонин – снижает уровень кальция в крови (через рецептор кальцитонина в кишечнике, костях, почках и мозге).
- Глюкагон – стимулирует распад гликогена в печени.
- ХГЧ – способствует клеточной дифференцировке и потенциально участвует в апоптозе . [26]
- Адреналин – выделяется мозговым веществом надпочечников во время голодания, когда организм находится под метаболическим стрессом. , он стимулирует гликогенолиз Помимо действия глюкагона .
G αi
[ редактировать ]Gαi . ингибирует выработку цАМФ из АТФ например соматостатин, простагландины
G αq/11
[ редактировать ]G αq/11 стимулирует мембраносвязанную фосфолипазу C бета, которая затем расщепляет фосфатидилинозитол-4,5-бисфосфат (PIP 2 ) на два вторичных мессенджера, инозитолтрифосфат (IP 3 ) и диацилглицерин (DAG). IP 3 индуцирует высвобождение кальция из эндоплазматического ретикулума . DAG активирует протеинкиназу C.Инозитол-фосфолипид-зависимый путь используется в качестве пути передачи сигнала для многих гормонов, включая:
- Адреналин
- АДГ ( вазопрессин /АВП) – индуцирует синтез и высвобождение глюкокортикоидов ( пучковая зона ) коры надпочечников ; Вызывает вазоконстрикцию (клетки V1 задней доли гипофиза )
- ТРГ – индуцирует синтез и высвобождение ТТГ ( передняя доля гипофиза ).
- ТТГ – индуцирует синтез и высвобождение небольшого количества Т4 ( щитовидная железа )
- Ангиотензин II – индуцирует синтез и высвобождение альдостерона ( клубочковая зона коры надпочечников в почках).
- ГнРГ – индуцирует синтез и высвобождение ФСГ и ЛГ (передняя доля гипофиза).
Г α12/13
[ редактировать ]- G α12/13 участвуют в передаче сигналов ГТФазы семейства Rho (см. ГТФазы семейства Rho ). Это происходит через суперсемейство RhoGEF, включающее домен RhoGEF структур белков). Они участвуют в контроле ремоделирования клеточного цитоскелета и, следовательно, в регулировании миграции клеток.
г β , г γ
[ редактировать ]- Комплексы Gβγ иногда также обладают активными функциями. Примеры включают связывание и активацию связанных с G-белком внутренних выпрямляющих калиевых каналов .
Малые ГТФазы
[ редактировать ]Малые ГТФазы, также известные как малые G-белки, аналогичным образом связывают ГТФ и ВВП и участвуют в передаче сигналов . Эти белки гомологичны альфа-(α)-субъединице, присутствующей в гетеротримерах, но существуют в виде мономеров. Это небольшие (от 20 до 25 кДа) белки , которые связываются с гуанозинтрифосфатом ( GTP ). Это семейство белков гомологично Ras GTPases и также называется GTPases суперсемейства Ras .
Липидация
[ редактировать ]Чтобы связаться с внутренним листком плазматической мембраны, многие G-белки и малые ГТФазы липидируются. [ нужна ссылка ] , то есть ковалентно модифицированный липидными расширениями. Они могут быть миристоилированными , пальмитоилированными или пренилированными .
Ссылки
[ редактировать ]- ^ Гуровиц Э.Х., Мельник Дж.М., Чен Ю.Дж., Курос-Мехр Х., Саймон М.И., Шизуя Х. (апрель 2000 г.). «Геномная характеристика генов альфа-, бета- и гамма-субъединиц гетеротримерного G-белка человека» . Исследование ДНК . 7 (2): 111–20. дои : 10.1093/dnares/7.2.111 . ПМИД 10819326 .
- ^ Клэпхэм Д.Э., Нир Э.Дж. (1997). «Бета-гамма-субъединицы G-белка». Ежегодный обзор фармакологии и токсикологии . 37 : 167–203. doi : 10.1146/annurev.pharmtox.37.1.167 . ПМИД 9131251 .
- ^ «Семь трансмембранных рецепторов: Роберт Лефковиц» . 9 сентября 2012 года . Проверено 11 июля 2016 г.
- ^ Jump up to: а б Цинь К., Донг С., Ву Г, Ламберт Н.А. (август 2011 г.). «Предварительная сборка G(q)-сопряженных рецепторов и G(q)-гетеротримеров» в неактивном состоянии» . Химическая биология природы . 7 (10): 740–7. дои : 10.1038/nchembio.642 . ПМК 3177959 . ПМИД 21873996 .
- ^ Толковский А.М., Левицкий А (1978). «Режим взаимодействия бета-адренергического рецептора и аденилатциклазы в эритроцитах индейки». Биохимия . 17 (18): 3795–3810. дои : 10.1021/bi00611a020 . ПМИД 212105 .
- ^ Больц Х.Х., Сирбу А., Стельцер Н., де Ланеролль П., Винкельманн С., Аннибале П. (2022). «Влияние диффузии мембранных белков на передачу сигналов GPCR» . Клетки . 11 (10): 1660. doi : 10.3390/cells11101660 . ПМЦ 9139411 . ПМИД 35626696 .
- ^ Рис Дж., Китай (2002). Биология . Сан-Франциско: Бенджамин Каммингс. ISBN 0-8053-6624-5 .
- ^ Невес С.Р., Рам П.Т., Айенгар Р. (май 2002 г.). «Пути G-белка». Наука . 296 (5573): 1636–9. Бибкод : 2002Sci...296.1636N . дои : 10.1126/science.1071550 . ПМИД 12040175 . S2CID 20136388 .
- ^ Jump up to: а б Нобелевская премия по физиологии и медицине 1994 г. , иллюстрированная лекция.
- ^ Пресс-релиз: Нобелевская ассамблея Каролинского института решила присудить Нобелевскую премию по физиологии и медицине за 1994 год совместно Альфреду Г. Гилману и Мартину Родбеллу за открытие «G-белков и роли этих белков в передаче сигналов в организме человека». клетки». 10 октября 1994 г.
- ^ «Пресс-релиз Нобелевской премии по физиологии и медицине 1992 года» . Нобелевская ассамблея Каролинского института . Проверено 21 августа 2013 г.
- ^ Пресс-релиз
- ^ «Пресс-релиз: Нобелевская премия по физиологии и медицине 2004 г.» . Нобелевская премия . Проверено 8 ноября 2012 г.
- ^ Шведская королевская академия наук (10 октября 2012 г.). «Нобелевская премия по химии 2012 года, Роберт Дж. Лефковиц, Брайан К. Кобилка» . Проверено 10 октября 2012 г.
- ^ Бош Д.Е., Сидеровски Д.П. (март 2013 г.). «Передача сигналов G-белка у паразита Entamoeba histolytica» . Экспериментальная и молекулярная медицина . 45 (1038): е15. дои : 10.1038/emm.2013.30 . ПМЦ 3641396 . ПМИД 23519208 .
- ^ Балтумас Ф.А., Теодоропулу М.К., Хамодракас С.Дж. (июнь 2013 г.). «Взаимодействие α-субъединиц гетеротримерных G-белков с GPCR, эффекторами и белками RGS: критический обзор и анализ взаимодействующих поверхностей, конформационных сдвигов, структурного разнообразия и электростатических потенциалов». Журнал структурной биологии . 182 (3): 209–18. дои : 10.1016/j.jsb.2013.03.004 . ПМИД 23523730 .
- ^ Jump up to: а б Сыроваткина В, Алегри КО, Дей Р, Хуан XY (сентябрь 2016 г.). «Регуляция, сигнализация и физиологические функции G-белков» . Журнал молекулярной биологии . 428 (19): 3850–68. дои : 10.1016/j.jmb.2016.08.002 . ПМК 5023507 . ПМИД 27515397 .
- ^ Лим, Венделл (2015). Клеточная сигнализация: принципы и механизмы . Брюс Майер, Т. Поусон. Нью-Йорк. ISBN 978-0-8153-4244-1 . OCLC 868641565 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Стюарт, Адель; Фишер, Рори А. (2015). Прогресс молекулярной биологии и трансляционной науки . Том. 133. Эльзевир. стр. 1–11. дои : 10.1016/bs.pmbts.2015.03.002 . ISBN 9780128029381 . ПМИД 26123299 .
- ^ Сыроваткина Виктория; Алегре, Камела О.; Дей, Раджа; Хуан, Синь-Юнь (25 сентября 2016 г.). «Регуляция, сигнализация и физиологические функции G-белков» . Журнал молекулярной биологии . 428 (19): 3850–3868. дои : 10.1016/j.jmb.2016.08.002 . ISSN 0022-2836 . ПМК 5023507 . ПМИД 27515397 .
- ^ «ИнтерПро» . www.ebi.ac.uk. Проверено 25 мая 2023 г.
- ^ Дигби Г.Дж., Лобер Р.М., Сетхи П.Р., Ламберт Н.А. (ноябрь 2006 г.). «Некоторые гетеротримеры G-белка физически диссоциируют в живых клетках» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (47): 17789–94. Бибкод : 2006PNAS..10317789D . дои : 10.1073/pnas.0607116103 . ПМК 1693825 . ПМИД 17095603 .
- ^ Хафизов К., Латтанци Г., Карлони П. (июнь 2009 г.). «Неактивные и активные формы G-белка, исследованные методами моделирования». Белки . 75 (4): 919–30. дои : 10.1002/прот.22303 . ПМИД 19089952 . S2CID 23909821 .
- ^ Юэнь Дж.В., Пун Л.С., Чан А.С., Ю Ф.В., Ло РК, Вонг Й.Х. (июнь 2010 г.). «Активация STAT3 специфическими субъединицами галфа и множественными димерами Gbetagamma». Международный журнал биохимии и клеточной биологии . 42 (6): 1052–9. doi : 10.1016/j.biocel.2010.03.017 . ПМИД 20348012 .
- ^ Спранг С.Р., Чен З, Ду Икс (2007). «Структурные основы эффекторной регуляции и терминации сигнала в гетеротримерных Gα-белках». Структурные основы эффекторной регуляции и терминации сигнала в гетеротримерных галфа-белках . Достижения в химии белков. Том. 74. стр. 1–65. дои : 10.1016/S0065-3233(07)74001-9 . ISBN 978-0-12-034288-4 . ПМИД 17854654 .
- ^ Коул Лос-Анджелес (август 2010 г.). «Биологические функции ХГЧ и связанных с ХГЧ молекул» . Репродуктивная биология и эндокринология . 8 (1): 102. дои : 10.1186/1477-7827-8-102 . ПМЦ 2936313 . ПМИД 20735820 .
Внешние ссылки
[ редактировать ]- ГТФ-связывающие белки Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)