АТФаза P-типа
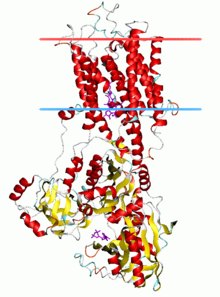 Кальций АТФаза , состояние E2-Pi | |||
| Идентификаторы | |||
|---|---|---|---|
| Символ | E1-E2_АТФаза | ||
| Пфам | PF00122 | ||
| ИнтерПро | ИПР008250 | ||
| PROSITE | PDOC00139 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1су4 / СКОПе / СУПФАМ | ||
| TCDB | 3.А.3 | ||
| Суперсемейство OPM | 22 | ||
| белок OPM | 3b9b | ||
| Мембраном | 224 | ||
| |||
АТФазы P-типа , также известные как E1 , представляют - E2 АТФазы собой большую группу эволюционно родственных ионных и липидных насосов, которые обнаружены у бактерий , архей и эукариот . [ 1 ] P-типа АТФазы α-спирального пучка представляют собой первичные транспортеры , названные в зависимости от их способности катализировать ауто- (или само) фосфорилирование (следовательно, P) ключевого консервативного остатка аспартата внутри насоса и их источника энергии, аденозинтрифосфата (АТФ). Кроме того, все они, по-видимому, взаимно преобразуются по крайней мере между двумя различными конформациями, обозначенными E 1 и E 2 . [ 2 ] АТФазы P-типа относятся к суперсемейству АТФаз P-типа (P-АТФаза) ( TC# 3.A.3 ), которое по состоянию на начало 2016 года включает 20 различных семейств белков.
Большинство членов этого суперсемейства транспортеров катализируют захват и/или отток катионов, однако одно подсемейство, флипазы ( TC# 3.A.3.8 ), участвует в переворачивании фосфолипидов для поддержания асимметричной природы биомембраны .
У человека АТФазы Р-типа служат основой нервных импульсов , расслабления мышц, секреции и всасывания в почках , всасывания питательных веществ в кишечнике и других физиологических процессов. Яркими примерами АТФаз P-типа являются натриево-калиевый насос (Na + /К + -АТФаза), протонно-калиевый насос (H + /К + -АТФаза), кальциевый насос (Ca 2+ -АТФаза) и протонный насос плазматической мембраны (H + -АТФаза) растений и грибов.
Общая транспортная реакция
[ редактировать ]Обобщенная реакция для АТФаз Р-типа:
нЛиганд 1 (внешний) + мЛиганд 2 (внутренний) + АТФ → нЛиганд 1 (входящий) + мЛиганд 2 (внешний) + АДФ + P i .
где лигандом может быть либо ион металла, либо молекула фосфолипида.
Открытие
[ редактировать ]Первой открытой АТФазой Р-типа была Na. + /К + -АТФаза , которую нобелевский лауреат Йенс Кристиан Скоу выделил в 1957 году. [ 3 ] На + /К + -АТФаза была лишь первым членом большого и все еще растущего семейства белков (см. мотив Swiss-Prot Prosite PS00154 ).
Структура
[ редактировать ]АТФазы Р-типа имеют одну каталитическую субъединицу массой 70–140 кДа. Каталитическая субъединица гидролизует АТФ, содержит сайт фосфорилирования аспартила и сайты связывания транспортируемого лиганда(ов) и катализирует транспорт ионов. Различные подсемейства АТФаз P-типа также нуждаются в дополнительных субъединицах для правильного функционирования. Дополнительные субъединицы, лишенные каталитической активности, присутствуют в АТФазных комплексах АТФаз P1A, P2A, P2C и P4. Например, каталитическая альфа-субъединица Na. + /К + -АТФаза состоит из двух дополнительных субъединиц, бета и гамма, участвующих в транспортировке, сворачивании и регуляции этих насосов. Первой кристаллизованной АТФазой P-типа была SERCA1a , сарко(эндо)плазматическая сеть Ca. 2+ -АТФаза быстросокращающихся мышц взрослого кролика . [ 4 ] Общепризнано, что структура SERCA1a является репрезентативной для суперсемейства АТФаз Р-типа. [ 5 ]
Каталитическая субъединица АТФаз Р-типа состоит из цитоплазматического участка и трансмембранного участка с сайтами связывания транспортируемого лиганда(ов). Цитоплазматический участок состоит из трех цитоплазматических доменов, обозначенных доменами P, N и A, содержащих более половины массы белка.
Мембранная секция
[ редактировать ]Трансмембранный участок ( домен М ) обычно имеет десять трансмембранных спиралей (M1-M10), причем сайты связывания для транспортируемого лиганда (лигандов) расположены вблизи средней точки бислоя. Хотя большинство подсемейств имеют 10 трансмембранных спиралей, есть некоторые заметные исключения. Предполагается, что АТФазы P1A будут иметь 7, а большое подсемейство насосов тяжелых металлов (P1B) будет иметь 8 трансмембранных спиралей. Всего АТФазы P5 содержат 12 трансмембранных спиралей.
Общим для всех АТФаз P-типа является ядро из 6 трансмембранных сегментов (также называемое «транспортным (Т) доменом»; M1-M6 в SERCA), которое содержит сайты связывания транслоцированных лигандов. Лиганд(ы) проникают через полуканал к месту связывания и выходят на другую сторону мембраны через другой полуканал.
В зависимости от АТФазы Р-типа различается дополнительное количество трансмембранных сегментов (также называемое «опорным (S) доменом», которое в зависимости от подсемейства колеблется от 2 до 6. Дополнительные трансмембранные сегменты, вероятно, обеспечивают структурную поддержку Т-домена и могут также имеют специализированные функции.
Домен фосфорилирования (P)
[ редактировать ]Домен P содержит канонический остаток аспарагиновой кислоты, фосфорилируемый (в консервативном мотиве DKTGT; «D» представляет собой однобуквенное сокращение аминокислоты аспартат) во время реакционного цикла. Он состоит из двух частей, широко разделенных по порядку. Эти две части собираются в параллельный β-лист из семи нитей с восемью короткими связанными α-спиралями, образуя складку Россмана .
Паттерн сворачивания и расположение критических аминокислот для фосфорилирования в АТФазах P-типа имеют складку галоиддегалогеназы, характерную для суперсемейства галогенациддегалогеназы (HAD) , как и предсказывает гомология последовательностей. Суперсемейство HAD функционирует по общей теме образования сложного эфира аспартата по механизму реакции S N 2 . Эта реакция S N 2 отчетливо наблюдается в растворенной структуре SERCA с ADP плюс AlF 4 − . [ 6 ]
Нуклеотидсвязывающий (N) домен
[ редактировать ]Домен N служит встроенной протеинкиназой, которая фосфорилирует домен P. Домен N вставлен между двумя сегментами домена P и образован семинитевым антипараллельным β-листом между двумя пучками спирали. Этот домен содержит карман для связывания АТФ, направленный в сторону растворителя рядом с P-доменом.
Домен актуатора (A)
[ редактировать ]Домен A служит встроенной протеинфосфатазой, которая дефосфорилирует фосфорилированный домен P. Домен А является наименьшим из трех цитоплазматических доменов. Он состоит из искаженной желеобразной структуры и двух коротких спиралей. Это актуаторный домен, модулирующий окклюзию транспортируемого лиганда(ов) в трансмембранных сайтах связывания, и он играет центральную роль в переносе энергии гидролиза АТФ в цитоплазматических доменах на векторный транспорт катионов в трансмембранном домене. Домен A дефосфорилирует домен P в рамках реакционного цикла с использованием высококонсервативного мотива TGES, расположенного на одном конце желейного рулета.
Нормативный (R) домен
[ редактировать ]Некоторые члены семейства АТФаз P-типа имеют дополнительные регуляторные (R) домены, слитые с насосом. Насосы P1B тяжелых металлов могут иметь несколько N- и C-концевых доменов, связывающих тяжелые металлы , которые, как было обнаружено, участвуют в регуляции. P2B Ca 2+ АТФазы имеют аутоинбитирующие домены в своих амино-концевых (растения) или карбокси-концевых (животные) областях, которые содержат сайты связывания кальмодулина , который в присутствии Са 2+ , активирует АТФазы P2B, нейтрализуя терминальное ограничение. Протонные насосы плазматической мембраны P3A имеют С-концевой регуляторный домен, который в отсутствие фосфорилирования ингибирует перекачку.
Механизм
[ редактировать ]Все АТФазы P-типа используют энергию, полученную из АТФ, для транспорта. Они образуют высокоэнергетический промежуточный продукт аспартил-фосфоангидрид в реакционном цикле и преобразуются между собой, по меньшей мере, между двумя различными конформациями, обозначенными E 1 и E 2 . Обозначение E 1 -E 2 происходит от первоначальных исследований этого семейства ферментов, проведенных на Na + /К + -АТФаза, где натриевая форма и калиевая форма обозначаются как Е 1 и Е 2 соответственно в «схеме Пост-Альберса». работает но , E1-E2 Доказано, что схема E1 E2 - существует более двух основных конформационных состояний. Обозначения подчеркивают селективность фермента . В E1 насос имеет высокое сродство к экспортированному субстрату и низкое сродство к импортированному субстрату. В E2 он имеет низкое сродство к экспортированному субстрату и высокое сродство к импортированному субстрату. Четыре основных состояния фермента образуют краеугольные камни реакционного цикла. В процессе реакции возникают несколько дополнительных промежуточных продуктов. Они называются E 1 ~P, E 2 P, E 2 -P* и E 1 /E 2 . [ 7 ]
Гидролиз АТФ происходит в цитоплазматической головке на границе между доменами N и P. Два сайта ионов Mg образуют часть активного сайта. Гидролиз АТФ тесно связан с транслокацией транспортируемого лиганда(ов) через мембрану на расстояние более 40 Å с помощью домена А.
Классификация
[ редактировать ]Филогенетический анализ 159 последовательностей , проведенный в 1998 году Аксельсеном и Палмгреном, предположил, что АТФазы P-типа можно разделить на пять подсемейств (типов; обозначенных как P1-P5), основанных строго на консервативном ядре последовательностей, исключая сильно вариабельные N- и C-концевые части. регионы. [ 8 ] Чан и др. (2010) также проанализировали АТФазы P-типа во всех основных типах прокариот, для которых были доступны полные данные о последовательности генома, и сравнили результаты с результатами для эукариотических АТФаз P-типа. [ 9 ] Филогенетический эукариот из которого они были выделены, и показал, что диверсификация семейства АТФаз Р-типа произошла до разделения эубактерий , архей и анализ сгруппировал белки независимо от организма , . Это подчеркивает значимость этого семейства белков для выживания клеток в условиях стресса. [ 8 ]
P1 АТФазы
[ редактировать ]АТФазы P1 (или АТФазы типа I) состоят из АТФаз переходных металлов/тяжелых металлов. Топологический тип I (тяжелые металлы) АТФазы Р-типа преобладают у прокариот (около десяти раз). [ 10 ]
P1A АТФазы (калиевые насосы)
[ редактировать ]АТФазы P1A (или типа IA) участвуют в K + импорт ( TC# 3.A.3.7 ). Они являются атипичными АТФазами Р-типа, потому что, в отличие от других АТФаз Р-типа, они функционируют как часть гетеротетрамерного комплекса (называемого KdpFABC ), где фактический K + транспорт опосредован другим подкомпонентом комплекса.
P1B АТФазы (насосы тяжелых металлов)
[ редактировать ]АТФазы P1B (или АТФазы типа IB) участвуют в транспорте мягких кислот Льюиса : Cu + , Аг + , С 2+ , Зн 2+ , компакт-диск 2+ , Пб 2+ и Ко 2+ (TC#s 3.A.3.5 и 3.A.3.6 ). Они являются ключевыми элементами устойчивости к металлам и гомеостаза металлов у широкого круга организмов.
Связывание металлов с трансмембранными сайтами связывания металлов (TM-MBS) в Cu + -АТФазы необходимы для фосфорилирования ферментов и последующего транспорта. Однако Ку + не имеет доступа к Cu + -АТФазы находятся в свободной ( гидратированной ) форме, но связаны с белком-шапероном . Доставка меди + от Archaeoglobus fulgidus Cu + -шаперон CopZ (см. TC# 3.A.3.5.7 ) к соответствующему Cu + -АТФаза CopA ( TC# 3.A.3.5.30 ) была изучена. [ 11 ] CopZ взаимодействовал и доставлял металл в N-концевые металлосвязывающие домены CopA (MBD). Cu + -нагруженные MBD, действуя как доноры металлов, не могли активировать CopA или усеченный CopA, не содержащий MBD. И наоборот, Cu + -нагруженный CopZ активировал CopA-АТФазу и конструкции CopA, в результате чего MBD оказались неспособными связывать Cu. + . Кроме того, в условиях безоборотности CopZ передал Cu + к TM-MBS CopA, в котором вообще отсутствуют MBD. Таким образом, MBD могут выполнять регуляторную функцию, не участвуя непосредственно в транспорте металлов, а шаперон доставляет Cu + непосредственно к местам трансмембранного транспорта Cu + -АТФазы. [ 11 ] Ву и др. (2008) определили структуру двух конструкций Cu (CopA)-насоса из Archaeoglobus fulgidus с помощью криоэлектронной микроскопии трубчатых кристаллов, что выявило общую архитектуру и доменную организацию молекулы. Они локализовали его N-концевой MBD в цитоплазматических доменах, которые используют гидролиз АТФ для управления транспортным циклом, и построили псевдоатомную модель, вписав существующие кристаллографические структуры в карты криоэлектронной микроскопии для CopA. Результаты также аналогичным образом указывают на Cu-зависимую регуляторную роль MBD. [ 12 ]
У Archaeoglobus fulgidus CopA ( TC# 3.A.3.5.7 ) инвариантные остатки в спиралях 6, 7 и 8 образуют два трансмембранных сайта связывания металлов (TM-MBS). Они связывают Cu + с высоким сродством в тригональной планарной геометрии. Цитоплазматическая Cu + шаперон CopZ передает металл непосредственно в ТМ-МБС; однако загрузка обоих TM-MBS требует связывания нуклеотидов с ферментом. В соответствии с классическим механизмом транспорта АТФаз Р-типа заселение обоих трансмембранных сайтов цитоплазматической Cu + является необходимым для фосфорилирования фермента и последующего транспорта в периплазматическую или внеклеточную среду. Исследования транспорта показали, что большая часть Cu + -АТФазы управляют цитоплазматической Cu + отток, хотя и с совершенно разными скоростями транспорта в соответствии с их различными физиологическими ролями. Архетипическая медь + -вытяжные насосы, ответственные за Cu + Толерантность, как и CopA Escherichia coli , имеет скорость оборота в десять раз выше, чем у тех, кто участвует в сборке купропротеина (или альтернативных функциях). Это объясняет неспособность последней группы вносить существенный вклад в отток металлов, необходимый для выживания в средах с высоким содержанием меди. Описаны структурные и механические детали функции АТФазы P-типа, транспортирующей медь. [ 13 ]
P2 АТФазы
[ редактировать ]АТФазы P2 (или АТФазы типа II) делятся на четыре группы. Топологические АТФазы II типа (специфичные для Na + ,К + , Ч + Что 2+ , мг 2+ и фосфолипиды) преобладают у эукариот (примерно в два раза). [ 10 ]
P2A-АТФазы (кальциевые насосы)
[ редактировать ]АТФазы P2A (или АТФазы типа IIA) представляют собой Ca 2+ АТФазы , транспортирующие Ca 2+ . P2A-АТФазы делятся на две группы. Члены первой группы называются сарко/эндоплазматической сетью Са. 2+ -АТФазы (также называемые SERCA). Эти насосы имеют два Ca 2+ сайты связывания ионов и часто регулируются ингибирующими вспомогательными белками, имеющими один трансмембранный сегмент (например, фосфоламбан и сарколипин) . В клетке они расположены в саркоплазматическом или эндоплазматическом ретикулуме. SERCA1a представляет собой насос типа IIA. Вторая группа P2A-АТФазы называются секреторным путем Ca. 2+ -АТФазы (также называемые SPCA). Эти насосы имеют один Ca 2+ сайт связывания ионов и расположены в секреторных пузырьках (животные) или вакуолярной мембране (грибы). (TC# 3.A.3.2)
Кристаллические структуры кальциевых насосов саркоплазматической/эндоплазматической сети, управляемых АТФ, можно обнаружить в RCSB. [ 14 ]
SERCA1a состоит из цитоплазматического участка и трансмембранного участка с двумя Ca 2+ -связывающие сайты. Цитоплазматический участок состоит из трех цитоплазматических доменов, обозначенных доменами P, N и A, содержащих более половины массы белка. Трансмембранный участок имеет десять трансмембранных спиралей (M1-M10), из которых две Ca 2+ -сайты связывания, расположенные вблизи середины бислоя. Сайты связывания образованы карбонилами боковых цепей и основной цепи M4, M5, M6 и M8. M4 раскручивается в этой области из-за консервативного пролина (P308). Это раскручивание M4 признано ключевой структурной особенностью АТФаз P-типа.
Доступны структуры как для состояний E 1 E 2 , так и для состояний Ca. 2+ АТФаза, показывающая, что Ca 2+ связывание вызывает серьезные изменения во всех трех цитоплазматических доменах относительно друг друга. [ 15 ]
В случае SERCA1a энергия АТФ используется для транспортировки 2 Са. 2+ -ионы со стороны цитоплазмы в просвет саркоплазматической сети и контртранспортируют 1-3 протона в цитоплазму . Начиная с состояния E 1 /E 2 , реакционный цикл начинается, когда фермент высвобождает 1-3 протона из катион-лигирующих остатков в обмен на цитоплазматический Ca. 2+ -ионы. Это приводит к сборке сайта фосфорилирования между АТФ-связанным доменом N и доменом P, в то время как домен A управляет окклюзией связанного Ca. 2+ . В этом окклюзированном состоянии Ca 2+ ионы похоронены в белковой среде, не имея доступа ни к одной из сторон мембраны. Состояние Ca 2 E 1 ~P образуется в результате киназной реакции, при которой домен P фосфорилируется, образуя АДФ. Расщепление β-фосфодиэфирной связи высвобождает гамма-фосфат из АДФ и высвобождает домен N из домена P.
Затем это позволяет домену A вращаться в направлении места фосфорилирования, создавая прочную связь как с доменами P, так и с N. Это движение домена A оказывает давление вниз на M3-M4 и сопротивление M1-M2, заставляя насос открываться на просветной стороне и формируя состояние E 2 P. Во время этого перехода трансмембранный Ca 2+ -связывающие остатки раздвигаются, разрушая сайт связывания с высоким сродством. Это согласуется с общей моделью транслокации субстрата, показывающей, что энергия первичного транспорта используется не для связывания субстрата, а для его повторного высвобождения из скрытых противоионов. В то же время N-домен подвергается воздействию цитозоля и готов к обмену АТФ в сайте связывания нуклеотидов.
Как Ка 2+ диссоциируют на люминальную сторону, сайты связывания катионов нейтрализуются связыванием протонов, что делает закрытие трансмембранных сегментов благоприятным. Это закрытие связано с вращением вниз домена А и перемещением домена P, что затем приводит к состоянию окклюзии E 2 -P*. Тем временем домен N обменивает ADP на ATP.
Домен P дефосфорилируется доменом A, и цикл завершается, когда фосфат высвобождается из фермента, стимулируемый вновь связанным АТФ, в то время как цитоплазматический путь открывается для обмена протонов на два новых Ca. 2+ ионы. [ 7 ]
Сюй и др. предложил, как Ca 2+ связывание вызывает конформационные изменения в TMS 4 и 5 в мембранном домене (M), которые, в свою очередь, вызывают вращение домена фосфорилирования (P). [ 15 ] Домены, связывающие нуклеотиды (N) и β-лист (β), очень подвижны: N гибко связан с P, а β гибко связан с M. Моделирование грибкового H + АТФаза, основанная на структурах Ca 2+ насоса, предположили сопоставимое вращение N на 70° относительно P для доставки АТФ к месту фосфорилирования. [ 16 ]
В одном сообщении предполагается, что этот саркоплазматический ретикулум (SR) Ca 2+ АТФаза гомодимерна. [ 17 ]
Кристаллические структуры показали, что консервативная петля TGES Ca 2+ -АТФаза выделяется в состоянии Ca 2 E 1 , но встраивается в каталитический сайт в состояниях E 2 . [ 18 ] Антонисен и др. (2006) охарактеризовали кинетику частичных стадий реакции транспортного цикла и связывания фосфорильных аналогов BeF, AlF, MgF и ванадата у мутантов с изменениями консервативных остатков петли TGES. Данные предоставляют функциональные доказательства, подтверждающие роль Glu. 183 в активации молекулы воды, участвующей в дефосфорилировании E 2 P → E 2 , и предполагают прямое участие боковых цепей петли TGES в контроле и облегчении внедрения петли в каталитический сайт. Кроме того, взаимодействия петли TGES, по-видимому, способствуют ее отделению от каталитического сайта во время перехода E 2 → Ca 2 E 1 . [ 18 ]
Кристаллические структуры кальциевой АТФазы доступны в RCSB и включают: PDB : 4AQR , 2L1W , 2M7E , 2M73 и другие. [ 19 ]
P2B АТФазы (кальциевые насосы)
[ редактировать ]P2B (или АТФазы типа IIB) представляют собой Ca 2+ АТФазы , транспортирующие Ca 2+ . Эти насосы имеют один Ca 2+ сайт связывания ионов и регулируется путем связывания кальмодулина с аутоингибирующими встроенными доменами, расположенными либо на карбокси-концевом (животные), либо на аминоконцевом (растения) конце белка-насоса. В клетке они расположены в плазматической мембране (животные и растения) и внутренних мембранах (растения). Плазматическая мембрана Ca 2+ -АТФаза (PMCA) животных представляет собой АТФазу P2B ( TC# 3.A.3.2 ).
P2C АТФазы (натрий/калий и протон/калий насосы)
[ редактировать ]P2C-АТФазы (или Тип IIC) включают тесно родственные Na + /К + и Х + /К + АТФазы животных клеток. ( ТС# 3.A.3.1 )
Рентгеновская кристаллическая структура Na почки свиньи с разрешением 3,5 Å. + /К + -АТФазу определяли с двумя ионами рубидия, связанными в окклюдированном состоянии в трансмембранной части α-субъединицы. [ 20 ] Несколько остатков, образующих полость для окклюзии рубидия/калия в Na + /К + -АТФазы гомологичны тем, которые связывают кальций в Са. 2+ -АТФаза сарко(эндо)плазматического ретикулума. Карбокси -конец α-субъединицы содержится в кармане между трансмембранными спиралями и, по-видимому, является новым регуляторным элементом, контролирующим сродство к натрию, возможно, под влиянием мембранного потенциала .
Кристаллические структуры доступны в RCSB и включают: PDB : 4RES , 4RET , 3WGU , 3WGV и другие. [ 21 ]
P2D-АТФазы (натриевые насосы)
[ редактировать ]P2D-АТФазы (или тип IID) включают небольшое количество Na. + (и К + ) экспортируют АТФазы, обнаруженные в грибах и мхах. (Грибок К + транспортеры; ТС# 3.A.3.9 )
P3 АТФазы
[ редактировать ]АТФазы P3 (или АТФазы III типа) делятся на две группы.
P3A-АТФазы (протонные насосы)
[ редактировать ]АТФазы P3A (или типа IIIA) содержат плазматическую мембрану H + -АТФазы прокариот, протистов, растений и грибов.
Плазматическая мембрана H + -АТФаза лучше всего охарактеризована в растениях и дрожжах. Поддерживает уровень внутриклеточного pH и трансмембранного потенциала . [ 22 ] Десять трансмембранных спиралей и три цитоплазматических домена определяют функциональную единицу АТФ-связанного транспорта протонов через плазматическую мембрану, а структура фиксируется в функциональном состоянии, ранее не наблюдавшемся у АТФаз Р-типа. Трансмембранный домен обнаруживает большую полость, которая, вероятно, заполнена водой и расположена около середины плоскости мембраны, где она выстлана консервативными гидрофильными и заряженными остатками. Транспорт протонов против высокого мембранного потенциала легко объяснить таким структурным устройством. [ 23 ]
P3B АТФазы (магниевые насосы)
[ редактировать ]АТФазы P3B (или типа IIIB) предположительно относятся к Mg. 2+ -АТФазы обнаружены в эубактериях и растениях. Грибковый Н + транспортеры ( TC# 3.A.3.3 ) и Mg 2+ ( ТС# 3.A.3.4 )
P4 АТФазы (фосфолипидфлипазы)
[ редактировать ]АТФазы P4 (или АТФазы IV типа) представляют собой флипазы, участвующие в транспорте фосфолипидов . [ 24 ] такие как фосфатидилсерин , фосфатидилхолин и фосфатидилэтаноламин . [ 25 ]
P5 АТФазы
[ редактировать ]АТФазы P5 (или АТФазы типа V) имеют неизвестную специфичность. Эта большая группа встречается только у эукариот и делится еще на две группы.
P5A АТФазы
[ редактировать ]АТФазы P5A (или типа VA) участвуют в регуляции гомеостаза в эндоплазматическом ретикулуме . [ 26 ]
P5B АТФазы
[ редактировать ]АТФазы P5B (или типа VB) обнаруживаются в лизосомальной мембране животных. Мутации этих насосов связаны с множеством неврологических заболеваний. [ 27 ] [ 28 ]
Дальнейшая филогенетическая классификация
[ редактировать ]Помимо перечисленных выше подсемейств АТФаз Р-типа, было идентифицировано несколько семейств прокариот с неизвестной функцией. [ 29 ] База данных классификации транспортеров предоставляет репрезентативный список членов суперсемейства P-АТФазы, которое по состоянию на начало 2016 года насчитывало 20 семейств. Члены суперсемейства P-АТФазы обнаружены у бактерий , архей и эукариот . Кластеризация на филогенетическом дереве обычно соответствует специфичности транспортируемого иона(ов).
У эукариот они присутствуют в плазматических мембранах или эндоплазматических ретикулярных мембранах. У прокариот они локализуются на цитоплазматических мембранах.
Позже были проанализированы АТФазы P-типа 26 видов эукариот. [ 10 ] [ 30 ]
Чан и др. (2010) провели эквивалентный, но более обширный анализ суперсемейства АТФаз P-типа у прокариот и сравнили их с таковыми у эукариот. Если одни семейства представлены у обоих типов организмов, то другие встречаются только у одного другого типа. Основными функциями прокариотических АТФаз Р-типа, по-видимому, являются защита от стрессовых условий окружающей среды. Только около половины семейств АТФаз Р-типа функционально охарактеризованы. [ 29 ]
Горизонтальный перенос генов
[ редактировать ]Многие семейства АТФаз P-типа обнаружены исключительно у прокариот (например, Kdp-типа K + поглощение АТФаз (тип III) и все прокариотические функционально неохарактеризованные семейства АТФаз P-типа (FUPA), тогда как другие ограничены эукариотами (например, фосфолипидные флипазы и все 13 эукариотических семейств FUPA). [ 10 ] Горизонтальный перенос генов часто происходит среди бактерий и архей, которые имеют сходное распределение этих ферментов , но редко между большинством эукариотических царств и еще реже между эукариотами и прокариотами. В некоторых типах бактерий (например, Bacteroidota и Fusobacteriota ) приобретение и потеря генов АТФазы, а также горизонтальный перенос происходили редко, в отличие от большинства других типов бактерий. Некоторые семейства (т.е. АТФазы Kdp-типа) претерпели гораздо меньший горизонтальный перенос генов, чем другие прокариотические семейства, возможно, из-за их мультисубъединичных характеристик. Функциональные мотивы лучше сохраняются в разных семейных линиях, чем в разных организменных линиях, и эти мотивы могут быть специфичными для семейства, что облегчает функциональные предсказания. В некоторых случаях в результате слияния генов создавались АТФазы P-типа, ковалентно связанные с регуляторными каталитическими ферментами. В одном семействе (семейство FUPA 24) ген АТФазы I типа (N-концевой) слит с геном АТФазы II типа (C-концевой) с сохранением функции только последнего. Минимизация генома привела к преимущественной потере генов АТФазы P-типа. Чан и др. (2010) предположили, что у прокариот и некоторых одноклеточных эукариот основной функцией АТФаз Р-типа является защита от экстремальных стрессовых условий окружающей среды. Классификация АТФаз P-типа с неизвестной функцией на филогенетические семейства обеспечивает руководство для будущих молекулярно-биологических исследований. [ 9 ]
Человеческие гены
[ редактировать ]Гены человека, кодирующие АТФазы P-типа или АТФазы P-типа, включают:
- P1B: С ++ АТФаза: АТФ7А , АТФ7В.
- P2A: SERCA Ca 2+ АТФаза : АТФ2А1 , АТФ2А2 , АТФ2А3.
- P2A: секреторный путь Ca 2+ -АТФаза : АТФ2С1 , АТФ2С2.
- П2Б: Нравится 2+ АТФаза : АТФ2В1 , АТФ2В2 , АТФ2В3 , АТФ2В4.
- P2C: Нет + /К + АТФаза : АТФ1А1 , АТФ1А2 , АТФ1А3 , АТФ1А4 , АТФ1В1 , АТФ1В2 , АТФ1В3 , АТФ1В4.
- P2C: Ч + /К + АТФаза желудка: АТФ4А ;
- P2C: Ч + /К + АТФаза, нежелудочная: АТФ12А.
- P4: Флиппаза : ATP8A1 , ATP8B1 , ATP8B2 , ATP8B3 , ATP8B4 , ATP9A , ATP9B , ATP10A , ATP10B , ATP10D , ATP11A , ATP11B , ATP11C.
- P5: АТФ13А1 , АТФ13А2 , АТФ13А3 , АТФ13А4 , АТФ13А5
См. также
[ редактировать ]- ЧАС + / К + -АТФаза
- Уже + / К + -АТФаза
- Плазматическая мембрана H + -АТФаза
- Сарко/эндоплазматическая сеть Ca 2+ -АТФаза
- V-ATPase
Ссылки
[ редактировать ]- ^ Палмгрен М.Г., Ниссен П. (2011). «АТФазы P-типа» (PDF) . Анну. Преподобный Биофиз . 40 : 243–66. doi : 10.1146/annurev.biophys.093008.131331 . ПМИД 21351879 .
- ^ Педерсен П.Л., Карафоли Э (1987). «Ионно-моторные АТФазы. I. Распространенность, свойства и значение для клеточных функций». Тенденции биохимических наук . 12 : 146–50. дои : 10.1016/0968-0004(87)90071-5 .
- ^ СКОУ АО (февраль 1957 г.). «Влияние некоторых катионов на аденозинтрифосфатазу периферических нервов». Биохим. Биофиз. Акта . 23 (2): 394–401. дои : 10.1016/0006-3002(57)90343-8 . ПМИД 13412736 .
- ^ Тоёсима К., Накасако М., Номура Х., Огава Х. (июнь 2000 г.). «Кристаллическая структура кальциевого насоса саркоплазматической сети при разрешении 2,6 А». Природа . 405 (6787): 647–55. Бибкод : 2000Natur.405..647T . дои : 10.1038/35015017 . ПМИД 10864315 . S2CID 4316039 .
- ^ Стоукс Д.Л., Грин, Нью-Мексико (2003). «Строение и функция кальциевого насоса». Annu Rev Biophys Biomol Struct . 32 : 445–68. doi : 10.1146/annurev.biophys.32.110601.142433 . ПМИД 12598367 .
- ^ ПДБ : 1T5T ; Соренсен Т.Л., Мёллер Й.В., Ниссен П. (июнь 2004 г.). «Перенос фосфорила и окклюзия ионов кальция в кальциевом насосе». Наука . 304 (5677): 1672–5. Бибкод : 2004Sci...304.1672S . дои : 10.1126/science.1099366 . ПМИД 15192230 . S2CID 30576015 .
- ^ Перейти обратно: а б Олесен С., Пикард М., Винтер А.М. и др. (декабрь 2007 г.). «Структурные основы транспорта кальция кальциевым насосом». Природа . 450 (7172): 1036–42. Бибкод : 2007Natur.450.1036O . дои : 10.1038/nature06418 . ПМИД 18075584 . S2CID 4323780 .
- ^ Перейти обратно: а б Аксельсен КБ, Палмгрен МГ (январь 1998 г.). «Эволюция специфичности субстратов в суперсемействе АТФаз P-типа» . Дж. Мол. Эвол . 46 (1): 84–101. Бибкод : 1998JMolE..46...84A . дои : 10.1007/PL00006286 . ПМИД 9419228 . S2CID 10238525 . Архивировано из оригинала 15 сентября 2000 г. Проверено 10 июня 2009 г.
- ^ Перейти обратно: а б Чан, Генри; Бабаян, Вартан; Блюмин, Эля; Ганди, Чарми; Хак, Кунал; Хараке, Даниэль; Кумар, Крис; Ли, Перри; Ли, Цзе Т. (2010). «Суперсемейство АТФаз P-типа». Журнал молекулярной микробиологии и биотехнологии . 19 (1–2): 5–104. дои : 10.1159/000319588 . ПМИД 20962537 . S2CID 7316282 .
- ^ Перейти обратно: а б с д Тевер, Марк Д.; Младший, Милтон Х. Сайер (23 июня 2009 г.). «Биоинформационная характеристика АТФаз P-типа, закодированных в полностью секвенированных геномах 26 эукариот» . Журнал мембранной биологии . 229 (3): 115–130. дои : 10.1007/s00232-009-9176-2 . ISSN 0022-2631 . ПМК 2709905 . ПМИД 19548020 .
- ^ Перейти обратно: а б Гонсалес-Герреро, Мануэль; Аргуэльо, Хосе М. (22 апреля 2008 г.). «Механизм АТФаз, транспортирующих Cu+: растворимые шапероны Cu+ непосредственно переносят Cu+ в места трансмембранного транспорта» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (16): 5992–5997. Бибкод : 2008PNAS..105.5992G . дои : 10.1073/pnas.0711446105 . ISSN 1091-6490 . ПМК 2329688 . ПМИД 18417453 .
- ^ Ву, Чэнь-Чжоу; Райс, Уильям Дж.; Стоукс, Дэвид Л. (1 июня 2008 г.). «Структура медного насоса предполагает регулирующую роль его металлосвязывающего домена» . Структура . 16 (6): 976–985. дои : 10.1016/j.str.2008.02.025 . ISSN 0969-2126 . ПМК 2705936 . ПМИД 18547529 .
- ^ Мэн, Дэн; Брушвайлер-Ли, Лей; Чжан, Фэнли; Брюшвайлер, Рафаэль (18 августа 2015 г.). «Модуляция и функциональная роль ориентаций N- и P-доменов Cu+-транспортирующей АТФазы в ионно-транспортном цикле». Биохимия . 54 (32): 5095–5102. doi : 10.1021/acs.biochem.5b00420 . ISSN 1520-4995 . ПМИД 26196187 .
- ^ «Рксб Pdb» .
- ^ Перейти обратно: а б Сюй, Чен; Райс, Уильям Дж.; Он, Ваньчжун; Стоукс, Дэвид Л. (8 февраля 2002 г.). «Структурная модель каталитического цикла Са (2+)-АТФазы». Журнал молекулярной биологии . 316 (1): 201–211. дои : 10.1006/jmbi.2001.5330 . ISSN 0022-2836 . ПМИД 11829513 . S2CID 596014 .
- ^ Кюльбрандт, Вернер; Зеелен, Йохан; Дитрих, Йенс (6 сентября 2002 г.). «Структура, механизм и регуляция H +-АТФазы плазматической мембраны Neurospora» . Наука . 297 (5587): 1692–1696. Бибкод : 2002Sci...297.1692K . дои : 10.1126/science.1072574 . ISSN 1095-9203 . ПМИД 12169656 . S2CID 16320388 .
- ^ Ушимару, Макото; Фукусима, Ёсихиро (15 сентября 2008 г.). «Димерная форма Са2+-АТФазы участвует в транспорте Са2+ в саркоплазматическом ретикулуме» . Биохимический журнал . 414 (3): 357–361. дои : 10.1042/BJ20071701 . ISSN 1470-8728 . ПМИД 18471093 . S2CID 698714 .
- ^ Перейти обратно: а б Антонисен, Энн Нихольм; Клаузен, Йоханнес Д.; Андерсен, Йенс Петер (20 октября 2006 г.). «Мутационный анализ консервативной петли TGES Са2+-АТФазы саркоплазматического ретикулума» . Журнал биологической химии . 281 (42): 31572–31582. дои : 10.1074/jbc.M605194200 . ISSN 0021-9258 . ПМИД 16893884 .
- ^ «Рксб Pdb» .
- ^ Морт, Дж. Пребен; Педерсен, Бьёрн П.; Тоуструп-Йенсен, Мэдс С.; Соренсен, Томас Л.-М.; Петерсен, Янне; Андерсен, Йенс Петер; Вильсен, Бенте; Ниссен, Поль (13 декабря 2007 г.). «Кристаллическая структура натриево-калиевого насоса». Природа . 450 (7172): 1043–1049. Бибкод : 2007Nature.450.1043M . дои : 10.1038/nature06419 . ISSN 1476-4687 . ПМИД 18075585 . S2CID 4344526 .
- ^ «Рксб Pdb» .
- ^ Кюльбрандт, Вернер; Зеелен, Йохан; Дитрих, Йенс (6 сентября 2002 г.). «Структура, механизм и регуляция H +-АТФазы плазматической мембраны Neurospora» . Наука . 297 (5587): 1692–1696. Бибкод : 2002Sci...297.1692K . дои : 10.1126/science.1072574 . ISSN 0036-8075 . ПМИД 12169656 . S2CID 16320388 .
- ^ Педерсен, Бьёрн П.; Бух-Педерсен, Мортен Дж.; Пребен Морт, Дж.; Палмгрен, Майкл Г.; Ниссен, Поль (13 декабря 2007 г.). «Кристаллическая структура протонного насоса плазматической мембраны». Природа . 450 (7172): 1111–1114. Бибкод : 2007Nature.450.1111P . дои : 10.1038/nature06417 . ISSN 0028-0836 . ПМИД 18075595 . S2CID 4413142 .
- ^ Ленуар Дж., Уильямсон П., Холтуис Дж. К. (декабрь 2007 г.). «О происхождении липидной асимметрии: обратная сторона ионного транспорта». Curr Opin Chem Biol . 11 (6): 654–61. дои : 10.1016/j.cbpa.2007.09.008 . hdl : 1874/26974 . ПМИД 17981493 .
- ^ Лопес-Маркес Р.Л., Поульсен Л.Р., Ханиш С., Мефферт К., Бух-Педерсен М.Дж., Якобсен М.К., Поморски Т.Г., Палмгрен М.Г. (2010). «Сигналы внутриклеточного нацеливания и детерминанты липидной специфичности комплекса ALA/ALIS P4-АТФаза находятся в каталитической альфа-субъединице ALA» . Мол Биол Клетка . 21 (5): 791–801. doi : 10.1091/mbc.E09-08-0656 . ПМК 2828965 . ПМИД 20053675 .
- ^ Соренсен Д.М., Холен Х.В., Холеманс Т., Вангелуве П., Палмгрен М.Г. (май 2014 г.). «На пути к определению субстрата орфанных P5A-АТФаз» (PDF) . Биохим. Биофиз. Минуты . 1850 (3): 524–35. дои : 10.1016/j.bbagen.2014.05.008 . ПМИД 24836520 .
- ^ Рамирес, А; Хаймбах, А; Грюндеманн, Дж; Стиллер, Б; Хэмпшир, округ Д; Сид, LP; Гебель, я; Мубайдин, А.Ф.; Врикат, А.Л.; Ропер, Дж; Ад-Дин, А; Хиллмер, AM; Карсак, М; Лисс, Б; Вудс, К.Г; Беренс, М.И.; Кубиш, К. (2006). «Наследственный паркинсонизм с деменцией вызван мутациями в ATP13A2, кодирующем лизосомальную АТФазу P-типа 5 типа». Природная генетика . 38 (10): 1184–91. дои : 10.1038/ng1884 . ПМИД 16964263 . S2CID 6502952 .
- ^ Ди Фонзо, А; Чиен, Х.Ф.; Сокал, М; Жирудо, С; Тассорелли, К; Иличето, Дж; Фаббрини, Дж; Маркони, Р; Финкати, Э; Аббруззезе, Г; Марини, П; Сквитьери, Ф; Хорстинк, М.В.; Монтанья, П; Либера, AD; Стокки, Ф; Голдвурм, С; Феррейра, Джей Джей; Меко, Дж; Мартиньони, Э; Лопиано, Л; Жардим, Л.Б.; Оостра, Б.А.; Барбоза, ER; Итальянская сеть генетики болезни Паркинсона; Бонифати, В. (2007). «Миссенс-мутации ATP13A2 при ювенильном паркинсонизме и болезни Паркинсона с молодым началом». Неврология . 68 (19): 1557–62. дои : 10.1212/01.wnl.0000260963.08711.08 . ПМИД 17485642 . S2CID 24070567 .
- ^ Перейти обратно: а б Чан, Генри; Бабаян, Вартан; Блюмин, Эля; Ганди, Чарми; Хак, Кунал; Хараке, Даниэль; Кумар, Крис; Ли, Перри; Ли, Цзе Т. (1 января 2010 г.). «Суперсемейство АТФаз p-типа». Журнал молекулярной микробиологии и биотехнологии . 19 (1–2): 5–104. дои : 10.1159/000319588 . ISSN 1660-2412 . ПМИД 20962537 . S2CID 7316282 .
- ^ Родригес-Наварро, Алонсо; Бенедикт, Бегоня (01 октября 2010 г.). «АТФаза оттока натрия или калия: АТФаза грибов, мохообразных и протозойных» . Биохимические и биофизические акты (ББА) – Биомембраны . 1798 (10): 1841–1853. дои : 10.1016/j.bbamem.2010.07.009 . ПМИД 20650263 .